




泌尿系统感染也称尿路感染。在感染性疾病中,其发病率仅次于呼吸道感染,可发生于各个年龄段的人群中,如儿童期尿路感染、伴随性生活发生率逐渐增加的急性膀胱炎、伴随绝经期激素水平变化出现的反复发作的尿路感染、糖尿病相关尿路感染以及高龄人群出现的各种合并疾病、与留置导尿管等相关的尿路感染等,涉及各级医疗机构的泌尿外科、老年科室以及其他临床各专业科室。对尿路感染而言,根据不同的目的有不同的分类方法,也因此造成了临床医师对尿路感染诊断和治疗的混乱。相对于肿瘤等领域,近些年来国内在尿路感染领域的创新性研究较少,很多尿路感染发生机制、临床治疗、感染复发的预防等方面突破性研究很少,因此在尿路感染的治疗上没有质的变化。抗菌药物的大量使用和不合理应用,导致尿路感染常见病原菌对临床常用抗菌药物耐药性增加,多重耐药细菌比例增加,给临床治疗带来进一步的困难。
本章将深入地阐述尿路感染的基本定义、临床常用分类方法、流行病学特点、发病机制、泌尿外科细菌生物膜等机制方面进行,并对尿路感染的临床表现、常用检查方法、诊断治疗原则、鉴别诊断等临床问题进行讨论。
(乔庐东 编 郑波 审)
又称尿路感染(urinary tract infection,UTI),是肾脏、输尿管、膀胱和尿道等泌尿系统各个部位感染的总称。
是尿路上皮对细菌等病原体侵入的炎症反应,通常伴随有尿液病原体检测阳性(细菌性尿路感染为细菌尿)和脓尿。
尿液中有细菌出现即称为细菌尿(简称菌尿)。细菌尿可以是有症状的,也可以是无症状的(无症状菌尿)。细菌尿定义本身包括了尿道、尿道口、尿路导管等部位的细菌定植,也包括了污染,临床根据标本采集方式不同而应用不同的“有意义的细菌尿”计数来表示尿路感染。
尿中存在白细胞,通常表示感染和尿路上皮对细菌入侵的炎症应答。脓尿可以发生于尿路感染,也可发生于尿路非感染性疾病(尿路结石、留置的尿路导管等)引发的尿路炎症反应。国内常使用脓细胞(炎症时白细胞发生变异或已残缺,其外形变得不规则、结构不清,称为脓细胞)来定义,实际上尿标本室温久置后,因pH、渗透压等改变,白细胞也可产生退行性变,难与脓细胞区别,所以白细胞和脓细胞在尿中出现的临床意义相同。
细菌尿和脓尿的关系:细菌尿和脓尿是完全不同的两个概念,临床上可以同时出现,也可以单独出现,代表着患者不同的临床状况。细菌尿不伴有脓尿通常意味着细菌定植,脓尿不伴有细菌尿可能为尿路结石、肿瘤、尿路导管刺激等。二者同时存在时,还要考虑患者的症状以及临床实际需求以决定是否需要抗菌药物治疗。
可分为非复杂性尿路感染和复杂性尿路感染。
(1)非复杂性尿路感染
1)非复杂性膀胱炎:
急性、偶发性或复发性膀胱炎,仅限于无已知尿路相关解剖和/或功能异常的非妊娠妇女。
2)非复杂性肾盂肾炎:
限于非妊娠,绝经前,无已知泌尿系统解剖或功能异常或合并症的女性的肾盂肾炎。
(2)复杂性尿路感染:
指尿路感染患者存在与宿主相关的因素(如糖尿病或免疫抑制)或与尿路相关的特定解剖或功能异常(如尿路梗阻、逼尿肌功能障碍导致的膀胱排空不全等),导致其感染比非复杂性感染更难以根除。对复杂性尿路感染新观点还建议考虑由多重耐药菌引起的感染。复杂性尿路感染的定义涉及广泛的潜在疾病,因此患病人群具有显著异质性。
可分为上尿路感染(输尿管开口以上尿路部分感染)和下尿路感染(输尿管开口以下尿路部分感染)。
可分为膀胱炎、肾盂肾炎(急性肾盂肾炎和慢性肾盂肾炎)、男性生殖系统感染(细菌性前列腺炎、附属性腺等部位的感染)、泌尿或男性生殖系统感染引发的血流感染(包括尿源性脓毒症)等相应部位感染。
可以分为孤立或散发感染(isolated or sporadic infection)和反复发作性感染(recurrent infection)。孤立或散发感染指患者从未发生过尿路感染或据上次发作间隔时间很长。反复发作性感染可以进一步分为再感染(reinfection)和细菌持续存在(bacterial persistence),再感染指外界细菌再次侵入泌尿系统引起的新的感染;细菌持续存在指复发性感染由存在于泌尿系统中的同一细菌(如泌尿系统结石或前列腺疾病)再次发作产生,也称为复发(relapse)。
包括非特异性感染(指一般性细菌感染)和特异性感染(指除一般细菌感染之外的其他特殊类型病原体感染,如性传播疾病、泌尿系统结核、真菌感染、血吸虫等寄生虫感染)。
由于感染的病程很难界定,所以除了慢性肾盂肾炎和慢性前列腺炎外,泌尿及男性生殖系统感染通常不用“慢性(如慢性膀胱炎)”一词。
其他与泌尿及男性生殖系统感染有关的定义将在具体章节介绍。
临床常见的尿路感染大多数为细菌感染,概括起来其流行病学特点表现为:
据统计,全球每年有1.3亿~1.75亿人患UTI,是仅次于呼吸道感染的第二大感染性疾病。据统计,女性一生有60%的可能性会患UTI,每次发作平均症状持续6.1d,行动受限2.4d,影响睡眠0.4d。菌尿发生率随着年龄的增加而增加,研究显示菌尿在5~14岁女性儿童中的发生率为1%,在年轻女性中增加到4%,以后以每年1%~2%的比例递增,到24岁时有近30%的女性会出现症状性尿路感染需要抗菌药物治疗。在65岁以上人群中,有20%的女性和10%的男性出现菌尿,而在医疗机构,尤其是老年患者医疗机构,因为糖尿病、导尿管留置等因素,菌尿、尿路导管相关尿路感染发生率更高,据统计在我国尿路感染占院内感染的9.39%~50%。
对于急性非复杂性下尿路感染,初次发作治愈后的复发是临床上困扰医师和患者的重要问题,临床上将半年内发作2次或1年内发作3次者定义为复发性UTI(recurrent urinary tract infection,rUTI)。研究表明,约27%的泌尿系统感染患者可在6个月之内发生再次泌尿系统感染,而6个月内3%的患者感染发生次数可超过3次。其中大多数患者没有需要纠正的尿路异常,但需要长期随访观察,严重影响生活质量。
据统计,尿路感染在美国每年产生16亿美元的治疗支出。尿路感染是人类健康所面临的严重威胁之一,其重要原因在于治疗尿路感染所造成的抗菌药物使用,会导致细菌耐药性的增加。根据欧洲的统计,每年有10 500吨抗菌药物被使用,其中48%用于畜牧业而52%用于人类;在人类消耗的抗菌药物中,80%用于非住院患者,其中因尿路感染抗菌治疗使用抗菌药物占很大比例。随着抗菌药物消耗的增加,细菌耐药情况随之增加。欧洲的统计数据显示,每年有25 000名患者死于多重耐药细菌感染,因此造成的医疗支出每年超过150万欧元。
(乔庐东 编 郑波 审)
大多数尿路感染的病原菌从肠道进入尿道,再由尿道上行进入膀胱,病原菌对肠内和尿路上皮黏膜的黏附能力在上行感染中发挥重要作用。这种感染途径在会阴附着粪便或使用涂有杀精子避孕套性交的妇女以及间歇或长期留置导尿管的患者中更为常见。尽管膀胱炎通常局限于膀胱,但约50%的感染可以上行至上尿路。临床和实验的证据强烈表明,大多数肾盂肾炎是病原菌由膀胱经输尿管到肾盂和肾实质的逆行上升感染引起的。膀胱炎引起的水肿会导致输尿管膀胱连接处的严重改变,从而产生输尿管膀胱反流。细菌一旦进入输尿管,可以畅通无阻地上行到肾脏。病原菌到达肾盂后,通过肾乳头尖端的集合管进入肾实质,然后通过集合小管继续上行。革兰氏阴性菌及其内毒素、妊娠和输尿管梗阻等影响正常输尿管蠕动功能的因素都会大大增加这种上行感染的发生率。
病原菌通过血行途径感染肾脏在正常个体中较少见,但若发生源自口腔的金黄色葡萄球菌菌血症或合并念珠菌感染,偶尔会导致肾脏的感染。研究表明,上尿路梗阻会增加血行途径感染的发生率。
病原菌通过淋巴管从邻近器官直接延伸到尿路一般仅发生在少数情况,如严重肠道感染或腹膜后脓肿,但很少有证据表明淋巴途径在尿路感染中起着重要的作用。
大多数尿路感染是由来源于肠道菌群的兼性厌氧菌感染引起的,所以尿路感染本质上是一种内源性感染。此外,尿路感染也可由来源于阴道菌群和会阴部皮肤的表皮葡萄球菌、白念珠菌等所引起。在所有这些病原菌中,大肠埃希菌导致了85%的社区获得性尿路感染和50%的医院获得性尿路感染。其余社区获得性尿路感染则主要由革兰氏阴性变形杆菌、克雷伯菌以及革兰氏阳性粪肠球菌和腐生葡萄球菌引起。医院内感染主要由大肠埃希菌、克雷伯菌、肠杆菌、柠檬酸杆菌、沙雷菌、铜绿假单胞、普罗维登斯菌、粪肠球菌和表皮葡萄球菌引起。较罕见的病原菌如阴道加德纳菌、支原体和解脲脲原体则可能会感染需要间歇或长期留置导尿管的患者。
既往研究中,导致肠外感染的大肠埃希菌可根据多重聚合酶链式反应分为多个种类,其中最常见的尿路致病性大肠埃希菌(uropathogenic escherichia coloi,UPEC)位于B2组别。其中,序列类型为ST131的大肠埃希菌特别值得注意,其引起的尿路感染可迅速进展为多重耐药。最近一项基于地理差异的ST131分离株的研究表明,其中一种大约在10年内出现的ST131亚型H30,是多重耐药大肠埃希菌感染的主要类别,与尿路感染的复发和败血症的发生高度相关。
能引起症状的厌氧菌尿路感染十分少见。然而,在远端尿道、会阴部和阴道通常有厌氧菌定植。在有临床症状的尿路感染中,尿培养只有厌氧微生物阳性的情况罕见。但是对于有膀胱刺激征的患者,如果镜下发现离心尿中存在球菌或革兰氏阴性杆菌,且常规尿培养需氧菌为阴性,需要考虑是否存在厌氧菌感染。厌氧菌感染经常出现在泌尿生殖系统的化脓性感染中。一项男性泌尿生殖系统化脓性感染的研究表明,88%的阴囊、前列腺和肾周脓肿存在厌氧菌感染。
病原菌的毒力因子在决定病原菌能否侵入尿路过程中发挥关键作用,并与感染的严重程度密切相关。通常认为,起源于肠道的致病菌,如UPEC,不但可以偶然引起尿路感染,还可以通过表达具有黏附功能的毒力因子引起尿路感染。在复发性尿路感染患者的尿液中可以发现病原菌上有相同的毒力因子。最近一项关于UPEC基因组分析的研究表明,其存在假定的分子伴侣系统基因和发挥黏附素、毒素、蛋白酶、侵袭素、血清抗性因子作用的自身转运蛋白基因。Sat是其中一种UPEC特异性自身转运蛋白,其在体外实验中显示能对尿路细胞产生毒性,在小鼠肾脏中引起细胞质空泡化和严重组织损伤。溶血素是另一种毒素,能对宿主细胞的细胞膜形成孔状损伤。最近的数据显示,UPEC还能够中和溶酶体,这种中和作用被溶酶体膜瞬时受体电位黏脂蛋白3(transient receptor potential mucolipin 3,TRPML3)所感知,激活直接分泌含有UPEC的溶酶体途径。
病原菌黏附于阴道和尿路上皮细胞是引起尿路感染的关键步骤,黏附作用与病原菌的黏附特性和上皮细胞的接受特性相关。UPEC能表达大量黏附到尿路组织的黏附素。其中最主要的一种黏附素就是菌毛。一个典型的有菌毛的细胞可含有100~400个菌毛。1个菌毛通常直径为5~10nm,长约2μm,主要由菌毛蛋白构成。根据其介导的不同红细胞血凝反应的能力,菌毛分为不同的类型,其中最常见的为1型菌毛和P菌毛。P菌毛是引起肾盂肾炎的主要毒力因子,由11种基因编码组成肾盂肾炎相关菌毛(pilus associated with pyelonephritis,pap)A~K,其中papG能与肾盂黏膜上的糖脂α-gal-1-4-β-gal受体黏附。1型菌毛在非致病性和致病性大肠埃希菌中均有表达。它可以介导豚鼠红细胞的血凝反应,由于甘露糖可以抑制1型菌毛活性,所以1型菌毛也被称为甘露糖敏感性血凝素(mannose-sensitive hemagglutinin,MSHA)。尿路感染患者尿液分析和动物模型研究显示,1型菌毛作为毒力因子引起尿路感染的能力是明确的。1型菌毛长1~3μm,直径约7nm,包含菌毛A(fimbriae A,Fim A)亚单位及Fim F、Fim G和Fim H3种小亚单位。Fim A占整个菌毛蛋白的95%以上,Fim H则位于菌毛的尖端,它可与膀胱黏膜上的甘露糖受体结合,从而使细菌在膀胱内立足,生长繁殖,引发感染,所以UPEC的菌毛是引起膀胱炎的关键所在。过去曾有人试图以整个菌毛作为抗原制造疫苗,但由于Fim A的抗原性多变,即使同一菌种的细菌,菌毛抗原也不同,故疫苗未研制成功。
上皮细胞的接受性在尿路感染发病机制中的作用,最初是在尿液样本中检测大肠埃希菌对阴道上皮细胞和尿路上皮细胞的黏附能力时提出的。研究人员发现,经常复发尿路感染的女性患者阴道上皮细胞接受性更高,大肠埃希菌更容易与之黏附。人体激素对上皮细胞接受性具有一定作用,在绝经后妇女中,低水平雌激素会增加尿路感染的发生率,雌激素替代疗法可以降低尿路病原菌的定植和尿路感染的发生率。一些女性会定期复发尿路感染,也可能与体内激素水平周期性改变影响上皮细胞接受性有关。
膀胱最表层的细胞称为伞状细胞,其表面被水晶状的六角复合物所覆盖,该复合物由4种被称为尿空斑蛋白(uroplakin)的膜蛋白(即UPⅠa、UPⅠb、UPⅡ和UP)Ⅲ组成。实验证明,UPⅠa与UPⅠb可特异性地与表达1型菌毛的UPEC相黏合。将大肠埃希菌接种于鼠的膀胱后,电子显微镜下可见细菌与黏膜呈单个黏附,有时也呈生物膜菌落状,突变后缺少Fim H黏附素的大肠埃希菌则见不到细菌和膀胱黏附的现象。Fim H介导的细菌与膀胱上皮细胞的黏附是导致尿路感染的一系列事件的初始步骤。在细菌与膀胱上皮细胞黏附后不久,UPEC迅速侵入膀胱表面细胞,并构建一个生态环境,帮助自身抵抗宿主的天然免疫。一旦侵入细胞内部,UPEC在胞质中快速生长分裂,形成小的细胞内细菌群落(intracellular bacterial communities,IBCs)。在快速生长的时候,细菌保持其固有的长约3μm的杆状结构,以疏松群落的方式在胞质中随意生长。6~8h后,早期IBCs会降低增殖的速率,显著缩短长度至平均约0.7μm,并形成生物膜样的群落。作为宿主反应的一部分,上皮细胞会大量脱落,将IBCs释放到尿液中,清除体内的大量细菌。在UPEC感染的患者尿液样本中,充满类似细菌的上皮细胞约占22%。此外,1型菌毛可与其他黏附于膀胱壁上的细菌相互作用形成生物膜(生物膜的生物特性和功能将在后面介绍)。
通过实验动物和志愿者试验,将10 6 ~10 7 /mL UPEC接种于受试者膀胱内,9h后细菌减至10 3 /mL,72h后细菌全被灭活,说明人体自身的免疫机制具有消除尿中细菌的能力。
在阴道口、尿道周围区域和尿道存在的正常菌落中含有大量微生物,如乳酸杆菌、凝固酶阴性葡萄球菌、棒状杆菌和链球菌等。这些微生物形成了一道对抗致病原菌定植的天然屏障。抗菌剂和杀精子剂会快速削弱正常菌落的定植能力,同时增加上皮细胞对致病菌的接受性。雌激素可以使糖原在阴道细胞内聚集,有利于乳酸杆菌的生长,使阴道pH降低,抑制阴道内细菌的繁殖。病原菌突破尿液和膀胱的正常防御机制的能力是其定植在尿道及其周围的关键,也是大多数尿路感染发生的先决条件。
正常人的尿液对病原菌具有抑制作用,尤其是在病原菌数量较少的时候。尿液中发挥抑制作用的因素有渗透压浓度、尿素浓度、有机酸和pH等。稀释的尿液,由于其渗透压低,使细胞内的水分增多,故可抑制细菌的生长;而高渗透压、低pH尿液对细菌有高度抑制性。大多数抗菌药物在尿液中的活性与局部高尿素和有机酸成分有关。尿液中最重要的抑菌物质可能为Tamm-Horsfall蛋白(可简称T-H蛋白)。此低分子量蛋白由远端肾曲小管上皮产生,在尿液中含量超过100mg/mL,可与尿路上皮结合并覆盖其表面。分析T-H蛋白的分子结构可发现其含有UPEC细菌1型菌毛受体,该受体与细菌黏合后,有利于细菌的排出。T-H蛋白也称为尿调制蛋白(uromodulin),它能增强尿路的局部免疫反应。但在T-H蛋白中不含有P菌毛受体,P菌毛菌株容易从尿中分离出来可能与此有关。T-H蛋白不仅能阻止细菌黏附和菌落形成以及排出尿内细菌,还可以与多核白细胞结合,增强其吞噬能力和免疫功能。此外,许多其他可溶性因子(如抗菌肽、补体、脂钙素2、溶菌酶、乳铁蛋白)也会被宿主细胞释放到膀胱腔中,这可能会给到达的细菌创造一个不那么友好的环境。可能保护尿路的抗菌肽包括防御素、人类抗菌肽LL-37和核糖核酸酶7,这些分子可能直接发挥抗菌活性,增加先天性免疫细胞招募,或改变尿液环境,使其对尿液中的病原体不利。其他宿主转录调节因子如低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)也是如此,在对细菌的反应中表达,潜在地促进一氧化氮、抗菌肽和β-防御素2等先天防御成分的合成。
最新的研究使用第二代脱氧核糖核酸(deoxyribonucleic acid,DNA)测序技术对尿液中的细菌进行定量分析,描绘了正常女性尿液的微生物组。研究人员使用耻骨上穿刺取得的尿液样本进行检测,尿培养阴性的患者样本中却显示存在着各种不同的微生物。尿培养是评估尿路感染的金标准,该研究则展示出一个更复杂的膀胱生态系统。比如,其中一个尿培养大肠埃希菌阳性参与者的DNA分析显示,45%为气球菌,21%为放线棒菌,而仅有2%是大肠埃希菌。
细菌能否在膀胱内存留、繁殖并引起感染,部分取决于膀胱排空的能力,还与膀胱的先天性免疫、获得性免疫和上皮细胞的剥落有关。膀胱或肾脏对感染的先天性免疫应答主要是形成局部炎症。由于膀胱上皮等黏膜屏障反复受到细菌攻击,它们通常对短暂的微生物存在具有耐受性,因此先天性免疫防御是防止感染的关键。先天性免疫应答的发生比获得性免疫应答更为迅速,涉及一系列免疫细胞,如多形核白细胞、中性粒细胞、巨噬细胞、嗜酸性粒细胞、自然杀伤细胞和树突状细胞等。同时,先天性免疫应答通过巨噬细胞、树突状细胞和自然杀伤细胞等促进获得性免疫的建立。宿主对病原体的识别涉及多个病原体相关分子模式受体(pathogen-associated molecular patterns,PAMPs),比如Toll样受体(Toll-like receptors,TLRs)。TLR信号通路可以激活先天免疫应答,而大量病原体可以激活TLR信号通路。研究表明,UPEC通过TLR信号通路调控炎症反应,进而增强自身的毒力因子,突破先天性免疫防御,导致最终的感染。UPEC产生的多糖胶囊抗原,特别是K2或K1血清型,可能对UPEC提供一些保护作用,以防止UPEC被宿主根除。此外,含有1型菌毛的细菌感染和破坏上皮细胞后会导致其片状脱落。入侵的细菌激活了细胞内的凋亡程序,诱导特异性凋亡酶——胱天蛋白酶(caspase)释放,使细胞凋亡脱落,这也是宿主对病原菌的防御措施之一。至于体液免疫,复发性UTI在女性人群中的流行表明,膀胱炎后持久的保护性免疫反应至少在女性亚群体中尚未建立。上尿路UTI(肾盂肾炎)可能产生更强的血清学反应,尽管尚不清楚所激发的抗体随后是否会到达膀胱以提供预防未来膀胱炎的保护。总体来说,与先天性免疫系统相比,适应性免疫在控制UPEC感染方面的重要性仍未得到充分研究。但了解抗UTI功能性、适应性免疫的基础可能对复发性UTI和疫苗开发有重大意义。
输尿管的正常蠕动是防御尿路感染的重要机制之一。因为输尿管的蠕动可机械性地防止细菌的黏附。如果输尿管的蠕动失常,膀胱输尿管反流、妊娠时输尿管肾积水等引起的输尿管梗阻都将促进感染的发生。细菌产生的脂多糖(lipopolysaccharide,LPS)及某些钙离子载体均可抑制输尿管平滑肌的收缩,促进感染的发生。实验研究表明,输尿管如无梗阻,则血行感染很难引起肾脏感染,通过输尿管的保护功能可将已种植在肾脏内的细菌排出体外。
人的一生中从新生儿到老年均可发生尿路感染。有研究显示,1 000例婴儿采用膀胱穿刺法做尿检查,发现约1%的婴儿有细菌尿,男性多于女性,这时期的尿路感染是全身严重感染的一部分。在学龄前儿童中,女孩尿路感染发生率10倍于男孩,常伴有梗阻性及神经性病变,故对学龄前儿童患者,应进行全面的尿路检查。学龄前女孩细菌尿的发生率为1.2%,而同年龄组的男孩则仅为0.03%。女性的细菌尿随着年龄的增长逐渐增高,约每10年增加1%,60~70岁人群发病率高达10%。女性的发病率进入生育期后,因为性行为导致的尿路感染明显增高。学龄前有尿路感染病史者,妊娠后细菌尿发生率可高达63.8%。围绝经期妇女阴道微生物菌群的变化可能会增加发生尿路感染的风险,因此影响绝经后妇女膀胱排空的机械和生理因素对于绝经后妇女很重要。男性患者发生尿路感染多与畸形、梗阻和前列腺炎有关,故不论年龄大小均应做全面的尿路检查,老年患者则应考虑良性前列腺增生。引起尿路感染的病原菌类型也受到患者性别和年龄的影响,比如,腐生葡萄球菌在年轻、性活跃的女性中可引起10%的人发生下尿路感染,而很少引起男性和老年人感染。
在任何解剖水平阻碍尿流的梗阻都会增加宿主尿路感染的发生率,包括泌尿系统中有结石或异物(如输尿管支架)以及与神经源性膀胱相关的疾病。梗阻导致的尿流停止能促进细菌的生长和提高其黏附到尿路上皮细胞的能力。在动物血源性尿路感染的模型研究中,输尿管结扎降低了肾脏对感染的抵抗能力。在临床上,一般的膀胱炎或肾盂肾炎在尿路梗阻时可能会威胁患者的生命。尽管梗阻会增加感染的严重程度,但其并不作为感染的诱发因素。比如,拥有大量残余尿的男性患者数年不发生尿路感染,而当放入导尿管后,少量细菌便可能导致严重感染。临时留置导尿管是增加尿路感染风险的主要医学操作,超过80%的医源性感染继发于留置导尿管。将导尿管插入尿道和膀胱会导致宿主释放纤维蛋白原等因子,这些因子会覆盖导管,使包括肠球菌和葡萄球菌属在内的多种病原体能够结合并在导管表面组装生物膜。
膀胱输尿管反流(vesicoureteral reflux,VUR)和尿路感染的关系在1960年首次被提出。研究显示,VUR有一定的遗传基础,在同胞儿童中的发病率显著高于一般健康儿童。儿童时期如存在明显的VUR和尿路感染,肾脏会发生进展性损伤,表现为肾脏瘢痕化、蛋白尿和肾衰竭。反流程度较轻时,肾脏损伤会自主恢复或经过治疗后好转。在成人身上,VUR通常不会引起肾功能下降,除非同时发生尿路梗阻和尿路感染。
尿路同时也是分泌性免疫系统的一部分。在肾盂肾炎发生时,尿液中可以检测到免疫球蛋白G(immunoglobulin G,IgG)和分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)。在体外实验中,从急性肾盂肾炎患者尿液中提取出的IgG和SIgA可以抑制相同大肠埃希菌对尿路上皮细胞的黏附作用。免疫因素影响尿路易感性的研究在动物和人体实验中取得了一定的进展。研究人员在动物模型实验中发现,P菌毛疫苗可以降低P菌毛大肠埃希菌对尿路上皮细胞的黏附能力并预防急性肾盂肾炎的发生。在人类免疫缺陷病毒(human immunodeficiency virus,HIV)阳性人群中,尿路感染的发生率5倍于正常人群,且更易发生复杂性尿路感染以及尿路感染复发,因此需要更长时间的治疗。
在女性糖尿病患者中,临床有症状或无症状尿路感染的发生率明显高于非糖尿病患者,然而在男性糖尿病患者中没有出现这样的差异。尽管糖尿病患者发生尿路感染通常是无症状的,但糖尿病是发生严重感染的易感因素之一。据报道,即使糖尿病得到很好的控制,无症状菌尿发生频率也会较高。一项随机对照试验(randomized controlled trial,RCT)证明,根除无症状菌尿并不能降低糖尿病患者出现有症状UTI和感染并发症的风险,糖尿病管理不善是有症状UTI和感染并发症的危险因素。
越来越多的证据表明,遗传因素可能导致UTI风险。先天免疫系统方面的遗传变异(包括模式识别受体分子、趋化因子、细胞因子和中性粒细胞活化的遗传变异)与宿主对尿路致病菌的反应至关重要。一项临床研究分别在容易出现无症状菌尿或急性肾盂肾炎的患者中发现了相同的遗传缺陷。无症状菌尿患儿的TLR4表达降低。肾盂肾炎高发儿童的中性粒细胞趋化因子受体1(CXC chemokine receptor 1,CXCR1)表达水平低于对照组,并且在该患者组中发现了新的遗传多态性。这些研究表明,基因控制的免疫机制会影响免疫力和UTI易感性。
细菌生物膜是聚集的微生物和它们的细胞外产物在固体表面形成的集落样结构,是细菌为适应恶劣环境而采取的一种生长方式。人体植入物表面生物膜的形成是一种自然现象,是细菌为了适应环境维持生存而发生的形态以及生理功能的改变,以微菌落为基本单位,包裹于多聚糖、蛋白等物质构成的基质中,形如膜状不可逆地附着于物体表面。细菌生物膜形成对于暂时或永久性人体植入物感染(阴茎假体及人工括约肌,详见相关章节)问题有重要的影响。
生物膜形成通常分为3步:
这一步的形成来自机体对外来异物的宿主反应。以尿路为例:异物进入尿路与尿液接触,尿液中的Tamm-Horsfall糖蛋白、各种离子、多糖及其他成分数分钟内聚集到异物表面,体液中的大分子成分如血清白蛋白、纤维蛋白原、胶原与纤维连接蛋白在细菌微生物到达之前快速在异物表面形成调节膜。调节膜的形成改变了异物的表面特性,使得病原微生物容易在异物表面聚集。
这是生物膜形成的第二步。病原微生物黏附于异物表面的能力受到静电力和疏水性的相互作用、离子强度、渗透压和尿pH等的影响。其确切的生物学机制仍在研究中。浮游细菌通过释放细胞释放质子和信号分子感知异物平面的存在向异物表面聚集,通过疏水性和静电力的作用黏附于异物表面开始生长繁殖(图1-1-3-1)。
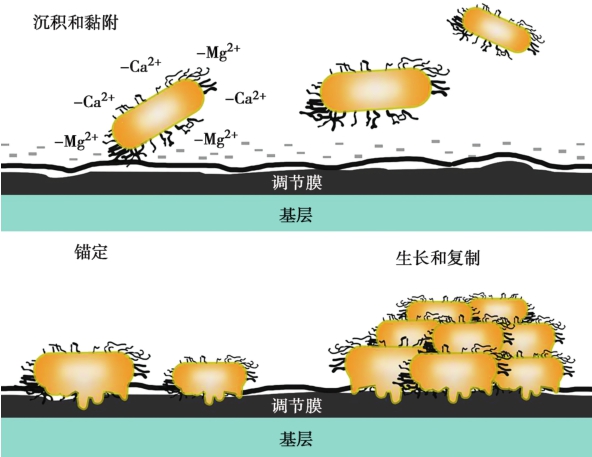
图1-1-3-1 细菌生物膜形成
此时微生物已经创造了一个躲避抗菌药物和宿主免疫反应的微环境。依菌种不同,微菌落可能由10%~25%细菌和75%~90%胞外多糖(exopolysaccharide,EPS)基质组成。这些微菌落构成了生物膜的基本单元,并进一步发展形成具有异质性粗糙表面的结构。生物膜通过“水通道”运输必要的营养和氧气,同时内部也通过基因表达分泌化学信号调控细菌密度。生物膜调节细菌群体感应(quorum sensing,QS)即细菌细胞之间通过感受自诱导物来调控细菌群体行为的现象,是细菌调控生物膜形成的重要机制之一。通过信号分子调控基因表达,这种交流可使细菌表达不同的生理行为,包括病原微生物的毒性、对抗菌药物耐药的形成、生物膜的形成与生长等。生物膜的形成与微生物代谢、毒力因子表达等密切相关。群体感应现象与生物膜的形成相互依赖,生物膜提供菌体聚集场所,避免群体感应信号分子的扩散,聚集菌体的群体感应现象为生物膜的形成提供基础。群体感应系统不仅可直接介导细菌生物膜的形成,还可调节胞内第二信使分子水平。
完整的细菌生物膜通常分为:①调节膜,连接到组织或生物材料的表面;②含有密集微生物的基底膜;③表层膜,是最外层,游离的微生物在这里自由活动并扩散于表面(图1-1-3-2)。
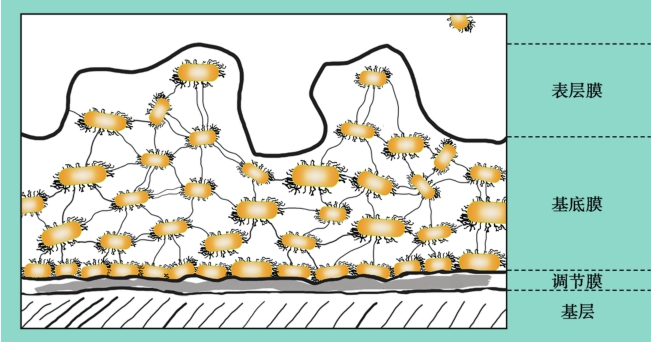
图1-1-3-2 完整生物膜结构示意图
即使在接触抗菌药物的情况下,细菌生物膜仍然会生长,而且抗菌药物的使用基于标本细菌培养,阳性的细菌学结果来自浮游的、自由活动的细菌,但由于细菌生物膜的存在会导致假阴性的细菌培养结果,使得抗菌药物的应用失去指导。由于细胞外基质的阻挡作用,抗菌药物难以穿透生物膜全层,仅能通过杀灭游离细菌而减少生物膜表层细菌的代谢活性而减缓生物膜形成的进程,这是细菌生物膜抗菌药物耐药的外部因素。内部因素则包括生物膜内细菌与生物膜外的游离细菌表型不同降低了对抗菌药物的敏感性,这是由于生物膜内细菌启动基因转变改变了细菌外膜、分子靶点(研究显示会出现65~80个蛋白的改变),而表型的改变对细菌耐药起重要作用;同时,生物膜内细菌生长速度缓慢,而很多抗菌药物通常对生长活跃的细菌更敏感,这也增加了生物膜内细菌对抗菌药物耐药性;生物膜内的细菌可以感知外部环境,细菌之间相互传递耐药基因。由于以上原因,生物膜内细菌通常可以在抗菌药物浓度比杀死生物膜外同种游离细菌时高1 000~1 500倍的环境中存活。
研究发现,在持续流动的、有细菌存在的人工尿液环境下,铜绿假单胞菌在特氟龙导尿管表面仅需要6h就形成了微菌落,24h就形成了结构完整的生物膜,基本上2d就可以在导尿管的内、外腔表面广泛分布。多数情况下,输尿管支架是在无菌环境下被置入的,但仍然不可避免地会出现细菌生物膜形成。在输尿管支架上形成生物膜的细菌种类包括革兰氏阳性菌、革兰氏阴性菌和真菌。因为细菌在生物膜中生长,所以只有30%的患者可以发现菌尿,有症状的临床感染发生率则更低。细菌生物膜会堵塞支架的内、外引流通道(图1-1-3-3),还会改变尿路导管的表面环境,使得尿液中的钙、镁离子沉积,如果合并产尿素酶的细菌(如变形杆菌属、摩根菌属等)感染,分解尿素产生CO 2 和氨离子,使尿液pH升高,在碱性尿环境下与尿液中的钙、镁离子结合,产生感染性结石(图1-1-3-4),包括碳酸磷灰石和磷酸镁铵结石,引起尿路导管的管腔阻塞,结石的形成又为细菌的进一步繁殖提供保护,形成恶性循环。

图1-1-3-3 金属支架表皮葡萄球菌生物膜生长堵塞支架螺旋网及内腔

图1-1-3-4 输尿管支架细菌生物膜伴有结石形成
人们在这一领域做了很多工作,包括在尿路导管上加抗菌药物涂层、镀银涂层等以期通过减少细菌黏附而减少细菌生物膜形成,但由于生物膜形成的第一步是宿主反应,即尿液中纤维蛋白成分形成调节膜,使得这些表面调节功能很快失效。口服抗菌药物对于减少长期置管患者的尿路感染发生几乎无效,而且会诱导细菌耐药。研究显示,掺在导管材质内的控释抗菌药物在置入导管后的1周内有减少无症状菌尿发生的作用,但超过1周则与对照组没有区别。对镀银涂层导尿管的研究得出了同样的结论,即可以减少1周内无症状菌尿的发生率,但尚缺乏长期置管患者研究。亲水涂层的设计源于生物膜形成的第二步,即细菌的黏附需要疏水性,亲水涂层的存在可以减少细菌黏附。临床研究发现,用于间歇清洁自家导尿的带亲水涂层导尿管与普通导尿管相比,使用1年内,患者尿路感染的发生率降低20%左右,但留置尿路导管6周患者的症状性尿路感染的发生率与对照组没有区别。肝素涂层设计也是针对细菌生物膜形成的第二步,即细菌黏附的电荷吸引力。细菌在尿液环境中带负电荷,而肝素本身也带有强烈的负电荷,可以产生对细菌的排斥力,从而减少细菌吸附。但已有的动物实验和临床研究结果显示细菌生物膜生长情况很不确定,临床疗效仍待进一步研究。磷酰胆碱(phosphorylcholine,PC)支架是近些年研发的输尿管支架工艺,因为PC存在于所有活体细胞的细胞膜中,人红细胞外膜脂质层约占人体总磷酰胆碱脂质的88%,PC高含量是保证血液组织相容性避免血液凝结的原因。而PC支架的原理是将亲脂单体和PC单体与其他共聚单体结合在一起作为输尿管支架的防护表层,从而提高组织相容性,减少纤维蛋白附着和细菌生物膜形成。研究显示,对比普通输尿管支架,留置3个月时,PC支架可以明显减少细菌生物膜形成(普通支架70%,PC支架为30%)。另外一项研究显示,PC支架对比普通支架,梗阻发生率为6.6%∶34%,支架移位发生率为4.4%∶8%,疼痛发生率为13.3%∶19%,UTI发生率为13.1%∶31%。这个结果令人振奋,但样本量小,尚需要大规模临床研究进一步证实其有效性。近年来,有一种低能表面声波(low-energy surface acoustic waves,SAW)被用于导管相关细菌生物膜的治疗,其原理是SAW直接传导至导管表面,可以抑制游离细菌黏附,达到干扰细菌生物膜形成的目的。已有研究显示,对于短期导尿和长达8周的导尿患者,低能SAW均能有效减少细菌生物膜的形成和菌尿的发生。
总体来说,泌尿外科生物材料使用增加说明大家已经认识到生物膜感染的重要性,但目前尿路导管的细菌生物膜感染仍然难以诊断、难以治疗,也缺乏理想的预防措施。未来目标在于发现新的方法诊断和量化生物膜感染、寻找有效的预防机制,以及寻找能有效清除生物膜内细菌的抗微生物制剂和理想的能抑制细菌黏附的表面调节剂。
有学者对20例既往有明确细菌学证据、应用抗菌药物效果不佳的慢性细菌性前列腺炎患者进行了前列腺穿刺活检或经尿道前列腺电切活检,在60%患者的前列腺组织中发现了和既往发作同样的细菌,这些细菌以生物膜形式牢固地附着在前列腺导管和腺泡壁上。近年来,越来越多的证据显示,细菌生物膜在前列腺慢性感染和炎症迁延不愈中起的重要作用。临床研究发现,慢性细菌性前列腺炎分离出的常见致病菌中,有94%的大肠埃希菌是产生物膜菌株(其中有63%是强产生物膜菌株),分别有75%和15%的革兰氏阴性菌株具有强的和中等的产生物膜能力,革兰氏阳性菌中常见的葡萄球菌分别有46%和36%具有强和中等产生物膜能力。产生物膜菌株感染的患者较非产生物膜细菌感染的前列腺炎患者具有更高的美国国立卫生研究院慢性前列腺炎症状评分(National Institute of Health Chronic Prostatitis Symptom Index,NIH-CPSI)。在接受标准的抗菌药物治疗后的随访中,虽然接近60%的患者细菌学转阴,但NIH-CPSI改善的患者不足10%。
前列腺炎患者的细菌生物膜形成黏附于导管系统的上皮细胞或存在于前列腺的钙化灶内,抗菌药物治疗容易清除游离细菌,但对生物膜内的细菌清除能力有限,细菌持续存在唤醒持续的免疫反应刺激和炎症浸润,导致症状迁延不愈或临床细菌检出困难,使抗菌药物的应用失去指导。目前对于这种状况,临床检测能力有限。而在治疗中,在初始标准疗程抗菌药物治疗失败后,有研究显示使用阿奇霉素和左氧氟沙星或环丙沙星联合用药进行又一个周期的治疗可以取得很好的效果,其中阿奇霉素不仅可以杀灭细菌,同时具有很好的对抗细菌生物膜的作用。
大鼠膀胱灌注大肠埃希菌后制作成尿路感染动物模型。取膀胱黏膜标本通过扫描电镜及光学显微镜观察发现,大肠埃希菌感染后2h可见细菌正在穿入膀胱黏膜光滑的表层,6h后在光滑的膀胱上皮表面出现大量包裹在类生物膜结构内的细菌聚集体形成的结节状细菌包涵体结构。进一步研究显示,这些结节状结构并不是固定在宿主细胞的细胞膜上,而是游离在上皮细胞胞质内,表面包含形成正常膀胱上皮细胞光滑表面的膜本体蛋白质,内部包含大量细菌,但这些细菌改变了自身结构,FimH菌毛消失,细菌失去杆状结构而变成均匀一致的球形;球形细胞表面仍然有大量的纤维表达,细菌之间通过这些纤维与细菌包涵体内部的矩阵结构紧密连接在一起,形成稳固的网络样支撑结构。免疫组化染色发现,这些结节状细菌包涵体具有典型大肠埃希菌生物膜形成的重要刺激物——1型菌毛和抗原43的表达以及生物膜基础成分(多糖-蛋白复合物)的表达,证实了这是一个细胞内的生物膜结构。这是人类第一次在上皮细胞内发现生物膜结构,此生物膜结构存在的意义在于急性感染时使得细菌存在于一个稳定的环境中,以应对机体自身免疫机制,避免被吞噬细胞吞噬,并且对抗菌药物治疗产生抵制。有学者将此定义为细胞内细菌群落(IBCs)。IBCs只产生于表层膀胱上皮细胞,在感染12h后,宿主表层细胞脱落时,IBCs通过激发未知信号通路在形成后数小时内自行消散,内部的细菌变成纤细的丝状溢出,并设法避免被快速清除而侵入邻近细胞或底层细胞,引发感染并启动新的IBCs形成周期,建立更稳固的IBCs。IBCs表面包含形成正常膀胱上皮细胞表面的膜本体蛋白质,因此可以逃避宿主的免疫机制,以溶酶体结合性膜蛋白(lysosome-associated membrane protein-1,LAMP-1)阳性的细胞内囊泡形式存在,称为膀胱内大肠埃希菌的慢性静态细胞内存储池(quiescent intracellular reservoirs,QIRs),也因此使得膀胱成为继肠道、阴道后的第三大肠埃希菌QIRs,它的存在是宿主基因变异和致病菌生存策略之间共同作用的结果。
已有学者对急性非复杂性膀胱炎患者的清洁中段尿标本进行检测,结果14例(18%)检测到IBCs,33例(41%)检测到丝状细菌,对比于未检测到IBCs和丝状细菌的患者,这些患者的尿培养细菌计数更多,症状更重。IBCs的理论很好地解释了如此少量细菌进入膀胱就会引起严重感染症状的原因。急性非复杂性下尿路感染初次发作治愈后的复发是临床上困扰医师和患者的重要问题。既往观点认为,反复发作性下尿路感染每次急性发作时的细菌与初次发作一样来自肠道或阴道,不是膀胱内细菌没有清除,而是由于患者抵抗力低下等原因造成的新感染。IBCs理论的出现使得反复发作性下尿路感染的发病机制有了新的解释,即再次发作的细菌可能不是来源于肠道或阴道,而是来自膀胱上皮细胞内的QIRs。动物实验研究证实,对于形成IBCs的大鼠模型,膀胱黏膜底层的上皮细胞内的QIRs在移行到表层时会引起尿路感染复发。临床研究也证实,68%的反复发作尿路感染是由于第一次发作同源细菌感染所致,而且对于反复发作的尿路感染患者,虽然尿培养已经证实了尿液无菌,但仍有24%患者的膀胱活检组织细菌培养阳性,这些存在于膀胱组织中的细菌有可能成为膀胱炎反复发作的细菌来源。但由于此方面的临床研究较少,所以尚不能定论,但IBCs的存在为反复发作膀胱炎的病因研究以及预防和治疗指导提供了很好的思路。
(刘犇 乔庐东 编 郑波 审)
对尿路感染而言,基于不同目的,不同学者给出不同的分类方法,本节就一些尿路感染相关研究机构制订的尿路感染分类方法进行详细阐述。需要强调的是,所有分类都是为了方便日常评估和用于临床研究的一种工具,总体目标是为临床医师和研究人员提供标准化的工具和命名。
除了按感染部位、两次感染之间的关系等分类外,目前国内外多采用美国感染性疾病学会(Infectious Diseases Society of America,IDSA)和欧洲临床微生物学与感染性疾病学会(European Society of Clinical Microbiology and Infectious Diseases,ESCMID)的分类方法。该方法制订的目的是指导治疗尿路感染的新抗菌药物研发,依据感染发生时不同的尿路状态对尿路感染进行分类,它是目前所有尿路感染治疗新药制订1~4期临床研究方案的设计基础。
急性非复杂性尿路感染是一种临床综合征。主要症状有尿痛、尿急、尿频、严重血尿、腰背和/或腹部不适,以及(极少部分患者)轻度发热。急性膀胱炎由微生物侵入膀胱和/或尿道表面黏膜引起的炎症反应。基本上所有急性膀胱炎患者都有菌尿,但1/3患者尿培养菌落计数<10 5 cfu/mL。有资料显示,大约有30%膀胱炎患者经研究证实存在肾脏感染但没有肾盂肾炎的临床症状,而一般的非侵入性检查很难确诊。临床使用非复杂性尿路感染一词主要针对没有已知潜在肾或泌尿系统功能障碍,但有尿痛、尿频和尿急表现的年轻女性,其所患疾病主要为细菌性膀胱炎,伴或不伴静息性肾盂肾炎。由于很多药物经肾脏代谢,从尿液排出,故抗菌药物容易到达感染部位。极少数女性患者下尿路症状由其他感染性疾病引起,最常见的是由沙眼衣原体、淋病奈瑟菌引起的尿道炎或单纯疱疹病毒感染或阴道炎,而此种情况患者无细菌尿表现,可作为临床鉴别诊断依据。
急性非复杂性肾盂肾炎是一种临床综合征,以发热、寒战、腰痛、肋脊角压痛为特征,可能伴有恶心、呕吐等其他症状。患者可不伴有下尿路感染,如尿痛等症状。急性肾盂肾炎少见菌血症引起的低血压等严重后果,这种低血压通常是由细菌感染肾脏引起的全身炎症反应综合征引起的。绝大多数急性非复杂性肾盂肾炎患者为年龄在18~40岁的女性。如果没有梗阻,一般以尿培养菌落计数≥10 4 cfu/mL作为急性非复杂性肾盂肾炎的诊断标准。急性非复杂性肾盂肾炎应被认为是一种深部组织感染,感染部位理化环境特殊和药物到达困难,因此局部宿主防御力相对较低。
尿路感染发生时,患者留置导尿管或存在尿路功能或解剖异常的情况,称为复杂性尿路感染。此类感染症状并不局限于下尿路,而且通常发生于老年患者,男性的尿路感染也被认为是复杂性尿路感染。复杂性尿路感染常由除大肠埃希菌以外其他的细菌引起,更容易对常用抗菌药物耐药,或因尿路植入物的存在导致感染很难治疗。
复杂性尿路感染是指患者发生尿路感染同时还存在以下一项或多项合并因素:①存在留置导管或使用间歇导管;②排尿后残余尿>100mL;③膀胱出口梗阻、结石或其他原因引起的泌尿系梗阻性疾病;④膀胱输尿管反流或其他泌尿系统异常,包括手术回肠襻;⑤肾脏疾病引起的氮质血症,即使没有明确的尿路解剖异常;⑥肾移植。
此分类方法虽然至今已近20年,但由于其方便临床医师实际操作,对指导临床医师制订相应的治疗方案、设计尿路感染相关抗菌药物临床研究等方面有很大的实用价值,故仍被广泛应用,并成为大多数更新分类方法的基础。
从医院感染控制的角度而言,美国疾病预防控制中心(Centers for Disease Control,CDC)于1988年定义了非社区(nosocomial)尿路感染,并于2008年应用“医疗保健相关尿路感染”(health care-associated UTI或HAI)替代了“非社区尿路感染”。医疗保健相关尿路感染包括症状性尿路感染(symptomatic urinary tract infection,SUTI)、无症状菌尿(asymptomatic bacteriuria,ASB)和其他泌尿系统感染(other infections of the urinary tract,OUTI)。之后,相关概念又经过了不断更新。CDC于2021年发布的《尿路感染(导管相关尿路感染和非导管相关尿路感染)事件》[ Urinary Tract Infection ( Catheter - Associated Urinary Tract Infection and Non - Catheter - Associated Urinary Tract Infection ) Events ]对医疗保健相关尿路感染的定义如下:
1.症状性尿路感染
(1)SUTI 1a:导管相关尿路感染(catheter-associated urinary tract infection,CAUTI)。
(2)SUTI 1b:非导管相关尿路感染(non-catheter-associated urinary tract infection,non-CAUTI)。
(3)SUTI2:年龄≤1岁患者的导管相关尿路感染或非导管相关尿路感染(CAUTI or non-CAUTI in patients 1 year of age or less)。
2.无症状细菌性尿路感染(asymptomatic bacteremic urinary tract infection,ABUTI)。
美国CDC尿路感染诊断标准见表1-1-4-1。
表1-1-4-1 美国CDC尿路感染诊断标准

续表

续表

引自:Urinary Tract Infection(Catheter-Associated Urinary Tract Infection[CAUTI]and Non-Catheter-Associated Urinary Tract Infection[UTI])Events.(January,2021). https://www.cdc.gov/nhsn/pdfs/pscmanual/7psccauticurrent.pdf.
CAUTI发生率=(CAUTI发生例数/导管天数)×1 000
除此之外,为加强泌尿外科手术或操作相关切口部位感染的监控,美国CDC制订了“医疗保健相关泌尿系统感染”(即原来的OUTI)的定义,包括肾、输尿管、膀胱、尿道或腹膜后或肾周围组织的感染。具体标准见表1-1-4-2。
表1-1-4-2 美国CDC泌尿系统感染诊断标准

引自:Urinary Tract Infection(Catheter-Associated Urinary Tract Infection[CAUTI]and Non-Catheter-Associated Urinary Tract Infection[UTI])Events.(January,2021). https://www.cdc.gov/nhsn/pdfs/pscmanual/7psccauticurrent.pdf.
* :无其他已知病因。
此分类方法用于医院感染控制意义重大。举例来说,无症状菌尿在普通人群中有一定的发生率,但除了孕妇、准备行尿路手术和尿路黏膜有破损风险的患者外,均无须筛查和治疗,然而从院内感染的角度去理解这一概念则有另一重意义,甚至定义为“无症状细菌性尿路感染”进行上报,旨在加强医院内感染的防控,引起医师的高度重视。从临床诊疗来讲,该定义并不包括社区获得性尿路感染以及常见的非复杂性膀胱炎、非复杂性肾盂肾炎等,对临床治疗的指导作用不大。
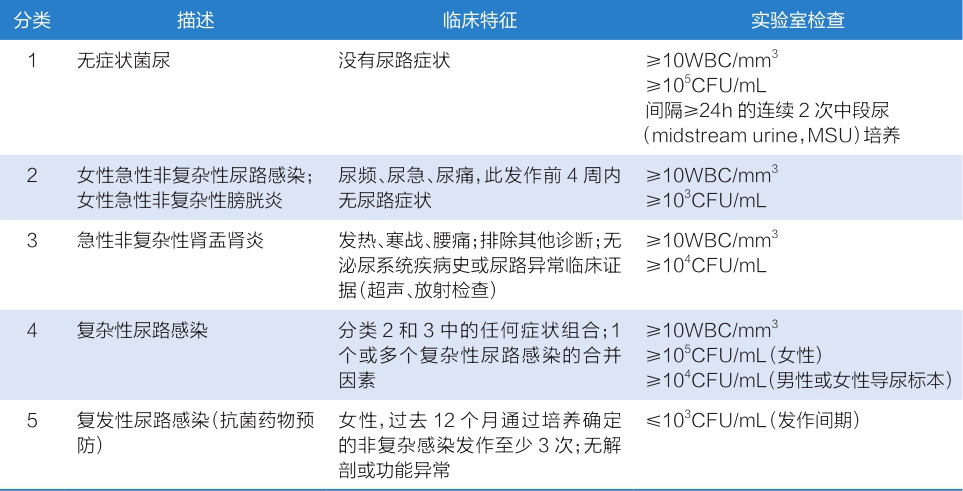
2010年,欧洲泌尿外科协会感染学组(European Section of Infection in Urology,ESIU)与国际尿路疾病咨询委员会(International Consultation on Urological Diseases,ICUD)合作,发起了一项旨在提高泌尿外科的诊断和管理水平的倡议,包括对123位作者的3 600篇参考文献进行系统回顾。倡议在IDSA和ESCMID分类基础上,结合临床药物实验中UTI的临床和微生物诊断标准,提出了一种基于临床表现和危险因素的尿路感染新分类方法(表1-1-4-3)。
表1-1-4-3 ESIU修正后尿路感染分类
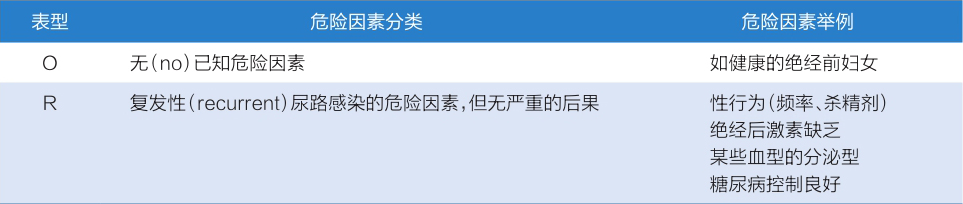
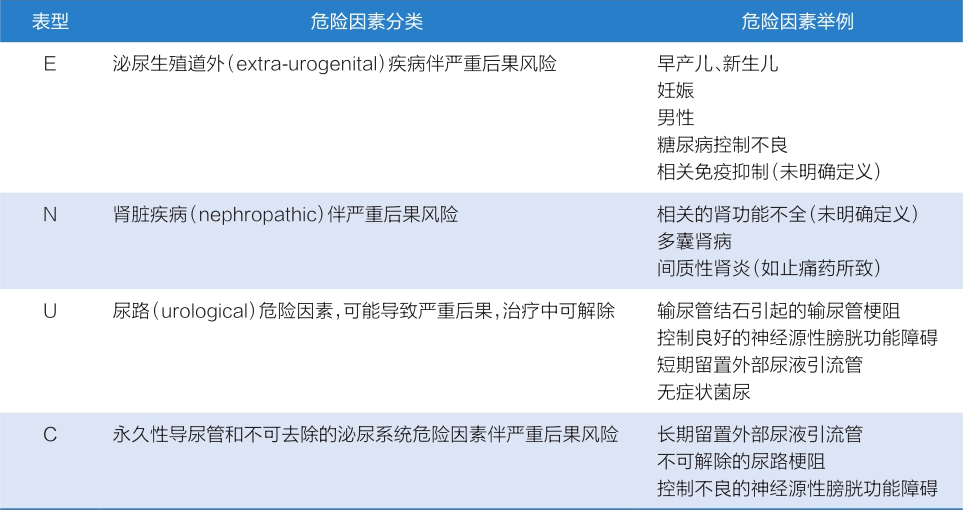
为了帮助临床医师对患者危险因素进行评估,ESIU还设定了危险因素评估标准——ORENUC危险因素评估系统,将患者尿路感染合并的危险因素分为六大类(表1-1-4-4)。其中,O:无已知危险因素;R:尿路感染复发危险因素,但无严重后果风险;E:泌尿生殖系统外危险因素;U:泌尿系统可解除的(暂时性)危险因素;C:有外部导尿管留置和无法解除的尿路危险因素。
表1-1-4-4 依据ORENUC系统的尿路感染宿主危险因素分类
续表
现结合ORENUC分类系统,对ESIU修正后尿路感染分类进行阐述:
指尿中发现一定数量非致病病原菌生长。大多数无症状人群尿中存在的细菌可能为共生定植菌群。此分类对于尿液中细菌的数量进行了详细的规定:①在没有症状的情况下,女性患者连续2次MSU、男性患者1次MSU中的细菌(潜在尿路病原菌)生长≥10 5 CFU/mL。对于女性患者,2次尿标本采集要求间隔24h以上,以排除污染。因女性患者一过性菌尿常见,10%~15%首次菌尿患者在重复培养时会出现阴性结果,间隔时间越长第2次尿标本培养阴性的可能性就越大。男性患者在留取尿标本过程中发生污染的概率很小,所以仅检验1次标本即可。②对于导尿标本,不论男女,细菌数≥10 2 CFU/mL即可确诊。男性患者需要除外前列腺炎。对于这些人群,自发性无症状菌尿可能为共生定植菌群所致,对症状性尿路感染是有保护作用的,所以临床应谨慎掌握治疗指征。本分类中让人困惑的是对尿中白细胞数进行了标注即“≥10个/mm 3 ”,这沿用了IDSA和ESCMID的诊断标准。但IDSA在2005年的《美国传染病学会成人无症状菌尿诊断和治疗指南》( Infectious Diseases Society of America Guidelines for the Diagnosis and Treatment of Asymptomatic Bacteriuria in Adults )中对无症状菌尿的诊断标准给出了明确的定义,即基于尿培养细菌学结果的诊断,并提出无症状菌尿患者伴有脓尿时不能作为应用抗菌药物指征。尿白细胞升高表示脓尿,临床上常将无症状菌尿和脓尿混淆,需要注意的是菌尿表示尿中存在病原菌,而脓尿仅表示尿路上皮的炎症反应,这个炎症反应可以由细菌引起(即尿路感染),也可以由结石等疾病刺激尿路上皮所引起,所以无症状菌尿是独立于脓尿之外的诊断。68%的年轻女性患者连续2次尿培养阳性但尿中并没有白细胞的升高,所以菌尿和脓尿二者可以分别存在,也可以同时存在,但总体趋势是尿中细菌计数越多,脓尿出现的概率越大。
包括散发性或复发性社区健康人群急性膀胱炎和急性肾盂肾炎。依据ORENUC危险因素分类系统,此部分患者存在宿主风险因素O和R,部分是E。这些尿路感染多见于尿路内无相关结构和功能异常的女性。有急性下尿路症状的妇女MSU尿路病原体菌落计数为≥10 3 CFU/mL即可诊断非复杂性膀胱炎。对于急性肾盂肾炎,泌尿病原体菌落计数≥10 4 CFU/mL被认为有诊断意义。
指尿路感染伴泌尿生殖系统结构或功能异常,或与非复杂性尿路感染相比存在增加不良后果或治疗失败风险的潜在疾病。依据ORENUC危险因素分类与复杂性UTI相关的危险因素主要属于N、U和C。
对于复杂性尿路感染,有意义的菌尿定义为女性患者MSU细菌培养≥10 5 CFU/mL,男性患者MSU细菌培养≥10 4 CFU/mL,导尿标本MSU细菌培养≥10 4 CFU/mL。
除此之外,复杂性尿路感染的细菌谱更广泛,细菌耐药情况也更明显(详见后面章节)。
即使在解剖和功能都正常的女性人群中,复发性尿路感染仍很常见。此分类定义患者近12个月至少有3次无并发症的尿路感染发作。复发性尿路感染需要经尿培养证实,依据急性非复杂性膀胱炎的细菌学判定标准,即MSU中病原菌≥10 3 CFU/mL判定。而EAU《尿路感染诊疗指南》(EAU Guidelines on Urological Infections )连续多年将复发性尿路感染定义为:每年至少发生3次UTI或在过去6个月中发生过2次UTI。具体诊断和治疗方案详见后面章节。
ESIU和ICUD尿路感染分类包含临床常见尿路感染疾病,但一些疾病的诊断标准与CDC医疗保健相关尿路感染诊断标准有差别。
临床医师对尿路感染患者,应根据临床症状、实验室检查和细菌培养以及是否合并危险因素和感染的严重程度等进行综合评估。为便于临床评估,ESIU对尿路感染诊断标准中的具体细节进行了充分的整理,详细评估内容见表1-1-4-5。表1-1-4-6则根据患者泌尿系统感染临床表现及严重程度进行了分级。
表1-1-4-5 UTI的诊断评估标准

续表

表1-1-4-6 泌尿系统感染临床表现及严重程度分级
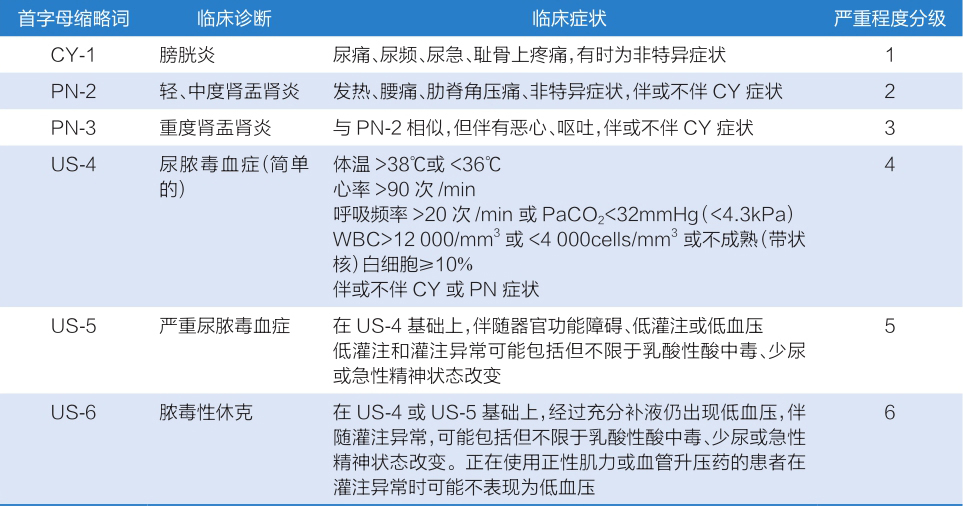
CY:膀胱炎(cystitis);PN:肾盂肾炎(pyelonephritis);US:尿脓毒血症;PaCO 2 :动脉血二氧化碳分压(arterial blood partial pressure of carbon dioxide);WBC:白细胞(white blood cell)。
ESIU以上分类方法、临床表现、危险因素、疾病严重程度以及相应处理原则汇总见图1-1-4-1。
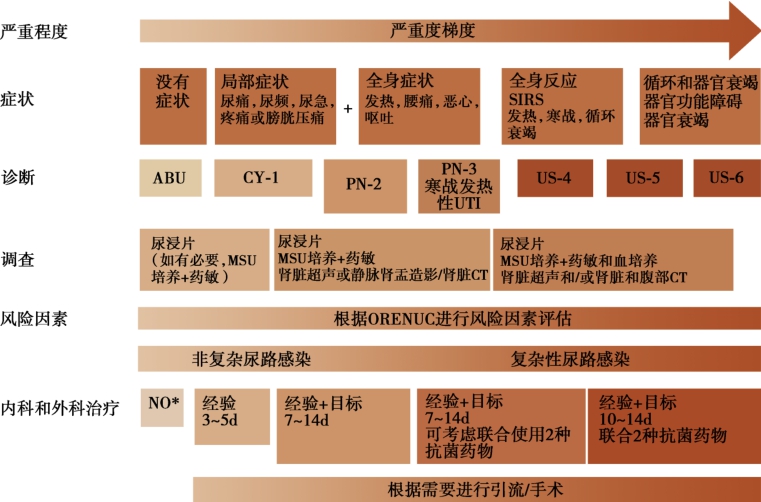
图1-1-4-1 ESIU尿路感染分类概要图及诊断和治疗原则
CT:计算机断层扫描;CY:膀胱炎;IV:静脉注射;MSU:中段尿液样本;PN:肾盂肾炎;US:尿脓毒血症;UTI:尿路感染。
* :目前公认的两个例外情况:妊娠期间和泌尿外科手术前。
引自:SMELOVAB V,NABER K,JOHANSEND TEB. Improved classification of urinary tract infection:future considerations. European Urology Supplements,2016,15(4):71-80.
(乔庐东 编 郑波 审)
尿常规检查通常包括尿液理学检查、尿生化检查和尿沉渣检查。不同时段尿标本留取的特点和用途见表1-1-5-1。
表1-1-5-1 不同时段尿标本留取的特点和用途

(1)尿量:
指24h内人体排出体外的尿液总量。尿量主要取决于肾脏功能,但也受精神、饮水量、活动量、年龄、药物应用和环境温度等因素的影响。
1)多尿:
成人24h尿量>2 500mL,儿童24h尿量>3 000mL称为多尿。①生理性多尿:指当肾脏功能正常时,由于外源性或生理性因素(如饮水过多、食用含水量多的食物、静脉输液、精神紧张等)所致的多尿,也可见于服用利尿剂、咖啡因、脱水剂等药物者;②病理性多尿:可见于内分泌疾病、肾脏疾病和代谢性疾病等的患者。
2)少尿与无尿:
成人尿量<400mL/24h或<17mL/h,学龄前儿童尿量<300mL/24h,婴幼儿尿量<200mL/24h,称为少尿(oliguria);成人24h尿量<100mL,小儿尿量<30~50mL,称为无尿(anuria)。少尿与无尿主要由肾前性、肾性和肾后性等因素所致。
(2)颜色:
因含有尿色素、尿胆素、尿胆原等物质,健康人的尿液肉眼观察多呈淡黄色或黄色。在病理情况下尿液可呈不同的颜色。
1)红色:
最常见的尿液颜色变化是红色,其中以血尿最常见。1 000mL尿所含血量超过1mL,外观可出现红色尿液,称为肉眼血尿。
2)深黄色:
最常见的是胆红素尿。含有大量结合胆红素的尿液称为胆红素尿。胆红素尿的外观呈深黄色豆油样,振荡尿液后其泡沫仍呈黄色,胆红素定性检查呈阳性,常见于胆汁淤积性黄疸及肝细胞性黄疸。尿液放置过久,胆红素被氧化为胆绿素,可使尿液外观呈棕绿色。另外,某些食物和药物也可使尿液外观呈黄色,如维生素B 2 、利福平等。

图1-1-5-1 蓝紫色尿液
3)白色:
①乳糜尿和脂肪尿外观呈乳白色、乳状浑浊或脂肪小滴,常见于丝虫病及肾周围淋巴管梗阻,脂肪挤压损伤、骨折和肾病综合征等;②脓尿和菌尿外观呈白色浑浊或云雾状,常见于泌尿系统感染,如肾盂肾炎、膀胱炎、尿道炎等;③结晶尿外观呈黄白色、灰白色或淡粉红色,主要由于尿液含有高浓度的盐类结晶所致,以磷酸盐和碳酸盐最常见,还可见尿酸盐、草酸盐结晶。
4)黑褐色:
见于重症血尿、变性血红蛋白尿,也可见于酪氨酸病、酚中毒、黑尿酸症或黑色素瘤等。
5)蓝色(图1-1-5-1):
主要见于尿布蓝染综合征,也可见于尿蓝母、靛青生成过多的某些胃肠疾病等,以及某些药物或食物的影响。
6)淡绿色:
见于铜绿假单胞菌感染,以及服用某些药物后,如吲哚美辛、亚甲蓝、阿米替林等。
(3)透明度:
正常尿液清晰透明。新鲜尿液发生浑浊可由盐类结晶、红细胞、白细胞(脓细胞)、细菌、乳糜等引起,呈现不同清晰度,如灰白色云雾状、红色云雾状、黄色云雾状、膜状、白色絮状等。
(4)比重:
指4℃条件下尿液与同体积纯水的重量之比,是尿液中所含溶质浓度的指标。比重与尿液中水分、盐类及有机物含量和溶解度有关,与尿液溶质(氯化钠等盐类、尿素、肌酐)的浓度呈正比,也受测试者年龄、饮食和尿量等影响;在病理情况下,则受尿糖、尿蛋白及细胞、管型等成分影响。
1)比重增高:
比重>1.025的尿液称为高渗尿或高比重尿,常见于血容量不足导致的肾前性少尿、糖尿病、急性肾小球肾炎、肾病综合征等。
2)比重降低:
比重<1.015的尿液称为低渗尿或低比重尿,常见于大量饮水、慢性肾小球肾炎、肾小管间质性疾病、慢性肾衰竭、尿崩症等。
3)尿比重固定:
尿比重固定于1.010±0.003,提示肾脏浓缩稀释功能丧失。
(5)酸碱度(pH):
尿液酸碱度受食物、药物和多种疾病的影响。
1)pH降低:
进食肉类及混合性食物等,服用氯化铵、维生素C等酸性药物,酸中毒、高热、糖尿病、痛风等。
2)pH增高:
进食蔬菜、水果,服用噻嗪类利尿剂、碳酸氢钠等碱性药物,碱中毒、膀胱炎及肾小管性酸中毒等。另外,尿液放置过久,尿素分解释放氨,可使尿液呈碱性。
3)药物干预:
尿液pH可作为指导用药的一个指标。用氯化铵酸化尿液,可促使碱性药物从尿液中排出;而用碳酸氢钠碱化尿液,可促使酸性药物从尿液中排出。
目前最常用的是半自动或全自动的尿液干化学分析仪,使用多联试剂带浸入,一次尿液可同时测定多个项目。
(1)蛋白质:
正常情况下,肾小球滤过膜能够有效阻止相对分子质量在4万以上的蛋白质通过。虽然相对分子质量<4万的蛋白质能够通过滤过膜,但又可被近曲小管重吸收。所以,健康成人每天通过尿液排出的蛋白质极少(30~130mg),一般常规定性方法检查呈阴性。蛋白质浓度>100mg/L或150mg/24h尿液,蛋白质定性检查呈阳性的尿液,称为蛋白尿。
1)生理性蛋白尿
功能性蛋白尿:
是指因剧烈运动(或劳累)、受寒、发热、精神紧张、交感神经兴奋等所致的暂时性蛋白尿,与肾血管痉挛或充血导致的肾小球毛细血管壁通透性增高有关,多见于青少年,尿蛋白定性不超过(+),定量不超过500mg/24h。
体位性蛋白尿:
又称为直立性蛋白尿,可能是由于人体直立位时前突的脊柱压迫左肾静脉导致局部静脉压增高所致,卧位休息后蛋白尿即消失。此种蛋白尿多发生于瘦高体形的青少年。
2)病理性蛋白尿:
见于各种肾脏及肾脏以外疾病所致的蛋白尿,多为持续性蛋白尿。①肾小球性蛋白尿:常见于急性肾炎、肾缺血和糖尿病肾病;②肾小管性蛋白尿:常见于肾盂肾炎、间质性肾炎、重金属中毒、药物损害及肾移植术后等;③混合性蛋白尿:常见于糖尿病、系统性红斑狼疮等;④溢出性蛋白尿:常见于溶血性贫血、挤压综合征、多发性骨髓瘤、浆细胞病、轻链病等;⑤组织性蛋白尿:常见于肾小管受炎症或药物刺激等;⑥假性蛋白尿:常见于肾脏以下的泌尿道疾病,如膀胱炎、尿道炎、尿道出血及尿液内混入阴道分泌物等。
(2)尿糖:
一般指尿液中的葡萄糖,也有微量乳糖、半乳糖、果糖、核糖、戊糖等。健康人尿液中有微量葡萄糖,定性检查为阴性。尿糖定性检查呈阳性的尿液称为糖尿。血糖浓度超过8.88mmol/h,尿液中开始出现葡萄糖时的血糖浓度称为肾糖阈。肾糖阈值可随肾小球滤过率和肾小管葡萄糖重吸收率的变化而变化。肾小球滤过率降低可导致肾糖阈值增高,而肾小管重吸收率降低则可引起肾糖阈值降低。肾小管重吸收能力降低也可引起葡萄糖尿,但其血糖浓度正常。
1)血糖增高性糖尿
代谢性糖尿:
由于糖代谢紊乱引起高血糖所致,典型的是糖尿病。
应激性糖尿:
指在颅脑外伤、脑血管意外、情绪激动等情况下,延髓血糖中枢受刺激,导致肾上腺素、胰高血糖素大量释放,出现的暂时性高血糖和糖尿。
摄入性糖尿:
指短时间内摄入大量糖类或输注高渗葡萄糖溶液,引起血糖暂时性增高而产生的糖尿。
内分泌性糖尿:
生长激素、肾上腺素、糖皮质激素等分泌过多,都可使血糖浓度增高。
2)血糖正常性糖尿:
指血糖浓度正常,但由于肾小管病变导致其重吸收葡萄糖的能力降低,即肾糖阈下降而出现的糖尿,又称为肾性糖尿。常见于慢性肾炎、肾病综合征、间质性肾炎、家族性糖尿病等。
3)暂时性糖尿:
可见于饮食性糖尿、精神性糖尿、妊娠期糖尿、应激性糖尿、新生儿糖尿和药物性糖尿等。
4)其他糖尿:
进食乳糖、半乳糖、果糖、甘露糖及一些戊糖等过多或体内代谢失调使血液浓度增高时,可出现相应的糖尿。
5)假性糖尿:
尿液中含有的某些还原性物质,如维生素C、尿酸、葡糖醛酸,以及一些随尿液排出的药物,如异烟肼、链霉素、水杨酸、阿司匹林等,可使尿糖定性检查出现假阳性反应。
(3)酮体:
是脂肪氧化代谢过程中的中间代谢产物。健康人血液中有少量的酮体。当肝脏内酮体产生的速度超过肝外组织利用的速度时,血液酮体浓度增高,称为酮血症。过多的酮体从尿液排出形成酮尿。尿液酮体检查主要用于糖代谢障碍和脂肪不完全氧化的判断与评价。
1)糖尿病酮症酸中毒:
由于葡萄糖利用减少,而分解脂肪产生酮体增加,糖尿病酮症酸中毒患者酮体检查呈阳性。尿液酮体对诊断糖尿病酸中毒或昏迷有极高的价值,并能与低血糖、心脑血管疾病的酸中毒或高血糖渗透性糖尿病昏迷相鉴别(尿液酮体一般不高)。但糖尿病酮症酸中毒患者伴有肾衰竭,而肾阈值增高时,尿液酮体亦可减少,甚至完全消失。
2)非糖尿病性酮症:
如感染性疾病(肺炎、伤寒、败血症、结核等)、严重呕吐、剧烈运动、腹泻、长期饥饿、禁食、全身麻醉后等患者均可出现酮尿。
3)中毒:
如氯仿、乙醚麻醉后和磷中毒等,尿液酮体检查也可呈阳性。
4)药物影响:
服用降糖药的患者,由于药物有抑制细胞呼吸的作用,也可出现尿酮体阳性的现象。
(4)尿液胆红素与尿胆原:
相关检查主要用于黄疸的鉴别,通常需要结合血生化指标进行判断。
(5)亚硝酸盐:
正常为阴性。阳性见于大肠埃希菌等革兰氏阴性菌引起的尿路感染,尿液中细菌数>10 5 /mL时多数呈阳性反应。阳性反应程度与尿液中细菌数不成正比。亚硝酸盐结合尿白细胞检测用于判断尿路感染。应注意尿中有大量淋巴细胞时该结果为阴性。
(6)白细胞酯酶:
尿液白细胞酯酶试验原理主要是单核细胞、中性粒细胞、嗜酸或嗜碱性细胞以及巨噬细胞等的细胞质中含有白细胞酯酶,而该种酶能够对吲哚酚酯进行水解形成有机酸与吲哚酚,吲哚酚进一步氧化则会形成靛蓝,或是吲哚酚与重氮盐结合形成重氮色素,因此其颜色深浅与酶含量成正比关系,从而能够对尿液中的白细胞进行检测。通常反应尿中性粒细胞变化,正常为阴性,尿路感染时多为阳性,存在一定的假阴性。
常用方法有尿沉渣显微镜检查和尿有形成分分析仪检查。
(1)细胞
1)红细胞:
离心尿液中红细胞数量增多,超过3个/HPF,且外观无血色的尿液称为镜下血尿。在低渗尿液中,红细胞胀大,甚至使血红蛋白溢出,形成大小不等的空环形,称为红细胞淡影或影形红细胞。①均一性红细胞:见于肾小球以外部位的泌尿系统出血,如尿路结石、损伤、出血性膀胱炎、血友病、剧烈活动等;②非均一性红细胞:见于肾小球肾炎、肾盂肾炎、肾结核、肾病综合征,此时多伴有蛋白尿和管型;③混合性红细胞:以上2种红细胞混合存在。
2)白细胞和脓细胞:
尿液中的白细胞主要是中性粒细胞,在新鲜尿液中其形态与血液白细胞一致;在炎症过程中被破坏或死亡的白细胞称为脓细胞。白细胞检查主要用于泌尿系统感染的诊断。如果尿液白细胞数量增多,超过5个/HPF,称为镜下脓尿。白细胞数量增多主要见于肾盂肾炎、膀胱炎、肾移植排斥反应、药物性急性间质性肾炎、新月形肾小球肾炎、阴道炎和宫颈炎等。
3)上皮细胞:
尿液中的上皮细胞来源于肾小管、肾盂、肾盏、输尿管、膀胱和尿道等,也可能因为阴道脱落上皮细胞污染标本所致。
上皮细胞检查对泌尿系统疾病有定位诊断的价值:①肾小管上皮细胞数量增多,提示肾小管有病变,见于急性肾小球肾炎、急进性肾炎和肾小管坏死;②移行上皮细胞数量增多,提示泌尿系统相应部位病变,如膀胱炎、肾盂肾炎患者移行上皮细胞明显增多,并伴有白细胞增多;③鳞状上皮细胞数量增多,主要见于尿道炎,并伴有白细胞或脓细胞数量增多。
(2)管型:
是蛋白质、细胞及其崩解产物在肾小管、集合管内凝固而成的圆柱形蛋白聚体,是尿沉渣中最有诊断价值的成分。构成管型的主要成分有由肾小管分泌的Tamm-Horsfall蛋白(T-H蛋白)、血浆蛋白、各种细胞及其变性的产物等。管型类型、性质对各种肾炎的诊断有重要的意义。管型的体积越大、越宽,表明肾脏损伤越严重。但是,当肾脏疾病发展到后期,可交替使用的肾单位减少,肾小管和集合管放缩稀释功能完全丧失后,则不能形成管型。所以,管型的消失究竟是病情好转还是恶化,应结合临床资料综合分析。
(3)结晶:
尿液的结晶多来自食物或盐类代谢。尿液盐类结晶的析出取决于该物质的饱和度及尿液的pH、温度和胶体物质(主要指黏液蛋白)的浓度等因素。
1)生理性结晶:
多来自食物及人体正常的代谢,如草酸钙结晶、磷酸盐结晶、马尿酸结晶、尿酸结晶及非结晶型尿酸盐等,一般无临床意义。
2)病理性结晶:
可由疾病因素或药物代谢异常所致,如胆红素结晶、脱氨酸结晶、亮氨酸结晶、胱氨酸结晶、胆固醇结晶和药物结晶等。
(4)其他:
除上述的有形成分外,尿液中还可见细菌、真菌、寄生虫、精子等。
1)细菌:
健康人新鲜尿液中无细菌存在和生长。当标本采集过程中尿液被污染时,可检出少量细菌,因此非经无菌手段采集到的新鲜尿液中检查到细菌无临床意义。如果在按无菌要求采集的尿液标本中见到较多量的细菌,同时见到大量白细胞和上皮细胞及红细胞,多提示尿路感染。
2)真菌:
多为白假丝酵母菌,常见于糖尿病患者、女性尿液或碱性尿液。
3)寄生虫:
尿液中的寄生虫及虫卵多为标本污染所致。如阴道毛滴虫多来自女性阴道分泌物,乳糜尿中可检查出微丝蚴。
既往研究显示,尿液外观浑浊对诊断症状性菌尿的敏感性为90.4%,特异性为66.4%。尿液生化检查用于诊断尿路感染的敏感性较低,阴性结果对除外尿路感染的特异性较高。尿沉渣对尿路感染诊断的敏感性为94.4%~100%,特异性为49.8%~73.4%,可以使38.5%~58.2%的患者免于尿培养检查。在临床中,对于诊断泌尿系统感染的常用指标有白细胞、亚硝酸盐、白细胞酯酶。研究显示,单项检测指标中,灵敏度和阴性预测值均是白细胞>白细胞酯酶>亚硝酸盐定性;特异性和阳性预测值均是亚硝酸盐定性>白细胞>白细胞酯酶。对于尿常规结果应进行综合判断后,再根据需要考虑细菌培养及药敏,以帮助临床对症治疗。
(1)排尿标本:
既往做过包皮环切术的男性患者收集尿标本前不需要特殊准备。未行包皮环切术的男性患者收集标本前,应上翻包皮,用肥皂水清洗阴茎头,然后用清水冲净后再收集标本。除非患者不能自行排尿,否则不必导尿取标本。对女性患者,应指导其分开阴唇,使用清水及湿纱布清洗尿道周围区域后再收集中段尿标本。不推荐使用消毒剂消毒尿道口。如果在排尿标本中检测到阴道上皮细胞和乳酸杆菌,考虑存在污染,此时应使用导尿标本。
(2)导尿标本:
导尿后收集导管中段尿比排尿标本更精确,但有医源性感染的可能。抗菌药物预防此类感染仅限于针对有感染高危因素的患者。如果患者无法自行排尿,应行导尿留取标本。
(3)耻骨上穿刺抽吸尿标本:
是最精确的留取标本的方法,但通常仅用于不能按要求排尿(如脊髓损伤)的患者,新生儿和截瘫患者也可以使用。
自1960年起,尿培养细菌菌落计数≥10 5 CFU/mL被认为是尿路感染的诊断指标,此数值对尿路感染诊断的特异性较高。1/3有下尿路症状的急性膀胱炎患者尿培养菌落计数<10 5 CFU/mL,以菌落计数≥10 2 CFU/mL作为尿路感染诊断标准的敏感性为95%,特异性为85%;使用抗菌药物治疗者以≥10 3 CFU/mL作为尿路感染诊断标准的敏感性为80%,特异性为90%。美国感染性疾病学会(IDSA)和欧洲临床微生物学和感染性疾病学会(ESCMID)规定的尿路感染细菌培养标准为:急性非复杂性膀胱炎,中段尿培养≥10 3 CFU/mL;急性非复杂性肾盂肾炎,中段尿培养≥10 4 CFU/mL;女性中段尿培养≥10 5 CFU/mL、男性中段尿培养,或女性复杂性尿路感染导尿标本≥10 4 CFU/mL。综上所述,并没有一个固定的数值可以用于在任何情况下诊断所有类型的尿路感染,需要根据临床情况具体分析。
(1)基本知识
1)药敏试验(drug susceptibility testing,DST):
体外测定药物抑菌或杀菌能力的试验,以便准确有效地利用药物进行治疗。
2)最低抑菌浓度(minimum inhibitory concentration,MIC):
是测量抗菌药物抗菌活性大小的一个指标,指在体外培养细菌18~24h后能抑制培养基内病原菌生长的最低药物浓度。
3)最低杀菌浓度(minimum bactericidal concentration,MBC):
指杀死99.9%(降低级3个数量)的供试微生物所需的最低药物浓度。
4)折点(breakpoint):
能预测临床治疗效果,用以判断敏感、中介、剂量依赖型敏感、耐药、非敏感的最低抑菌浓度(MIC)或抑菌圈直径(单位为mm)的数值,是临床医师选择抗菌药物治疗病原菌感染的一个重要依据。
5)NCCLS/ CLSI:
美国国家标准化委员会(National Committee Clinical Laboratory)/美国临床实验室标准化研究所(Clinical and Laboratory Standards Institute)。
6)多重耐药(multidrug-resistant organism,MDRO):
指细菌同时对多种常用抗微生物药物发生耐药。其定义为一种微生物对三类(比如氨基糖苷类、大环内酯类、β-内酰胺类、喹诺酮类、林可霉素类、四环素类)或三类以上抗菌药物同时耐药,而不是同一类的三种。
7)泛耐药(extensively-drug resistant,XDR):
指细菌对常用抗菌药物几乎全部耐药,革兰氏阴性杆菌仅对黏菌素和替加环素敏感,革兰氏阳性球菌仅对糖肽类和利奈唑胺敏感。
8)全耐药(pandrug resistant,PDR):
指细菌对所有分类的抗菌药物全部耐药,革兰氏阴性杆菌对包括黏菌素和替加环素在内的全部抗菌药物耐药,革兰氏阳性球菌对包括糖肽类和利奈唑胺在内的全部抗菌药物耐药。
9)敏感(sensibility,S):
表示被测抗菌药物普通剂量在体内达到的浓度大于被测定细菌的最低抑菌浓度(MIC),治疗有效。
10)耐药(resistance,R):
表示被测抗菌药物最大剂量在体内浓度小于被测菌的最低抑菌浓度,即使用大剂量该抗菌药物治疗仍无效。
11)中介(intermediary,I):
表示介于敏感和耐药之间的缓冲区域,需加大剂量使用才可能有效,在药物选择时应尽量避免使用此类药物。
(2)药敏试验目的:
对敏感性不能预测的临床分离菌株进行药敏试验,其意义在于预测抗菌治疗的效果,指导临床医师选择抗菌药物,提供所选择药物的依据以及监测耐药性。
(3)药敏试验判断标准:
目前我国药敏试验判断标准是参照美国临床实验室标准化研究所(CLSI)发布的标准文件,根据微生物学、抗菌药物的药代动力学(pharmacokinetics,PK)/药效学(pharmacodynamics,PD)和临床资料设定并定期修订抗菌药物对不同细菌敏感的折点,通过折点将细菌分为敏感(S)、中介(I)、耐药(R)。
(4)细菌耐药模式
1)常见细菌耐药模式:
β-内酰胺酶(β-lactam,BL)、超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)、头孢菌素酶(cephalosporinase)、甲氧西林耐药葡萄球菌(methicillin resistant Staphylococcus ,MRS)、高水平氨基糖苷类耐药肠球菌(high level aminoglycoside resistant Enterococcus ,HLARE)、耐青霉素肺炎链球菌(penicillin resistant streptococcus pneumoniae,PRSP)。
2)不常见的细菌耐药模式:
产碳青霉烯酶肠杆菌、耐万古霉素肠球菌(vancomycin resistant Enterococcus ,VRE)、耐万古霉素金黄色葡萄球菌(vancomycin resistant Staphylococcus aureus ,VRSA)。
(5)药敏报告单的基本信息:
①细菌名称、药敏方法、样本类型、MIC值、敏感度;②药物种类的选择(天然耐药的抗菌药物不做药敏试验);③检测标志性药物,提示对其他抗菌药物的敏感性;④检测耐药机制,根据耐药机制提示对其他抗菌药物的敏感性。
(6)抗菌药物药敏含义:
①每个方格中的一群类似药物,其结果解释(S、I、R)和临床疗效相似;②每个方格中药物间“或”字表明这些药物交叉耐药性和敏感性几乎完全相同;③大量菌株检测时,重要误差率+极重要误差率<3%,次要误差率<10%;④“或”用于解释“仅有敏感”解释标准的类似抗菌药物之间(如头孢唑啉或头孢曲松对流感嗜血杆菌);⑤由“或”连接的一种抗菌药物试验结果可预报其他抗菌药物结果;⑥无“或”连接的药物,由于结果不一致或研究数据不充分,一种药物检测结果不能预测其他药物结果。
(7)药敏结果阳性
1)培养阳性不一定是感染,可能标本污染,可能为定植菌。注意区别定植菌、污染菌、致病菌。
2)适应证明确,细菌感染,明确感染部位、感染性质、感染诊断才需要使用抗菌药物。天然耐药的抗菌药物肯定无效,耐药≠治疗无效,敏感≠治疗有效,一定要结合临床表现和治疗结果进行判断。
3)感染部位的外科治疗(清创、引流、换药)比使用抗菌药物更加重要。
4)改善患者全身情况:器官功能支持,纠正酸碱失衡、电解质紊乱、低蛋白血症、高血糖等。
(8)药敏结果阴性
1)非感染性疾病。
2)感染已治愈。
3)感染未治愈:各种原因导致病原体未检测出来。采样运送不当,标本采集、送检、保存不当,导致病原菌死亡,污染菌大量增殖。
4)抗菌药物影响:经抗菌治疗,标本中含大量抗菌药物,病原菌受损害,不能正常生长。
5)特殊病原体:常规培养无法检测的病原体,如厌氧菌、结核分枝杆菌、衣原体、支原体、病毒等,需要做进一步检测。
(9)药物选择:
①感染菌对同一种类药物的MIC越小,效果越好;②不同种类抗菌药物之间MIC无可比性;③MIC值是体外药敏标准,PK/PD是体内标准,临床疗效与MIC值的PK/PD动态密切相关,治疗方案应参考结合二者制订(时间依赖性抗菌药物在剂量足够的前提下,延长给药时间能获得更好的疗效,浓度依赖性抗菌药物在一定条件下,可以增加剂量,缩短给药时间,提高疗效)。
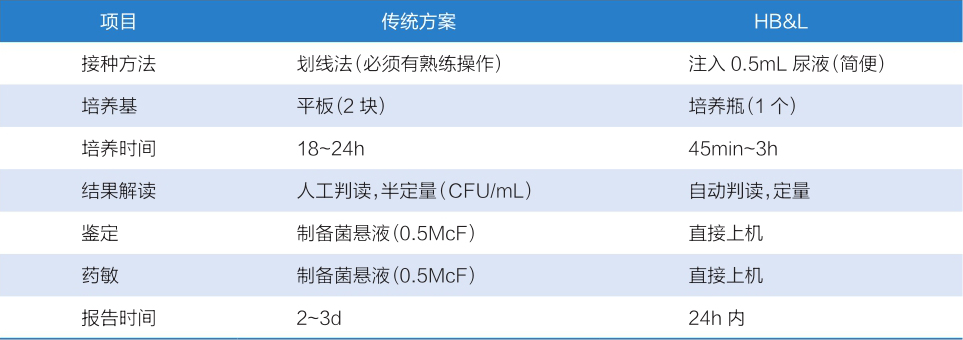
目前,临床上诊断UTI的金标准是尿培养,然而尿培养过程复杂,从标本采集到鉴定出结果耗时较长,并且大部分送检标本培养结果为阴性,浪费大量的人力、物力。随着现代化科技的飞速发展,临床检验技术也在不断更新,正向着自动化、快速、准确的方向发展。因此,寻找一种省时且准确率高的筛检方法,对于临床诊断UTI有十分重要的意义。HB&L微生物培养仪是一种快速、自动化的尿液和生物样品细菌筛查仪器。其利用光散射技术检测细菌生长,通过散射信号被计算和转化为生长曲线,实时推算原始样本中的细菌浓度,不仅定性细菌是否存在于培养液中,更重要的是通过数学算法反映原始样本中细菌的浓度。对于尿液标本,可于45min后得到阳性判断,3h出阴性结果,同时实时检测生长曲线,更方便做下一步生化、药敏和鉴定。KROUMOVA等人研究表明,质谱分析前采用HB&L增菌技术将样品富集到生长培养基中,能够快速鉴定生长菌落中的细菌。还有研究表明,尿液快速筛查系统中用于增菌的HB&L体液培养基适合于所有人体体液培养及血培养,并且能够培养较难培养的细菌。HB&L与传统方法区别详见表1-1-5-2。
表1-1-5-2 尿液培养HB&L与传统方法区别
聚合酶链反应(polymerase chain reaction,PCR)利用特异的DNA引物,将标本中的目标DNA序列成百万倍扩增,使敏感性和特异性大大提高。由于方法十分敏感,操作过程中的细小污染就容易出现假阳性结果,同时已经死亡失去致病性的微生物也可呈现阳性反应。因此,对其结果的分析应密切结合临床。临床上通常利用尿道拭子取得尿道分泌物后,进行PCR检测,根据结果指导治疗。
淋球菌、沙眼衣原体、解脲脲原体、单纯疱疹病毒、人乳头状瘤病毒是性病的主要病原体,常用检测方法有分泌物直接涂片法、快速抗原检测法、细菌(病毒)培养法、PCR检测法。分泌物直接涂片法虽然方法简便、易鉴定,但其阳性检测率低,误诊率、漏诊率高。快速抗原检测法作为无创性检测方法,具有不需要任何仪器设备、操作时间短、易于肉眼观察等优势,但同样存在阳性检测率低的问题。细菌培养法是目前世界卫生组织(World Health Organization,WHO)推荐的检测金标准。细菌(病毒)培养法对标本采集、检测人员操作技术、细菌培养条件均有较高的要求,同时还有检测时间长、操作烦琐、服用抗菌药物易产生假阴性等缺点,在一定程度上均可影响细菌的阳性检出率。PCR检测法是通过体外酶合成特异性DNA片段来检测目的DNA片段的方法,具有特异性强、灵敏度高、快速简便的特点。与细菌培养法比较,PCR检测法对标本的质量要求低,对于死亡的细菌同样具有特异性。同时,PCR检测法是针对细菌的DNA进行检测,因此能克服标本过少的问题。
大多数尿路感染病例根据临床症状和实验室检查结果就能做出正确的诊断,足够确定大多数患者的治疗方案,因此并不需要常规影像学检查。但是,对于具有以下危险因素的病例,需要进行影像学检查,如潜在输尿管梗阻[如结石(尤其是感染性结石)、输尿管狭窄、肿瘤等]或外科治疗病史诱发梗阻(如输尿管改道或再植),潜在肾乳头坏死,合理应用抗菌药物5~6d效果欠佳,需透析或严重肾功能不全的多囊肾、糖尿病、神经源性膀胱、少见病原体感染(如真菌、结核分枝杆菌、变形杆菌等相关尿素裂解病原体)等。对于明确细菌持续存在的原因,可进行影像学检查,特别是对于可能只有通过外科手段处理的难治性或复发性尿路感染病例,导致持续性菌尿存在、可处理的泌尿外科疾病如感染性结石、慢性细菌性前列腺炎、单侧感染后的萎缩肾、异物、尿道憩室和感染的尿道周围腺体、单侧髓质海绵肾、肾切除后无反流、外观正常但受感染的输尿管残端、感染的脐尿管囊肿、感染的肾盏交通性囊肿、肾乳头坏死、瘘管通向膀胱的膀胱周围脓肿等,应行影像学检查明确。
超声检查具有简便、无创伤、无痛苦、可反复多次检查等优点。相对于其他检查手段,超声检查经济、价值性高,对人体无放射性损害或造影剂过敏风险,可动态实时多切面连续检查。因此,肾脏超声检查是一个重要的肾成像技术,特别适用于识别结石、肾积水、肾积脓和肾周脓肿等。对于单一结石,应该结合放射线照片和超声检查的结果共同诊断。超声检查也用于判断膀胱残余尿的多少及前列腺的大小。超声检查的不足之处在于其依赖检查者对图像的解释和技术操作。此外,对肥胖或着装的患者以及检查部分有引流管或开放性伤口的患者,实施超声检查存在技术上的缺点。
肾-输尿管-膀胱(kidney-ureter-bladder,KUB)X线片可显影大部分泌尿系统结石,但需要与钙化、静脉石相鉴别。KUBX线片对于判断输尿管支架、引流管等其他异物有一定价值。静脉尿路造影(intravenous urography,IVU)可以通过显影情况发现病变,如观察肾盂显影情况评估肾脏功能(肾绞痛发作也可导致显影不良);观察肾盏杯口是否清晰锐利、输尿管走形是否自然,肾盏杯口呈虫蚀样改变或输尿管僵直常见于结核;观察肾盏肾盂输尿管是否扩张评估梗阻、是否有压迹评估肿物挤压、是否有充盈缺,损评估肾盂输尿管膀胱肿瘤或X线阴性结石。IVU是确定输尿管畸形及有无膀胱输尿管反流的一个重要检查,可能适用于评估神经源性膀胱、膀胱憩室以及极少数因尿道憩室导致持续感染的女性患者。但是,CT尿路成像由于具有强大的处理功能,三维重建后可立体、清晰地再现泌尿系全貌,较IVU更受青睐。
CT和MRI是能提供最佳解剖细节的放射学检查。它们在诊断急性局灶性细菌性肾炎、肾和肾周脓肿,以及放射线阴性结石方面,比排泄性尿路造影和超声检查敏感度更高。常规CT平扫+增强扫描及计算机体层摄影尿路造影(computed tomography urography,CTU)检查可用于诊断泌尿系各种疾病,包括外伤、炎症、结石、肿瘤、先天性畸形及血管性疾病等。在超声检查有阳性发现时,CT是进一步明确病变的有效检查,优于MRI。使用CT来定位肾和肾周脓肿时,CT为外科引流及经皮肾穿刺的通路提供了良好的参考。MRI在软组织分辨上有极高的优势。MRI在评估肾的炎症方面并没有取代CT,但在确定肾周炎症的范围方面具有一定优势。
锝[ 99m Tc]二巯丁二酸(technetium-99m dimercaptosuccinic acid, 99m Tc-DMSA)肾静态显像是一种用于发现肾脏炎症病变的非侵入性影像学检查。显像结果可见肾脏炎症反应引起的局部灌注不足导致的病变区域肾实质内示踪剂活性降低或缺乏(图1-1-5-2),目前被认为是诊断肾盂肾炎、肾脏瘢痕化的金标准。但既往行经皮肾镜碎石患者及其他需要建立肾脏操作通道的患者可在同位置出现肾脏示踪剂摄取降低或缺乏,需进行鉴别。该检查具有无创、高敏感性和高特异性的特点,文献报道敏感性为87%,特异性高达100%。对于出现尿路感染引起的肾实质受累,应重视并及时处理。有报道 67 Ga扫描在诊断肾盂肾炎和肾脓肿方面有作用,但并不常用,并且可能在没有感染的患者中出现阳性诊断。
在传统标志物中,可选择那些从尿路感染诊断开始就在临床使用的标志物。一项1 223例病例的回顾性分析结果显示,传统标志物在尿脓毒血症阴性预测值为75%,尿脓毒血症阳性预测值为40%。根据Averbeck等人的评论,亚硝酸盐是一种替代标志物,其敏感性仅为35%~57%,阳性预测值(positive predictive value,PPV)很高,为96%。含有亚硝酸盐的脓尿,培养阳性者为67%。尿蛋白是尿路感染的非特异性标志物。当出现尿路感染之后,尿液中会产生尿蛋白,而且随着尿路感染的严重程度不同,尿蛋白的成分及数量也会有所变化。
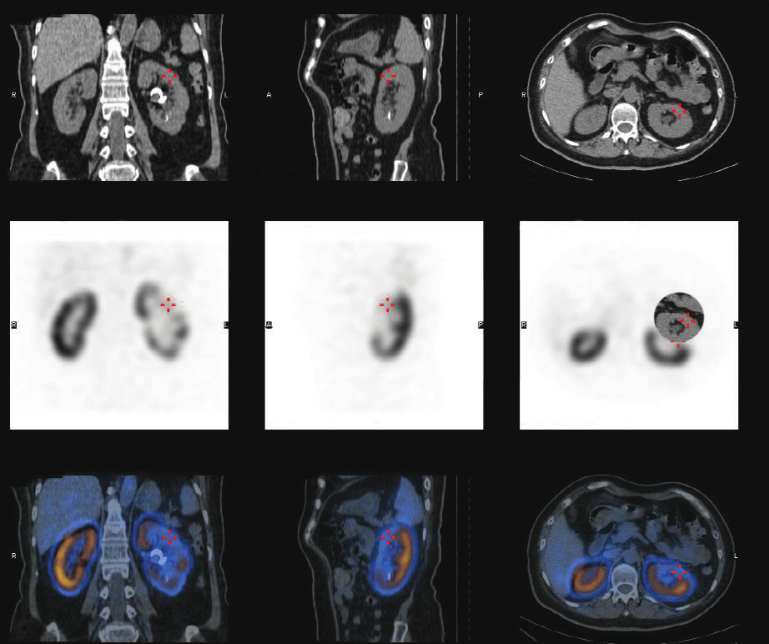
图1-1-5-2 99m Tc-DMSA肾静态显像显示左肾肾盂肾炎瘢痕形成
是相对分子量为115 000~140 000的血清β球蛋白,因最早发现其和肺炎球菌的C多糖相结合而得名(1930年),是由5个相同的亚单位以非共价键结合而成的环状五球体,由肝细胞合成,在人的血清、脑脊液、胸腹水等多种体液中均可测出。CRP的半衰期约为15h。正常人CRP的浓度很低(0.068~8.2mg/L),但在组织损伤、急性感染发生后6~8h开始升高,24~48h达峰值,可达正常值的数百倍甚至上千倍,升高幅度与感染程度成正比,炎症治愈后浓度迅速下降,7~12d可恢复至正常水平。CRP持续增高提示机体存在慢性炎症或自身免疫疾病,CRP在病毒感染时不会升高,其变化不受患者的个体差异、机体状态和治疗药物的影响。
1950年,有研究人员将CRP纯化并形成结晶,用电子显微技术和X线衍射技术探索结构发现,CRP由5个完全相同的单体组成,每个单体呈球形,以非共价形式构成对称的环状五球体,极少数蛋白具有这样的构型。其他动物的CRP与人CRP的氨基酸序列有惊人的相似性,因而,人们认为CRP是最保守的蛋白质,对物种的生存有重要意义。近年的研究证明,CRP与人类IgG重链第三恒定区(CH3)的氨基酸排列顺序非常相似,与补体(complement,C)1和某些人白细胞抗原(human leukocyte antigen,HLA)的氨基酸排列顺序也有相似之处,提示CRP与IgG、C1、HLA具有共同起源。CRP具有与IgG和补体相似的调理和凝集作用,促进巨噬细胞的吞噬,刺激单核细胞表面的组织因子表达及其他免疫调节功能。CRP在炎症或组织损伤时皆可升高,但CRP与其他蛋白升高(2~3倍)不同,可升高100~1 000倍,尽管为非特异性的,但对于细菌感染、各种炎症过程及组织坏死与损伤及其恢复期的筛检、监测、病情评估与疗效判断都有重要价值。有研究表明,血培养阳性组较阴性组有所升高,且有显著性差异,也可为临床诊断血流感染提供参考。革兰氏阳性组与革兰氏阴性组CRP水平有差异但未见显著性,可部分反映CRP对血培养阳性组中革兰氏阳性与革兰氏阴性感染鉴别意义相对较小。
是血清降钙素(calcitonin,CT)的前肽物质。在细菌感染/脓毒血症状态下,PCT在各个组织、器官大量形成并释放进入血液循环系统,感染后3~4h开始升高,于6~12h达到峰值,8~24h达到稳定期,半衰期接近24h,最高浓度可以达1 000ng/mL。其代谢不受类固醇等药物治疗影响,肾功能不全时,PCT半衰期可不同程度的延长。在感染疾病严重程度的发展过程中,PCT随着严重程度的不同(局部感染、脓毒症、严重脓毒症、脓毒性休克),呈现由低到高的浓度变化。PCT<0.05ng/mL为正常,0.05~0.5ng/mL考虑为局部感染,0.5~2ng/mL考虑可能存在全身感染,2~10ng/mL高度怀疑感染及全身炎症反应,>10ng/mL考虑存在严重脓毒症、脓毒性休克。研究发现,尿路感染出现菌血症患者中PCT平均值为(8.08±16.37)ng/mL,非菌血症组为(0.34±0.37)ng/mL,使用PCT≥1.16ng/mL作为尿路感染引起菌血症诊断标准的敏感率为100%,特异性为97%,阳性预测值84%,阴性预测值100%,显著优于血乳酸、CRP(通常在12~24h开始升高,20~72h快速上升,3~7d进入稳定期)和白细胞水平。而CRP对于判断患者是否存在脓毒症、脓毒性休克以及患者30d死亡率没有作用。PCT可用于区分不同病原菌感染。研究显示,对于感染性脓毒症,革兰氏阴性杆菌感染患者的PCT水平显著高于革兰氏阳性球菌感染和真菌感染,分别为8.9ng/mL(1.88~32.6ng/mL)、0.73ng/mL(0.22~3.4ng/mL)和0.58ng/mL(0.35~0.73ng/mL),有助于经验性应用抗菌药物的选择。PCT还可用于指导临床感染性疾病治疗中抗菌药物的使用。一项前瞻性、多中心、随机、对照、开放性研究纳入1 575例感染患者,随机分为PCT指导组( n =761)和标准治疗组( n =785)。PCT指导组在PCT峰值下降80%以上或PCT水平降至0.5μg/L以下时建议停用抗菌药物;标准治疗组根据当地抗菌药物使用原则应用。结果显示:PCT指导治疗组每位患者的医疗总费用降低3 503欧元,相比无PCT指导治疗的患者节省9.2%。降低的费用主要来自缩短的住院时间、血培养减少以及抗菌药物治疗天数减少。因此,应用PCT监测抗菌药物疗效可减少抗菌药物暴露时间,不增加死亡风险,具有显著的卫生经济学价值。
是一种细胞因子,属于白介素的一种。IL-6由两条糖蛋白链组成:一条为α链,分子量为80kd;另一条为β链,分子量为130kd。IL-6是多功能的细胞因子,当其作为急性期炎症因子时,主要刺激参与免疫反应的细胞增殖、分化并提高其功能,参与炎症反应和发热反应,通过IL-6受体和gp130作用于不同靶细胞,发挥多种生物调节作用。IL-6是体循环中半衰期最长的前炎症介质,激活快速,半衰期约为1h。IL-6的生物学作用包括诱导肝脏CRP产生和释放、诱导PCT产生(炎症反应发生后,IL-6先生成,之后诱导PCT和CRP生成),是炎症、脓毒症的早期敏感性“警示”标志物,并且随着疾病的进展IL-6水平逐渐升高。一项纳入6项研究的荟萃分析显示,IL-6用于脓毒症的诊断敏感性为80%,特异性为85%,曲线下面积(area under curve,AUC)为0.868,IL-6用于脓毒症的辅助诊断准确性高。Otto等人研究显示,寒战、发热性尿路感染患者会出现IL-6水平升高,有菌血症者血IL-6水平显著高于没有菌血症者,尤其在患者有典型的肾盂肾炎症状、体温显著升高时更为明显,并持续数天,说明IL-6水平升高程度与患者感染的严重程度相关。一项纳入24例脓毒症患者(15例脓毒症和9例重度脓毒症或脓毒性休克)的研究将患者分为两组(死亡组包括6例重度脓毒症或脓毒性休克和1例脓毒症患者,存活组包括17例剩余患者),连续监测第0、12、24、48、72、96小时的PCT、IL-6、CRP、红细胞沉降率(erythrocyte sedimentation rate,ESR;简称血沉)和WBC变化值。结果显示,存活者组IL-6浓度持续快速下降,而非存活组IL-6浓度延迟下降,与PCT和CRP相比,IL-6能更好地评估脓毒症患者的预后。另一项研究纳入100例器官功能障碍和疑似感染的危重患者,连续7d监测IL-6、PCT和CRP水平,结果显示:重症感染患者IL-6的7d AUC高达0.883,28d死亡率预测因子中仅IL-6有统计学意义,这说明IL-6是28d死亡率的显著预测因子。
综上所述,在脓毒症/重度脓毒症或脓毒性休克辅助诊断中,PCT有最高的敏感度,而IL-6有更高的特异性。有研究指出,一次内毒素刺激的人体试验中,不同标志物的动力学变化详见图1-1-5-3。IL-6联合PCT可以优势互补,提高辅助诊断脓毒症的及时性与正确率。
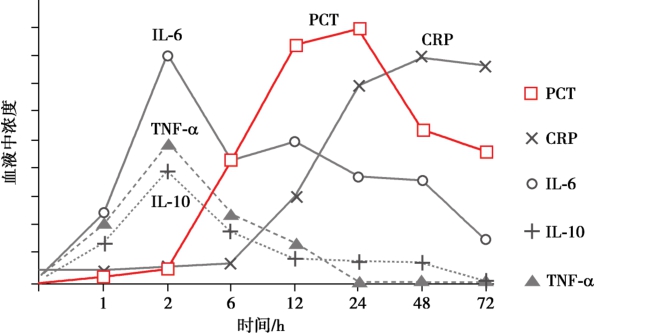
图1-1-5-3 内毒素刺激后体内各种炎症标志物的动力学变化
是反映肾脏慢性损害的一种有潜力的标志物,在慢性肾脏病患者中能确切反映肾脏损害的程度。炎症、感染、肿瘤、缺血、肾损伤、烧伤、外科手术等都能诱导NGAL表达上调。NGAL水平在感染12h后升高并在3d内达到顶峰。并且,该标志物对年龄和性别的差异很小,因此不需要进行标准化。NGAL的排泄不依赖肾小球滤过,因此并不需要肌酐标准化。基于上述结果,尿NGAL可作为诊断儿童和成人尿路感染的合适标志物。虽然尿路NGAL在尿路感染期间也升高,但根据所列数据,尿路NGAL似乎是预测尿路感染更敏感的标志物。对于鉴别上、下尿路感染,NGAL也可能是一个有用的标志物。
在宿主细胞-病原体相互作用过程中,细胞因子的爆发是为了召集先天性免疫系统的细胞,增强对病原体的防御。在尿路感染中,细胞因子主要产生于膀胱的尿上皮细胞,并分泌到尿液中。目前主要研究的细胞因子包括白介素1B(interleukin-1B,IL-1B)、白介素8(interleukin-8,IL-8)。IL-1B可能是一种很有前途的标志物。IL-8在所有炎症过程中起中心作用。在发生尿路感染时可以观察到IL-8浓度升高,因此可将其作为急性肾盂肾炎的预测因子,但其特异性较低。IL-8在发生各种先天性泌尿系统异常时均有升高。因此,当存在解剖结构障碍时,IL-8不适合用于诊断尿路感染。
是中性粒细胞来源的颗粒蛋白,其结构包含222个氨基酸的单链蛋白,含有8个半胱氨酸残基,在第100、114或145位天冬氨酸残基上具有糖基化位点,结构类似中性粒细胞弹性蛋白,与其同源性为45%。HBP辅助诊断尿道感染:U-HBP作为判断尿路感染的敏感性和特异性分别是93.3%和90.3%,阴性预测值也达到98.3%,但U-HBP的阳性预测值不太理想,只达到70%。U-HBP与亚硝酸盐结合起来将是一个很好的生化指标。
基质金属蛋白酶是一种金属蛋白酶,具有降解细胞外基质成分的特殊作用。在尿路感染期间,MMP-9常与NGAL并存。Hatipoglu等人测量了145例儿童的尿MMP-9/NGAL复合物水平,发现临界值为0.08ng/mg时预测UTI诊断的敏感性为98%,特异性为97%。它可以是一个比NGAL更好的指标,由于敏感性和特异性高,可用于鉴别无症状菌尿。
下列生物标志物在尿路感染期间升高,但没有充分的信息说明它们的临床用途,包括:糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP1)、Toll样受体(toll-like receptor,TLR)4、TLR2、神经生长因子(nerve growth factor,NGF)、CD14、CD44。
存在争议且目前考虑没有价值的生物标志物包括在泌尿系统感染诊断或鉴别诊断有效性研究中出现矛盾结果的标志物,或者显示无用的标志物,不适合用于诊断或鉴别诊断尿路感染,对预测感染没有帮助或不实用,包括肾损伤分子-1(kidney injury molecule-1,KIM-1)、腺苷三磷酸(adenosine triphosphate,ATP)、髓系细胞触发受体-1(triggering receptor expressed on myeloid cells-1,TREM-1)、载脂蛋白D等。
传统的病原学诊断是临床医师根据患者的临床表现做出的一系列鉴别诊断,然后针对这些诊断结果进行相应的检测,通常一项检测只能对应一种病原体,而宏基因组学第二代测序技术(metagenomics next generation sequencing,以下简称二代测序)检测能覆盖更广范围的病原体。
二代测序在感染性疾病诊断领域中的优势在于其能检测到其他传统手段无法检测到的病原体。因此,二代测序可能在应用于临床疑难杂症或免疫抑制患者时有更大意义。另外,二代测序也被报道可用于“排除”检测,即检测阴性有助于排除感染性疾病诊断,但前提条件是测序覆盖度足够高,能确保样本中存在的病原微生物被检测出来。二代测序的其他潜在应用还包括病原体的耐药基因检测、医院感染控制监测,以及社区传染性疾病暴发监测,但这些应用通常需要极高的覆盖深度。
若怀疑细菌、真菌、DNA病毒、寄生虫、不典型病原体感染且需进行二代测序检测时,建议采用DNA检测;若怀疑核糖核酸(ribonucleic acid,RNA)病毒感染,则建议采用RNA检测。对于临床疑似感染的病重、病危或免疫抑制、免疫缺陷患者,建议在完善传统实验室及分子生物学检测的同时,采集疑似感染部位标本进行二代测序。对于怀疑局灶性感染的患者,在对局灶部位完成常规生物化学、培养或PCR检测后,若未能获取病原学诊断结果,推荐将二代测序作为二线首选检测手段。
二代测序结果应在与患者临床表现及实验室检查密切结合的前提下进行解读和验证。对于二代测序结果为阴性,但根据其他辅助检查结果(如培养结果)高度提示感染可能的尚不能排除感染的患者,建议必要时再次取样重复二代测序检测。对于脓毒症患者,推荐联合采用传统实验室培养和二代测序来提高病原学的检出率。对于新发、罕见、疑难感染性疾病,以及免疫缺陷患者,二代测序能显著提高病原体的检出率,可作为一线检测手段。目前,二代测序的成本仍较高,尚不能作为轻症感染性疾病的一线检测手段。
(崔亮 编 郑波 审)
泌尿系统感染相关症状包括尿频、尿急、尿痛、耻骨上区不适,有些患者可伴有腰骶部的疼痛和肉眼血尿。门诊患者中大部分为急性膀胱炎,最常见的症状为尿痛、尿急、尿频,下腹部不适、酸胀,可伴有终末血尿,有时为全程血尿,甚至有血块排出,可有急迫性尿失禁。男性慢性前列腺炎患者可在性交或饮酒后诱发膀胱炎。
上尿路感染患者除了排尿症状以外,可伴有全身症状,如寒战、发热、腰痛、恶心、呕吐等。约有1/3的膀胱炎患者可进一步发现同时存在急性肾盂肾炎。输尿管支架植入引起的相关肾盂肾炎患者可没有明显的腰痛症状。对尿路感染有诊断意义的临床症状和体征为尿痛、尿频、血尿、背部疼痛和肋脊角压痛。
除一般体格检查以外,应进行全面的泌尿系统体检,男性患者还包括外生殖器检查和直肠指检。急性膀胱炎患者可合并耻骨上区压痛。发热、肋脊角叩击痛对急性肾盂肾炎诊断特性高。
盆腔和直肠指检可用于鉴别是否同时合并女性附件炎或男性前列腺炎。当患者出现不明原因发热、寒战、严重低血压、神志不清、感染中毒性休克表现时,要考虑肾盂肾炎的可能。
(1)尿常规生化检查:
现今最常见的是半自动或全自动的尿液干化学分析仪。尿生化检查用于诊断尿路感染的敏感性不高,阴性结果对除外尿路感染的特异性较高。一项纳入360例疑似尿路感染患者的研究表明,尿液干化学分析法检测的灵敏度和阴性预测值明显高于尿沉渣分析法。尿生化检查指标包括:①亚硝酸盐(nitrite,NIT),正常为阴性,阳性可见于大肠埃希菌等革兰氏阴性杆菌引起的泌尿系统感染。阳性反应程度与尿液中细菌数成正比。研究表明,WBC计数试验的灵敏度高于亚硝酸盐试验,可用于尿路感染的筛查;亚硝酸盐试验的灵敏度虽较低,但特异度及阳性预测值均比较高。在临床工作中,如果将二者联用,可以最大限度诊断出泌尿系统感染的患者。②白细胞酯酶:泌尿系统感染时为阳性;如果尿中有大量淋巴细胞,检测结果为阴性。③尿蛋白:泌尿系统感染者可有蛋白尿,通常<2g/24h。
(2)尿沉渣
1)尿沉渣显微镜检查:
离心尿尿沉渣中白细胞1~2个/HP表示非离心尿中白细胞为10个/mm 3 ,配合革兰氏染色可作为感染的确定性指标。应注意,尿检中没有发现白细胞不能排除上尿路感染。此外,尿检中发现白细胞可见于非感染性肾疾病。无菌尿的脓尿要警惕结核等疾病的存在。
2)尿有形成分分析检查:
在严格质量控制下,对尿路感染诊断的敏感性为94.4%~100%,特异性为49.8%~73.4%。此方法不能完全替代显微镜检查,可作为显微镜检查前的筛选。
参见上一节内容。
参见上一节内容。
参见上一节内容。
根据疾病情况可以选择膀胱镜等相关检查。
1.上尿路感染患者发热、畏寒等全身症状较明显,而尿路症状不明显时容易误诊为全身感染性疾病,询问病史、完善尿常规及尿液细菌学检查有助于鉴别。
2.女性有尿路感染症状时需考虑是否存在阴道炎、生殖器溃疡或者淋病等情况。如果患者存在阴道分泌物或外阴炎症常可鉴别,盆腔双合诊有助于排除盆腔肿块和盆腔炎。
3.对于有下尿路感染症状并有脓尿,但尿培养阴性的患者,需与淋球菌感染和支原体感染相鉴别。
4.对于有下尿路感染症状但没有感染依据的女性患者,需与膀胱过度活动症鉴别。膀胱过度活动症主要见于女性患者,以尿频为主要表现,影像学检查和实验室检查结果基本正常。
5.青年男性尿路感染需与前列腺炎引起的下尿路症状相鉴别。慢性前列腺炎会表现为会阴部和下腹部坠胀、隐痛不适,阴囊潮湿等症状。中老年男性尿路感染则需与前列腺增生引起的下尿路症状相鉴别。
6.泌尿系统感染需与泌尿系统结核相鉴别。泌尿系统结核表现为长期的尿路感染症状,顽固性脓尿,抗感染治疗效果不佳,结核菌素纯蛋白衍生物(purified protein derivative,PPD)试验、结核感染T细胞斑点(T-SPOT)试验阳性等有助于鉴别。
7.泌尿系统感染需与泌尿系统结石和肿瘤相鉴别。泌尿系统结石和肿瘤的影像学检查一般会有阳性发现。
8.泌尿系统感染还需与尿道憩室、异物、息肉等相鉴别。膀胱镜检查有助于鉴别。
1.明确感染性质 临床上,出现泌尿系统感染症状时,应尽可能明确感染性质和致病菌,依据尿液细菌培养和药敏试验结果,有针对性地用药,这是治疗的关键。尚无尿细菌培养结果时,可先根据尿沉渣涂片革兰氏染色来初步估计致病菌,选择恰当的治疗药物。
2.鉴别上尿路感染和下尿路感染。
3.明确是血行感染还是上行感染 血行感染发病快,有寒战、高热等全身症状,应当选用血浓度高的抗菌药物,常需静脉给药。
4.查明有无泌尿系统梗阻因素 泌尿系统梗阻往往不易治愈,且容易产生耐药菌株,易复发。
5.检查是否存在泌尿系统感染的诱发因素 ①机体抵抗力低下:如妊娠或糖尿病、贫血、慢性肝病、慢性肾病、肿瘤及先天免疫缺陷或长期使用免疫抑制剂;②梗阻因素:如先天性泌尿系统畸形、结石、肿瘤、前列腺增生或神经源性膀胱等;③医院性因素:如留置导尿管、造瘘管,行尿道扩张、前列腺穿刺、膀胱镜检查;④其他因素:如女性尿道短(容易引起上行感染,特别是经期、更年期和性交时)、尿道口畸形或尿道口附近炎症。
6.抗菌药物的选择 在治疗过程中,必须注意尿液中要有足够浓度的抗菌药物,而不是单纯依靠血中抗菌药物浓度。如果患者有梗阻诱因,必须延长用药时间,同时应适时消除诱因,如手术解除梗阻因素。
7.手术治疗 在适当时间针对感染灶或病因实施相应的手术治疗。泌尿外科相关微创手术患者,术前准备应充分,选择合适的手术时机;术中应控制手术时间,降低局部压力,必要时分期治疗,多通道手术、多镜联合使用,甚至开放手术也是较好的选择。
8.尿液pH左氧氟沙星对大肠埃希菌和表皮葡萄球菌的抗菌效果随着pH升高而升高;磷霉素对大肠埃希菌、表皮葡萄球菌和金黄色葡萄球菌的抗菌效果随着pH升高而降低;头孢呋辛对大肠埃希菌和金黄色葡萄球菌的抗菌效果亦随着pH的升高而降低。因此,通过调节尿液pH能够改变致病菌对抗菌药物的敏感性。
1.急性非复杂性膀胱炎患者经治疗和采取一定预防措施后,总体预后较好。未经治疗的膀胱炎患者进展至上尿路感染的情况较少见。
2.急性非复杂性肾盂肾炎,如果诊断和治疗及时,预后较好。
3.如果患者存在严重上尿路病变(畸形、反流、狭窄等),出现泌尿系统感染复发的概率高,发生肾功能不全的可能性增加。
(陈敏丰 编 郑波 审)
[1]SCHAEFFER AJ,MATULEWICZ RS,KLUMPP DJ. Infections of the urinary tract//WEIN AJ,KAVOUSSI LR,PARTIN AW,PETERS CA,et al. Campbell-Walsh Urology[M]. 11th ed. Philadelphia,PA:Elsevier,2016.
[2]张天震,刘伶普,李文超,等.群体感应系统介导细菌生物膜形成的研究进展[J].生物加工过程,2020,18(2):177-183.
[3]ANDERSON GG,MARTIN SM,HULTGREN SJ. Host subversion by formation of intracellular bacterial communities in the urinary tract[J]. Microbes Infect,2004,6(12):1094-1101.
[4]TENKE P,KÖVES B,NAGY K,et al. Update on biofilm infections in the urinary tract[J]. World J Urol,2012,30(1):51-57.
[5]MAZZOLI S. Biofilms in chronic bacterial prostatitis (NIH-Ⅱ)and in prostatic calcifications[J]. FEMS Immunol Med Microbiol,2010,59(3):337-344.
[6]BARTOLETTI R,CAI T,NESI G,et al.The impact of biofilm-producing bacteria on chronic bacterial prostatitis treatment:results from a longitudinal cohort study[J]. World J Urol,2014,32(3):737-742.
[7]KOLUMBIć LAKOS A,SKERK V,MALEKOVIć G,et al. A switch therapy protocol with intravenous azithromycin and ciprofloxacin combination for severe,relapsing chronic bacterial prostatitis:a prospective non-comparative pilot study[J]. J Chemother,2011,23(6):350-353.
[8]ANDERSON GG,PALERMO JJ,SCHILLING JD,et al. Intracellular bacterial biofilm-like pods in urinary tract infections[J].Science,2003,301(5629):105-107.
[9]ROSEN DA,HOOTON TM,STAMM WE,et al. Detection of intracellular bacterial communities in human urinary tract infection[J]. PLoS Med,2007,4(12):e329.
[10]RUBIN RH,SHAPIRO ED,ANDRIOLE VT,et al. Evaluation of new anti-infective drugs for the treatment of UTI. Infectious Diseases Society of America and the Food and Drug Administration[J]. Clin Infect Dis,1992,15(Suppl 1):216.
[11]RUBIN RH,SHAPIRO ED,ANDRIOLE VT,et al. Evaluation of new anti-infective drugs for the treatment of urinary tract infection. Infectious Diseases Society of America and the Food and Drug Administration[J].Clin Infect Dis,1992,15(1):S216-S227.
[12]CENTERS FOR DISEASE CONTROL. Urinary Tract Infection (Catheter-Associated Urinary Tract Infection[CAUTI]and Non-Catheter-Associated Urinary Tract Infection[UTI])Events.(Jan 2022). https://www.cdc.gov/nhsn/pdfs/pscmanual/7psccauticurrent.pdf.
[13]SMELOVAB V,NABER K,JOHANSEND TEB. Improved Classification of Urinary Tract Infection:Future Consideration[sJ].European Urology Supplements,2016,15(4):71-80.
[14]FLANAGAN PG,ROONEY PG,DAVIES EA,et al. Evaluation of four screening. Tests for bacteriuria in elderly people[J].Lancet,1989,333(8647):1117-1119.
[15]KIM SY,KIM YJ,LEE SM,et al. Evaluation of the Sysmex UF-100 urine cell analyzer as a screening test to reduce the need for urine culture for community-acquired urinary tract infection[J]. Am J Clin Pathol,2007,128(6):922-925.
[16]袁汉尧. 临床检验诊断学[M]. 广州:广东科学技术出版社,2002.
[17]降钙素原急诊临床应用专家共识组. 降钙素原急诊临床应用的专家共识. 中华急诊医学杂志[J],2012,21(9):944-951.
[18]王扬. 尿液不同检测方法对泌尿系统感染的诊断价值研究[J]. 中国现代药物应用,2021,15(5):251-252.
[19]刘小宁. 尿常规亚硝酸盐检测对细菌性尿路感染的诊断价值研究[J]. 中国医药指南,2018,16(7):97.
[20]TAKAHASHI W,NAKADA TA,YAZAKI M,et al.Interleukin-6 levels act as a diagnostic marker for infection and a prognostic marker in patients with organ dysfunction in intensive care units[J].Shock,2016,46(3):254-260.
[21]ROUPAKIAS S,SINOPIDIS X,TSIKOPOULOS G,et al. Dimercaptosuccinic acid scan challenges in childhood urinary tract infection,vesicoureteral reflux and renal scarring investigation and management[J]. Minerva Urol Nefrol,2017,69(2):144-152.
[22]李同海,张白羽,郭彩芬,等. 尿源性脓毒血症的治疗进展[J]. 医学综述,2019,25(9):1756-1760.
[23]冷云,周玉真,董科,等. 尿液pH对常见泌尿系感染细菌抗菌药物敏感性的影响[J]. 现代预防医学,2019,46(13):2445-2447,2454.
[24]孙召洋,刘文健,张景皓,等. 泌尿系统感染检测方法研究进展[J]. 检验医学,2019,34(12):1133-1138.
[25]LI Y,XIE G,QIU J,et al. A new biosensor based on the recognition of phages and the signal amplification of organicinorganic hybrid nanoflowers for discriminating and quantitating live pathogenic bacteria in urine[J]. Sensors Actuators B:Chem,2018,258:803-812.
[26]CLEMENT S,YOUNG J,MUNDAY E. Comparison of a urine chemistry analyser and microscopy,culture and sensitivity results to detect the presence of urinary tract infections in an elective orthopaedic population[J]. Contemp Nurse,2004,17(1-2):89-94.
[27]KASS H. Edward,bacteriuria and pyelonephritis of pregnancy[J]. Archives of Internal Medicine,1960,105(2):194.
[28]WIGTON S,ROBERT. Use of clinical findings in the diagnosis of urinary tract infection in women[J]. Archives of Internal Medicine,1985,136(12):2222-2227.
[29]王丹晨,邱玲.脂蛋白相关磷脂酶A2与缺血性脑卒中研究进展[J]. 标记免疫分析与临床,2018,25(9):1402-1405,1412.
[30]杜娟,张林涛,杨文航,等.尿常规及尿液有形成分分析在尿路感染诊断中的初筛价值研究[J]. 中华医院感染学杂志,2016,26(20):4617-4620.
[31]ANDREA T,LAURA S,ANTONIETTA C,et al. Evaluation of the Uro4 HB&L system for the rapid diagnosis of lower respiratory tract infections in intensive care units[J]. Journal of Microbiological Methods,2010,81(3):235-239.
[32]COHEN MS,PING G,FOX K,et al.Sexually transmitted diseases in the People's Republic of China in Y2K:back to the future[J]. Sexually Transmitted Diseases,2000,27(3):143-145.
[33]LAMPINEN TK,CHAN K,ANEMA A,et al. Self-screening for rectal sexually transmitted infections:human papillomavirus.Diseases Society of America[J]. Clinical Infectious Diseases,2006,42(2):308-309.
[34]ESTELLE L,ANTOINE DR,PANAGIOTIS F,et al. Dynamics of the transcriptional landscape during human fetal testis and ovary development[J]. Human Reproduction,2020,35(5):1099-1119.
[35]JOU WW. Utility of dipstick urinalysis as a guide to management of adults with suspected infection or hematuria[J]. South Med J,1998,91(3):266-269.
[36]黄健.中国泌尿外科和男科疾病诊断治疗指南(2019版)[M].北京:科学出版社,2020.
[37]MAJD M,RUSHTON HG,CHANDRE R,et al.Technetium-99m-DMSA renal cortical scintigraphy to detect experimental acute pyelonephritis in piglets:comparison of planar (pinhole)and SPECT imaging[J].J Nucl Med,1996,37(10):1731-1734.
[38]《尿路感染诊断与治疗中国专家共识》编写组. 尿路感染诊断与治疗中国专家共识(2015版)[J].中华泌尿外科杂志,2015,36(4):241-245.
[39]JÓZSEF HORVÁTH,BJÖRN WULLT,KURT G NABER,et al. Biomarkers in urinary tract infections which ones are suitable for diagnostics and follow-up?[J]. GMS infectious diseases,2020,8:Doc24.
[40]王前,郑磊,曾方银,等. 超敏C-反应蛋白的研究现状及临床应用[J].中华检验医学杂志,2004,27(8):542-544.
[41]刘同波,王茂全,关伟,等.降钙素原、C反应蛋白和白细胞介素-6在血液病患者血流细菌感染中的诊断意义[J].中国实验血液学杂志,2018,(5):1548-1552.
[42]REINHART K,MEISNER M,BRUNKHORST F.Markers for sepsis diagnosis:what is useful?[J]. Crit Care Clin,2006,22(3):503-519.
[43]JIMÉNEZA AJ,MARTIN PG,LIZCANO AL,et al.Usefulness of procalcitonin for predicting bacteremia in urinary tract infections[J].Actas Urol Esp,2015,39(8):502-510.
[44]NAKAJIMA A,YAZAWA J,SUGIKI D,et al.Clinical utility of procalcitonin as a marker of sepsis:a potential predictor of causative pathogens[J].Intern Med,2014,53(14):1497-1503.
[45]DJONG DE,OERS JAV,BEISHUIZEN A,et al.Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients:a randomised,controlled,open-label trial[J]. Lancet Infect Dis,2016,16(7):819-827.
[46]HOU T,HUANG D,ZENG R,et al.Accuracy of serum interleukin(IL)-6 in sepsis diagnosis:a systematic review and metaanalysis[J].Int J Clin Exp Med,2015,8(9):15238-15245.
[47]JEKARL DW,LEE SY,LEE J,et al.Procalcitonin as a diagnostic marker and IL-6 as a prognostic marker for sepsis[J].Diagnostic Microbiology and Infectious Disease,2013,75(4):342-347.
[48]《中华传染病杂志》编辑委员会.中国宏基因组学第二代测序技术检测感染病原体的临床应用专家共识[J].中华传染病杂志,2020,38(11):681-689.
[49]《宏基因组分析和诊断技术在急危重症感染应用专家共识》组. 宏基因组分析和诊断技术在急危重症感染应用的专家共识[J]. 中华急诊医学杂志,2019,28(2):151-155.