




结直肠癌(colorectal cancer,CRC)的发生和发展较复杂,常呈现正常上皮—腺瘤—腺癌的经典演进过程,受饮食、遗传和表观遗传、代谢、肠道菌群及环境等多种因素的影响。因此,为更好地探索各个因素在CRC发生和演进过程中的作用和分子机制,以及为发现诊断标志物和评估药物疗效提供研究手段,建立有效的结直肠肿瘤动物模型具有重要意义。随着科学的进步与发展,实验动物模型也经历了许多建立、筛选与选择的过程,最终小鼠成为最理想的实验动物模型之一。小鼠具有体形小、繁殖快、易于饲养、遗传背景清晰、基因组与人类高度同源等诸多优势和特点,目前应用十分广泛。结直肠肿瘤动物模型根据建模方式的不同,主要分为自发和诱发性肿瘤模型、种植性肿瘤模型、基因工程小鼠实验模型及CRC转移模型等。
小鼠是人类疾病研究中最常用、最理想的实验动物模型,随着数十年科学研究的发展,小鼠繁育的品种与品系越来越多,已经成为实验动物中培育品系最多的动物。根据小鼠遗传背景的特点可以分为近交系、封闭群和杂交群等,其中近交系小鼠应用最广。近交系小鼠往往是指全同胞兄妹或亲子代小鼠经过至少连续20代以上交配后,98.6%以上的遗传位点实现纯合状态。因此,近交系小鼠个体间的差异很小,基因型和遗传特征几乎完全相同,对各种实验处理的反应也几乎完全一致,这可以使实验设计的组间比较结果更加可靠和具有说服力,进而在统计学允许的范围内最大限度地降低实验样本量。
在肿瘤研究中,有几种小鼠品系应用最为广泛,如裸鼠、C57BL/6小鼠、BALB/c小鼠、SCID小鼠、NOD/SCID小鼠等,它们在外观、习性、免疫学状态等方面都存在不同的特点,可以满足不同实验设计的需要。小鼠品系繁多,在此无法全部涵盖,下面就几种常见小鼠品系的特点做简要介绍。
裸鼠(nude mice)是肿瘤研究领域最常用的实验动物模型之一,因全身无毛而称为裸鼠。1962年英国科学家Grist在非近交系小鼠培育过程中偶然发现个别小鼠无毛,同时伴有先天性胸腺发育不良。1966年英国科学家Flanagan第一次对这种小鼠进行了研究报道,他发现该变异种小鼠在第11号染色体上存在一个新的等位基因自发突变,表现为免疫缺陷表型。当时在免疫学研究领域,科学家们曾经尝试通过药物抑制T细胞功能或者外科切除胸腺等手段来实现小鼠的免疫缺陷状态,但是免疫抑制的效果均不甚满意,裸鼠的出现迅速成为理想的免疫学、肿瘤学实验动物模型,得到了广泛的应用。
随后,科学家们对裸鼠的基因学、形态学、免疫学等特点展开了深入研究。裸鼠的无毛表型并不是因为毛囊结构的异常,而是毛发在生长过程中会发生卷曲,无法穿透表皮层,因而表现为无毛状态。裸鼠由于没有胸腺,T细胞无法分化成熟,细胞免疫力低下,对于病毒感染、肿瘤细胞等均无种植排斥反应。该特点有利于肿瘤种植模型的实施,但同时也导致裸鼠的免疫力低下,容易患病毒性肝炎和肺炎,普通环境下仅能存活6个月~1年。但是,裸鼠如果在无特定病原体(specific pathogen free,SPF)的特殊环境下饲养,它的寿命可以延长到与普通小鼠相同,为18个月~2年。
裸鼠这些表型的出现主要是由于 FoxN1 (forkhead box N1)基因纯合突变导致, FoxN1 基因编码的蛋白质是一种转录因子,在小鼠发育过程中参与调节胸腺的发育、血管生成和角化细胞的分化,参与T细胞的成熟和抗原的表达。该基因缺失会导致胸腺上皮细胞(thymic epithelial cell,TEC)和T细胞前体细胞的分化和增殖障碍,而TEC又是T细胞成熟过程中的关键因子。但是,该基因的杂合突变并不会产生可见表型。由于纯合型雌裸鼠的受孕力很低、乳腺发育不良和有食幼仔的习惯,因此裸鼠的繁育一般采用纯合型雄鼠和杂合型雌鼠交配的方式以获得子代。
鉴于免疫缺陷的特点,裸鼠最常应用于肿瘤种植模型,以及在此基础上进行的药物敏感性研究。此外,裸鼠还可以应用于免疫学、病原微生物学和遗传学等研究领域,为科学进步做出了巨大贡献。但是,由于裸鼠仍然有正常的B细胞和较强的NK细胞免疫应答,不适合白血病、淋巴瘤等血液系统肿瘤的研究,而且T细胞会随着小鼠的周龄增长而增强,因此一般常规采用年幼的裸鼠(5~10周龄)进行实验以提高成瘤率。
1921年美国科学家Little使用Abby Lathrop小鼠通过近亲交配,繁育出数个近交系小鼠,其中第57号雌鼠和第52号雄鼠交配后产出的后代小鼠被标记为C57,再根据小鼠毛色的不同进行定义,毛色为黑色者为C57BL(BL为black的缩写)。1937年Little将C57BL父系小鼠进行了品系分离,并将第6组亚系命名为C57BL/6。1947年,美国著名的Jackson实验室从Little实验室引进了C57BL/6品系小鼠进行繁育,并将小鼠品系的名字命名为C57BL/6J(J为Jackson实验室的简称)。1951年,美国国立卫生研究院(National Institute of Health,NIH)从Jackson实验室将C57BL/6J小鼠的第32代子代引进并命名为C57BL/6N(N为NIH的简称)。至此,C57BL/6小鼠各种相关亚系命名相对成熟和稳定。
C57BL/6小鼠是实验研究中应用最广泛的近交系小鼠之一,该品系最大的特点是品系稳定,实验结果可靠性和精度高,可比性好。2002年12月人类完成了C57BL/6小鼠的基因组测序,使它成为世界上第一个完成基因组测序的小鼠品系。它的基因组比人类基因组要小,大小约2.5Gb,预计基因也少于3万个。约有40%的小鼠基因与人类基因组高度相似,80%的人类基因可以在该基因组中找到对应的基因。目前,绝大多数基因工程小鼠都是建立在该品系基础之上,各种Cre工具鼠也是利用C57BL/6小鼠完成构建。在C57BL/6小鼠基础上建立起来的实验体系完备,品系资源丰富,因此它也成为研究基因功能的最关键背景鼠之一。
1913年,美国纽约的Halsey J.Bagg将购买的白化小鼠进行近交系繁育,并将自己的名字Bagg和白化的英文Albino组合起来,给它们命名为BALB。1935年该小鼠的近交系繁育已传至第26代,George Davis Snell将该品系小鼠引种到Jackson实验室,并在BALB的名字后面加了一个小写字母c,代表毛色基因的隐性上位作用,BALB/c小鼠的名字也就最终形成。
该品系具有白化、免疫缺陷的特征,品性极为温顺,易于繁育,且雌雄体重差异较小。特别是该品系对致癌物极其敏感,有利于各种类型肿瘤实验模型的建立。近年来,肿瘤免疫治疗成为最热门的研究领域之一,特别是免疫检查点阻断剂(PD-1抗体等)和过继免疫细胞疗法(CAR-T等)取得令人瞩目的成果。新的肿瘤免疫药物的研发蓬勃发展,在药物开发过程中,迫切需要理想的肿瘤免疫小鼠模型和人源化小鼠模型,而BALB/c就成为最满意的背景鼠。
重症联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠是一种 Prkdc 基因纯合突变小鼠,该基因纯合突变导致编码免疫球蛋白重链(IgH)和T细胞抗原受体(TCR)基因重排异常,抑制B细胞和T细胞分化成熟,但是小鼠机体的NK细胞、巨噬细胞和粒细胞等均功能正常。与裸鼠的单纯T细胞功能障碍相比,SCID小鼠的B细胞和T细胞均分化障碍,免疫缺陷状态更加严重,可以适用于白血病、淋巴瘤等血液系统肿瘤和寄生虫的相关研究。
非肥胖型糖尿病/重症联合免疫缺陷(nonobese diabetic/severe combined immunodeficiency,NOD/SCID)小鼠,是由非肥胖型糖尿病(nonobese diabetic,NOD)小鼠与SCID小鼠杂交产出。NOD小鼠是一种自发性胰岛炎和胰岛素依赖性糖尿病的小鼠,同时伴有固有免疫部分功能缺陷,如巨噬细胞、NK细胞、DC细胞、补体系统功能等。NOD小鼠与SCID小鼠杂交产生的NOD/SCID小鼠既保留了SCID小鼠T细胞和B细胞功能障碍,又保留了NOD小鼠的固有免疫功能障碍,免疫缺陷程度更高,适用于更高要求的实验。由于NOD小鼠的糖尿病产生是T细胞依赖的,所以它与SCID小鼠杂交后不再产生糖尿病症状。
自发性肿瘤模型是指实验动物未经人为干预处理而自然发生肿瘤的一种模型。由于该模型与人类肿瘤更为相似,能够更好地模拟在自然状态下肿瘤的形成和发展过程,所以在肿瘤的研究领域中具有重要的意义。但是,由于动物自发产生结直肠腺瘤和CRC的发生率低、耗时长、耗费大,并且稳定性较差,所以该模型在实际结直肠肿瘤研究中较少应用。
诱发性肿瘤模型是指使用特定物质人为诱导实验动物产生肿瘤的模型,包括饮食诱发性模型等,其中最常见的是化学试剂诱发性模型。由于该模型构建方法相对较为简便、规范和快速,具有较高的成功率和可控性,所以该模型应用较广。
目前,二甲肼(1,2-dimethylhydrazine,DMH)及其代谢产物氧化偶氮甲烷(azoxymethane,AOM)是最常见的CRC化学诱导剂,可通过口服、皮下注射和腹腔注射等多种途径给药。DMH是一种间接致癌剂,首先在肝脏内被代谢为AOM,进而生成活性产物甲基氧化偶氮甲醇,最终进入肠道上皮细胞,通过促进DNA烷基化而诱导癌变。AOM常诱发结肠癌,并表现出与人类结肠癌较为相似的病理和分子特征。相比DMH,AOM的致癌效果稳定且高效。因此,在早期研究中人们常使用DMH,而现在AOM应用越来越广泛。Neufert等在 Nature Protocols 上刊文,给予小鼠腹腔注射AOM(10mg/kg),每周1次,连续6周,30周后可观察肠道成瘤。研究显示,小鼠结肠肿瘤的诱导效果受多种因素影响,包括化学诱导剂种类、剂量、给药方式、持续时间及动物品系等。
诱变剂AOM联合致炎剂葡聚糖硫酸钠(dextran sulfate sodium,DSS)复合诱导法,即AOM/DSS模型,呈现出周期短和成瘤率高等特点,并且能够高度模拟溃疡性结肠炎发展至CRC的病理过程,是一种常见的肠炎相关性结直肠癌动物模型。DSS是一种化学促炎剂,给予小鼠饮用后可引起以血便、腹泻和溃疡等为主要特征的结肠炎症。DSS诱发结肠炎的具体机制仍不明确,可能与免疫细胞功能障碍、肠道菌群紊乱、黏膜屏障破坏以及DSS对结肠上皮的毒性作用等多种因素相关。据Neufert等在 Nature Protocols 上报道,AOM/DSS模型组小鼠给予单次腹腔注射AOM(10mg/kg),连续3个循环给予2.5%DSS饮水,其中每个循环为2.5%DSS饮用7天和正常水饮用14天,10周后观察肠道炎症和成瘤情况。AOM/DSS模型,可建立炎癌转变的动态过程,因此在肠炎相关性结直肠癌研究中发挥重要的作用。
除上述化学试剂外,其他化学诱导剂还包括N-甲基-N′-硝基-N-亚硝基胍、N-甲基-N-亚硝基脲、N-乙基-N-亚硝基脲和2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶等,其他化学致炎剂还包括2,4,6-三硝基苯磺酸等,这些化学诱导剂和化学致炎剂在诱发性肿瘤模型中发挥较为重要的作用。
不同小鼠品系对AOM和DSS等化学诱导剂的反应差异较大。有研究表明当给予相同剂量的AOM腹腔注射和DSS溶液口服,BALB/c小鼠的成瘤率可以达到100%,但是相同条件下C57BL/6N小鼠的成瘤率只有50%,另外两个品系(C3H/HeN小鼠和DBA/2N小鼠)几乎没有成瘤或仅形成数量很少的腺瘤。因此,在实验设计中,合理选择小鼠品系,设定合适的化学诱导剂处理浓度和时间,对最终是否能够成功建立模型影响较大。
结直肠肿瘤的发生一般经历多个病理过程,包括异常腺管、微腺瘤、腺瘤和腺癌等。在AOM/DSS模型所形成的结直肠肿瘤中也可以观察到这一系列病理演变过程,包括低级别上皮内瘤变、高级别上皮内瘤变、腺癌等。
有研究表明,小鼠和大鼠AOM/DSS模型中所形成的肠道肿瘤与人类结直肠肿瘤的分子生物学特征高度相似,往往也存在Wnt信号通路的激活,免疫组化检测提示在小鼠结肠腺瘤中存在β联蛋白异常表达,但是β联蛋白的突变位点与人类结直肠肿瘤有所不同。此外,APC/β联蛋白信号通路下游的一些靶基因( c - myc 、 cyclin D1 、 CDK4 等)的表达情况也会发生改变。与人类CRC相似,AOM/DSS模型肿瘤中也会存在 KRAS 基因的突变等。
虽然化学试剂能够建立与人类结直肠肿瘤具有高度相似性特征的动物模型,但是总体上形成的肿瘤大多处于腺瘤阶段,仅少数为腺癌,除非造模时间足够长。这些模型由于诱导周期长和转移率低等特点,在CRC转移机制的研究中仍然会有一定的局限性,因此需要建立其他动物模型以满足相关研究需求。
种植性肿瘤模型是指将人源或鼠源的肿瘤细胞或组织种植到小鼠体内继续生长的动物模型,该模型具有几个突出的优势,有利于对肿瘤分子机制进行系统深入的研究。第一,有利于实验设计和分组,小鼠个体差异较小,遗传背景相同,小鼠成瘤后,给予干预处理,实验结果更有说服力。第二,易于通过各种手段对肿瘤进行检测和观察。如果是皮下成瘤实验,肿瘤位于小鼠体表,有利于对肿瘤大小、形态进行测量和观察;如果细胞携带一些荧光标记或酶活性,可以进行活体成像,检测肿瘤细胞的成瘤、增殖和转移能力。第三,肿瘤组织可以在同种或同品系动物中连续传代种植,使珍贵的或罕见的肿瘤组织得以保存、扩增并应用于实验研究。第四,实验周期一般不长,实验条件易于控制,实验效率高,稳定性好。目前该模型在肿瘤研究领域的应用十分广泛。
根据肿瘤种植的部位、种属、样本来源等不同,种植性肿瘤模型有许多不同的特点和要求,下面将分别详细加以介绍。
种植性肿瘤模型根据种植部位不同,可分为异位和原位种植模型。异位种植模型是指将肿瘤细胞或组织种植至小鼠体内与其来源不同的部位,包括皮下、脾、肝、腹腔、门静脉和肠系膜静脉;而与之不同的是,原位种植模型是指将肿瘤细胞或组织种植至小鼠体内与其来源的部位,例如将CRC细胞或组织种植至盲肠或直肠原位,以最大限度地保留原有生长环境和生物学特性,进而更加客观地研究CRC的演进过程和分子机制。
在异位种植模型中,最常见的是皮下种植模型。CRC皮下种植模型是指将CRC细胞悬液或CRC组织块种植于小鼠皮下,进而在小鼠皮下形成癌组织的一种动物模型,接种部位常位于血供较丰富的背部、腋下、腹部或颈部等皮下组织。皮下种植模型的接种方法可分为癌细胞悬液法和癌组织块法。癌细胞悬液法,通常将处于对数生长期的癌细胞重悬于PBS溶液中,用注射器吸取一定体积的细胞悬液直接接种于小鼠皮下,一定时间后可于皮肤表面观察到肿瘤的形成。癌组织块法,是指在无菌条件下,先将肿瘤切成体积为1~2mm 3 小块,接种于小鼠皮下进而观察成瘤。皮下种植模型的成功率受诸多因素影响,包括细胞或组织的类型、数量、活力、注射部位以及小鼠的品系、周龄、免疫和营养状况等。皮下种植模型具有方法简单、成瘤率高、成瘤时间短、便于观察等特点,已成为应用最广泛的肿瘤模型之一,在研究肿瘤的生物行为学、探讨分子机制、评估药物敏感性和制订个体化治疗方案等方面具有突出优势。但是,该模型形成的肿瘤周围通常有纤维膜包绕,所以极少发生转移,因此皮下种植模型不是研究肿瘤转移的有效模型。
为了更好地模拟肿瘤生长环境,研究者们构建了原位种植模型。CRC原位种植模型是指将CRC细胞悬液或组织块种植于小鼠的盲肠或直肠部位,进而研究其原位生长及远处肝转移过程的一种动物模型。根据种植材料的不同,CRC原位种植模型可分为癌细胞悬液法和癌组织块法。根据种植部位的不同,CRC原位种植可分为盲肠原位和直肠原位种植模型。临床上,结直肠癌的常见发病位置为结肠和直肠,而CRC原位种植模型的接种位置之所以选择盲肠和直肠这两个部位,是由小鼠的解剖结构所决定的,小鼠的结肠壁薄而不易操作,相反小鼠的盲肠膨大且壁较厚、直肠位置较浅而易于操作,这些特征导致该部位具有较高的种植成功率。
在盲肠原位种植法中,研究者通常将小鼠麻醉并暴露其盲肠,使用微量注射器将50~100μl CRC细胞悬液缓慢注射至浆膜层,使用酒精棉球轻压注射部位以防止游离癌细胞溢出,最后将盲肠放回原处并关腹。除盲肠浆膜部位外,也可在显微镜下,将CRC细胞悬液注射于盲肠黏膜与肌层之间。在无菌条件下,可将来源于患者的CRC组织块切成1mm 3 大小的颗粒后,使用直接缝合或医用OB胶粘合的方法将组织块颗粒种植入盲肠浆膜部位。与癌细胞悬液法相比,癌组织块法除能够保留患者真实的肿瘤微环境,还可以避免因接种细胞数量不够而导致成瘤率下降的风险,也可以规避因细胞悬液漏出而引起腹腔广泛转移。因此,实验者会先经皮下成瘤模型,将细胞悬液种植于小鼠皮下,待皮下形成实体瘤后再原位接种至盲肠壁。另外,在癌组织块法中,也可使用盲肠造疝法或造口法,将肿瘤颗粒种植于浆膜后于体外观察成瘤,此种方法与腹腔回纳法相比,具有体外易于观察和取样方便等诸多优势,还可防止因肿瘤细胞脱落、侵袭或种植引起腹腔局部或广泛转移而影响研究结果。
除盲肠原位种植模型外,人们为避免开腹而研发出直肠原位种植模型。在该模型中,小剂量CRC细胞悬液经与基底胶混合后,注射到距肛门>5cm的远端直肠后壁的黏膜下层,进针深度约1mm。另外,也可经麻醉、肛门切开及暴露直肠壁后,将CRC组织块种植于小鼠直肠黏膜下层。相较于盲肠原位种植模型,直肠原位种植模型具有操作简单、对小鼠损伤小和方便观察等特点,但是由于直肠壁较薄存在癌细胞漏出的风险,以及由于直肠梗阻导致小鼠生存期缩短,这些劣势也一定程度上限制了该模型后期的远处肝转移过程。综上所述,原位种植所建立的肿瘤模型与人类CRC的发生环境、生长特点及癌细胞通过门静脉循环系统进入肝脏而发生远处转移的过程较为相似,能够较好地模拟CRC的原位生长及淋巴结和肝转移过程,在研究CRC发生、发展和转移领域中的应用非常广泛。
种植性肿瘤模型根据肿瘤细胞或组织是否与宿主来源于同一种属,分为同种和异种种植模型。同种种植模型是指将肿瘤细胞或组织种植至同一种属的宿主体内,如将小鼠CRC细胞或组织接种至小鼠体内继续生长,由于来源于同一种属,因此该模型可以使用免疫功能正常的宿主小鼠,可应用于肿瘤免疫微环境、免疫耐受和免疫治疗等方面的研究;而异种种植模型是指将肿瘤细胞或组织种植至不同种属的宿主体内,如将人结直肠细胞或组织接种至小鼠体内继续生长,由于来源于不同种属,因此该模型通常使用免疫缺陷小鼠,因此该模型不适用于肿瘤免疫相关研究。
在异种种植模型中,根据接种材料的不同,分为细胞系来源异种种植模型(cell-derived xenograft,CDX)和患者来源异种种植模型(patient-derived xenograft,PDX)。CDX是指取对数生长期的人肿瘤细胞系(如CRC细胞系)重悬于PBS溶液后,接种于免疫缺陷小鼠体内以形成实体瘤。PDX是指将来源于患者的肿瘤组织经处理后,接种到免疫缺陷小鼠体内而形成实体瘤。相较于CDX,PDX被认为与患者来源肿瘤具有较一致的相似度,能够高度保留患者肿瘤的遗传学和病理学特征,因此该模型给肿瘤个体化治疗提供广阔前景(图8-1-1)。
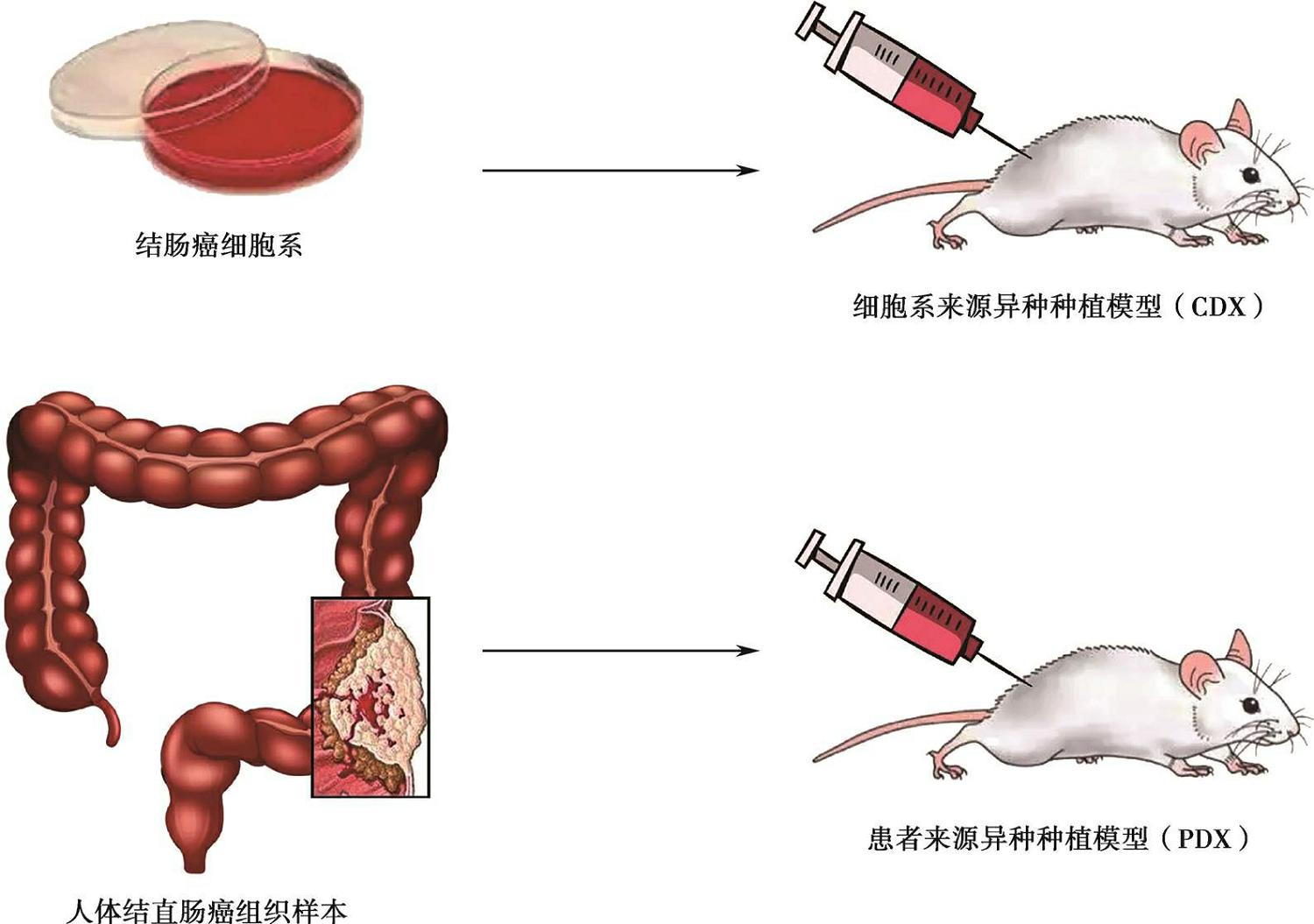
图8-1-1 结直肠癌细胞系和患者来源异种种植模型
由于肿瘤异质性和个体化治疗概念的提出,基于PDX的临床前研究越来越受到重视。PDX将患者的新鲜肿瘤组织种植于免疫缺陷小鼠体内以高度保留原发肿瘤的特质,因此在探讨肿瘤生物学表现、药效评估和患者个体化治疗等方面具有重要意义。患者来源标本可使用手术或穿刺获得的患者原发或转移部位组织、腹水中分离的癌细胞或血液中的CTC。实验动物方面,通常选用免疫缺陷小鼠,包括裸鼠、SCID小鼠、NOD/SCID小鼠和NSG小鼠(NOD-SCID-IL-2 receptor gamma null)等。接种部位可选择皮下、肾包膜下或原位种植。三种方法各有利弊,皮下种植是PDX模型中最常见的一种类型,该方法操作简单,取材方便,能够在体外直接观察肿瘤体积和形态的变化,但是该模型也存在一些缺点,如种植成功率较低、肿瘤不易于发生远处转移等。第二种为肾包膜下种植,由于肾包膜血供丰富,因此肾包膜下也是较为常见的接种部位,与皮下种植相比,该方法的成功率明显升高,但是由于操作复杂、技术要求高、对小鼠损伤较大以及观察不够直观等也限制了该模型的应用。与患者来源肿瘤一致性最高的模型是原位种植,如将CRC组织或细胞接种到盲肠或直肠部位,能够高度保留CRC的生长环境而模拟其发生、发展和转移过程,但是由于操作难度更大、成功率较低而限制了其应用。总体来说,PDX模型能够高度保留患者来源肿瘤组织在病理学和遗传学方面的特征,以及临床预测价值高等优势,在研究肿瘤生物学特征、探讨发生发展机制、药物筛选评估以及个体化治疗方面发挥非常重要的作用,逐渐成为临床前研究领域中首选的理想模型,但成功率不高是难推广的核心问题。
小鼠与人类的基因组具有高达95%以上的相似度,它在育种、传代、繁育、饲养成本等方面具有明显优势,因此成为生物医学研究领域最常用的模式动物之一。随着科学研究的不断深入,野生型小鼠已经无法满足实验研究的需要,基因工程小鼠应运而生,并迅速成为肿瘤研究领域最热门的体内实验模型。目前的基因工程技术可以对小鼠进行点突变、基因敲除、基因敲入、转基因、定点转基因及人源化等,并且可利用条件性基因打靶技术(Cre-loxP、Flp-FRT重组酶系统等)进行条件性基因敲除或敲入,实现目的基因的组织特异性表达、药物诱导性表达等,极大程度上为某个基因功能的研究提供强有力的实验手段和充足的体内实验证据。
基因工程小鼠一般建立在C57BL/6小鼠品系基础上,发展历程大概经历了四个阶段。第一阶段,人们将目的基因直接导入小鼠受精卵,实现目的基因的过表达,但是这种导入方式具有较大的随机性,成功率偏低,且有可能由于随机插入而影响正常基因的功能。第二阶段,美国的Mario Capecchi教授、Oliver Smithies教授和英国的Martin Evans教授将技术进行了改进,根据基因同源重组的原理,可以完成外源基因的定点整合,实现基因敲入或基因敲除,由于该基因编辑技术具有较高的精确性,因此也称为“基因打靶技术”,三位科学家也因该技术获得了2007年诺贝尔生理学或医学奖。基因打靶技术虽然精确度较高,可实现定点敲入或敲除等基因编辑操作,但还是存在一些不足之处,如对胚胎干细胞(embryonic stem cell,ES)的操作仅能实现小鼠全身基因的敲入或敲除,对重组ES细胞进行阳性筛选、阴性筛选等操作的实验成本较高,实验周期较长。第三阶段,科学家们将基因打靶技术进行了改进,Cre-loxP重组酶系统的应用可以实现基因的组织特异性或时空可控性表达。Cre工具鼠的大量开发应用使这种组织特异性表达可以涵盖小鼠机体的各个组织或细胞。此外,CreloxP、Flp-FRT等多个重组酶系统协同发挥“分子开关”作用,可以实现更加精密的基因调控操作。第四阶段,CRISPR/Cas9技术(2020年诺贝尔化学奖)的开发应用成为了现阶段基因工程小鼠的主流操作技术,针对目的基因设计和构建gRNA和Cas9表达质粒,可实现目的基因功能区域的定点切割,该技术效率高、周期短、成本低,并且可对目的基因多个位点或多个基因同时进行敲除或敲入操作,优势明显。
结直肠肿瘤的发病机制十分复杂,除饮食、肥胖、吸烟、运动等病因外,基因突变在很大程度上影响结直肠肿瘤的发生发展。一部分结直肠肿瘤患者表现为遗传性或家族聚集性特点,如家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)患者往往携带 APC 基因的胚系突变,该基因突变导致大部分患者青少年期就会出现大量结直肠息肉或腺瘤,并且一生中癌变的概率几乎是100%。林奇综合征是一组包含错配修复基因胚系突变的疾病,该类患者发生CRC和子宫内膜癌的概率明显升高。此外, P53 、 KRAS 等基因的突变在肠癌发生发展中也发挥关键性作用。针对如何更加系统深入地研究这些基因的功能,特别是如何提供更加确切可靠的体内实验证据?基因工程小鼠为此提供了最合适的实验模型。
现阶段的基因工程小鼠技术已经可以实现单个或多个基因在小鼠机体内某种组织中特异性表达或敲除,并可实现在药物诱导下的时空特异性表达。原本全身敲除某个基因可能会导致小鼠胚胎死亡,但是新技术则可以避免这种现象的发生,使得今后研究更多基因的功能成为可能。目前应用在CRC研究领域的基因工程小鼠种类繁多,涉及的基因众多,在此无法全部涵盖,以下举例介绍几种常见的基因工程小鼠模型。
APC (adenomatous polyposis coli)基因是Wnt信号通路中一个重要的抑癌基因,是结直肠肿瘤中最常见的突变基因之一,约80%的散发性结直肠癌患者的肿瘤组织中存在 APC 基因突变。同时, APC 基因又是FAP患者的致病基因,该基因的胚系突变将导致多发性结直肠腺瘤发生和腺瘤癌变率明显升高,且呈常染色体显性遗传。
鉴于 APC 基因在结直肠肿瘤发生发展中的重要作用,以该基因为靶点设计构建基因工程小鼠就成为研究肠道肿瘤发生发展过程的最经典的动物模型之一。目前的 APC 基因工程小鼠根据构建策略不同,有很多种类型。
1990年美国威斯康星大学麦迪逊分校的William Dove博士首先在C57BL/6J背景鼠基础上构建了C57BL/6J- APC min/+ 小鼠品系,他们将小鼠 APC 基因的第850位点产生无义突变,将编码亮氨酸的密码子(TTG)转变成终止密码子(TAG),产生APC截断蛋白,导致APC蛋白功能失活,使其不能与下游β联蛋白结合形成降解复合体,无法有效降低 cmyc 、 cyclin D1 等癌基因在细胞内的表达水平,使Wnt信号通路持续激活。该类型小鼠会产生肠道多发腺瘤,因此又被称为Min(multiple intestinal neoplasia)小鼠,它可以有效模拟FAP的发病机制,具有自发性、稳定性、可遗传性等特点,是目前国际公认的较为理想的肠道肿瘤研究模型之一,得到了广泛的应用。但是该小鼠模型也有不足之处,它虽然会产生较多的肠道息肉或腺瘤,但是它们最终进展为侵袭性腺癌的极少,这与临床FAP患者的疾病发展进程存在不一致。该小鼠模型更适用于研究早期肠道肿瘤的发生、发展和癌前病变的分子机制。
APC min/+ 小鼠一般有120天左右的自然生存期,大多数在9周龄左右开始出现肠道腺瘤,在整个生存期内每只小鼠肠道会产生约30个的息肉性病变,分布在小肠、结肠和直肠,并且伴有黑便、脱肛、贫血、高脂血症、脾大等表现。 APC Min/+ 小鼠诞生以后,科学家们还陆续构建了 APC 基因不同突变位点的小鼠模型,如Δ14、Δ716、Δ1309和1638N等。相比经典的 APC Min/+ 小鼠, APC Δ716 小鼠会产生更多的肠道微小息肉,平均300个/只,但是主要集中在小肠, APC 基因不同位点的突变模型可以满足不同研究的需求。
此外, APC Min/+ 小鼠还可以与其他基因缺陷小鼠进行杂交,通过对子代小鼠基因型的鉴定,筛选出双基因突变小鼠,进而研究另外一个基因在 APC Min/+ 小鼠肠道肿瘤发生中的作用,揭示多个基因突变的协同作用,模拟人类多基因突变累积导致肿瘤发生的过程。例如, APC Δ716 合并 Cdx2 基因突变小鼠,发生息肉的部位会更多地集中在结肠,而不是小肠,这更加符合人类肠道肿瘤的特点。 APC Δ716 合并 Smad4 基因突变小鼠,肠道腺瘤会很快转变为浸润性腺癌,但往往不发生转移,可以作为人类肠癌模型进行研究。目前,通过这种途径建立起来的 APC Min/+ 小鼠相关双基因突变小鼠模型已经有100余种,广泛应用于各类研究中。
APC 基因需要与其他蛋白结合,调控并激活Wnt信号通路,介导结直肠肿瘤的发生,因此,除 APC 基因外,该信号通路中的其他关键基因突变可能也会在结直肠肿瘤发生过程中发挥重要作用。β联蛋白基因就是 APC 下游Wnt信号通路的最重要的基因之一。例如,在小鼠肠道上皮中特异性过表达β联蛋白的N末端截短突变体(δ N131 β联蛋白),维持β联蛋白高水平表达状态,就会导致小鼠肠道中产生多发性不典型增生病变,类似 APC Min/+ 小鼠的肠道早期病变。β联蛋白基因第3外显子包含了β联蛋白的所有丝氨酸/苏氨酸磷酸化位点,它能够被糖原合成激酶β(3glycogen synthase kinase 3β,GSK3β)磷酸化而介导β联蛋白的降解。如果将小鼠肠道上皮中的该基因的磷酸化位点突变,则会导致β联蛋白在肠道上皮中的降解减少,β联蛋白表达升高,Wnt信号通路持续激活进而导致小鼠肠道中多发性腺瘤的发生。虽然β联蛋白基因工程有一些文献报道,但是与 APC 基因工程小鼠相比要少得多,应用也不是很广泛。
错配修复(mismatch repair,MMR)是维持机体基因组稳定性的重要修复系统,它能够对在DNA复制过程中发生错误的碱基进行替换修复或小片段修复,而且对DNA损伤也能发挥修复作用。一旦MMR功能缺失,将导致基因组错误的累积,肿瘤的发生率会明显升高。林奇综合征就是一组 MMR 基因胚系突变而产生的疾病,最常见发生突变的 MMR 是 MLH1 、 MSH2 、 MSH6 和 PMS2 等,由于基因突变的累积,患者一生中罹患CRC、子宫内膜癌等恶性肿瘤的概率明显升高。
理论上讲,根据CRC发生的基因学基础建立的基因敲除小鼠模型是比较理想的研究思路,因此科学家们成功构建了 Mlh1 、 Msh2 和 Msh6 等基因敲除小鼠。该类型小鼠会出现包括胃肠道在内的多器官肿瘤,且大多数小鼠会在未成年期死于侵袭性淋巴瘤。 Msh2 -/- 小鼠的肿瘤表现为高度微卫星不稳定状态,这与林奇综合征患者的肿瘤情况相似。这些基因工程小鼠模型的成功构建为进一步深入研究林奇综合征患者肿瘤的发病机制和治疗靶点提供了良好的实验平台。
在人类基因组中, SMAD4 基因和 APC 基因位于不同的染色体,但是在小鼠基因组中,它们同位于小鼠第18号染色体,相距约30cm。如果将 Smad4 突变引入 APC Δ716 小鼠中,则小鼠腺瘤会进展为侵袭性腺癌。即使如此,该类型小鼠( cis - APC/Smad4 小鼠)在整个生存期内发生远处转移的概率很小,其发生肿瘤的组织学特点类似于人类的右半结肠癌,并且与TGF-β的Ⅱ型受体突变有关。一部分 cis - APC/Smad4 小鼠还会发生十二指肠乳头部位的腺癌,临床上一部分全结肠切除术后的FAP患者也会有类似现象发生。
近年来,除上述常见模型外,CRC相关的基因工程小鼠模型得到持续开发,种类繁多,在分子机制、药物筛选和治疗等研究领域中发挥越来越重要的作用。笔者所在研究团队也构建了多种基因工程小鼠模型以用于结直肠肿瘤相关研究。例如,Wang等研究显示,在AOM或AOM/DSS等化学诱导剂诱导下,一方面,肠道特异性 Hmga2 敲入小鼠能够通过MDM2/P53依赖途径促进CRC肿瘤的发生和发展;另一方面,该小鼠通过STAT3/CCL2途径促进肿瘤微环境中巨噬细胞的招募和M2型极化,在结直肠肿瘤免疫逃逸过程中发挥重要作用。另外,Yu等研究显示,在使用AOM/DSS模型诱导或与 APC Min/+ 小鼠杂交后,与WT小鼠相比, Mir4435 - 2hg 敲除能够通过增加多形核髓源性抑制细胞的浸润而重塑免疫抑制微环境,并由此促进结直肠肿瘤的形成与进展。
近年来,随着人们对CRC病因、分子诊断和治疗方面的不断探索,CRC患者的生存率有了显著提高,但是CRC的转移仍然是患者死亡的最主要原因之一。根据肿瘤生物学行为的不同,CRC会发生不同部位的转移,包括淋巴转移、肝转移、肺转移、腹膜转移、卵巢转移等,少数患者还会发生脑转移和骨转移。这些转移的发生一方面是由于肿瘤细胞本身的基因突变导致细胞发生上皮-间充质转换,肿瘤细胞在驱动因子的作用下以某种途径脱离原发灶部位;另一方面,肿瘤细胞到达转移部位,与局部微环境相互作用,定植并生长,形成转移灶。深入研究结直肠肿瘤细胞发生转移的分子机制,具有十分重要的科学意义,这就需要构建科学、合理、可行的CRC转移模型。目前,多种CRC转移模型的构建已相对成熟,下面将简要加以介绍。
结直肠癌肝转移模型分为自发性和实验性结直肠癌肝转移小鼠模型。自发性结直肠癌肝转移小鼠模型,是指将CRC组织或细胞悬液种植于盲肠或直肠部位,原位肿瘤不经过其他干预进而自发转移至肝脏的一种模型,该模型最大限度地模拟了结直肠癌肝转移的过程,即盲肠和直肠原位种植肝转移模型。实验性结直肠癌肝转移小鼠模型,是指人为将CRC细胞注射至脾、肝或门静脉中,以模拟结直肠癌肝转移的过程,包括脾种植肝转移模型、肝种植模型和门静脉/肠系膜静脉注射模型。
盲肠和直肠原位种植肝转移模型,高度模拟了位于盲肠和直肠壁上的CRC细胞通过局部浸润、脱落、侵入血管而通过门静脉系统转移至肝脏的自然过程,是目前最理想的结直肠癌肝转移模型,证据等级较高。但由于其技术要求高且操作复杂的限制,该模型在CRC肝转移的研究领域并未得到广泛推广。
由于脾静脉与肠系膜上静脉相互汇合形成肝门静脉而进入肝脏,因此将CRC细胞注射入脾可构建脾种植肝转移模型,该方法操作简单,并且肝转移率高。根据是否切除脾,脾种植肝转移模型分为脾保留法、脾切除法和半脾模型。脾保留法是指将CRC细胞注射入小鼠脾脏的上极或下极,之后需使用酒精棉球按压注射部位以防止癌细胞外溢,最后将脾复位。该方法操作简单,并且能够保留小鼠脾脏的抗肿瘤免疫功能,应用范围较广,但是由于该模型会引起腹腔内多个肿瘤灶形成,包括肝部位转移灶和脾注射部位的原发肿瘤,进而缩短小鼠存活期而影响实验结果。脾切除法是指将CRC细胞注射入脾后,将其切除。该模型的优势在于,由于不合并有脾肿瘤而导致肝转移成功率升高,表现为肝转移肿瘤数量多且体积大,能较好地模拟CRC根治术后经血行途径发生肝转移的过程。但是由于手术操作复杂以及切脾后破坏小鼠免疫系统等因素会导致其存活率降低。而半脾模型是一种介于脾保留法和脾切除法之间的改良模型。首先,脾中央使用一次性钛夹夹闭并切断,分成两个带血管蒂的半脾。之后将100μl左右的CRC细胞悬液注射入脾下极被膜下,待约10分钟即CRC细胞经脾静脉进入肝后,结扎切断脾下极血管并切除脾下极,保留脾上极并将其回复至腹腔内。半脾模型既能保留脾的免疫功能,又能避免脾肿瘤负荷过大对小鼠的损伤,是一种既能发挥脾保留法和脾切除法的优点,又能规避两者缺点的模型。综上所述,脾种植肝转移模型能够较好地模拟CRC细胞侵入门静脉系统后发生肝转移的生物学行为,是研究该过程的一种理想动物模型。
肝种植模型和门静脉/肠系膜静脉注射模型是两种研究CRC晚期转移的模型。肝种植模型是指将CRC细胞悬液直接注射入小鼠肝实质内,或者将CRC组织切成小块后直接种植入肝脏内,进而在肝内形成转移瘤的一种动物模型。门静脉/肠系膜静脉注射模型是指将CRC细胞悬液缓慢直接注射至小鼠门静脉或肠系膜静脉内,通过门静脉系统转移至肝脏的一种动物模型,手术操作较为复杂,需规避因大量、快速注射癌细胞引起的静脉栓塞风险。在结直肠癌肝转移过程中,CRC细胞经历从原发部位脱离、向周围组织发生浸润、侵入血管或淋巴管、在血管中逃避机体免疫杀伤以及通过肠系膜静脉进入门静脉等多个阶段后,最终在肝脏中定植。因此,结直肠癌肝转移是一个多因素调控、由多步骤构成的极其复杂的生物学过程。而肝种植模型和门静脉/肠系膜静脉注射模型虽然转移成功率较高,但是这两种模型仅模拟了结直肠癌肝转移的终末阶段,因此不适用于早期阶段和淋巴道转移领域的研究。
肺是CRC远处转移的第二大常见部位,仅次于肝。与结直肠癌肝转移相比,结直肠癌肺转移表现出明显不同的生物学特性。直肠中下段癌更易出现肺转移,主要是由于直肠中下段的癌细胞可通过直肠中、下静脉经髂静脉进入下腔静脉而定植于肺。除解剖因素外,其他因素,如肺转移前微环境的形成以及原发灶肿瘤细胞特定基因特征导致的亲靶器官性等,都可能导致结直肠癌肺转移的形成。因此,构建结直肠癌肺转移动物模型具有重要意义,而尾静脉注射肺转移模型是目前该研究领域中应用最广泛的方法。在该模型中,将小鼠固定并扩张其尾静脉后,通常于鼠尾侧面取中下1/3至中点处的尾静脉进针,将100~200μl混匀后的CRC细胞悬液直接注射入小鼠尾静脉中,进而在几周后对肺脏中的转移瘤进行观察。尾静脉注射肺转移模型较好地模拟了CRC通过血行途径发生肺转移的生物学过程,具有操作简单、转移率高和可重复性强等特点,在探索结直肠癌肺转移的分子机制和筛选药物等方面具有诸多优势。
腹腔转移是晚期CRC常见的转移途径,常伴有癌性腹水,与患者不良预后相关。腹腔转移可来源于原发灶中CRC细胞突破浆膜层而扩散,也可来源于手术中癌细胞脱落而种植至腹腔中。脱落之后的CRC细胞在腹腔中通过获得一系列能力,如抗失巢凋亡能力、免疫逃逸能力以及在缺氧环境中生长和转运的能力等,最终在腹腔器官表面或腹膜上定植下来。该模型构建方法简单,小鼠经麻醉后,在无菌条件下取腹部正中切口,将处于对数生长期的CRC细胞悬液注射入腹腔内,关腹,于数天或数周后观察腹腔转移情况。由于该模型最终会导致CRC细胞在腹腔内广泛转移,缺乏转移靶器官的特异性,这个表现在一定程度上限制了该模型的应用。按照CRC的转移途径可分为淋巴转移、血行转移和种植转移三种类型,腹腔种植模型是研究晚期CRC通过种植转移途径发生腹腔转移的一种理想模型,在CRC淋巴转移和血行转移途径的研究领域中具有局限性。
淋巴转移是CRC的重要转移途径之一,是确定临床分期和决定治疗方案的重要依据,但是淋巴转移机制的研究还不够深入,相对应的动物实验模型也较少。近年来,随着免疫治疗在CRC领域的临床应用,免疫研究相关动物模型的需求日益增多。淋巴结作为机体对抗肿瘤的一道重要免疫防线,近距离接触肿瘤细胞,对肿瘤细胞及其分泌的细胞因子做出反应,并招募免疫细胞发挥抗肿瘤作用。淋巴结中免疫细胞的数量和状态在一定程度上反映了机体肿瘤免疫耐受的程度及可动员的免疫潜能,因此,CRC淋巴转移模型的设计和应用十分具有科学意义和临床转化前景。
目前一个相对比较成熟的CRC淋巴转移模型是将肿瘤细胞直接接种于小鼠的直肠黏膜下,数周后解剖小鼠,观察相应区域淋巴结的转移情况。由于小鼠的直肠壁较薄,接种的技术细节要求较高,一般要选择细的穿刺针,细胞悬液的体积不宜太大,可以选择Matrigel与细胞混合,以降低细胞悬液渗漏的风险,穿刺针在直肠黏膜下潜行一段距离后再注射细胞,注射过程也要缓慢,最好能够看到在直肠黏膜下形成一个透明的小泡。否则,如果穿刺针穿透直肠壁,肿瘤直接接种于腹腔,或者肿瘤细胞未能存留在直肠壁,而是经肛门流出,都很难成瘤成功。
建立淋巴转移模型还要对小鼠的淋巴系统有所了解,有研究报道小鼠直肠引流的第一站淋巴结为髂动脉间淋巴结,第二站淋巴结为髂动脉旁淋巴结,第三站淋巴结为肾门淋巴结。了解这些小鼠淋巴结的分布范围有利于解剖留取准确的样本,完成相关的实验检测。
除了直接将肿瘤细胞注射于直肠黏膜下,还可以将CRC细胞悬液接种于小鼠后肢及后肢爪垫皮下等部位,可在局部引流淋巴结内观察到转移癌组织。这些模型为深入解析早期CRC发生淋巴转移的生物学行为、探索分子机制、筛选诊断标志物、评估药效和发现治疗靶点等方面的研究提供有力的支撑。
虽然CRC转移到脑和骨的发生率较低,但是这两种转移方式不仅严重影响患者的生活质量,而且其预后也极差,因此CRC脑和骨转移逐渐受到重视。CRC脑和骨转移模型可使用左心室内、颈动脉内或尾静脉内癌细胞悬液注射法构建。左心室内注射法通常在超声引导下进行,小鼠麻醉后取仰卧位,在左侧胸壁第二肋间距胸骨缘3mm处,以45°向左心室进针3~5mm,待见到明显回血后缓慢将CRC细胞悬液注射入左心室内。颈动脉内注射法常行1~2cm长颈部正中切口,显露一侧颈总动脉后,于颈总动脉分叉下方5~6mm即颈内动脉处以斜角进针,缓慢匀速将CRC细胞悬液注射入颈动脉内。相较于左心室内注射法,颈动脉内注射法对技术的要求相对较低。而尾静脉内注射法的操作虽然相对简单,但是由于器官靶向性较差,在发生脑和骨转移之前就已出现其他器官的转移而影响实验结果。另外,CRC脑和骨转移模型还可构建脑内和骨髓内原位种植模型,但是操作复杂和成功率低的特点限制了这两个模型的推广度。
(吴晶晶 来茂德)
类器官是指将具有干细胞潜能的细胞或含有干细胞的组织经过体外三维(3-dimensional,3D)培养,形成具有特异性器官样结构的多功能细胞团。类器官是一种由多种细胞类型构成的体外三维培养物,能够较好地模拟体内组织器官的结构和功能,具有自我更新和在体外长期传代培养的特点。患者肿瘤来源类器官是指利用手术切除、活检等方式获得的肿瘤标本经处理后,在特定条件下对肿瘤细胞进行体外培养而建立的3D多细胞群,与患者来源的肿瘤组织具有高度相似性。近年来,类器官和肿瘤类器官技术不断发展。2009年,Sato教授等在添加了EGF、头蛋白(noggin)和R-脊椎蛋白1(R-spondin1)的培育体系中,将小鼠Lgr5+肠道干细胞在体外进行3D培养后,成功诱导出小肠类器官。2011年,该团队通过改良培养条件,成功培育出结肠类器官,并在结肠腺瘤和腺癌中建立结肠肿瘤类器官模型。2015年,van de Wetering教授等建立了由20多例CRC患者来源的肿瘤及邻近正常组织构成的类器官生物样本库,并进行了药物筛选研究。2017年,被Nature Methods评为生命科学领域年度技术,是一种极具发展前景的体外实验模型。
结肠类器官可从手术或活检肠道标本中获得,将切成小段的结肠组织消化、沉降和过滤后,滤过液经离心后弃上清液,沉淀中含结肠隐窝。结肠癌类器官也可取自手术获得的结肠癌标本,并通过类似的方法获得,最后将沉淀物置于基质胶Matrigel中培养,基础培养基中通常含有DMEM/F12、N2、B27、Glutamax、N-acetylcysteine,另外需在基础培养基中额外加入一些细胞因子,如EGF和R-spondin1等。目前,结肠和结肠癌类器官的培养试剂均已商品化。
相较于体外2D细胞培养模型和体内PDX动物模型,类器官作为一种体外3D培养模型具有巨大的优势。类器官最大的优势表现为可在体外稳定传代,能够保持来源组织的形态结构、基因表型、生物学功能和特征,实验操作简便,培养周期较短,通常1~2周即可完成传代,并且可冷冻保存,复苏后还可继续培养。CRC类器官取自手术或活检肿瘤标本,与患者来源肿瘤表现为高度同源,能够保留患者肿瘤组织的异质性,且在传代扩增中维持基因组稳定性,在基础、临床前和临床转化研究领域中均具有广泛的应用前景。
在基础研究领域,一方面CRC类器官可以用以建模,为研究其生物学行为和发生机制提供载体;另一方面,可以将CRISPR/Cas9技术与类器官技术相结合,以研究某个或某组特定基因在CRC发生、发展和演进过程中的功能和机制。
在临床前和临床转化研究领域中,CRC类器官应用价值更大。首先,CRC类器官技术可用于高通量抗肿瘤药物筛选,特别是CRC类器官生物库的建立,能够为个体化治疗提供有力保障,实现精准治疗。其次,肿瘤类器官技术可用于药物毒理学研究,在药物开发过程中,可使用类器官对药物的毒性和药效进行检测和评估,为CRC的新药研发提供参考。另外,还可用于分子诊断标志物的筛选,为临床转化提供证据支持。但是,类器官模型作为一种新兴技术,发展尚未成熟,还存在一定的局限性,具体表现在以下几个方面。第一,缺乏正常肠道或CRC组织的间质成分,包括各种免疫细胞、基质、血管和神经组织等,因此类器官和真正的器官之间区别仍然较大,肿瘤类器官模型无法用于免疫耐受、免疫治疗、肿瘤微环境、血管形成等方面的研究,这也是类器官培养技术亟待解决的问题。第二,优化和降低培养成本,类器官培养过程中常需要加入一些细胞因子等成分,导致培养成本升高,并且不同的培养方法会造成类器官的不同,因此降低类器官的培养成本并优化其培养方案可提升该模型的使用率。第三,类器官能传代,但不能长期传代。第四,到目前为止,仍然有一部分器官和肿瘤组织无法培养出类器官,因此需加大该方面的研究推广力度。
综上所述,正常结肠和CRC类器官技术已发展较为成熟,不仅与患者来源组织器官保持有高度相似的生理、病理和遗传学特征,还具备操作简单和可传代冻存等特点,在肠道正常发育、CRC发生发展机制、药物筛选和个体化精准治疗方面具有非常重要的意义。
肿瘤发生的研究相对比较困难,往往涉及少数细胞群的动态演变过程,如何精细模拟这个过程极具挑战性。类器官实验模型可以在一定程度上给肿瘤发生的研究提供帮助。2021年,科学家van Neerven等在 Nature 上报道,在肠道干细胞群中Wnt信号通路的平衡对于维持肠道局部稳定性、调控肠道上皮细胞快速更新具有重要作用。他们将 APC 基因突变肠道上皮类器官与野生型(wild-type,WT)肠道上皮类器官共培养,实验结果发现前者会分泌Wnt信号通路的拮抗剂,进而促进野生型类器官分化,而GSK3β抑制剂氯化锂则可以降低这种影响,减少腺瘤形成。类器官模型的应用使肠道肿瘤发生过程的研究变得可视化和可编辑化,有利于揭示其中的分子机制。
CRC患者的死亡原因之一就是对化疗药物不敏感。类器官实验模型作为一种可以建立在临床患者肿瘤样本基础上的体外实验模型,既能够实现最大限度接近肿瘤原发灶药敏特性,又可以兼顾实验成本、检测周期和高通量的要求,是临床药敏检测的理想模型之一。2022年,Ohta教授等在 Nature 上报道,LGR5+p27+细胞的存在往往是耐药产生的细胞群之一, COL17A1 基因表达的上调在维持该群细胞功能中发挥重要作用。在敲除 COL17A1 基因的类器官实验模型中,LGR5+p27+细胞群占比会明显下降,并且恢复对化疗的敏感性。该研究成果为CRC的耐药研究提供了新的思路。
Hanahan等在 Cell 发表的综述里阐明,血管生成(angiogenesis)是恶性肿瘤的特征之一。当恶性肿瘤生长到一定体积后,血管生成是维持肿瘤生长的必要条件,一方面新生血管能够为肿瘤提供营养,另一方面新生血管能够带走肿瘤所产生的代谢产物。肿瘤的血管生成是一个受多因素调控及多个信号通路参与的复杂生物学过程。一系列细胞因子与该过程密切相关,包括血管内皮细胞生长因子、成纤维细胞生长因子和血管抑素(angiostatin)等。新生血管生成在肿瘤的发生、发展、转移、演进和复发过程中均发挥重要作用。因此,构建出能够模拟肿瘤血管生成的体外三维模型对研究肿瘤的分子机制以及发现治疗靶点都具有非常重要的意义,抑制血管生成被认为是遏制肿瘤发展的有效治疗策略之一。目前,在该模型中,人们通常使用人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC),经过稳定培养后,置于基质胶中进行3D培养,内皮细胞通过其分裂和迁移能力而形成管腔样的新生血管结构,并可在镜下对血管生成进行量化分析。若在该模型中,将CRC细胞与HUVEC共培养,则可以研究肿瘤细胞对血管生成的影响。另外,在CRC中,可利用该模型开发血管生成抑制剂及相关药物,并在血管生成耐药基因的筛选中发挥重要作用。综上所述,该模型方法简单,可操作性强,在肿瘤血管生成领域的研究中应用较为广泛。
除上述模型外,多种体外模型也应用于CRC相关研究。随着肿瘤研究的深入,越来越多的恶性肿瘤特征不断得以发现,包括促进细胞增殖、抵抗细胞死亡、浸润和转移、能量异常、免疫逃逸、表观遗传重编程和多态微生物组等。在CRC中,不同的实验模型可用于不同的恶性肿瘤特征研究,如Transwell迁移侵袭实验、细胞划痕实验、软琼脂克隆形成实验、CCK8细胞增殖实验和流式细胞术等可在体外对CRC细胞的迁移、侵袭、增殖、凋亡和细胞周期调控进行分析和检测。另外,体外CRC细胞/免疫细胞共培养实验、免疫荧光、流式细胞术和酶联免疫吸附测定法等实验手段在结直肠肿瘤免疫和微环境研究领域中发挥重要作用。由于这些体外模型和实验方法较为常见,此处不展开讨论。
综上所述,多种体内、外实验模型广泛应用于CRC研究中,体内模型包括自发和诱发性肿瘤模型、种植性肿瘤模型、基因工程小鼠实验模型以及CRC转移模型,体外模型包括CRC类器官实验模型、体外血管生成三维模型及其他体外实验模型(图8-2-1)。各种体内和体外的模型都有其优越性和局限性,应该发现各模型的优势并直视其存在的不足,根据自己的研究需求选择适合的模型。另外,随着新技术和新方法的不断涌现,需要不断学习才能得以提高。我们希望研究者们在将来可以构建更理想的CRC体内、外模型,为探索发病机制、揭示生物学行为、发现诊断分子标志物、药物筛选以及临床转化治疗方面提供有效的研究手段和平台。
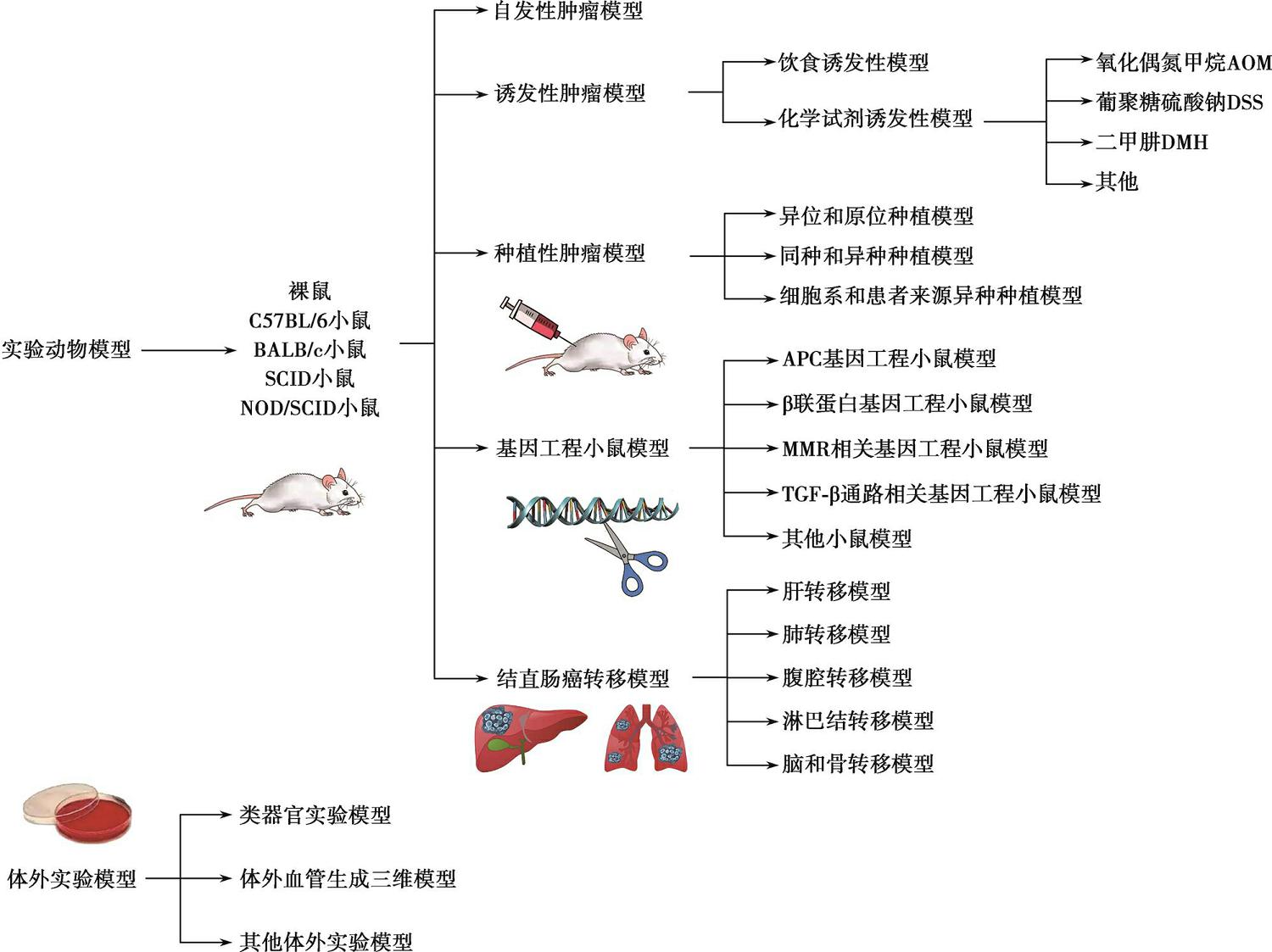
图8-2-1 结直肠肿瘤的体内、外实验模型
(王健 来茂德)
[1]NEUFERT C,BECKER C,NEURATH M F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression[J].Nat Protoc,2007,2(8):1998-2004.
[2]DE ROBERTIS M,MASSI E,POETA M L,et al. The AOM/DSS murine model for the study of colon carcinogenesis:From pathways to diagnosis and therapy studies[J]. J Carcinog,2011,10:9.
[3]BISSAHOYO A,PEARSALL R S,HANLON K,et al.Azoxymethane is a genetic background-dependent colorectal tumor initiator and promoter in mice:effects of dose,route,and diet[J]. Toxicol Sci,2005,88(2):340-345.
[4]STIEDL P,GRABNER B,ZBORAY K,et al. Modeling cancer using genetically engineered mice[J]. Methods Mol Biol,2015,1267:3-18.
[5]BURTIN F,MULLINS C S,LINNEBACHER M. Mouse models of colorectal cancer:Past,present and future perspectives[J]. World J Gastroenterol,2020,26(13):1394-1426.
[6]SENDA T,IIZUKA-KOGO A,ONOUCHI T,et al. Adenomatous polyposis coli(APC)plays multiple roles in the intestinal and colorectal epithelia[J]. Med Mol Morphol,2007,40(2):68-81.
[7]AOKI K,TAMAI Y,HORIIKE S,et al. Colonic polyposis caused by mTOR-mediated chromosomal instability in Apc+/Delta716 Cdx2+/-compound mutant mice[J]. Nat Genet,2003,35(4):323-330.
[8]TAKAKU K,OSHIMA M,MIYOSHI H,et al. Intestinal tumorigenesis in compound mutant mice of both Dpc4(Smad4)and Apc genes[J]. Cell,1998,92(5):645-656.
[9]ROMAGNOLO B,BERREBI D,SAADI-KEDDOUCCI S,et al. Intestinal dysplasia and adenoma in transgenic mice after overexpression of an activated beta-catenin[J]. Cancer Res,1999,59(16):3875-3879.
[10]HARADA N,TAMAI Y,ISHIKAWA T,et al. Intestinal polyposis in mice with a dominant stable mutation of the betacatenin gene[J]. EMBO J,1999,18(21):5931-5942.
[11]WANG Y,HU L,WANG J,et al. HMGA2 promotes intestinal tumorigenesis by facilitating MDM2-mediated ubiquitination and degradation of p53[J]. J Pathol,2018,246(4):508-518.
[12]WANG X,WANG J,ZHAO J,et al. HMGA2 facilitates colorectal cancer progression via STAT3-mediated tumor-associated macrophage recruitment[J]. Theranostics,2022,12(2):963-975.
[13]YU H,CHEN C,HAN F,et al. Long noncoding RNA MIR4435-2HG suppresses colorectal cancer initiation and progression by reprogramming neutrophils[J]. Cancer Immunol Res,2022,10(9):1095-1110.
[14]SATO T,VRIES R G,SNIPPERT H J,et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature,2009,459(7244):262-265.
[15]SATO T,STANGE D E,FERRANTE M,et al. Longterm expansion of epithelial organoids from human colon,adenoma,adenocarcinoma,and Barrett’s epithelium[J].Gastroenterology,2011,141(5):1762-1772.
[16]VAN DE WETERING M,FRANCIES H E,FRANCIS J M,et al. Prospective derivation of a living organoid biobank of colorectal cancer patients[J]. Cell,2015,161(4):933-945.
[17]VAN NEERVEN S M,DE GROOT N E,NIJMAN L E,et al.Apc-mutant cells act as supercompetitors in intestinal tumour initiation[J]. Nature,2021,594(7863):436-441.
[18]OHTA Y,FUJII M,TAKAHASHI S,et al. Cell-matrix interface regulates dormancy in human colon cancer stem cells[J]. Nature,2022,608(7924):784-794.
[19]HANAHAN D,WEINBERG R A. The hallmarks of cancer[J]. Cell,2000,100(1):57-70.
[20]HANAHAN D,WEINBERG R A. Hallmarks of cancer:the next generation[J]. Cell,2011,144(5):646-674.
[21]HANAHAN D. Hallmarks of cancer:new dimensions[J].Cancer Discov,2022,12(1):31-46.