




炎性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)与克罗恩病(Crohn’s disease,CD),前者是肠道慢性非特异性炎症,主要累及结肠,后者为一种慢性肉芽肿性炎症,可累及整个消化道,两者均表现为反复急性发作与间隔长短不一的缓解期相互交替的自然病程,是一种慢性难治疾病,严重影响患者的工作和生活质量。IBD在不同国家、地区、不同种族人群中的发病率不同,有显著的地域及种族差异。IBD在欧美国家较常见,UC的发病率为(1.5~20.3)/10万人,患病率为(21.4~2 490)/10万人;CD的发病率为(0.7~20.2)/10万人,患病率为(8.3~319.0)/10万人。而在亚洲国家,IBD少见,近10年有逐渐增加的趋势,但仍远低于欧美国家。亚洲国家由于多为发展中国家,开展流行病学研究存在更多的困难,如感染性结肠炎、肠结核及肠道寄生虫感染等发病率较高,易与IBD混淆,增加了诊断难度;由于发病率低,很难进行以人群为基础的流行病学调查;缺乏完善的登记制度等。目前,国内研究多以医院为基础,尚缺乏大规模的以人口为基础的流行病学调查,故无法得到确切的患病率和发病率。近期三项基于人群的前瞻性研究提示我国IBD、UC及CD的发病率已分别升至(1.77~3.14)/10万、(1.45~2.05)/10万和(0.13~1.09)/10万,且各种迹象显示其仍在日益攀升。
IBD的病因及发病机制至今仍未完全明确。目前认为IBD的病因及发病机制因果关系复杂,可能与遗传因素、免疫紊乱及肠道微生态有关。
IBD患者的家族聚集现象很常见,据报道10%~20%的IBD患者有IBD家族史,而且兄弟姐妹间的IBD发病率高出普通人10%。1963年,美国芝加哥大学对于UC的研究中发现,89个家族成员中有50个是亲兄妹或表兄妹,与先证者的家庭组成类似。对于区域性肠炎,22个家族成员中有15个同时患病,他们包括亲兄弟、亲姐妹及第一表兄弟姐妹。研究表明,有家族史的患者发病时间似乎比较早,而且有CD家族史的人群患CD的概率比UC家族史的人群患UC的概率要高,这提示CD与UC相比有更强的基因易感性。一些学者致力于研究IBD家族史与发病年龄、病变部位、病变类型的关系及疾病的发展过程,发现86%的家族患者其病变部位一致,82%的家族患者其病变类型一致。有趣的是,在连续一代代的家族患病成员中,其发病年龄越来越年轻化。总之,在有UC家族史的人群中,UC的发病率增高,同样,在有CD家族史的人群中,CD的发病率也增高。
在20世纪40年代后期及50年代前期,免疫机制被认为可能在很多没有明确病因的疾病中起重要作用。最初对IBD是一种“免疫介导”疾病的认识仅仅提供了一个概念性的说法,但实际上如何通过免疫介导致病发生发展的具体机制还不清楚。1956年,Kirsner和Elchlepp利用1920年Auer使用兔子耳朵暴露于稀释的二甲苯后产生的对异种蛋白的原位自身过敏的原则,通过灌肠把作为抗原的鸡蛋蛋白放在兔子的远端肠道从而得到免疫复合物,后来在该区域发现了UC表现,从而说明了免疫因素在IBD中确实起作用。Auer-Kirsner模型成为目前最常用的UC模型。
在二十世纪六七十年代,免疫因素成为IBD病因研究中的热点。随后的胃肠道免疫研究发现,IBD患者的免疫系统是正常的,其对普通的病原体能正常产生抗体。在约40年(1950—1990年)的研究期间,对于导致IBD发生的免疫异常依然没有一个确定性的证据。同时也没有证据表明自身免疫参与IBD的发生发展。目前阐述的大部分免疫机制,包括各种抗体随着UC或CD的病情缓解而出现或消失,都显示了继发的肠道黏膜慢性炎症性活动。
IBD免疫系统中的细胞及分子特性、活化以及维持的因素仍未明确。异型核白细胞、淋巴细胞、单核细胞、巨噬细胞、嗜酸性粒细胞、肥大细胞以及帕内特细胞在肠道感染和多种试验性的肠道损伤中被发现有所增高,因此并不能认为它们是IBD特异性的细胞。多种细胞因子参与免疫反应和炎症过程,这是当前关于发病机制的研究热点之一。对细胞因子作用及免疫系统如何发挥调节作用的研究追溯至1972年由巨噬细胞诱导T细胞产生IL-1,1976年Chen和Sabato发现了IL-2,1984年Sharon和Stenson证明了在UC患者的结肠黏膜中促炎性细胞因子白三烯B4成50倍增高等。现在越来越多的细胞因子及其他免疫分子被发现,但没有一个是在IBD中特异性存在的。目前研究普遍认为细胞因子在肠道免疫反应中的3种作用途径主要是调节上皮细胞黏附分子的表达、释放促炎症介质及免疫调节因子的作用。
环境在IBD致病过程中有重要作用,但关于肠道微生态的正确认识及它们如何导致疾病的发生发展仍未明确。微生态作为致病因素在CD中很有可能成立,因为CD患者的肠道微生态菌群明显增多,且抗生素治疗效果显著。IBD致病的感染源有细菌、病毒、真菌等,种类繁多。Sartor提出,普通肠道病原的感染或暴露微生物、环境毒素诱导组织损伤及增加黏膜的通透性,导致继发内源菌群的侵入,使菌群产物,如PG-PS、脂多糖(lipopolysaccharide,LPS)、甲酰三肽(N-formyl-methionylleucyl-phenylalanine,fMLP)进一步增加。炎症性反应在正常人群中是自限性的,可以自愈而没有任何残留损伤。然而,在基因易感性的宿主中免疫反应会不恰当地扩大化,导致肠道慢性炎症性反应。
目前普遍认为细菌菌落及其产物可能在IBD的发病机制中有重要作用。肠道内的异常菌落已经被认识,厌氧菌落的成功培养证明了CD患者肠道内比正常对照组有更多的革兰氏阳性(G+)球菌落及革兰氏阴性(G-)杆状菌落。UC患者的细菌培养与正常对照组的菌落数量相当,但从患者中分离的埃希菌属与对照组相比有更强的黏附性。细菌细胞的各种产物可以使完好无缺的微生物体产生组织及免疫炎症,这些产物包括PG-PS、LPS、FMLP等。这些细菌产物可以激活巨噬细胞,释放细胞因子,导致细胞黏附分子的过度表达,调节迟发型T细胞和B细胞反应,触发激肽释放及补充性的瀑布反应。这些联动或许可以解释IBD的病理生理过程。
Wakefield等认为CD可能与潜在的麻疹病毒感染有关,并提出长期的肠系膜血管炎导致胃肠道黏膜多灶性缺血梗死,从而导致CD的假设。这些损伤组织在电子显微镜下与副黏病毒损伤类似,且免疫组织化学染色及体内麻疹病毒的杂交结果同样支持以上观点。流行病学数据也支持CD与麻疹病毒感染有关系。但仍需完善更多的工作来更准确地支持或否决这样的假设。
肠道黏膜上皮是由上皮细胞排列组成的单层结构,肠道上皮细胞的黏液层是宿主抗细菌免疫反应的第一个保护线。早期的研究表明,特异的黏液在IBD患者中可能被消耗,后续研究未能区分在UC、CD患者及正常对照组人群中的黏膜成分的不同点。IBD患者的黏液成分可能没有缺陷,但是血凝素黏合剂的改变在UC及CD患者中被发现,提示可能是细菌的黏附能力及上皮细胞的其他物质改变导致IBD。
Chiodini及其同事从一部分CD患者中分离培养了结核分枝杆菌。在过去数年里,一个特异的分枝杆菌DNA的插入序列——IS900,在M分枝杆菌的基因组里面被发现,现在已经被克隆,而且经过PCR技术已用于CD肠道标本的标记。3%~65%的CD组织中可以发现IS900。M结核分枝杆菌与CD之间的关系仍不能确定。虽然传统的真菌感染没有被认为是病因机制的一种,但有学者的研究表明酵母菌可能在CD的发病机制中有重要作用。
UC最常发生于青壮年期,根据我国资料统计,发病高峰年龄为20~49岁,性别差异不明显。多数起病缓慢,少数急骤,病程多在4~6周以上,发作诱因常为精神刺激、疲劳、饮食失调、继发感染。
(1)黏液脓血便:
是UC最常见的症状,急性期常常表现为血性腹泻,可带黏液或脓性分泌物。70%的UC患者在急性期每天约排便5次,腹泻轻重不一,轻者每天2~3次,重者每1~2小时1次,主要原因是结肠炎症。
(2)腹痛:
腹痛一般不太剧烈,多位于左下腹或下腹部,性质常为阵发性痉挛性绞痛,伴肠鸣、便意,便后疼痛可暂缓解,有腹痛-便意-便后缓解规律。出现持续性腹痛、腹胀及肠鸣音减弱时,应警惕中毒性巨结肠的发生。
(3)里急后重:
当活动性炎症累及肛门、直肠、乙状结肠时,可导致排便紧迫感和排便时痉挛样痛。
(4)腹部包块:
在UC中较少见。当炎症累及乙状结肠时,偶在体形消瘦的患者中可触及左下腹包块。
病程较长者常有乏力、食欲缺乏、消瘦、贫血等;急性发作期常有低热或中等发热,重症可有高热、心率加速等全身毒血症状及水、电解质平衡紊乱等。
UC患者可出现结节性红斑、坏疽性脓皮病、眼部病变(葡萄膜炎和虹膜炎)、关节病变(关节痛和关节炎)、骶髂关节炎、原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)、胆石症和肉芽肿性肝炎。总体来说,其肠外表现发生率较CD低。但PSC在UC患者中则比在CD患者中更常见。
CD最常发生于青年期,根据我国统计资料,发病高峰年龄为18~35岁,男性多于女性(男女患者之比约为1.5∶1)。临床表现呈多样化,慢性腹泻是最常见的临床表现,其他常见症状有腹痛、腹部包块、瘘管形成及乏力、食欲缺乏、发热、体重减轻等。当患者尤其是年轻患者出现这些症状时,应注意考虑CD的可能。
(1)腹痛:
常位于右下腹或脐周,间歇性发作,常为痉挛性阵痛伴腹鸣,多于进餐后加重,排便或肛门排气后缓解。腹痛的发生可能与进餐引起胃肠反射或肠内容物通过炎症、狭窄肠段引起局部肠痉挛有关,亦可由部分或完全性肠梗阻引起,此时伴有肠梗阻症状。全腹剧痛和腹肌紧张,提示病变肠段急性穿孔。持续性腹痛预示炎症性病变有所进展,提示炎症波及腹膜或腹腔内脓肿形成。
(2)腹泻:
慢性腹泻是CD最常见的临床症状,85%的CD患者在急性期出现排便次数增多,粪质变稀,如持续超过6周,则自限性感染性腹泻可能性不大,应高度注意CD可能。腹泻主要由病变肠段炎症渗出、蠕动增加及继发性吸收不良引起。粪便多为糊状,多无脓血或黏液,病变侵犯结肠下段或直肠时可有黏液血便及里急后重。
(3)腹部包块:
以右下腹与脐周多见,肿块边缘不清楚、大小不一、质地中等、有压痛。发生于10%~20%的CD患者。由于肠粘连、肠壁增厚、肠系膜淋巴结肿大、内瘘或局部脓肿形成所致。固定的腹部包块提示粘连,多已有内瘘形成。
(4)瘘管形成:
是CD特征性表现,因炎症累及肠壁全层并穿透至肠外组织或器官而形成。分为内瘘和外瘘,前者可通向其他肠段、肠系膜、膀胱、输尿管、阴道、腹膜后等处,后者通向腹壁或肛周皮肤。
(5)肛门周围病变:
包括肛周脓肿、肛周瘘管、皮赘、肛裂等病变,有结肠受累者较多见,可为CD首发或突出的临床表现。约10%的CD患者首诊时有肛周瘘管。
发热为常见的全身表现之一,与肠道炎症活动及继发感染有关。间歇性低热或中度热常见,少数呈弛张高热伴毒血症。少数患者以发热为主要表现,发生于消化道症状出现之前。
营养障碍由慢性腹泻、食欲减退及慢性消耗等因素所致。主要表现为体重下降,可有贫血、低蛋白血症和维生素缺乏等表现。青春期前患者常有生长发育迟滞。
CD的肠外表现较多,包括结节性红斑、坏疽性脓皮病、嘴唇水肿样/溃疡样病变、鹅口疮、牙龈黏膜和颊黏膜溃疡、葡萄膜炎和虹膜炎、关节病变(关节痛和关节炎)、骶髂关节炎、肝脏脂肪样变、骨质疏松和骨质疏松症等。据报道CD患者肠外表现发生率高达47%,当病变累及结肠时肠外表现最常发生,其中以肌肉骨骼系统的异常最为常见。
UC缺乏诊断的金标准,主要基于临床、内镜、病理组织学、影像学改变及外科手术所见共同做出判断,在排除感染性和其他非感染性结肠炎的基础上进行诊断。若诊断存疑,应在一定时间(一般是6个月)后进行内镜及病理组织学复查。
如前所述。
(1)结肠镜:
结肠镜对UC的诊断具有重要价值。主要为累及结直肠的连续性、弥漫性病变,部分可累及回肠末端(倒灌性回肠炎)。轻度炎症反应的内镜特征为红斑、黏膜充血和血管纹理消失;中度炎症反应的内镜特征为血管形态消失、出血黏附在黏膜表面、糜烂,常伴有粗糙呈颗粒状的外观及黏膜脆性增加(接触性出血);重度炎症反应内镜下则表现为黏膜自发性出血及溃疡。缓解期可见正常黏膜表现,部分患者可有假性息肉形成,或瘢痕样改变。病变反复发作可出现肠壁增厚、结肠袋变浅变钝或消失、肠腔狭窄、假息肉及黏膜桥形成,甚至可有癌变发生。
(2)染色内镜:
内镜下黏膜染色技术能提高内镜对黏膜病变的识别能力,结合放大内镜技术通过对黏膜微细结构的观察和病变特征的判别,有助于UC诊断。对病程较长的患者,染色内镜在发现癌前病变和肿瘤病灶方面很有意义。常规肠镜检查中容易漏掉的浅表凹陷型癌或癌前病变则可通过染色黏膜的方法发现病灶。
UC患者的黏膜活检及手术切除标本的组织学改变均主要表现为炎性黏膜弥漫的、局限于黏膜的慢性炎性细胞浸润,主要特点是隐窝浸润,特别是中性粒细胞浸润;杯状细胞黏液分泌减少、隐窝炎/隐窝脓肿及隐窝结构破坏均是UC的典型病理表现。组织学可见以下主要改变。
(1)活动期表现:
①固有膜内有弥漫性、慢性炎性细胞和中性粒细胞、嗜酸性粒细胞浸润;②隐窝急性炎性细胞浸润,尤其是上皮细胞间有中性粒细胞浸润和隐窝炎,甚至隐窝脓肿;③隐窝结构改变,隐窝大小、形态不规则,分支、出芽,排列紊乱,杯状细胞减少等;④黏膜表层糜烂、溃疡形成和肉芽组织增生。
(2)缓解期表现:
①黏膜糜烂或溃疡愈合;②固有膜内中性粒细胞浸润减少或消失,慢性炎性细胞浸润减少;③隐窝大小、形态不规则,排列紊乱;④腺上皮与黏膜肌层间隙增宽;⑤可见帕内特细胞化生(结肠左曲以远)。
无条件行结肠镜检查的单位可行钡剂灌肠检查。检查所见的主要改变:①黏膜粗乱和/或颗粒样改变;②肠管边缘呈锯齿状或毛刺样改变,肠壁有多发性小充盈缺损;③肠管短缩,袋囊消失呈铅管样。
大体和组织学改变见上述UC的特点。手术标本见病变局限于黏膜及黏膜下层,肌层及浆膜一般不受累。
UC有特异的实验室检查诊断标准,主要用于帮助判断疾病严重程度及活动性。
(1)血液检查:
活动期UC患者常出现白细胞、血小板、急性反应性蛋白及红细胞沉降率增加。贫血较常见,主要由于失血和缺铁引起。UC患者由于血小板升高,凝血因子Ⅴ、Ⅶ、Ⅷ活性增加及纤维蛋白原增加而存在高凝状态,易出现血栓性栓塞。
(2)粪便检查:
肉眼即可见血、脓或黏液。涂片可见红细胞、白细胞。需行病原体(包括细菌、真菌、病毒、寄生虫及其虫卵)检测以排除感染性肠炎。而粪便中钙防卫蛋白由于可稳定反映由中性粒细胞介导的肠道炎症程度,可用于区分IBD和IBS,并反映疾病的活动性。
在排除其他疾病(详见下述“六、鉴别诊断”部分)的基础上,可按下列要点诊断。
(1)具有上述典型临床表现者为临床疑诊,安排进一步检查。
(2)同时具备上述结肠镜和/或影像学特征者,可临床拟诊。
(3)如再具备上述黏膜活检和/或手术切除标本组织病理学特征者,可以确诊。
(4)初发病例如临床表现、结肠镜检查和组织学改变不典型者,暂不确诊UC,应予密切随访。
CD缺乏诊断的金标准,需结合临床表现、实验室检查、内镜检查、影像学检查和组织病理学检查进行综合分析并密切随访。
如前所述。
用以评估患者的炎症反应程度和营养状况等。初步的实验室检查应包括血常规、C反应蛋白、红细胞沉降率、血清白蛋白等,有条件者可做粪便钙卫蛋白检测。抗酿酒酵母菌抗体或抗中性粒细胞胞质抗体不作为CD的常规检查项目。
(1)结肠镜:
诊断CD最重要的手段,结肠镜检查应达末端回肠。典型CD内镜下肠道表现为:节段性、非对称性的黏膜炎症,小而深的阿弗他溃疡和纵向溃疡。病程较长时,于回肠末端可见鹅卵石样改变,可有肠腔狭窄和肠壁僵硬等,尚可见结肠黏膜广泛的再生性增生(息肉样病变)。
(2)染色内镜:
对CD的诊断意义同UC(见上述UC的诊断)。
(3)胶囊内镜:
胶囊内镜与其他检查比较的优点是非侵袭性、无痛舒适,可以直接观察到整个小肠表面的黏膜病变、部位及范围。胶囊内镜对小肠黏膜异常相当敏感,但对一些轻微病变的诊断缺乏特异性,且有发生滞留的危险。主要适用于疑诊CD但结肠镜及小肠放射影像学检查阴性者。胶囊内镜检查阴性倾向于排除CD,阳性结果需综合分析并常需进一步检查证实。
(4)小肠镜:
目前我国常用的是气囊辅助式小肠镜(balloon-assisted enteroscopy,BAE)。该检查可在直视下观察病变、取活检和进行内镜下治疗,但为侵入性检查,有一定的并发症发生风险。主要适用于其他检查(如胶囊内镜或放射影像学)发现小肠病变或尽管上述检查阴性而临床高度怀疑小肠病变需进行确认及鉴别者,或已确诊CD需要BAE检查以指导或进行治疗者。小肠镜下CD的病变特征与结肠镜所见相同。
(5)超声内镜:
有助于确定病变的范围和深度,发现腹腔内肿块或脓肿。
(6)胃镜:
少部分CD病变可累及食管、胃和十二指肠,但一般很少单独累及。原则上胃镜检查应列为CD的常规检查项目,尤其是有上消化道症状、儿童和IBD类型待定患者。
(1)小肠CT造影(CT enterography,CTE)/MRI小肠造影(magnetic resonance imaging enterography,MRE):
CTE/MRE是迄今评估小肠炎性病变的标准影像学检查,有条件的单位应将此检查列为CD诊断的常规检查项目。该检查可反映肠壁的炎症反应改变、病变分布的部位和范围、狭窄的存在及其可能的性质(炎性或纤维性狭窄),肠腔外并发症,如瘘管形成、腹腔脓肿或蜂窝织炎等。活动期CD典型的CTE表现为肠壁明显增厚(>4mm);肠黏膜明显强化伴有肠壁分层改变,黏膜内环和浆膜外环明显强化,呈“靶症”或“双晕征”;肠系膜血管增多、扩张、扭曲,呈“木梳征”;相应系膜脂肪密度增高、模糊;肠系膜淋巴结肿大等。
(2)钡剂灌肠造影:
钡剂灌肠造影已被结肠镜检查所代替,但对于肠腔狭窄无法继续进镜者仍有诊断价值。小肠钡剂造影灵敏度低,已被CTE或MRE代替,但对无条件行CTE检查的单位则仍是小肠病变检查的重要技术。该检查对肠狭窄的动态观察可与CTE/MRE互补,必要时可两种检查方法同用。X线所见为多发性、跳跃性病变,病变处见裂隙状溃疡、鹅卵石样改变、假息肉、肠腔狭窄、僵硬,可见瘘管。
(3)经腹超声检查:
可发现肿大的淋巴结、脓肿、结节,甚至瘘管。由于其具有无创、可多维观察病灶、简便易行和价格低廉的特点,在CD这样需终身随访、多次复查的疾病中的诊断价值及优势明显。欧洲和北美国家已把超声检查纳入CD的常规检查,作为CD首选的筛查和随访手段。
(1)黏膜活检:
内镜下取活检最好包括炎症和非炎症区域,以确定炎症是否节段性分布。病变部位较典型的改变有:①非干酪性肉芽肿;②阿弗他溃疡;③裂隙状溃疡;④固有膜慢性炎性细胞浸润、陷窝底部和黏膜下层淋巴细胞聚集;⑤黏膜下层增宽;⑥淋巴管扩张;⑦神经节炎;⑧隐窝结构大多正常、杯状细胞不减少等。非干酪性肉芽肿是诊断CD的主要标准之一,但活检标本中该病变发现率仅36%~50%。
(2)手术切除标本:
大体标本可见肠管局限性病变、节段性损害、鹅卵石样外观、肠腔狭窄、肠壁僵硬等特征。病变肠段镜下可见穿壁性炎症、肠壁水肿、纤维化及系膜脂肪包绕等改变,局部淋巴结亦可有肉芽肿形成。手术切除标本中肉芽肿病变发现率达40%~60%。
在排除其他疾病(详见下述“六、鉴别诊断”部分)的基础上,可按下列要点诊断。
(1)具备上述临床表现者可临床疑诊,安排进一步检查。
(2)同时具备上述结肠镜或小肠镜(病变局限在小肠者)特征及影像学(CTE或MRE,无条件者采用小肠钡剂造影)特征者,可临床拟诊。
(3)如再加上活检提示CD的特征性改变且能排除肠结核,可做出临床诊断。
(4)如有手术切除标本(包括切除肠段及病变附近淋巴结),可根据标准做出病理确。
(5)对无病理确诊的初诊病例随访6个月以上,根据对治疗的反应及病情变化判断,对于符合CD自然病程者可做出临床确诊。如与肠结核混淆不清但倾向于肠结核者,应按肠结核进行诊断性治疗8~12周,再行鉴别。
UC诊断成立后,需全面估计病情和预后,以制订治疗方案。
可分为初发型和慢性复发型。初发型指无既往病史而首次发作,该类型在鉴别诊断中应特别注意,因其亦涉及缓解后如何进行维持治疗的考虑;慢性复发型指临床缓解期再次出现症状,临床上最常见。
UC病情分为活动期和缓解期,活动期UC按严重程度分为轻度、中度、重度。改良Truelove和Witts疾病严重程度分型标准易于掌握,临床上非常实用(表6-1-1)。
表6-1-1 改良Truelove和Witts疾病严重程度分型

注:中度介于轻度、重度之间。
推荐采用蒙特利尔分型(表6-1-2),该分型特别有助于癌变危险性的估计和监测策略的制订,亦有助于治疗方案的选择。
表6-1-2 溃疡性结肠炎病变范围的蒙特利尔分型
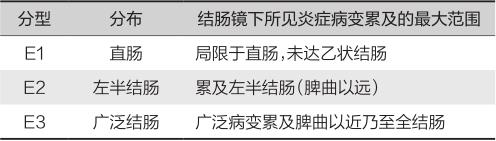
肠外表现包括关节损伤(如外周关节炎、脊柱关节炎等),皮肤黏膜表现(如口腔溃疡、结节性红斑和坏疽性脓皮病),眼部病变(如虹膜炎、巩膜炎、葡萄膜炎等),肝胆疾病(如脂肪肝、PSC、胆石症等),血栓栓塞性疾病等。并发症包括中毒性巨结肠、肠穿孔、下消化道大出血、上皮内瘤变、癌变。
CD诊断成立后,需要进行全面的疾病病情和预后的评估并制订治疗方案。
推荐按蒙特利尔CD表型分类法进行分型(表6-1-3)。
表6-1-3 克罗恩病(CD)的蒙特利尔分型
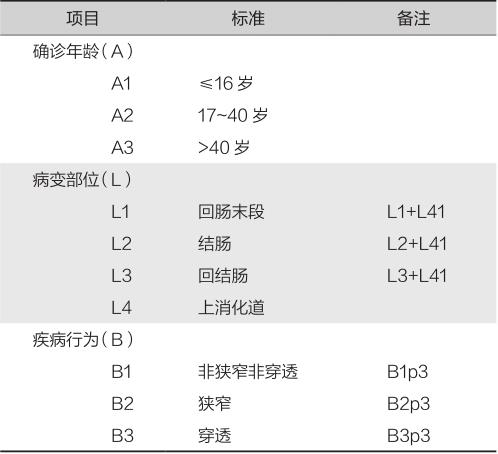
注:① L4可与L1、L2、L3同时存在;②随着时间推移,B1可发展为B2或B3;③ p为肛周病变,可与B1、B2、B3同时存在。
临床上用克罗恩病活动指数(Crohn’s disease activity index,CDAI)评估疾病活动性的严重程度并进行疗效评价。Best等的CDAI计算法被广泛应用于临床和科研(表6-1-4)。CD活动指数<150分为缓解期,≥150分为活动期,其中150~220分为轻度,221~450分为中度,>450分为重度。
表6-1-4 Best克罗恩病活动指数计算法
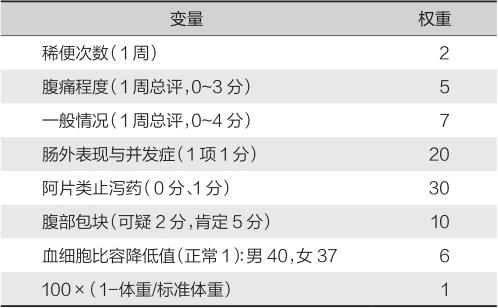
注:血细胞比容正常值按国人标准。总分为各项分值之和。
CD肠外病变和并发症的肠外表现可累及口、眼、关节、皮肤、泌尿及肝胆等系统;并发症可有肠梗阻、出血、肠穿孔、瘘管、炎性包块或脓肿等,应分别在诊断中注明。
多见于各种细菌感染,如志贺菌、空肠弯曲杆菌、沙门菌、产气单胞菌、大肠埃希菌、耶尔森菌等。常有流行病学特点(如不洁食物史或疫区接触史),急性起病常伴发热和腹痛,具有自限性(病程一般为数天至1周,不超过6周);抗菌药物治疗有效;粪便检出病原体可确诊。
有疫水接触史,常有肝脾大。确诊依赖于粪便检查见血吸虫卵或孵化毛蚴阳性;急性期肠镜直乙结肠见肠黏膜有黄褐色颗粒,活检黏膜压片或组织病理见血吸虫卵。免疫学检查有助鉴别。
有流行病学特征,果酱样粪便,结肠镜下见溃疡较深、边缘潜行、间以外观正常的黏膜,确诊有赖于从粪便或组织中找到病原体,非流行区患者血清阿米巴抗体阳性有助于诊断。高度疑诊病例采用抗阿米巴治疗有效。
肠结核、真菌性肠炎、抗生素相关性肠炎(包括假膜性肠炎)、缺血性结肠炎、放射性肠炎、嗜酸性粒细胞性肠炎、过敏性紫癜、胶原性结肠炎、白塞病、结肠息肉病、结肠憩室炎及人类免疫缺陷病毒感染合并结肠病变应与本病鉴别。还要注意结肠镜检查发现的直肠轻度炎症改变,如不符合UC的其他诊断要点,常为非特异性,应认真寻找病因,观察病情变化。
重度UC或在免疫抑制剂维持治疗病情处于缓解期的患者出现难以解释的症状恶化时,应考虑合并艰难梭菌或CMV感染的可能。确诊艰难梭菌感染行粪便艰难梭菌毒素试验(EIA检测Toxin A/B)。确诊CMV感染行肠镜下活检HE染色找巨细胞包涵体及免疫组织化学,以及血CMV-DNA定量。
详见CD鉴别诊断部分。
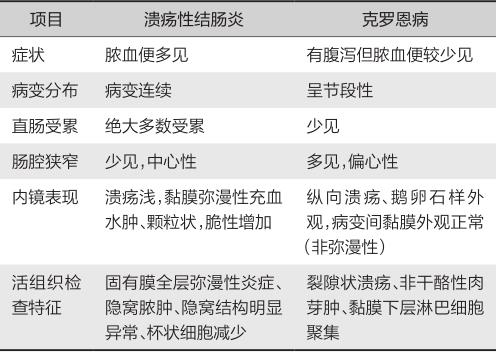
根据临床表现、内镜和病理组织学特征不难鉴别(表6-1-5)。
表6-1-5 溃疡性结肠炎和克罗恩病的鉴别
回结肠型CD与肠结核的鉴别常会相当困难,因为除活检发现干酪样坏死性肉芽肿为肠结核诊断的特异性指标外,两病的临床表现、结肠镜下所见及活检所见常无特征性区别,然而干酪样坏死性肉芽肿在活检中的检出率却很低。因此强调在活检未见干酪样坏死性肉芽肿的情况下,鉴别依靠对临床表现、结肠镜下所见及活检进行综合分析。
以下表现倾向CD诊断:肛周病变(尤其是肛瘘/肛周脓肿),并发瘘管、腹腔脓肿,疑为CD的肠外表现如反复发作口腔溃疡、皮肤结节性红斑等;结肠镜下见典型的纵向溃疡、典型的鹅卵石样外观、病变累及≥4个肠段、病变累及直肠肛管。下列表现倾向肠结核诊断:伴活动性肺结核,结核菌素试验强阳性;结肠镜下见典型的环形溃疡、回盲瓣口固定开放;活检见肉芽肿分布在黏膜固有层且数目多、直径大(长径>400μm)、特别是有融合,抗酸染色阳性。
其他检查:活检组织结核分枝杆菌DNA检测阳性有助肠结核诊断,γ-干扰素释放试验(如T-SPOT TB)阴性有助排除肠结核。小肠检查如见回结肠病变与近段小肠(末段回肠以近)病变,特别是多节段病变共存,倾向CD诊断。
鉴别仍有困难者,予诊断性抗结核治疗,治疗数周(2~4周)症状明显改善,并于2个月后肠镜复查病变痊愈或明显好转,支持肠结核,可继续完成正规抗结核疗程。有手术指征者行手术探查,绝大多数肠结核可在病变肠段和/或肠系膜淋巴结病理组织学检查中发现干酪样坏死性肉芽肿而获病理确诊。
两者均可以肠道溃疡为主要表现且病变部位并无明显差异,通常病程短、单个部位受累、明显隆起性病变、腹腔淋巴结明显肿大(>2cm)时要注意原发性肠道淋巴瘤,活检是确诊依据。
推荐应用白塞病国际研究组的诊断标准:①反复发生口腔溃疡,过去12个月内发病不少于3次;②反复发生生殖器溃疡;③眼病;④皮肤病变;⑤皮肤针刺试验阳性(无菌穿刺针刺入患者前臂,24~48小时后出现直径>2mm的无菌性红斑性结节或脓疱)。确诊需有①加其余4项中的2项特征。
对IBD的治疗,目前着眼于控制炎症和调节免疫紊乱,以有效控制疾病发作和维持缓解。传统治疗IBD的三大类药物(氨基水杨酸制剂、糖皮质激素、免疫抑制剂)的研究取得了很大的发展,目前仍是治疗IBD最常用的药物。随着IBD发病机制的深入研究,特别是遗传、免疫学、细胞分子生物学方面的重大进展,使IBD的治疗发生了重大的变化,许多治疗IBD的新型药物如生物制剂开始应用于临床。
氨基水杨酸制剂是临床治疗IBD并预防其复发最常用的药物,主要适用于轻、中度UC及CD的诱导缓解;灌肠剂适用于轻、中度结肠远端UC患者,尤其适用于病变部位距离肛门60cm以内者;栓剂适用于病变在直肠者。氨基水杨酸制剂也可用于轻中度UC及CD的维持治疗。
糖皮质激素治疗IBD的适应证是中、重度UC和CD或暴发性炎症,以及氨基水杨酸制剂疗效不佳的轻、中度患者,尤其适用于重型活动期及暴发型患者,对急性发作期有较好疗效。
IBD治疗常用的免疫抑制剂有嘌呤类药物包括硫唑嘌呤(azathioprine,AZA)及6-巯嘌呤(6-mercaptopurine,6-MP)、甲氨蝶呤(methotrexate,MTX)、环孢素和他克莫司。免疫抑制剂用于CD或UC的主要适应证有:糖皮质激素治疗无效或不耐受(出现高血压、骨质疏松和压缩性骨折、糖尿病、精神异常等)的慢性活动性病变者;糖皮质激素依赖的CD或UC患者;瘘管性CD患者;缓解期的维持治疗;术后预防复发。
生物制剂通过抑制各种炎症因子或者通过抑制炎症细胞向肠道聚集发挥抗炎作用,前者如抗肿瘤坏死因子-α(tumor necrosis factor,TNF-α)制剂、抗IL-12/IL-23抗体及Janus激酶(Janus kinase,JAK)抑制剂等,后者如抗整合素抗体及1-磷酸鞘氨醇受体激动剂等。TNF-α制剂以英夫利西单抗和阿达木单抗最常用。乌司奴单抗可拮抗IL-12/IL-23共有的p40亚基,最早用于治疗银屑病,近几年批准用于治疗CD。维多珠单抗是一种抗整合素α4β7抗体,特异性阻断整合素α4β7与胃肠道血管细胞黏附分子结合,抑制炎症细胞向肠道聚集,减轻肠道炎症反应,具有肠道选择性。英夫利西单抗作为临床上正式用于炎症IBD治疗的首个生物制剂,其适应证有以下方面。
(1)中至重度活动性CD,经正规治疗即糖皮质激素或免疫抑制剂(AZA、6-MP或MTX等)治疗无效或激素依赖,或不能耐受(禁忌证或严重不良反应)者。
(2)CD合并肠瘘、肛瘘或直肠阴道瘘,经正规治疗(包括抗生素、免疫抑制剂等)无效者。
(3)儿童CD。
(4)CD的某些肠外表现。
(5)病情严重的活动性CD或CD合并瘘,虽未使用过糖皮质激素,但临床上希望病情尽快好转者。
(6)经正规治疗即糖皮质激素或免疫抑制剂(AZA、6-MP或MTX等)治疗无效的UC患者。
经英夫利西单抗治疗有效或取得缓解者继续定期使用以维持缓解。
抗生素在治疗IBD的败血症并发症(如脓肿、肛瘘和肛裂、腹膜炎及中毒性巨结肠)中发挥了重要的作用,主要适用于UC或CD合并感染、CD肛周病变、预防CD术后复发。
IBD患者肠道内存在菌群失调,正常细菌的数量减少,若给患者补充正常细菌即益生菌,使肠道内菌群失调得到纠正,可使病情缓解,肠道菌群可以影响免疫系统的发育和免疫应答的调节,从而保持肠黏膜的稳态。
内科药物在UC的治疗过程中占据主导地位,然而外科手术干预也同为不可或缺的重要组成部分。及时有效的外科手术可以迅速缓解症状、解除并发症、提高患者生活质量,甚或在急症时挽救患者的生命。
(1)急性重度溃疡性结肠炎进展快、病死率高,治疗目的不是挽救结肠,而是挽救生命,对药物治疗无效的急性重症溃疡性结肠炎,应由多学科讨论确定治疗方案,避免延误手术时机。
(2)对内科治疗疗效不佳的慢性复发型UC推荐及时手术治疗。病变范围广或治疗期间疾病范围逐渐扩大、全身状况恶化(持续贫血或低蛋白血症伴C反应蛋白升高)、反复合并艰难梭菌感染、药物不良反应或疾病肠外表现导致的生活质量下降、儿童慢性复发型UC导致生长发育障碍均需要及早手术治疗。
(3)高龄(>50岁)患者合并症多,延误最佳手术时机增加病死率,早期择期手术比长期药物治疗可获得更好的生存率和经济学优势。因此,对于高龄或有多个合并症的患者,如预计药物治疗失败的风险较高,建议尽早手术。
(4)UC合并狭窄发生率约14.2%,其中约10%发生上皮内瘤变或癌变。由于取检困难,且结肠炎相关肿瘤浸润性更强,即使内镜活检为阴性或低级别上皮内瘤变也不能排除肿瘤可能,因此对病程长(>8年)的UC合并狭窄,尤其是伴有其他风险因素如PSC、内镜无法通过并准确取活检者,推荐手术治疗。
(5)对UC癌变、内镜切除不满意和不适宜内镜切除的上皮内瘤变者推荐手术治疗。UC合并结直肠癌CRC或上皮内瘤变时,同时性或异时性多源发肿瘤的发生率较高。边界清楚的高级别上皮内瘤变首选内镜下切除,并根据切除标本的病理结果决定是否补做结肠切除术或定期随访;非腺瘤样异型增生相关病变或肿物的癌变率高,因此推荐手术。内镜下不可见(扁平)的高级别上皮内瘤有40%~60%已癌变,推荐手术;内镜下不可见(扁平)的低级别上皮内瘤应采用手术治疗还是内镜下监测尚无定论,需要患者、内镜医师及结直肠外科医师共同讨论决定。
UC常见的并发症包括出血、穿孔、急性肠梗阻及暴发型结肠炎。药物治疗的进步,如英夫利西单抗类药物的出现,显著降低了上述并发症的发生率,从而减少了UC对急诊手术的需求。在生物制剂治疗的时代,UC患者手术治疗的时机仍有争议,尤其是针对急性重度激素抵抗的UC患者。消化内科医师认为急性重度激素抵抗的UC患者在进行手术前应先试用英夫利西单抗类药物,但外科医师认为长时间、无效的药物治疗可增加患者手术相关并发症的风险,因而更加倾向于早期手术。
(1)全结直肠切除+回肠造口术或可控性回肠膀胱术:
在明确没有直肠恶变的情况下,可施行本手术。该手术操作相对简单,且术后并发症较少,但是患者术后终身佩戴造口袋,对患者的生活质量有较大的影响,尤其对青少年的生活及心理影响较为明显,目前应用较少。
(2)全结肠切除+回肠直肠吻合术(colectomy with ileorectal anastomosis,IRA):
该手术的先决条件为直肠黏膜未发现异常。符合要求的患者相对较少。IRA的优点是避免了造口,并发症发生率低,排便功能保留较好和生活质量较高;且不会对生育功能造成影响。
(3)全结直肠切除+回肠储袋肛管吻合术:
该术式现在是UC最常见的择期手术方式。先决条件是患者需有功能正常的肛门括约肌。该手术恢复了肠道的连续性,有较好的贮便功能,患者术后生活质量高,是近年来临床选择最多的术式。目前回肠贮袋的重建方式分为J型(较为常用),还有S型和W型等。
CD的手术治疗常常仅是对其并发症进行处理,且术后复发率相当高。CD的外科治疗通常是在急症状态或亚急症状态下进行的,围手术期并发症高。因此,对CD的手术指征、手术方式及围手术期的护理需要有原则性的把握,否则将较早地出现危及生命的相关并发症、短肠综合征及营养不良等状态。
(1)以纤维性狭窄为主或药物治疗无效的狭窄,可导致反复腹胀、腹痛,伴狭窄近端肠管明显扩张,影响患者进食,恶化营养状况,降低生活质量,推荐择期手术治疗。对于无临床症状的肠狭窄和炎性狭窄,诱导和维持疾病缓解是主要治疗目标,可暂不手术。
(2)穿透型CD可形成肠壁深大溃疡,溃疡的存在不但增加机体炎症负荷,增加药物诱导、维持缓解的难度,还常造成肠内瘘、肠外瘘或反复消化道出血,甚至癌变。对于药物治疗效果不佳、病变局限但长期不愈合的CD深大溃疡,推荐手术切除;对于CD肠内瘘和肠外瘘患者,即使保守治疗后肠瘘暂时闭合,短期内避免手术,但由于存在肠壁溃疡,肠瘘容易复发,最终多数患者需要手术治疗;诊断明确的CD癌变强烈推荐手术,对于诊断困难、不排除癌变但无法获取病理学证据的慢性病灶,推荐手术切除。
(3)CD肠穿孔伴弥漫性腹膜炎应急诊手术,考虑到腹腔污染对肠吻合的不利影响,急诊手术过程中推荐实施肠造口术。如果肠穿孔面积较小,腹腔污染较轻,可以在密切监测下先尝试保守治疗,争取非手术或择期手术。十二指肠穿孔不宜造口,可以行瘘口修补,并行胃十二指肠置管减压,保证修补口以下部位的肠管通畅,以便术后给予肠内营养。
(4)CD伴急性消化道大出血发生率为0.9%~6.0%,发病急,病情重,非手术治疗困难,病死率较高。这类患者多有CD反复发作史,诊断较明确,出血部位多在病变最严重处,但仍需要排除其他疾病如胃肠道血管畸形、梅克尔憩室炎等引起的出血。对危及生命的大出血、非手术治疗失败者,强烈推荐急诊手术切除病灶以控制出血。
(5)儿童和青少年CD中大部分发生于青春前期或青春期,10%~40%的CD患儿出现生长发育迟滞。如果药物治疗、营养治疗无法有效控制疾病活动且病灶局限者推荐手术切除,可使病情进入缓解期,再积极地给予营养治疗和药物治疗,保证儿童和青少年正常生长发育。
需接受手术的CD患者往往存在营养不良、合并感染,部分患者长期使用激素,因而存在巨大手术风险。择期手术前推荐进行手术并发症风险评估,对于存在手术并发症风险因素的择期手术患者,强烈推荐进行有针对性的预康复,以消除手术并发症风险因素,减少手术并发症。具体措施包括纠正营养不良、诱导活动期疾病缓解、尽量撤减激素、通过引流和使用抗生素等措施控制腹腔或腹膜外感染等。
与UC不同(部分UC可手术治愈),CD的手术治疗常常仅是对其并发症进行处理,且术后复发率相当高。其手术方式大致可分为以下两类:
(1)非切除手术:
包括狭窄成形术、转流手术、旁路手术、脓肿引流及瘘管切除/修补等。
(2)切除手术:
目前肠段切除一般是首选方式。但复发与肠管保留是手术治疗CD必须考虑的两个问题。总体来说,由于CD本身的疾病特点,复发常随着时间的推移而增多,最终患者可能需要接受多次的肠段切除,而每一次切除都会增加患者出现短肠综合征以及相关代谢性并发症的风险。因此,对于已有肠段切除史的患者,要谨慎施行第二次肠段切除。
(杨鑫 吴现瑞 兰平)
IBD和CRC的关联很早就有报道,而CD对IBD相关CRC的促进作用直到20世纪70年代才得以证实。疾病本身的炎症刺激以及免疫抑制药物的使用往往使IBD患者更易发生恶性肿瘤。与散发性CRC相比,IBD相关CRC发病年龄较轻,发病率也与IBD疾病本身特点及伴随病变有关。另外,IBD相关CRC多为多灶性、平坦、界线不清的病损,呈现典型的炎症—不典型增生—恶性肿瘤过程,发展较快。而由于本身疾病症状的混淆,肿瘤常常较晚才得以明确诊断,预后也较散发性CRC差。本节重点对IBD相关CRC的流行病学、疾病防治和预后等方面进行阐述,以期增加对IBD相关CRC的认识,并对IBD相关CRC的诊疗提供帮助。
据统计,IBD相关的CRC约占每年新发CRC的2%,是CRC的危险因素之一。另外,IBD相关CRC的发病风险是普通人群的2~3倍,占IBD患者全因死亡率的10%~15%。但研究结果也常因研究地区、研究时期及人群等因素影响而有所差别。一项荟萃分析提示,IBD患者中CRC的标准化发生率是普通人群的1.7倍。而随着病程的增加,IBD相关CRC的累积风险逐渐上升。据统计,亚洲IBD患者发生CRC的累积风险在10年、20年和30年分别为0.02%、4.8%和13.9%。近年来,受益于肠镜的规范监测,IBD相关CRC早期肿瘤检出率有所上升;而得益于积极手术治疗和新型药物使用带来的IBD疾病活动的良好控制,其发病率呈现一定的下降趋势。不过,这在CD和UC中的情况稍有差别。
不同的研究显示,UC患者发生CRC的风险波动于0.9~8.8倍,而全结肠炎患者发生CRC的风险甚至可以高达23倍。据一项2001年的荟萃分析报道,UC患者在确诊10年、20年、30年后发生CRC的累积风险分别为2%、8%、18%。而一项2014年的研究结果则显示该风险在10年、20年、30年后分别是1%、3%、7%。两项研究的数据在一定程度上说明近年来UC患者CRC的发病率有下降趋势。另一项研究进一步纳入了96 447例UC患者及949 207名对照患者,结果提示UC患者发生CRC以及死于CRC的风险较对照组高,但随着时间的推移已经大幅下降。
相较于UC,CD与CRC的关联较晚才被发现。一项基于14项相关研究的荟萃分析结果显示,CD患者发生CRC的相对风险为2.5,而病变累及结肠的患者相应的相对风险则为4.5。另一项针对病变部位的研究则发现CD患者中结肠型病变的患者发生CRC的相对风险为5.6,回结肠型患者的相对风险为3.2,而回肠型患者的相对风险为1.0。在不考虑病变累及部位的情况下,CD患者发生CRC的累积风险在10年、20年、30年后分别为2.9%、5.6%、8.3%。有趣的是,CD对直肠的影响较小,其主要增加结肠的癌变风险。但在既往有肛门或肛周病变的患者中,肛门及直肠的癌变风险显著增加。
为了降低IBD相关CRC的发生率,对患者的管理取决于对患者个体化的风险评估。然而,既往的研究虽然报道了许多IBD相关CRC的独立风险因素,但仍然无法可靠精准地预测哪些IBD患者会最终发展成CRC。为了更好地预防IBD相关CRC的发生,识别IBD相关CRC的风险因素、探索筛查和监测方案,积极进行药物和手术预防是公认的IBD相关CRC的重要预防措施。
IBD相关CRC的危险因素主要包括年龄、炎症程度和范围、IBD确诊时的年龄、是否伴随PSC和CRC家族史等。
对于年龄增长本身是否是IBD相关CRC的危险因素,并且独立于非IBD相关的散发性CRC背景,目前结论并不一致。通常认为IBD诊断时年龄对IBD相关CRC发病率有较大影响。在<30岁确诊的IBD患者中,标准化的CRC发病率是30岁后确诊患者的4倍以上。不过,后续研究指出两组中的风险比无明显差异。较年轻的IBD发病年龄发生CRC的风险增加,更可能反映了疾病持续时间和随着时间的累积炎症,而不是在IBD较年轻发病患者中的癌变加速。
在一项基于人群的研究中,根据结肠炎侵犯程度进行分类研究,发现所有UC患者发生CRC的相对风险为2.7,全结肠炎为5.6,而CD结肠炎为2.1,直肠炎为1.7。没有明显结肠炎症的患者和局限于直肠的UC患者发生CRC的风险则没有增加。另外,广泛性结肠病变(CD中50%的结肠累及,或在病程中任何时候UC的炎症延伸至脾曲近端)与中度CD和左侧UC相比,IBD相关CRC发生的风险增加2~3倍。
多个慢性炎症的替代指标均被证实是IBD相关结直肠肿瘤的有效预测因子,包括组织学炎症评分、内镜下炎症评分、狭窄及炎性假瘤等。目前也有部分指南推荐使用这些替代标志物来对患者进行风险分层。但这些替代标志物无法直接可靠地量化患者的炎症负荷。累积炎症负荷(cumulative inflammatory burden,CIB)由此被圣马克研究小组提出用以评估UC患者CRC的累积风险。计算公式为两次肠镜监测时组织学炎症评分的均值乘以以年为单位的监测间隔的长度来计算每个监测间隔的CIB,最后将所有监测区间的CIB相加,得到最终CIB得分。据分析,CIB每增加10个单位,发生结直肠肿瘤的风险增加2.1(95%置信区间1.4~3.0)。
有CRC家族史(而非IBD家族史)的IBD患者并发CRC的风险明显增加。据统计,CRC家族史可使IBD相关CRC的发生率升高2~3倍。一级、二级亲属都会增加IBD相关CRC的风险,并且在50岁以下确诊的CRC患者的一级亲属往往具有更大的风险。
PSC是IBD相关CRC的独立风险因素。与无PSC的患者相比,IBD伴发PSC的患者发生CRC的风险上升3~5倍。相关机制目前尚未完全明确,多考虑与胆汁酸代谢、肠道或胆道微生物改变,以及易导致结肠及胆道肿瘤的全身免疫改变有关。IBD伴发PSC的患者常有较高的结直肠肿瘤检出率,同时该类患者的肠道低度不典型增生更易进展为恶性肿瘤。所有国际相关协会都建议在PSC诊断时就开始进行结直肠肿瘤监测,如果诊断为不典型增生,则应采取更积极的监测策略和外科干预措施。
IBD患者抗炎药物的使用可能有助于预防CRC的发生,包括氨基水杨酸类、免疫抑制剂、TNF拮抗剂、熊脱氧胆酸(ursodeoxycholic acid,UDCA)等。值得注意的是,针对IBD相关CRC的药物预防的证据多来自回顾性研究和非IBD人群的经验。
目前主流观点认为氨基水杨酸类药物可以降低UC患者发生CRC的风险(对CD尚无明确结论),2017版欧洲克罗恩病和结肠炎组织(European Crohn’s and Colitis Organisation,ECCO)指南也建议UC患者(病变不局限于直肠患者)使用美沙拉秦进行药物预防。最近的一项荟萃分析提示,与不使用5-氨基水杨酸盐(5-aminosalicylic acid,5-ASA)的UC患者相比,5-ASA可以降低49%CRC风险。不过,具体的剂量、起始时间、剂型/给药途径以及产生疗效所需的最小持续时间仍有待研究。值得注意的是,5-ASA主要作用于炎症相关癌变的早期阶段,因此必须从发病开始持续给药;而一旦肠道出现不典型增生,5-ASA的作用将大大降低。5-ASA的预防作用一方面是因为它的抗炎作用,另一方面也与它对多个促癌通路的抑制作用有关。
巯嘌呤类药物对IBD相关CRC的预防作用目前并没有定论,包括荟萃分析在内的多个研究结论并不一致。2017版ECCO指南也指出,目前没有足够的证据来推荐或反对使用巯嘌呤类药物进行化学预防。而考虑到长期使用巯嘌呤类药物存在的潜在促癌作用,应相当谨慎地将该药物作为CRC预防用药。
包括TNF拮抗剂在内的多种生物制剂被广泛用于IBD的治疗。考虑到有效的炎症控制可能是降低IBD相关CRC风险的主要因素,生物制剂或许可以用于CRC预防。但目前仅有部分研究结果支持TNF拮抗剂的预防作用。而由于高成本、可能的安全隐患以及长期使用对患者造成的不便,通常不建议将TNF拮抗剂单独用于IBD患者预防CRC。目前的相关研究多局限于TNF拮抗剂,并且多为回顾性分析,因此,生物制剂对于IBD相关CRC的预防作用尚需更大的临床样本以及前瞻性研究来进一步证实。
UDCA是一种甾体胆汁酸,除了具有增加胆汁流量和改变胆汁酸池疏水指数的作用,还有免疫抑制和抗肿瘤的作用。一项荟萃分析发现“低至中”剂量[<25mg/(kg·d)]UDCA可以降低CRC的发生率,有望用于IBD相关CRC的预防。在IBD和PSC患者中,UDCA的这种作用可能在治疗4年后才开始体现。需要注意的是,使用剂量达到28~30mg/(kg·d)时可能会增加PSC患者的肝功能失代偿以及死亡率,还会增加UC患者CRC的发生率。通常不建议单独将UDCA作为IBD伴发PSC患者的CRC预防用药,反而在应用UDCA时应注意定期监测,避免大剂量UDCA使用的情况。
许多其他药物,包括非甾体抗炎药、他汀类药物、叶酸和钙/维生素D补充剂等均有少量的相关研究。但目前的研究结果无法证明它们在IBD相关CRC中的保护作用。
早期的研究普遍建议UC患者在确诊10年后进行预防性结肠切除术。但是,结直肠残端仍有发生肿瘤的风险,预防性结肠切除术并不能完全防止结直肠肿瘤的发生。另外,由于对IBD相关CRC的进一步研究、更有效的药物治疗及内镜技术的应用,结肠镜监测已经取代了IBD患者的预防性结肠切除手术。
为了尽早识别不典型增生或早期癌症,以便进行适当的管理、提高生活质量和生存率,多个国际学会就筛查开始和监测间隔时间提供了指南。这些指南有许多共同之处,但也有一些细微差别。在没有伴随PSC的情况下,目前的指南建议可根据IBD症状出现的时间进行结肠镜筛查,多数情况下为8~10年。对于伴随PSC患者,应在确诊PSC时即开始进行筛查性结肠镜检查,并建议此后每年进行一次肠镜监测。对于没有PSC的患者,可根据风险分层每1~5年进行1次肠镜监测。以2017版ECCO指南为例,建议高风险患者(伴有严重活动性炎症的广泛结肠炎、过去5年内发现的狭窄或不典型增生,或确诊年龄<50岁的CRC患者的一级亲属)每年进行肠镜监测;建议中风险患者(广泛性结肠炎伴轻中度活动性炎症、假息肉或确诊年龄>50岁的CRC患者的一级亲属)每2~3年进行肠镜监测;建议无中、高风险患者每5年进行肠镜监测。
在IBD相关CRC肿瘤发生发展的进程中,可以遵循由无异型增生到不确定性异型增生,再到低级别异型增生(low-grade dysplasia,LGD)、高级别异型增生(high-grade dysplasia,HGD),最终演化为CRC的标准规律,也可以由LGD和HGD直接转变而来(异型增生,定义为一种明确的肠上皮细胞来源的肿瘤性改变,局限于基底膜,不侵犯固有层)。2015年炎性肠病患者结肠镜息肉检出监测和管理国际共识(Surveillance for Colorectal Endoscopic Neoplasia Detection and Management in Inflammatory Bowel Disease Patients:International Consensus Recommendations,SCENIC)推荐“异型增生相关的病变或肿块”和“腺瘤样肿块”(dysplasia-associated lesion or mass,DALM)的术语不再使用,取而代之的是可见或不可见的病变,这种更为简化的描述(源自Paris内镜分类)。
值得注意的是,可见病变,在形态学上被描述为息肉样(有蒂或无蒂)或非息肉样(略微隆起、扁平或凹陷),边界分为明显或模糊。其他值得注意的描述,包括上覆溃疡的存在和黏膜下浸润的特征,如凹陷黏膜下注射未能隆起,这些描述可以预测无法进行内镜切除,并提高对癌症的怀疑。据统计,在IBD患者中,64%~92%结直肠异型增生是可见的。根据美国胃肠病协会推荐,可见的异型增生病变,其轮廓清晰,直径<2cm,无浸润性癌特征表现,以及无黏膜下纤维化(内镜下特征,如黏膜凹陷、不规则的表面结构、辐射皱襞或黏膜下盐水注射未能对称隆起等)的病变无论形态如何均可考虑内镜下切除。直径>1cm的LGD需12个月后复查肠镜,有蒂或直径<1cm的LGD可24个月后复查肠镜。直径>2cm的病变,目前尚缺乏使用内镜切除的可靠数据,如病变复杂(侧向发育、高度不规则及边界模糊等),多次尝试未能完全切除或局部复发的异型增生,在这种情况下,应避免内镜深部组织活检,减少黏膜下瘢痕形成,以便以后的内镜切除。上述病灶可考虑内镜切除后严密监测(第1年每3~6个月复查肠镜)或手术治疗。内镜下切除直径>2cm病变的远期预后,还需要更多的数据支持。病变直径过大、具有浸润性肿瘤特征或黏膜下纤维化的病变,推荐手术治疗。同时ECCO推荐,对于息肉样异性增生,只要病变能完全切除,结肠其他部位无非息肉样增生,且无不可见的息肉样增生,内镜下息肉切除术可充分治疗。对于非息肉样异型增生的病变,内镜治疗可以作为一个选择,如果病变可以完全切除,而结肠其他部位没有非息肉样或不可见异型增生的证据,继续规范的结肠镜监测是合理的。其中不确定性异型增生,因患者可能伴有炎症相关的病理改变,因此难以明确是否有异型增生,此时可以先行优化治疗,促进黏膜愈合,3~6个月复查结肠镜。如果对病变的可切除性有疑问,建议转诊至专门的内镜医师或IBD中心。
对于简单病灶的切除,标准的息肉切除技术基本能够满足此类病灶的处理。当病变过大或高度不规则,因结肠的异型增生局限在黏膜而无淋巴转移风险,可考虑内镜黏膜切除术及内镜黏膜下剥离术。当使用内镜黏膜切除术时,>2cm结直肠病变经常需要分段切除(43%),这与肿瘤复发率增加(高达20%)有关,而内镜黏膜下剥离术能使这些病变获得更高的整块切除率和更低的复发率。结肠炎相关的异型增生,在实施内镜黏膜下剥离术前应评估病变周围黏膜,其应处于内镜缓解期(Mayo评分0~1分或溃疡性结肠炎内镜下严重程度指数评分0~2分),且患者应处于临床缓解期,最好是内镜和组织学缓解期;病灶应满足边界清楚、表面无溃疡、无隆起征及无内镜特征提示浸润性癌等条件。黏膜下纤维化程度是影响内镜黏膜下剥离术成功的关键因素,CD合并肠道纤维化的患者可能会影响内镜黏膜下剥离术的实施。有研究表明,UC相关的异型增生出现黏膜下纤维化的概率可能高于散发性结直肠腺瘤,前者发生率为66.6%~97%,且切除速度较慢。内镜不能切除的情况参见外科手术。
内镜下不可见的异型增生,即在无可见病灶下,非靶向活检获取提示的异型增生,不可见的异型增生和同时性CRC有关。关于不可见异型增生,既往研究多基于落后的内镜设备,难以发现轻微的病灶,这使得不可见异型增生的真正风险很难被估计。既往的数据(1994年)提示,在312例患者中有272例是不可见异型增生(87%),与此有较大差异的研究(2015年)报道,纳入的172例患者中,仅16例患者(9%)提示是不可见异型增生。因此,当非靶向活检显示不典型增生时,CD患者理应行高清结肠镜检查和色素内镜检查。在3~12个月内重复的非靶向活检,经2位以上经验丰富的病理医师认证为单一或多灶性LGD。在高清晰度结肠镜和色素内镜检查发现有不可见的HGD或LGD,患者通常应行手术治疗。基于在UC患者癌症进展率的数据,建议患者行保留直肠的全结肠切除术或直肠结肠切除术,目前CD相关的临床数据尚缺乏。此外,对于单灶性LGD的这一建议存在争议,并且,鉴于现有证据,为特定患者提供规范的内镜监测作为全结肠切除术的替代方案可能是合适的。一项纳入42例UC合并LGD患者的前瞻性研究报道称,19%的患者(2例发生癌症和6例发生HGD)有LGD进展,而17%有持续性LGD,其余64%有无限期或未发现异常增生。
ECCO建议CD合并CRC情况下,应遵循肿瘤手术的原则进行手术,并适当清扫淋巴结。对于结肠狭窄和长期广泛的克罗恩结肠炎,应考虑肿瘤手术的原则,因为术前难以确诊CRC,并且不建议使用狭窄成形术。美国结直肠外科协会推荐,在常规肠镜检查中发现不可见的异型增生、LGD或HGD的患者,通常应在3~6个月由有经验的内镜医师行高清肠镜检查和色素内镜检查,并重复随机活检,如在高清结肠镜和色素内镜检查时发现有不可见的异型增生、LGD或HGD的患者,建议行全结肠切除术或直肠结肠切除术。此外,对于不适合内镜切除或扁平黏膜异型增生、多灶性异型增生或结直肠腺癌,推荐全结肠切除术和回直肠吻合术或全直肠结肠切除术,而不是节段性切除术,因为CD患者因LGD或HGD行结肠切除术,其超过1/3的手术标本最终发现多灶性异型增生。现有数据表明,有14%~40%行结肠部分切除术的CD患者,最终会发展为异时性CRC,因此,对于此种情况,建议行全结肠切除或全结肠直肠切除。然而,关于异型增生在CD中的许多支持证据,都是基于在使用色素内镜检查和高清白光结肠镜检查之前进行的研究,尚缺乏进一步的研究数据。在行全结肠切除的CD患者中,对于保留直肠的患者,每1~2年规范的内镜监测是合理的。据报道,只有0.7%保留直肠的患者在全结肠切除后回直肠吻合术后发生直肠癌。根据ECCO推荐,HGD伴随CRC及进展为CRC的可能较高,推荐手术治疗。在一项纳入600例UC患者的前瞻性研究中,随访的30年间,有19例(3.2%)患者出现HGD,11例患者行结肠切除术,并且术后病理显示有5例(45.5%)出现癌变,未行手术的8例患者在后继随访中,有2例(25%)进展为CRC。由于非腺瘤样异型增生的隆起病变与异时或同时性结肠癌高度相关,无论活检分析发现的异型增生程度如何(HGD或LGD),患者都应行结肠切除术。荟萃分析提示,在纳入450例行结肠切除术的UC-LGD患者中17%有同时性CRC。
UC患者有两种主要的手术方式,全结直肠切除加永久末端回肠造口或全结直肠切除加回肠贮袋肛管吻合(ileal pouch-anal anastomosis,IPAA)。梅奥诊所发表的一项早期研究数据,着眼于对UC相关CRC和家族性结肠息肉病的IPAA重建,认为在UC相关异型增生的背景下,IPAA是非晚期的远端CRC的合理选择。有数据显示,在纳入343例行回直肠吻合术(IRA)的UC患者中,直肠恶性肿瘤的发生率术后10年为3.2%,20年为7.3%。保留直肠的手术方式,如回肠直肠吻合和留有Hartmann袋的手术方式,其仍有直肠继续癌变的风险,因此不作为理想选择。由于CD患者多灶性异型增生,以及在结肠部分切除后较高的异时性结肠癌发生率的特点,当患者诊断为CRC或HGD时,建议行直肠结肠切除术。在CD患者中,确诊异型增生后,结肠切除和全结肠直肠切除及末端回肠造口是较为常见的手术方式。此外,全结直肠切除和永久性末端回肠造口也解决了严重肛周病变及肛门失禁的问题。因IPAA重建需要健康的小肠及相对健康的直肠,结合CD小肠及肛周的病变特点,IPAA不作为CD患者可选择的手术方式。
因内镜监测的介入,IBD相关CRC发病率呈现降低的趋势,且以早期病变(Ⅱ期)为主。但是,在CD中CRC诊断时仍以进展期多见。IBD相关CRC的预后是有争议的。有研究报道,UC相关CRC患者和非IBD相关CRC患者杜克分期分布相似。与非IBD相关CRC相比,CD相关CRC患者诊断时处于杜克A期和B期肿瘤的发生率较低(36% vs 42%),杜克C期肿瘤发生率较高(31% vs 27%)和杜克D期肿瘤(23% vs 21%)。经过5年的随访,59%的UC和非UC相关CRC患者肿瘤所致病死率相同,而CD相关CRC患者病死率高于非CD相关CRC(62% vs 56%),因CD相关CRC诊断时多为进展期,预后不如散发性CRC。从术后并发症来说,IBD本身可能带来不利影响,有研究报道,IBD相关的结肠癌手术患者,在住院时间、手术切口感染率、深静脉血栓形成率、术后输血率以及术后30天的再入院率等方面,明显高于散发性CRC患者,并易发生切口裂开及切口愈合缓慢。近期的研究数据显示,在IBD相关CRC的化疗方面,IBD相关CRC发病年龄轻,多处于进展期,右半结肠的病变比例较高,2年生存率显著低于散发性CRC。
与此不一致的是,梅奥诊所近期一项病例对照研究,纳入107例IBD合并直肠癌患者,215例散发性直肠癌患者,数据表明,IBD合并直肠癌患者和散发性直肠癌患者远期预后相似,IBD并不影响直肠癌无复发生存率,但是直肠癌合并IBD的术后病理相较于散发直肠癌,显示有更强的淋巴管侵袭及较高的环周切缘阳性率。在IBD合并直肠癌的人群中,新辅助化疗的比例较低,IBD组Ⅱ期和Ⅲ期疾病的新辅助化疗率分别为28.6%(6/21例患者)和53.5%(23/43例患者),对照组为60.0%(24/40例患者)和87.2%(75/86例患者)。同时也有研究报道,IBD相关CRC相较于散发性CRC可能有治疗延迟的情况,但是,Ⅱ期和Ⅲ期无复发生存率和5年生存率并无差异,IBD相关CRC Ⅳ期患者总的生存率降低。研究表明,IBD相关CRC与微卫星高度不稳定CRC的形态相似,对以氟尿嘧啶为基础的化疗有效,此外,IBD相关CRC和散发性CRC患者在肿瘤复发率、无进展生存率和总生存率上并无显著差异。
肿瘤靶向药物对IBD相关CRC的预后及IBD病情的影响,少有文献报道。近期有文献报道,在IBD合并肿瘤的患者中,免疫检查点抑制剂(抗PD-1和抗CTLA-4)的使用可能增加胃肠道不良事件发生风险,使用抗血管内皮生长因子(vascular endothelial growth factor,VEGF)单抗治疗尚未发现其促进IBD疾病活动的表现。在生物制剂时代,各类生物制剂对IBD相关CRC预后的影响尚待可靠证据。
(钱文伟 温伟伟 李毅 朱维铭)
IBD是发生在胃肠道原因不明的慢性非特异性炎症性疾病,主要包括UC和CD。IBD是由环境、遗传易感性、肠道菌群失调、异常免疫应答等多种因素共同作用所致,目前病因和发病机制有待进一步研究。
临床研究显示,10%~15%的IBD患者可以进展为CRC,即结肠炎相关性结肠癌(colitis-associated cancer,CAC)。CAC是IBD患者的严重并发症之一,其致死率也明显高于散发性结肠癌患者。因此,深入探究CAC的发病机制对于结肠癌的预防、早期筛查、临床治疗具有重要的临床意义。
CRC的发生遵循“正常—腺瘤—癌变”的模式,而CAC的发生则遵循“炎症—异型增生—癌变”的过程。IBD肠道黏膜持续炎症反应是CAC发生的核心事件,可导致氧化应激及肠黏膜中激活免疫细胞产生大量炎症因子,引起基因表达异常,促进CAC的发生。总体来讲,CAC发生的机制主要包括以下4个方面:炎症因子的产生及其相关信号通路的持续激活、氧化应激及其诱导的基因改变、肠道菌群失调引起的免疫应答紊乱、表观遗传修饰导致的肿瘤相关基因表达异常。
TNF-α是一种常见的促炎性细胞因子,对维持慢性炎症具有重要作用,与细胞增殖、分化和死亡等多种细胞生物学过程密切相关。TNF-α主要由活化的巨噬细胞、树突状细胞和T细胞产生,通过与TNF受体Ⅰ型(TNF receptor type I,TNFR1)和TNF受体Ⅱ型相互作用并激活一系列细胞级联反应。TNF-α主要作用机制如下:通过持续性激活NF-κB信号通路,促进CAC的发展;通过损伤DNA启动肿瘤发生,刺激肿瘤血管生成。动物实验表明,与野生型小鼠相比,氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸钠(dextran sulphate sodium,DSS)诱导的小鼠CAC模型中,TNFR1 -/- 小鼠结肠癌发生率和癌细胞数量明显减少。抗TNF-α单克隆抗体(英夫利西单抗)可显著抑制CAC小鼠模型结肠癌的发生。临床研究表明,IBD患者肠黏膜中TNF-α的表达显著上调,英夫利西单抗已被证明可有效减轻IBD患者的肠道炎性反应,在临床上已经得到广泛应用。
NF-κ B是一个转录因子家族,由p50、p52、p65(RelA)、c-Rel和RelB 5个成员组成。IκB是NF-κB抑制剂,与NF-κB在细胞质中形成复合物,阻止NF-κB信号通路的激活。IκB激酶(IKKα、IKKβ、IKKγ)在细胞因子、生长因子、丝裂原、微生物成分等多种因子作用下,调节IκB降解,从而导致NF-κB通路的激活,促进多种炎症和肿瘤相关靶基因的表达。
NF-κB是炎症反应的核心调节因子,参与包括IBD在内的多种炎症性疾病的发病和几乎所有的免疫反应。NF-κB促进包括TNF-α和IL-6在内的各种促炎性细胞因子和趋化因子的表达,参与IBD的炎症过程。此外,NF-κB通过促进血管生成相关基因的表达而调节肿瘤的进展和转移,有助于肿瘤细胞增殖和存活。
临床研究发现,在IBD患者的肠黏膜上皮细胞和巨噬细胞中检测到高水平的活化NF-κB。动物实验表明,上调NF-κB信号在促进CAC进展过程中发挥着重要作用。与野生型小鼠相比,在AOM/DSS诱导小鼠CAC模型中,条件性敲除肠黏膜IKKβ可导致结肠癌细胞数目显著减少;骨髓免疫细胞中特异性IKKβ缺失导致肠黏膜促炎性细胞因子显著降低,从而缓解肠道持续激活的炎症反应,抑制肿瘤的生长。NF-κB信号通路缺乏可导致肠上皮细胞凋亡增加、抗菌肽表达紊乱、细菌向黏膜移位中断,提示NF-κB信号在调节肠上皮完整性和黏膜免疫系统中发挥着重要作用。
IL-6在IBD及CAC的发生过程中发挥重要作用。此外,IL-6还参与调节肠上皮细胞的存活和增殖能力,在组织稳态和再生中也发挥重要作用。IL-6通过NF-κB依赖的方式由巨噬细胞和效应T细胞产生。IL-6与膜相关蛋白gp130相互作用的IL-6受体(IL-6Rα)结合,触发JAK及其下游的STAT3、Shp-2-Ras和PI3K-AKT的激活。STAT3是一种重要的转录因子,通过结合到特定的DNA序列,促进细胞周期素D1、增殖细胞核抗原、存活素、促存活蛋白Bcl-xL和 VEGF 等多种基因的转录,从而发挥促癌效应。
研究表明,活动期IBD患者肠黏膜固有层中IL-6及其受体水平、STAT3、抗凋亡基因 Bcl - 2 和 Bcl - xL 的表达明显高于正常组织。在UC相关的CAC患者的肿瘤组织标本中,IL-6及STAT3的表达水也显著增加。动物实验表明,抑制IL-6/STAT3信号通路能显著降低AOM/DSS处理小鼠CAC的发生率。IL-6/STAT3轴还通过激活IL-22的表达促进肿瘤的发生。IL-22主要由CD4 + T细胞、自然杀伤细胞和NKT细胞合成,在肠黏膜愈合、上皮屏障和慢性炎症中发挥着重要作用。IL-22中和蛋白(IL-22BP)的缺失引起IL-22信号持续激活,导致 APC Min/CAC 小鼠结肠癌的发生率明显高于IL-22缺失的 APC Min/CAC 小鼠和野生型小鼠,这表明IL-22和IL-22BP通路调节了肠黏膜愈合和肿瘤的发展。
IL-23是IL-12细胞因子家族的成员之一,由树突状细胞和其他抗原提呈细胞产生,在肿瘤微环境中诱导炎症反应,在肿瘤进展中发挥重要作用。IL-23在CAC患者和CAC模型小鼠结肠黏膜中的表达水平显著高于正常肠黏膜组织。IL-23可提高Th17细胞功能的水平,通过诱导IL-17的产生而促进结肠炎和结肠癌的发生。
Th17细胞是CD4 + T细胞的一种亚群,在调节IBD的免疫应答过程中发挥重要作用。Th17细胞产生多种促炎性细胞因子,如IL-17A、IL-17F、IL-21和IL-22。其中,IL-17A不仅具有强烈的促炎效应,对结肠癌的形成也有显著促进作用。IBD患者血清和结肠黏膜中IL-17水平升高。在AOM/DSS诱导的小鼠CAC模型中,IL-17A缺乏小鼠能显著抑制STAT3以及丝氨酸/苏氨酸激酶通路的激活,减少促炎性细胞因子IL-6和TNF-α的产生,抑制CAC的形成。此外,使用IL-17A抗体可以显著抑制AOM/DSS处理的小鼠CAC的发生。IL-23或IL-23R缺陷小鼠结肠黏膜中IL-17A等促炎性细胞因子表达显著降低,同时肿瘤发生率也明显降低。综上所述,IL-23/IL17通路在IBD和CAC的病理生理过程中发挥重要作用。
氧化应激是导致IBD肠道持续性炎症反应和炎癌转化的重要机制之一。活动期UC和CD患者肠道炎症黏膜内含有大量的活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS),因此一直被认为是一种氧化自由基超载病。ROS和RNS主要由巨噬细胞、中性粒细胞等先天免疫细胞产生,能够促进肠上皮细胞中DNA损伤,导致致瘤性基因累积增加,加速癌细胞的形成和生长。此外,ROS与DNA反应可导致染色体断裂,并增加染色体不稳定性,与对照组的UC患者相比,异型增生或癌症患者的肠黏膜活检标本端粒缩短的程度明显增加。同时,ROS产物作为化学信号,直接激活NF-κB和p38/MAPK通路,进而影响细胞的增殖、分化和凋亡,促进结肠癌的形成。
肠道菌群在维持肠道稳态中发挥着重要作用。生理条件下,肠道共生菌绝大多数属于厌氧菌,主要包括拟杆菌门、厚壁菌门、放线菌门和变形菌门,能够保护宿主细胞免受病原体定植,并有助于肠道内形成免疫细胞调节群体。反之,肠道菌群失调则可导致肠道炎症性病变,与IBD和CAC的发生发展密切有关。研究显示,IBD患者肠杆菌数量明显增加,厚壁菌门数量减少。与散发性结肠癌患者相比,CAC患者的肠黏膜中肠杆菌和单胞菌属富集,而具核梭形杆菌和瘤胃球菌属明显减少。
炎症驱动的CAC的发生依赖于肠道菌群。研究表明,与正常小鼠相比较,在无菌条件下,CAC小鼠模型体内几乎不产生肿瘤。此外,采用CAC小鼠菌群定植的无菌小鼠的肿瘤发生率和肿瘤负荷显著高于来自健康小鼠的菌群定植者。在AOM/DSS小鼠中使用万古霉素可通过中性粒细胞的丢失减少肿瘤的发生。
肠上皮细胞和固有免疫细胞表面常表达Toll样受体,可直接识别微生物病原体相关分子模式,二者结合后,通过髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖性途径激活NF-κ B等信号通路,引起炎性反应,引起肿瘤发生。研究发现,AOM/DSS诱导的结肠CAC小鼠模型中,TLR4缺陷小鼠结肠癌发生率显著低于正常小鼠组。在野生型小鼠CAC模型中,TLR/MyD88信号通路的阻断,能通过降低结肠上皮细胞的增殖能力、炎症细胞的浸润,减少TNFα、IL-17A、IL-6等促炎性细胞因子的产生,从而缓解肠道炎性反应,抑制肿瘤形成。
大肠埃希菌是肠杆菌科目前研究较多的致癌细菌。通过药物抑制大肠埃希菌的肠道定植,可显著减轻CAC小鼠模型肠道炎症和减少肿瘤的发生。一些大肠埃希菌菌株可以产生聚酮合酶(polyketide synthase,PKS)起源的基因毒素colibactin,导致肠上皮细胞的慢性DNA损伤。从大肠埃希菌中删除 PKS 基因毒性岛可以减少AOM诱导的IL-10 -/- 和APC Min -IL-10 -/- 小鼠的肿瘤的发生。除了基因毒性,PKS大肠埃希菌定植的小鼠与共生大肠埃希菌定植的小鼠相比,TNF表达增加,阻断TNF信号通路可减少PKS大肠埃希菌定植小鼠的结肠炎和结肠癌的进展。
表观遗传学是与遗传学相对应的概念。遗传学是指基于基因序列改变所致基因表达水平变化。表观遗传学是指基于非基因序列改变所致基因表达水平变化,如DNA甲基化、RNA干扰、基因组印记、基因沉默、核仁显性、休眠转座子激活等。这里主要介绍RNA干扰和DNA甲基化在CAC发生发展中的作用。
miRNA在包括IBD在内的多种免疫介导疾病的调节中发挥核心作用,与CAC的发生密切相关。miRNA是一类由18~22个核苷酸组成的小分子非编码RNA,在转录后水平抑制目标基因的表达,是表观遗传修饰的重要机制之一。具体原理如下:miRNA通过引导RNA诱导的沉默复合体结合到目标mRNA分子3′-非翻译区的互补序列,导致mRNA降解或翻译抑制,发挥各种生物学效应。通常一种miRNA能够作用于多个靶基因,而一个靶基因也可同时被多种miRNA调控,因此形成了错综复杂的miRNA调节网络,从而参与细胞免疫应答、增殖、分化、凋亡等各个方面的调节。在IBD中,miRNA可通过干扰NF-κB、IL23/IL23R、IL-6/STAT3等炎症信号通路发挥作用,包括miR-21、miR-26A和miR-301A在内的多种miRNA参与IBD和CAC的发生和发展。
miR-21是关键的促癌基因之一,在IBD患者肠黏膜中表达明显升高,在CAC患者肿瘤组织中的表达水平也显著上调。在DSS诱导的小鼠结肠炎模型中,抑制miR-21的表达可显著减轻结肠炎症反应。有报道显示UC中上皮细胞miR-21上调可通过增加肠黏膜细胞通透性促进IBD的发生。在AOM/DSS诱导小鼠CAC模型中,与野生型小鼠相比,miR-21缺失小鼠产生的IL-6、IL-23、IL-17A等促炎性细胞因子显著减少,其靶基因肿瘤抑制因子——程序性细胞死亡4显著上调,NF-κ B信号通路的激活受到抑制,从而抑制CAC的形成。有研究报道,活动期IBD患者肠上皮细胞中miR-301A表达水平显著升高,miR-301A通过降低抑癌基因 BTG1 的表达,降低小鼠结肠上皮细胞完整性,促进炎症及肿瘤发生。另有研究显示,在miR-26A髓细胞特异性过表达的小鼠中,miR-26A通过抑制NF-κ B/STAT3的激活和IL-6的产生来抑制巨噬细胞激活,进而抑制肠道炎症反应及CAC的发生。
DNA甲基化是指在DNA甲基化转移酶(DNA methyltransferase,DNMT)的作用下,在基因组CpG岛的胞嘧啶5号碳位共价键结合一个甲基基团。CpG岛是基因组中富含CpG二核苷酸的一些区域,主要位于基因的启动子和外显子区域。在正常细胞中,CpG岛通常是未甲基化的,使基因转录成为可能。然而,在肿瘤细胞中,这些CpG岛会发生高甲基化,对肿瘤的发生有重要影响。DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。DNMT主要包括DNMT1、DNMT2、DNMT3A、DNMT3B、DNMT3L等类型,DNMT1主要作用在于维持甲基化状态,而DNMT3A和DNMT3B则主要介导DNA从头甲基化。
DNA过度甲基化是IBD癌变过程中的典型特征,可直接导致肿瘤相关基因表达静默。既往有研究报道,CD患者结肠黏膜组织中抑癌基因脆性组氨酸三联体的甲基化修饰水平升高,进而显著降低其蛋白质表达水平,从而导致结肠癌发生风险升高。此外,CD炎症反应会导致患者肠黏膜 Sox17 和 GATA4 、组织因子通路抑制因子2等抑癌基因启动子区域的高甲基化,抑制这些基因的表达,导致患者CRC高发风险显著提高。除抑癌基因外,CD患者肠黏膜炎症反应可改变肠道黏膜 Notch4 、 FUT7 、NDRG家族蛋白4等癌症相关调控基因的启动子区域甲基化水平,提高肠道癌症发生风险。在活动期UC患者手术切除的肠黏膜组织中, MYOD1 、 CDH1 和 HPP1 等肿瘤相关基因位点基因的甲基化修饰显著增高,且与炎性反应状态密切相关。通过分析UC相关CAC患者结肠上皮CpG位点DNA甲基化水平,发现促肾上腺皮质激素释放激素受体2的DNA甲基化水平在癌与非癌结肠黏膜组织中具有显著差异,提示促肾上腺皮质激素释放激素受体2基因高甲基化修饰可能有助于UC患者的结肠癌高危人群筛查。另有研究表明,miR-34b-5p的DNA启动子区域高度甲基化,导致其下游基因 c - myc 、 CRL4DCAF4E3 连接酶的表达上调,最终导致CAC的发生。
综合上述,CAC发生的核心事件是肠道慢性炎症反应,并涉及免疫反应、氧化应激、肠道菌群和表观遗传修饰等多种病因病机的共同参与。深入研究上述机制,可为CAC的预防和早诊早治提供新的方法。
(刘占举 常云丽)
[1]NG S C,SHI H Y,HAMIDI N,et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century:a systematic review of population-based studies[J].Lancet,2017,390(10114):2769-2778.
[2]LODDO I,ROMANO C. Inflammatory bowel disease:genetics,epigenetics,and pathogenesis[J]. Front Immunol,2015,6:551.
[3]OOI C J,FOCK K M,MAKHARIA G K,et al. The Asia-Pacific consensus on ulcerative colitis[J]. J Gastroenterol Hepatol,2010,25(3):453-468.
[4]NIKOLAUS S,SCHREIBER S. Diagnostics of inflammatory bowel disease[J]. Gastroenterology,2007,133(5):1670-1689.
[5]TRUELOVE S C,WITTS L J. Cortisone in ulcerative colitis;final report on a therapeutic trial[J]. Br Med J,1955,2(4947):1041-1048.
[6]SATSANGI J,SILVERBERG M S,VERMEIRE S,et al.The montreal classification of inflammatory bowel disease:controversies,consensus,and implications[J]. Gut,2006,55(6):749-753.
[7]BEST W R,BECKTEL J M,SINGLETON J W,et al.Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study[J]. Gastroenterology,1976,70(3):439-444.
[8]GREUTER T,VAVRICKA S,KÖNIG A O,et al. Malignancies in inflammatory bowel disease[J]. Digestion,2020,101(Suppl 1):136-145.
[9]PORTER R J,ARENDS M J,CHURCHHOUSE A M D,et al. Inflammatory bowel disease-associated colorectal cancer:translational risks from mechanisms to medicines[J]. J Crohns Colitis,2021,15(12):2131-2141.
[10]LUTGENS M W,VAN OIJEN M G,VAN DER HEIJDEN G J,et al. Declining risk of colorectal cancer in inflammatory bowel disease:an updated meta-analysis of population-based cohort studies[J]. Inflamm Bowel Dis,2013,19(4):789-799.
[11]WIJNANDS A M,DE JONG M E,LUTGENS M W M D,et al. Prognostic factors for advanced colorectal neoplasia in inflammatory bowel disease:systematic review and metaanalysis[J]. Gastroenterology,2021,160(5):1584-1598.
[12]BEMELMAN W A,WARUSAVITARNE J,SAMPIETRO G M,et al. ECCO-ESCP consensus on surgery for Crohn’s disease[J]. J Crohns Colitis,2018,12(1):1-16.
[13]ALSUGHAYER A,GRASS F,MCKENNA N P,et al. Does IBD portend worse outcomes in patients with rectal cancer? A case-matched analysis[J]. Dis Colon Rectum,2020,63(9):1265-1275.
[14]KAPLAN G G. The global burden of IBD:from 2015 to 2025[J]. Nat Rev Gastroenterol Hepatol,2015,12(12):720-727.
[15]NAGAO-KITAMOTO H,KITAMOTO S,KAMADA N.Inflammatory bowel disease and carcinogenesis[J]. Cancer Metastasis Rev,2022,41(2):301-316.
[16]POPIVANOVA B K,KITAMURA K,WU Y,et al. Blocking TNF-alpha in mice reduces colorectal carcinogenesis associated with chronic colitis[J]. J Clin Invest,2008,118(2):560-570.
[17]GRIVENNIKOV S I,WANG K,MUCIDA D,et al. Adenomalinked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth[J]. Nature,2012,491(7423):254-258.
[18]KOSTIC A D,XAVIER R J,GEVERS D. The microbiome in inflammatory bowel disease:current status and the future ahead[J]. Gastroenterology,2014,146(6):1489-1499.
[19]LIND G E,THORSTENSEN L,LØVIG T,et al. A CpG island hypermethylation profile of primary colorectal carcinomas and colon cancer cell lines[J]. Mol Cancer,2004,3:28.