




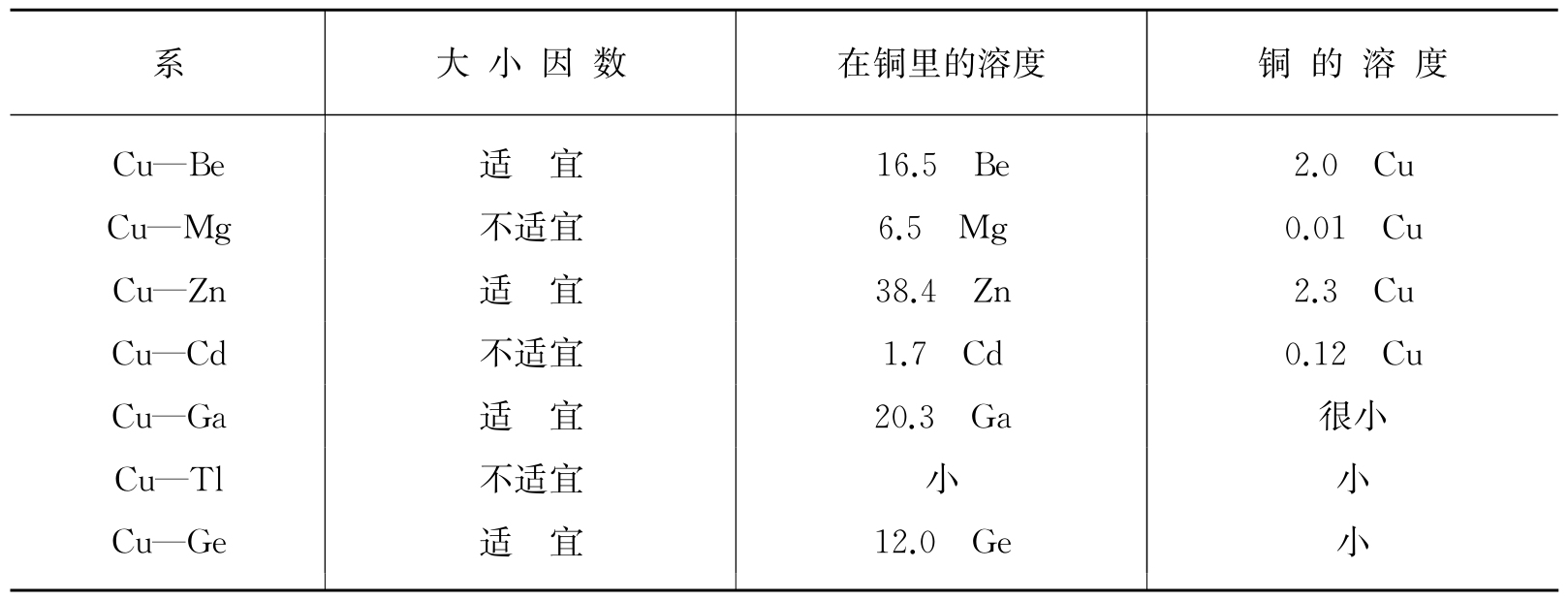
在前面几节中,我们曾经试图为分子和原子引入一个具体的和写实的图像. 我们的目的是为宏观性质的讨论奠基,因为分子和原子是一切物质的微观组成. 单单分子和原子具有一定大小与形状这个概念本身就往往对很重要的工程问题给出有用的启发. 作为第一个例子,可以举出形成置换齐时所遵循的关于原子大小的规律,这曾由休姆·罗瑟里(Hume-Rothery)等写成公式. 置换齐是两种金属的合金,其中基本元素的某些晶格点座为齐化元素的原子占有. 显然由纯几何学的考虑就可以作出结论:两类原子的大小不能有很大的差别;否则在进行置换时不能不严重地扰动晶格结构,也就是只能形成局部齐化. 实际上,上面提及的研究工作者发现原子半径的差别大于15%时就不能形成任何成分的固溶体. 这一半径是指表1.1、1.2和1.3所列举的金属半径. 在表1.8中,把不同金属在铜中的溶解度以及铜在这些金属中的溶解度和原子半径作了比较. 按照这一规律,Ag—Au体系应该是高溶度的一个最好的例证. 因为两种组分都是面心立方晶格,原子价相同,而原子半径仅相差2%. 这一结论由事实证实了:Ag—Au体系形成遍及全部组分的单相置换齐.
表1.8 几种铜合金初相的溶解度
(溶度以溶质的原子百分数计算)
另一个例子是某些分子化合物的发现. 笼合物(clathrates)是一种大分子将较小的分子或原子包容在笼子结构中的化合物;这一术语常指氢醌类[p-C 6 H 4 (OH) 2 ]的化合物. 加合物(adducts)与这相似,是尿素分子形成的长形扭曲柱体状晶体. 在这些化合物中,形成外壳的分子与内包分子间不形成化学键,只是一种分子被另一种分子的晶格包围了. 由于三个大氢醌分子间的强键,使化合物取得了稳定性. 当然,只有晶化分子能够形成一个坚固的笼子,而这笼子相对于内包物是足够大的时候才能形成这样的化合物. 当内包分子很小时,它可能从晶格的间隙中逸走. 例如我们能够制备Ar,Kr,Xe,SO 2 ,HCl,C 2 H 2 和氢醌的这类化合物,只需在压力下使氢醌在放有这些气体的容器内结晶就能得到. 当重新加热时,气体又会逸出. 这在工程应用上很有价值,我们可以在常压和常温下“储藏”稀有气体,同时也可以利用这方法分离和提纯稀有气体.
尿素和硫脲形成的加合物对工业更为有用. 尿素分子不形成上面氢醌分子那样的球体壳,而是结晶成长的扭曲柱体,由三个螺旋体连锁而成,有管形内心可以包藏长分子. 尿素化合物的内部空间小些,能够有效地包藏直链分子. 硫脲分子所形成的管子其断面较大,直链分子在里面会感到太松,因此它可以包藏带支链的分子. 显然在这类结构中,组分的比率仅依赖于内包分子的长度. 因此可以想象,这类化合物的很大一部分没有化学计量的分子比率,纯粹是由于空间要求的偶合才会出现化学计量的化合物. 在工程应用上,可以利用它们来分离两种沸点相近而形状不同的化合物,因为一种分子可以装在管子里,而另一种分子由于尺寸不合宜而装不进去;能装的形成加合物而结晶,这样就可以与装不进去的分子分离. 例如:正十一烷(C 11 H 24 ;沸点195.8℃)和十氢化萘(C 10 H 18 ;沸点193.3℃),或者是苯(沸点80.1℃)和环己烷(沸点80.8℃). 这样生成的分子化合物可以用水分解除去尿素,因而回收了被包的分子.
与这同一道理的是分子筛:人造沸石具有天然沸石所具有的一切特性,但如果把人造沸石里的盐和水分子排除出去,那就在人造沸石的晶体里出现了这些分子原来占有的孔隙. 这些孔隙有一定大小,是分子的尺寸;因此适合这尺寸的分子就很容易吸附上去为晶体所捕捉,而不合适的分子就很容易通过而“筛出去”了. 用不同的晶体和制备方法可以得到不同尺寸的“筛孔”,这是分离气体的一个有效方法.
最后我们也可以提起直到现在还没有制备出一种氟酸盐(M
+
FO
3
)或过氟酸盐
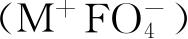 ,而氯酸盐、过氯酸盐、溴酸盐、过溴酸盐、碘酸盐、过碘酸盐都能制备. 看来问题只是因为七价的氟正离子太小了(见表1.4),半径只有0.07Å,而相应的氯离子是0.26Å、溴离子是0.39Å、碘离子是0.50Å,另外,二价的氧负离子半径是1.4Å;所以即使氟酸或过氟酸中的氧离子已经挤得“背靠背”了,而中间的氟离子还是小得碰不上氧离子的边,不能形成化学键. 这是分子结构中尺寸效果的又一例子.
,而氯酸盐、过氯酸盐、溴酸盐、过溴酸盐、碘酸盐、过碘酸盐都能制备. 看来问题只是因为七价的氟正离子太小了(见表1.4),半径只有0.07Å,而相应的氯离子是0.26Å、溴离子是0.39Å、碘离子是0.50Å,另外,二价的氧负离子半径是1.4Å;所以即使氟酸或过氟酸中的氧离子已经挤得“背靠背”了,而中间的氟离子还是小得碰不上氧离子的边,不能形成化学键. 这是分子结构中尺寸效果的又一例子.