在一般条件下,物质有三种状态:气态、液态和固态. 这三种状态有明显的区别,并且各有特性,使我们易于识别它们. 气态的特征在于它内部分子组织的无秩序性. 实际上,气态分子几乎是独立的,除了在碰撞瞬间外,分子的质心运动、分子的转动以及分子内部原子的振动都可以认为不受同时存在的其他分子的干扰. 因而研究气态时,我们对单个分子的行为最感兴趣. 固态具有另一种极端情形,分子排列得很紧密而有规则地成为晶体;自然,相互作用就成为最主要的. 液态则介于气态和固态之间,不过在一般条件下更近于固态,宁可叫作无组织固体或熔融固体,而不是有组织气体或冷凝气体. 极端情形的轮廓可以比较清楚地想象出来,也就容易构成简单的模型. 液态具有类似气体和晶体的双重性质,因此问题就复杂一些,并且需要更详细的分析. 这一点在以后的讨论中会说明.
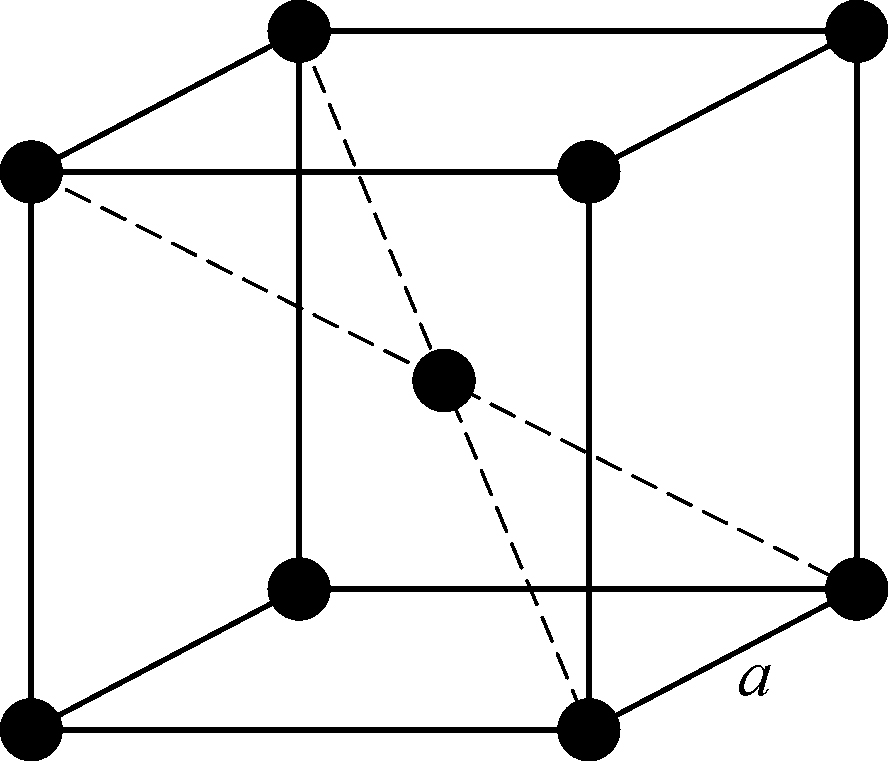
图1.1 体心立方晶格
固体分子间的相互作用很强烈,致使形成了完全有规则的结构——晶格. 例如碱金属:锂(Li)、钠(Na)、钾(K)、铷(Rb)和铯(Cs)都有同样的体心立方格子,如图1.1所示. 原子占据了立方体的中心和各个角隅. 如果立方体的边长为a,最邻近的原子间距为
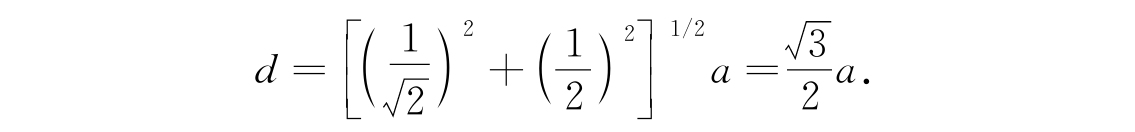
表1.1中列出了这些金属的a和d值,单位为埃(Å). 一埃等于一亿分之一厘米(10
-8
厘米).原子和分子世界里面的大小总是几个以至十几个埃,所以如果说米是我们日常生活中的自然尺度,那么埃就是原子和分子世界中的自然尺度了. 一价贵金属铜(Cu)、银(Ag)和金(Au)有如图1.2所示的面心立方格子,除了立方体的各角,原子还占据了各个面的中心. 若边长为a,则最近邻的原子间距为
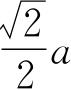 . 这些金属的a和d值列在表1.2中.
. 这些金属的a和d值列在表1.2中.
表1.1 碱金属的体心立方a、d值 (单位为Å)
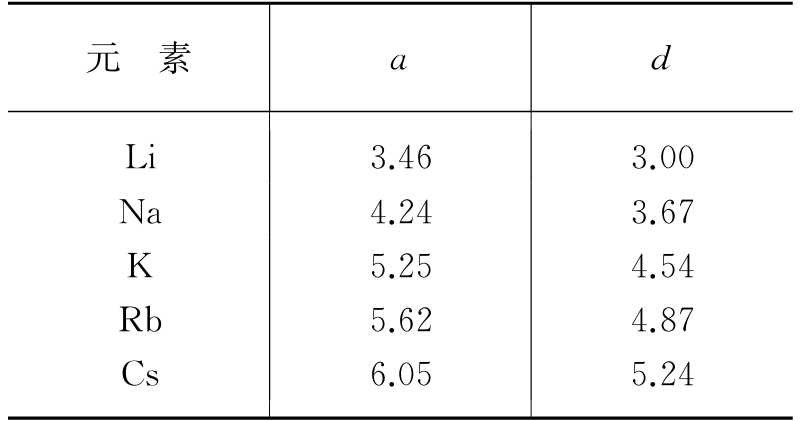
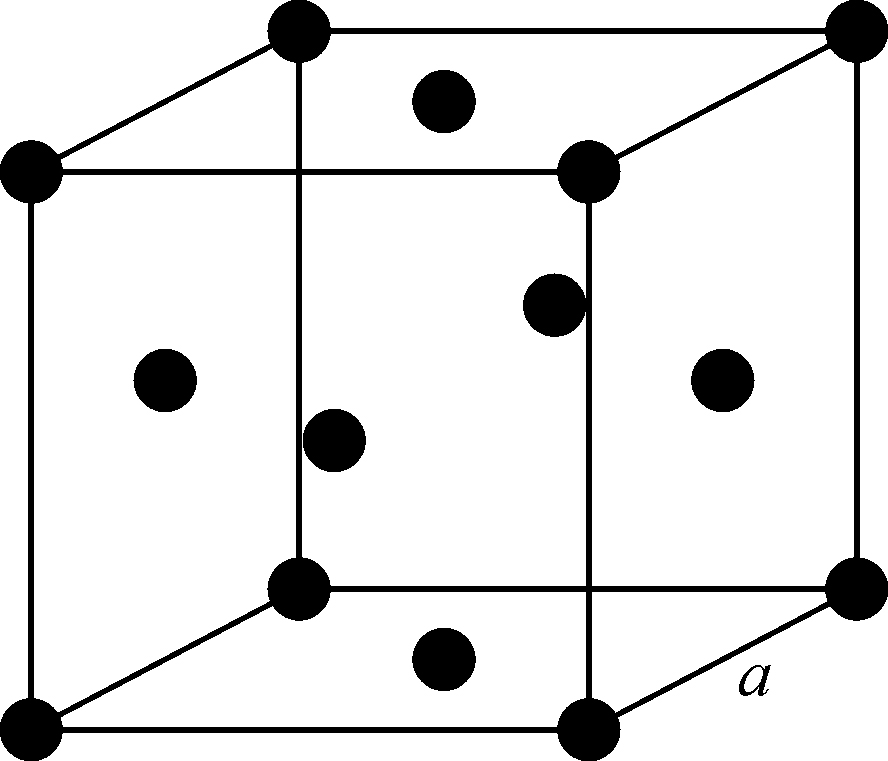
图1.2 面心立方晶格
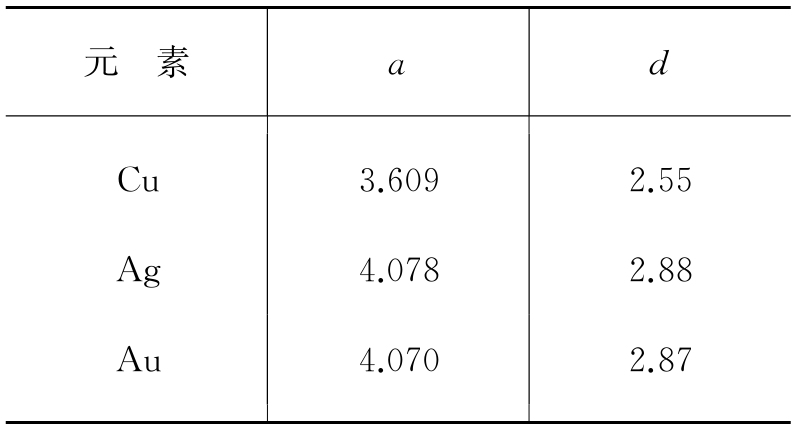
表1.2 一价贵金属的面心立方a、d值 (单位为Å)
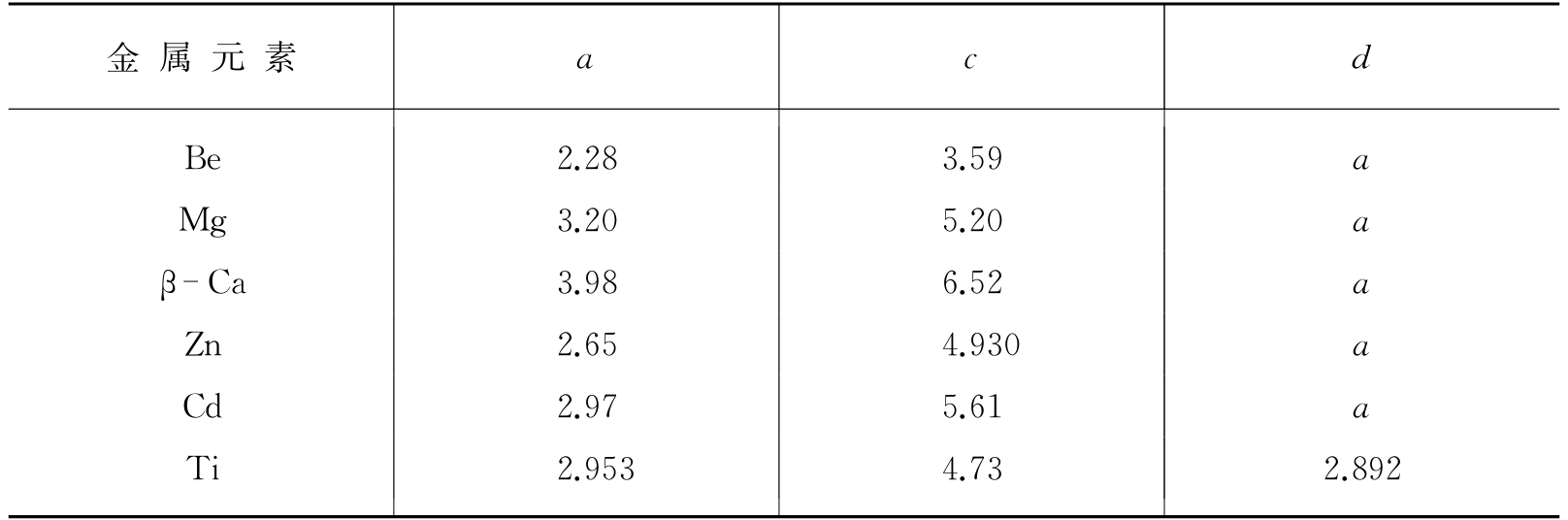
体心立方和面心立方是具有最大对称性的晶格. 其他的金属如镁(Mg)、锌(Zn)等有所谓的六方密堆积晶格,如图1.3所示,有晶格参数a和c,a是六角形底的边长,c是高. 表1.3列出了这类结构的a、c及d的数值. 自然,还有更复杂的晶格. 例如氯化钠晶体的结构可以分解成钠离子和氯离子的两组规则排列(图1.4),可以认为是钠离子的面心立方格子和氯离子的面心立方格子互相结合而成的体系. 现代关于固体的定义认为所有的固体都是晶体. 玻璃没有确定的规则的晶体结构,所以被认为是液体.
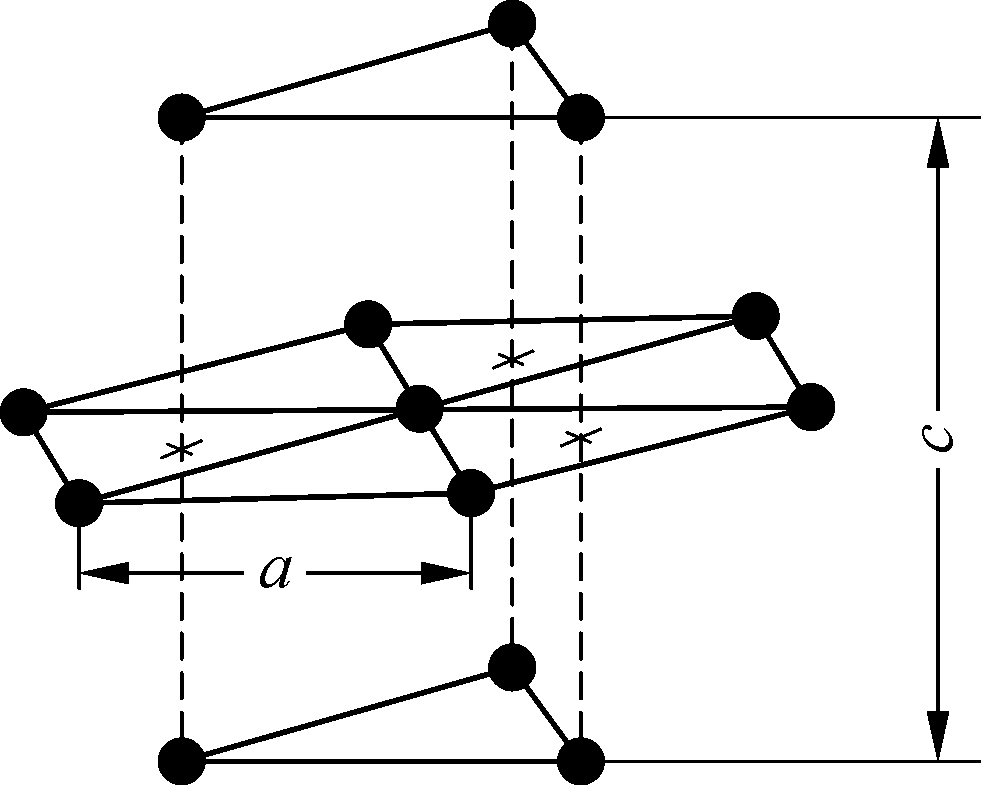
图1.3 六方密堆积晶格
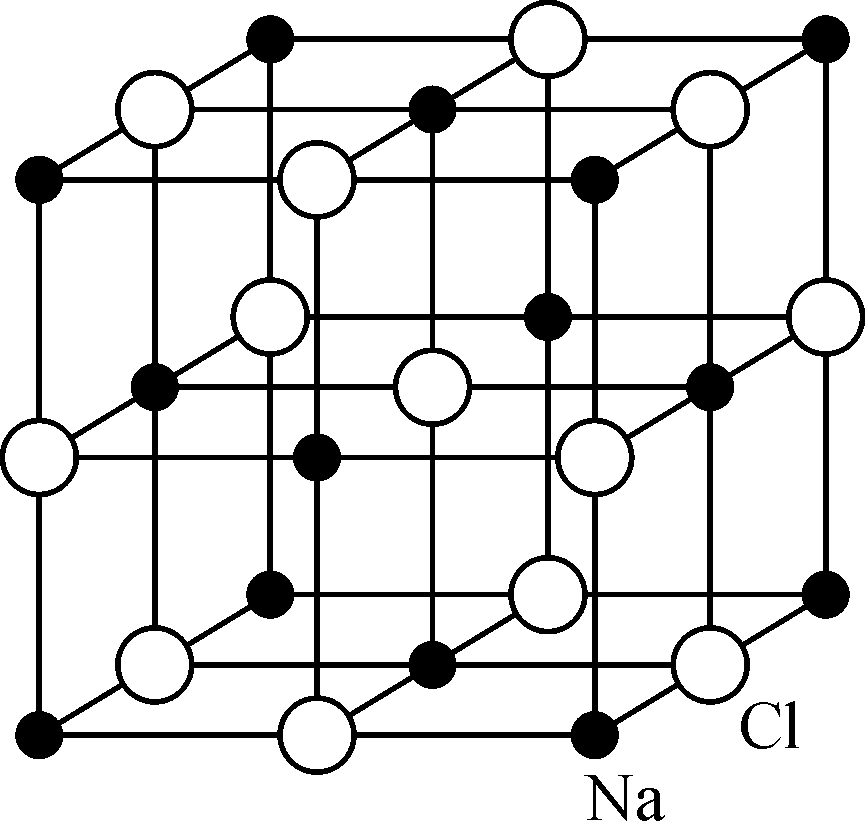
图1.4 NaCl晶体结构
表1.3 六方密堆积结构的金属的a、c、d值 (单位为Å)