




当轴突和树突在发育中的大脑中生长时,它们会探测周围的环境。为了帮助自己找到能形成突触的神经元,它们拥有被称为“生长锥”的运动能力很强的末梢(图3–1)。轴突或树突的轴是圆柱形的,而生长锥则以类似变形虫的方式伸展活动。用手臂来比喻,典型的生长锥的形状有点儿像手,从手掌边缘延伸出的手指状的突起称为“丝状伪足”,前臂就是轴突或树突的轴。丝状伪足可以伸长和缩回,并能吸附或脱离其他细胞表面的分子。
轴突或树突的伸长及生长锥的形状和运动都受蛋白质链状聚合物的控制。在轴突或树突的轴内有微管蛋白的聚合物,形成了直径约为25纳米的空心小管。生长锥的丝状伪足没有微管,但有肌动蛋白聚合物组成的微丝。微丝的直径约为6纳米,微管和微丝的长度可以增加或减少。微管具有极性,从而使微管蛋白被添加到最靠近生长锥的微管末梢。因此,轴突或树突的延伸需要在最靠近生长锥的微管末梢加入微管蛋白,而另一端的微管蛋白则极少或不被移除。微丝的情况也是如此,它的延伸依靠在丝状伪足的顶端添加肌动蛋白。
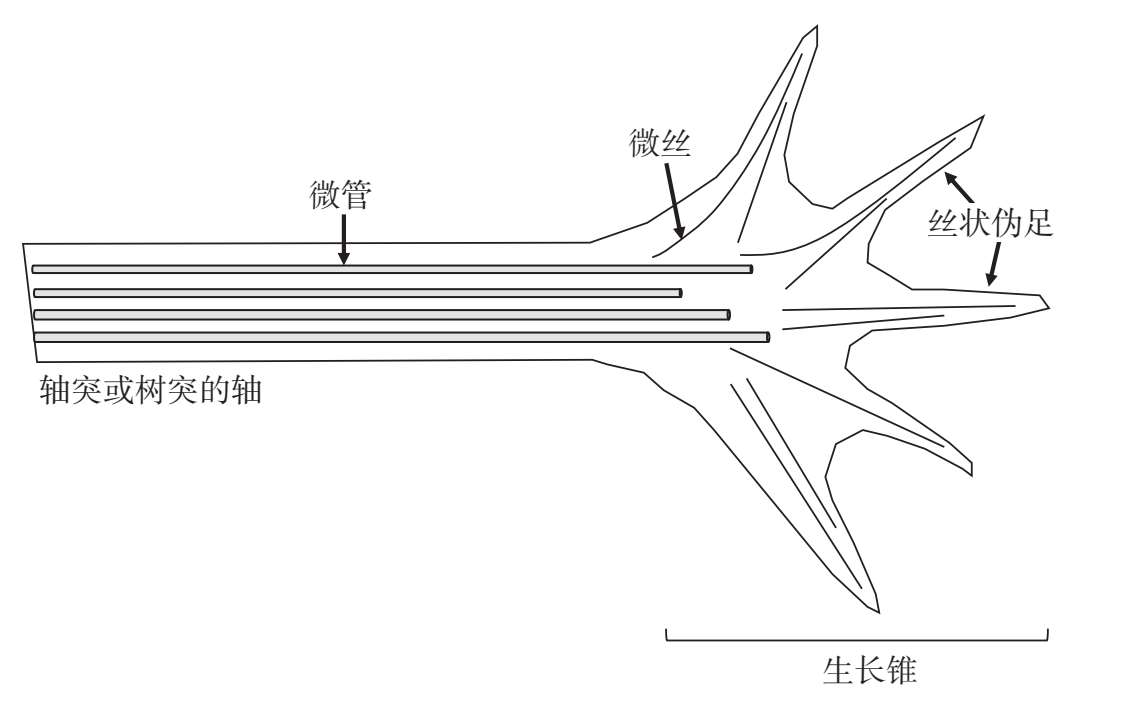
图3–1 生长锥的基本结构。生长锥位于生长中的轴突或树突的远端。它的形状像一只手,有一个像手掌的基部,从这里伸出“丝状伪足”的手指状结构。有两种蛋白质动态聚合物控制着轴突和树突的生长。由肌动蛋白聚合物组成的微丝控制着丝状伪足的伸缩,及其与其他细胞表面的黏附。生长锥与其他细胞或细胞外基质的相互作用决定了轴突或树突在生长过程中是转向还是形成分支。微管由微管蛋白聚合物构成,控制轴突或树突的伸长或缩短
生长锥负责确定轴突或树突的生长方向、生长速度及在何处形成分支。生长锥膜上的蛋白质可以吸附或脱离其他细胞表面或细胞外基质上的锚蛋白。生长锥膜上的一些细胞黏附蛋白与生长锥内部的肌动蛋白微丝相连。神经元细胞黏附蛋白与生长锥表面的锚定蛋白结合,可促使生长锥向该方向生长。生长锥两侧的丝状伪足可能会附着在锚蛋白上,从而形成分支。生长锥遇到的黏附蛋白不仅会影响轴突或树突的生长方向,还会影响它们的生长速度。
20世纪50年代初,丽塔·莱维–蒙塔尔奇尼与维克多·汉伯格在圣路易斯华盛顿大学工作时观察到,当将小鼠的癌细胞植入还在鸡蛋中生长的鸡胚胎时,发育中的小鸡体内的神经细胞生长得更快,并朝向肿瘤细胞生长。于是,莱维–蒙塔尔奇尼开发了一种细胞培养系统,将一小块背根神经节组织放在培养皿中。背根神经节中的神经元是感觉神经元,它们的轴突支配着全身的皮肤、肌肉、肌腱和其他组织。莱维–蒙塔尔奇尼和汉伯格发现,肿瘤细胞和某些正常细胞释放的一种扩散性物质可以刺激被培养的感觉神经元的轴突生长(Cowan 2001)。莱维–蒙塔尔奇尼将这种物质命名为“神经生长因子”(NGF)。研究者后来确定,NGF是一种蛋白质。
明尼苏达大学的保罗·莱图尔诺和他的同事们发现,被培养的感觉神经元的生长锥会向NGF的焦点源移动(Gallo, Lefcourt, and Letourneau 1997)。当生长锥的一侧暴露于NGF时,轴突就会转向该方向。他们发现,由于生长锥中的微丝聚合度增加,NGF导致了丝状伪足的形成。NGF还可能增强生长锥丝状伪足与细胞外基质中蛋白质的黏附力。
莱维–蒙塔尔奇尼发现唾液腺能产生大量的NGF。从进化的角度来看,这一点非常有趣,因为众所周知,许多动物都会舔自己的伤口。如果一只小鼠身上有伤口,其他小鼠甚至会帮它舔伤口。这种舔伤口的行为加快了小鼠伤口的愈合,有证据表明,这是因为唾液中的NGF在起作用(A. Li et al. 1980)。
自NGF被发现以来,其他蛋白质也被证明能够促进神经元的生长和存活。BDNF就是一种对大脑尤为重要的神经营养因子。BDNF等蛋白质由细胞核中染色体上的基因编码。编码BDNF的基因有两个拷贝,一个遗传自母亲,另一个遗传自父亲。为了确定BDNF是否影响及如何影响大脑的发育,科学家利用基因编辑技术使小鼠体内编码BDNF的一个或两个基因失效(被“敲除”)。当两个BDNF基因都被“敲除”时,发育中的胚胎就会死亡,只剩下一个初级大脑。当一个BDNF基因被“敲除”从而使小鼠的BDNF水平降低50%时,小鼠虽然能存活下来,但表现出行为异常,包括学习和记忆能力受损及过度焦虑。研究人员在检查这类小鼠的大脑后发现,大脑中多个区域的突触减少,海马的神经发生减少。有趣的是,BDNF水平降低的小鼠会暴饮暴食并变得肥胖,这是因为BDNF作用于下丘脑的神经元以抑制食欲。总之,来自小鼠的证据表明,BDNF对大脑发育至关重要,BDNF水平降低50%会对神经元网络的发育产生不利影响,导致行为异常(Vanevski and Xu 2013)。
细胞黏附分子和神经营养因子能帮助引导轴突寻找可以形成突触的神经元。那神经递质在大脑发育中起作用吗?
20世纪80年代,我在科罗拉多州立大学从事博士后研究时,发现谷氨酸在海马神经元网络的形成过程中扮演着重要角色。在我开展实验的时候,神经科学家们认为谷氨酸只是神经元之间突触的信号。为了弄清谷氨酸是否会在突触形成之前影响树突或轴突的生长,我从发育中的大鼠胚胎的海马中提取了神经元加以培养。在培养的前两天,这些神经元长出了一条长轴突和数个较短的树突(图1–2)。让神经元再生长几天后,我给它们拍照记录,然后在培养基中加入谷氨酸。在暴露于谷氨酸4小时、8小时和24小时后,我再次拍照记录。为了对比,我还拍摄了未接触谷氨酸的培养基中神经元的照片。
我做实验的时候数码相机还没有问世,因此我使用的是35毫米相机和黑白胶片。我会写下图片的顺序,冲洗胶片,然后使用放大机将神经元的图像投影到一张纸上。我描下了投射的神经元图像,还拍摄了一张“微型尺”的照片,用来计算轴突和树突的实际长度。总之,这是一个烦琐的过程,结果表明谷氨酸抑制了树突的生长,但对轴突的生长没有影响(Mattson, Dou, and Kater 1988)。当我在高倍放大镜下观察树突的生长锥时,我发现,在接触谷氨酸的前几分钟,丝状伪足会延伸。在随后的几个小时里,丝状伪足缩回,生长锥的顶端呈圆形,很像突触的树突棘。问题随之而来:谷氨酸如何影响树突的生长,又为什么不影响轴突的生长?
20世纪80年代中期,钱永健开发出荧光分子探针,使科学家们能够实时观察活细胞中的各种化学物质,他因此获得2008年的诺贝尔化学奖。他将其中一种分子探针命名为“Fura-2”,它能使细胞内的Ca 2+ 水平可视化(Grynkiewicz, Poenie, and Tsien 1985)。因为电生理学家已经证明,谷氨酸会让Ca 2+ 通过膜上的通道流入神经元,所以我决定使用Fura-2来观察海马神经元暴露于谷氨酸时,树突和轴突中的Ca 2+ 水平会发生什么变化。结果是,树突中的Ca 2+ 水平迅速增加,但轴突中的Ca 2+ 水平却没有增加。这可能是因为谷氨酸的受体位于树突膜中,而轴突中没有。Ca 2+ 的流入是谷氨酸影响树突生长的原因,因为使用药物阻断Ca 2+ 流入时,谷氨酸就不再影响树突生长(Mattson, Dou, and Kater 1988)。于是问题就变成:Ca 2+ 是如何对树突的生长产生影响的?其他实验表明,Ca 2+ 的流入会导致丝状伪足中的微丝快速聚合,随后抑制树突轴中微管的聚合。
谷氨酸影响树突生长的能力,促使我想知道它是否在大脑发育时神经元回路的形成过程中发挥了作用。为了回答这个问题,我采用了与丽塔·莱维–蒙塔尔奇尼类似的培养方法。我从一个被称为“内嗅皮质”的脑区中取出一小块组织(外植体)。内嗅皮质的谷氨酸能神经元轴突通常与海马的神经元形成突触。我想知道,这些轴突释放的谷氨酸是否会影响它们与海马神经元之间突触的形成(Mattson, Lee, et al. 1988)。我首先制造出了内嗅皮质外植体培养物,让神经元的轴突在外植体的细胞体向外径方向生长。然后,我将海马神经元放入培养物中,其中一些神经元长在内嗅皮质外植体中神经元的轴突上,另一些则附着在培养皿表面,离内嗅皮质轴突较远。我发现,生长在内嗅皮质神经元轴突上的海马神经元的树突比生长在培养皿表面的短。为了确定从轴突释放的谷氨酸是不是树突生长减少的原因,我用一种能阻断谷氨酸受体的药物处理了培养物。这种处理导致树突生长增加,证明轴突释放的谷氨酸会导致树突生长减少。
下一个问题是:从内嗅皮质神经元轴突释放的谷氨酸,是否会影响这些轴突与海马神经元树突之间突触的形成。我使用了一种染色方法,这种方法使我能够沿着树突纵向对突触加以观察和计数。结果显示,轴突释放的谷氨酸会促使突触形成。因此,谷氨酸不仅作用于突触,还在大脑发育过程中对这些突触的建立起作用。耶鲁大学的霍利斯·克莱因发现,谷氨酸在发育中的蝌蚪视觉系统神经元回路的组织中也起着关键作用(Cline and Constantine-Paton 1990)。因此,谷氨酸很可能在所有动物的神经系统中都发挥着雕塑神经元回路的作用。
克莱因和我的研究证明谷氨酸在大脑发育过程中对神经元网络的形成起着关键作用,在这之后,斯坦福大学的卡拉·沙茨等人证明,在感官输入大脑之前,啮齿动物的神经元回路中会出现自发活动。阻断谷氨酸受体和阻止神经元之间形成突触连接的药物则可以阻止这种自发活动。拉里·卡茨和卡拉·沙茨于1996年发表的一篇文章中总结了谷氨酸能神经元网络活动在实验动物大脑皮质中构建回路的机制:“在发育早期,内部产生的自发活动会根据大脑对功能和生存所必需连接的初始配置的‘最佳猜测’来雕塑回路。随着感觉器官的成熟,发育中的大脑对自发活动的依赖减少,对感官经验的依赖增加。自发产生的神经活动和依赖经验的神经活动依次结合,使大脑在发育和整个人生中不断适应动态变化的输入。”(Katz and Shatz 1996, 1133)
支持谷氨酸在大脑发育过程中对建立功能性神经元网络发挥作用的经验证据主要依赖于对小鼠和大鼠的研究数据,但彼得·柯万和他的同事们提供的证据表明,同样的机制也发生在人类身上(Kirwan et al. 2015)。他们用多能干细胞制造了人类大脑皮质神经元培养物,结果表明,神经元形成了大规模网络,其结构和功能特征与发育中的人类大脑皮质相似。具有振荡活动模式的谷氨酸能神经元网络在数周内形成。振荡的频率最初会增加,然后减少,最后呈现出组织化的活动模式。当谷氨酸受体(AMPA和NMDA受体)被阻断时,这些回路的构建及其持续的自发活动就会消失。事实证明,少数神经元接受的谷氨酸能输入量是其他神经元的4倍多。柯万等人认为,突触较多的神经元代表了协调大脑皮质持续活动模式的中枢神经元。这种由谷氨酸突触活动驱动的活动模式可能是使用头皮上的电极做脑电图(EEG)记录时所看到的电活动模式的细胞基础。人们认为,这些振荡是加强和微调整个大脑突触连接的一种机制。
对谷氨酸能神经元网络建立机制的发现,引发了一个令人困惑的问题。如果Ca 2+ 的流入是启动兴奋性谷氨酸能突触形成的信号,那么抑制性GABA能突触形成的信号又是什么呢?耶海兹克尔·本·阿里及其同事(2012)提供了一个可能的答案。在成熟的大脑中,GABA会使神经元超极化,因此不仅不会增加,甚至会降低突触后神经元中的Ca 2+ 水平。研究人员利用电生理技术记录了胚胎和出生后大鼠脑切片中海马锥体细胞对GABA的反应。他们发现,在胚胎和新生大鼠的脑切片中,GABA可使锥体细胞去极化。然后,在大鼠出生后第一周,神经元对GABA的反应从去极化变为超极化。进一步的实验为这一惊人的结果提供了解释。大鼠胚胎期神经元细胞内的Cl – 浓度较高,而在出生后早期大脑发育过程中,随着对GABA反应的转变,细胞内的Cl – 浓度随之降低。因此,在大鼠胚胎发育期间,当GABA能突触正在建立时,GABA具有去极化作用(即导致Cl – 从神经元流出),预计会导致Ca 2+ 流入。所以,钙可能是大脑发育过程中启动GABA能突触形成的细胞内信号。