




结晶学家认为,晶体的基本性质是指一切晶体所共有的、由格子构造所决定的特性。晶体的基本性质主要有:自限性、均一性、异向性、对称性、稳定性和定熔性等。晶体这些基本性质是非晶体物质所不具有的特性。
晶体的自限性亦称自范性,是指晶体在自然力作用和理想的条件下化学元素能自发地形成几何多面体外形的性质。这个性质可以用来解释为什么元素不同晶体的几何外形也不同。例如,在自然力作用和一定理化条件下,二氧化硅可以自发形成六方柱菱面体水晶;元素碳C可自发形成八面体的金刚石;元素铁Fe和硫S可自发形成立方体的黄铁矿等。这说明,晶体的形态不同,是元素不同和内部格子构造不同的外在表现。但应指出的是,自然界自发形成的实际晶体中,具有规则几何多面体的理想晶形并不多见,而常见的是不规则形态的歪晶。这说明,晶体在自然界中生长时会受到外界条件限制而呈现的不规则现象。可见,晶体的形态不同,既取决于化学元素和格子构造,也受到外部条件的限制。
晶体的均一性是指同一晶体的任何部位的质点分布是相同的,因而其物理和化学性质均具有相同的性质。这种性质也称为结晶均一性。
晶体的均一性由于来源于其组成质点的周期性重复排列,所以晶体各个部分的物理、化学性质都是相同的。我们把水晶晶体分割成许多小块,每一小块都具有相同的成分、光性、密度、导热性、膨胀性等。这主要是因为水晶是具有格子构造的固体,在其格子构造中各部分的质点分布相同。所以,同一晶体的任何部位都具有相同的性质,从而表现出晶体的结晶均一性。这个性质可以用来帮助我们区别不同矿物晶体。
需要指出的是,非晶体也具有均一性,如玻璃的不同部位的折射率、膨胀系数、热导率等性质方面都是相同的,但是其均一性是统计意义上、平均近似的均一性,称为统计均一性,与非晶体的液体和气体的统计均一性相似,但与晶体的结晶均一性有着本质区别。
晶体的异向性或称之为各向异性,是指晶体不同方向的质点排列距离不同导致物理性质随方向的不同而表现出略微差异的特性。晶体的解理、颜色和光学性质都有随方位而变化的特点,这是由于晶体同一格子构造中,在相互平行的方向上结点间距都是一致的,而不相互平行的一般是不一样的。如钻石在平行八面体晶面方向容易破裂,因此解理比较发育;碧玺在平行长轴和垂直长轴方向的颜色(红与绿)不一样;蓝晶石(亦称二硬石)的硬度,平行于晶体延长方向可用小刀刻动,摩氏硬度为4.5~5.5,垂直于晶体延长方向小刀则不能刻动,摩氏硬度为6~7,这是因为它们的方位不同;云母、方解石等矿物晶体,受到外力作用后,极易在某些方向上产生解理面,因为它们某些方向上解理发育;水晶的常光和非常光所产生的折射率值不同也可视为异向性。可见,晶体的解理、颜色、硬度和折射率值等差异都是晶体异向性的典型表现。
非晶体不具有晶体的异向性,一般只具有等向性。例如,玻璃各个方向的折射率值都是相同的。
对称性是指晶体中的相同部分或相同性质在不同方向或不同位置上有规律地重复出现的性质。如水晶晶体的外部形态上,常有相同的晶面、晶棱和角顶重复出现。这种性质称为晶体的宏观对称性。晶体的对称性不仅表现在宏观上,还体现在晶体内部结构微观上及其物理化学性质上。这是由于晶体内部质点在三维空间周期性平移重复排列是一种微观的对称性,所以晶体的宏观对称性是其微观对称性的体现。
对称性是晶体极其重要的性质,是晶体内部质点周期性重复排列的本质体现,因此也是晶体对称分类的基础(详见第五节晶体的对称)。
晶体的最小内能是指在相同的热力学条件下,晶体与同种成分物质的非晶体、液体、气体相比较,其内能最小。例如,水晶与玻璃在相同的热力学条件下比较,水晶的内能最小。内能包括质点的动能和势能。动能与质点所处的热力学条件有关,温度越高,质点的热运动越剧烈,动能越大;反之,温度越低,质点的动能越小。因此,不能用动能直接比较物体间内能的大小,可供直接比较的是质点间的势能。因为,在温度一定的情况下,势能决定物质内能的大小,而势能的大小取决于质点间的距离和排列方式。例如,水晶内部质点在三维空间呈周期性重复排列是质点间的引力和斥力达到平衡的结果,因此势能最小,内能也就最小。而石英玻璃的内部质点的排列是无序的,质点间的距离不等于平衡距离,因而它的势能比水晶大,内能也就比水晶的内能大。
晶体的稳定性是指在相同的热力学条件下,晶体与同种成分的非晶体相比较,晶体的状态最为稳定的性质。例如,水晶与石英玻璃在相同的热力学条件下相比较,水晶的状态最为稳定,这是由水晶内能最小决定的,也就是说水晶的稳定性是其内能最小的必然结果。从根本意义上说,水晶的稳定状态是其格子构造规律决定的,即格子构造中质点间引力和斥力达到平衡的结果。由于晶体是一个相对稳定的体系,所以水晶能历久弥新。而非晶体石英玻璃却做不到。
晶体的定熔性是指晶体在受热溶解时,具有固定熔点的性质。这种性质可以用物体的加热曲线来加以说明,如图2-4-1(a、b)。
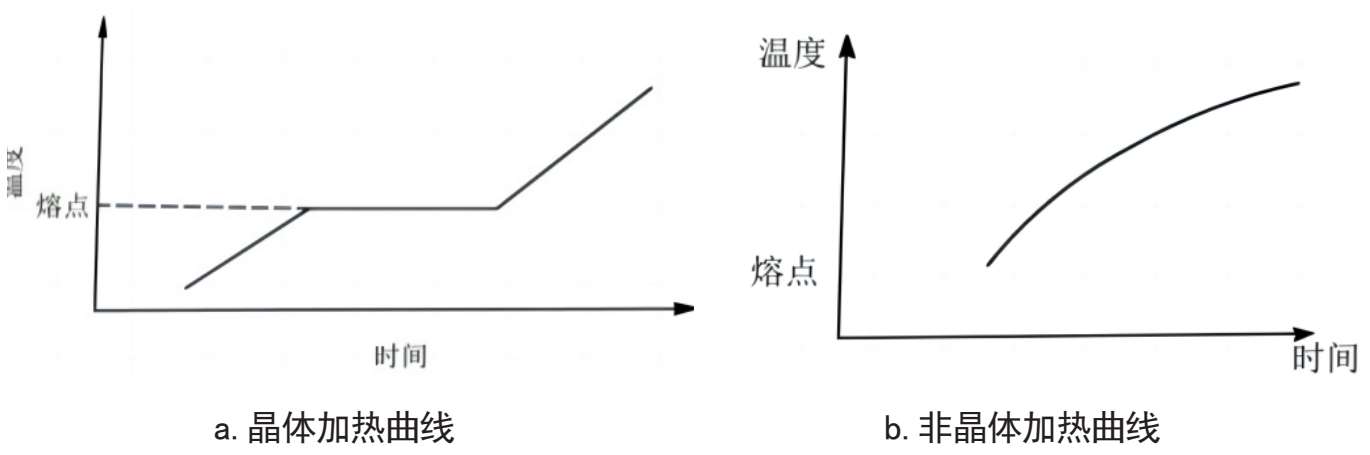
图2-4-1 物体加热曲线示意图
图(a)示意,当晶体加热时,开始阶段温度是随着时间的增长逐渐上升,当达到某一温度时,晶体出现溶解,而温度停止上升,此时所增加的热量,被用于破坏晶体的格子构造,直到晶体完全溶解,温度才又继续上升,加热曲线具一个平台的三段式折线。晶体在加热的过程中,停顿阶段的温度称为晶体的熔点。如水晶在加热过程中停顿阶段的温度为1713℃,即水晶的固定熔点。晶体在加热时,由于晶体中每个质点若要脱离平衡位置达到破坏格子构造,而所需的能量必须是相等的,因此每种晶体都有自己固定的熔点。
图(b)示意,非晶体与晶体完全不同,表现在整个加热过程中,温度始终是逐渐升高的,没有明显的停顿阶段,直到完全熔化,其加热曲线为一条光滑的曲线。说明非晶体加热时会随温度的升高逐渐变软,最后变成黏稠的熔体,不存在由固相向液相转变的突变点即固定的熔点。
可见,定熔性是区别晶体与非晶体的重要依据。同样,也是区别水晶与玻璃的重要依据。