




对合成化学家来说,一种高度可预测的连接反应的价值几乎是无穷无尽的!这也是理想中的反应,但是符合“点击”(click)要求的化学反应几乎凤毛麟角。在CuAAC反应的启发下,斯坦福大学的贝尔托西教授发展的张力诱导的环状炔与叠氮的环加成反应 [4] (copper-free click reaction),以及在材料化学领域已经取得广泛应用的巯基—烯加成反应(thiol-ene click reaction)也被科学家们认可。其中,张力诱导的环状炔与叠氮的环加成反应更是促成了生物正交化学领域的重大进展,化学家们甚至可以通过这种模式直接在生命体内进行人工可控的化学反应。例如,2020年,美国生物技术公司Shasqi依靠点击化学在人体内进行高效、专一的反应,其抗癌药物靶向肿瘤细胞疗法已进入Ⅰ期临床试验,这是首次在患者体内进行点击化学反应。同时,国际上一系列应用点击化学技术的试剂、药物、材料也已经成功地走向市场。
相比于药物化学目前最广泛使用的一系列连接反应,CuAAC反应的合成空间极大受限于叠氮化合物与端炔类化合物的可得性。简单地说,就是反应实现了,但是砌块却并不够。2019年,我们报道了一种重氮转移试剂氟磺酰基叠氮(FSO 2 N 3 ),解决了叠氮化合物的可得性问题 [5] 。在进行重氮转移反应时,FSO 2 N 3 可以在温和的水油两相条件下,无需金属催化剂,以接近1:1的形式,快速、正交地将一级胺官能团转化为对应的叠氮。该反应对于烷基、芳基、磺酰基取代的一级胺同样有效。FSO 2 N 3 在溶液中的使用相对安全方便,极高的重氮转移效率使得合成的有机叠氮产物并不需要分离纯化。从一级胺官能团分子砌块出发,模块化地在96孔板中建立一级胺的砌块库,一天内就可以在其中直接合成对应的叠氮砌块库。叠氮砌块库可以和端炔原位进行CuAAC反应,实现从前体端炔化合物出发,进行极大多样性的合成改造,不需要分离纯化,直接进行分子功能筛选。这种合成即得的模式,为加速发现药物先导化合物提供了一种有力的工具,该方法被命名为“模块化的点击化合物库构建方法”。
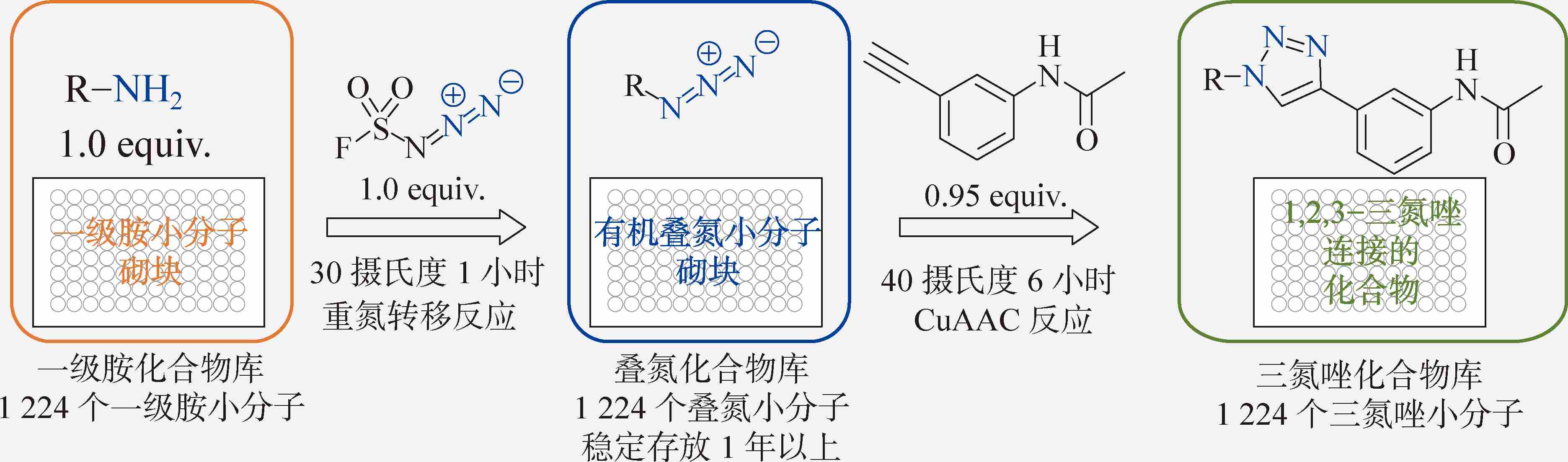
一种模块化的点击化合物库构建方法
2014年,沙普利斯小组又报道了与CuAAC反应不同的一类反应,称为“六价硫氟交换反应”(SuFEx) [6] 。这种新的反应利用的也是六价硫氟化学键具有独特高能,但在动力学上却极为稳定的性质。SuFEx在过去几年内得到了越来越多的关注和应用,被称为“第二代点击化学反应”。六价硫氟化合物作为亲电试剂,在与其他亲核试剂进行硫氟交换反应时具有独特的性质,即在特定条件下同时具备动力学上的高度稳定性和高度反应活性。我们称其为“边缘的酸碱反应性”(fringe acid-base reactivity),即一个简单易得且低极性的亲电官能团具有极高的化学稳定性,甚至可成为在生物体中不可被轻易活化的官能团,却同时可能具有极高的化学反应性,即在外加第三方诱导因素的条件下可被活化,与普通的亲核试剂进行高效的连接或者转化。这种独特的过程兼顾了选择性以及合成上的高效性。因此,六价硫氟交换反应的发现,提供了一个可用于多学科交叉创新的合成方法学。
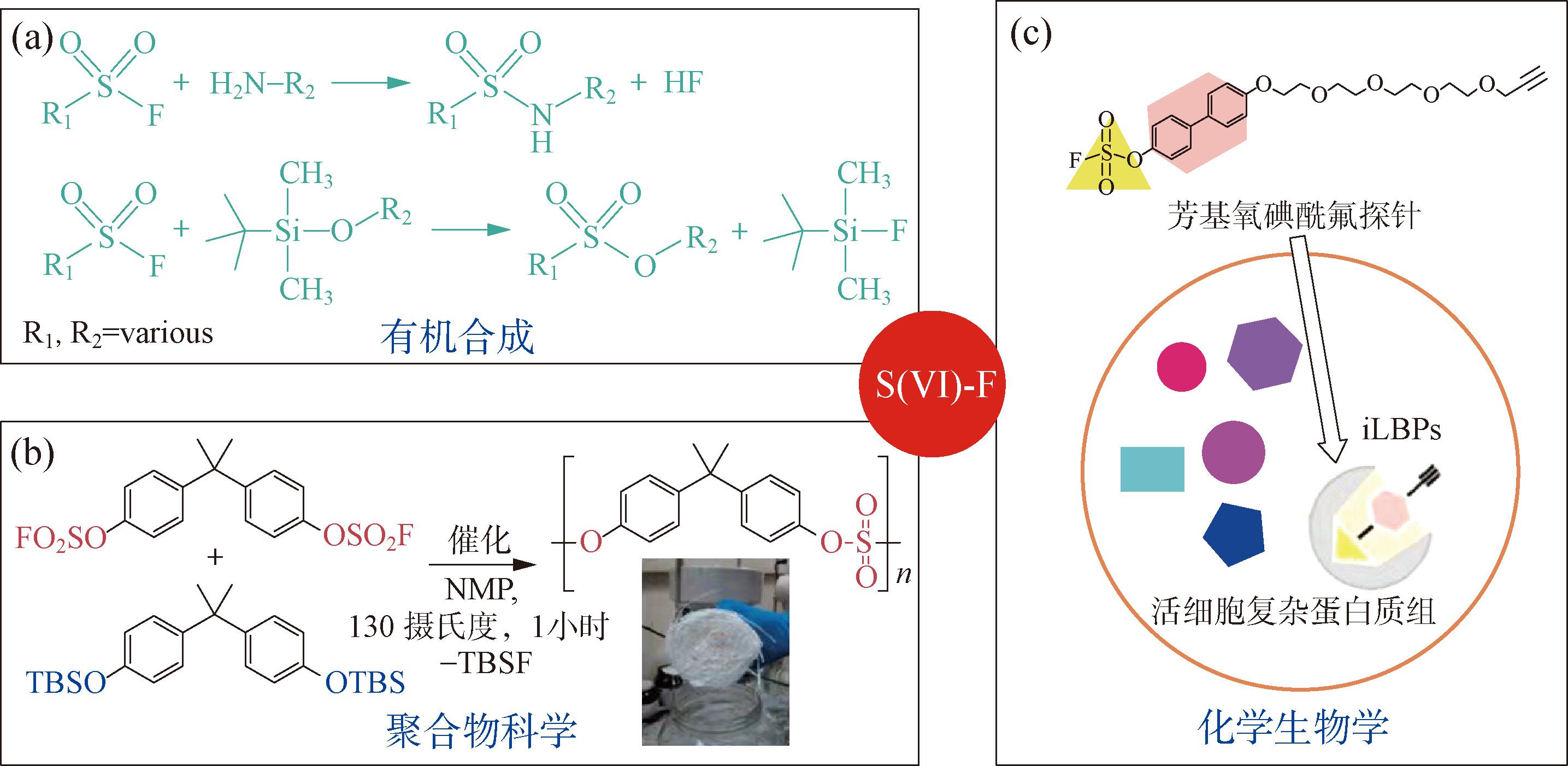
六价硫氟交换反应及其应用
目前,合成化学学科的发展日臻成熟,易得的物质、元素间基本的反应性以及可能且稳定的连接形式大多已经被反复深入研究,但是随着生命科学研究进入原子、分子尺度,体系与过程呈现极端复杂性,对生命过程的认知和调控也对传统的合成化学在效率和选择性方面提出了新的高要求,这些新的科学问题也将为合成化学家发现或者“再”发现新的化学反应性带来更多的机会。点击化学和生物正交化学正是在这样的时代背景下,走上了历史舞台,并带领化学进入了功能主义的时代。这个领域的成功故事将进一步启发新一代的化学家们去寻找有价值的化学反应性,并且在重要问题导向下将新化学反应性应用于学科交叉中。同时,这种简单实用,但针对重要科学问题的化学方法的成功毫无疑问将会影响合成学科未来的发展方向,在合成化学学科的发展历史上将具有划时代的意义。
[1]Kolb H C, Finn M G, Sharpless K B. Click chemistry: diverse chemical function from a few good reactions[J]. Angewandte Chemie International Edition,2001,40(11):2004—2021.
[2]Rostovtsev V V, Green L G, Fokin V V, et al. A stepwise Huisgen cycloaddition process: copper(Ⅰ)-catalyzed regioselective“ligation”of azides and terminal Alkynes[J]. Angewandte Chemie International Edition,2002,41(14):2696—2599.
[3]Tornøe C W, Christensen C, Meldal M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(Ⅰ)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides[J]. The Journal of Organic Chemistry,2002,67(9):3057—3064.
[4]Agard N J, Prescher J A, Bertozzi C R. A srain-promoted [3+2]azide-alkyne cycloaddition for covalent modification of biomolecules in living systems[J]. Journal of the American Chemical Society,2004,126(46):15046—15047.
[5]Meng G Y, Guo T J, Ma T C, et al. Modular click chemistry libraries for functional screens using a diazotizing reagent[J]. Nature,2019,574:86—89.
[6]Dong J J, Krasnova L, Finn M G, et al. Sulfur(Ⅵ)fluoride exchange (SuFEx):another good reaction for click chemistry[J]. Angewandte Chemie International Edition,2014,53(36):9430—9448.