




DNA由碳、氢、氧、氮、磷5种元素组成,基本组成单位是脱氧核糖核苷酸。脱氧核糖核苷酸又是由脱氧核糖、磷酸和含氮碱基组成,其中碱基有4种,分别是腺嘌呤(Adenine,A)、鸟嘌呤(Guanine,G)、胞嘧啶(Cytosine,C)和胸腺嘧啶(Thymine,T)。
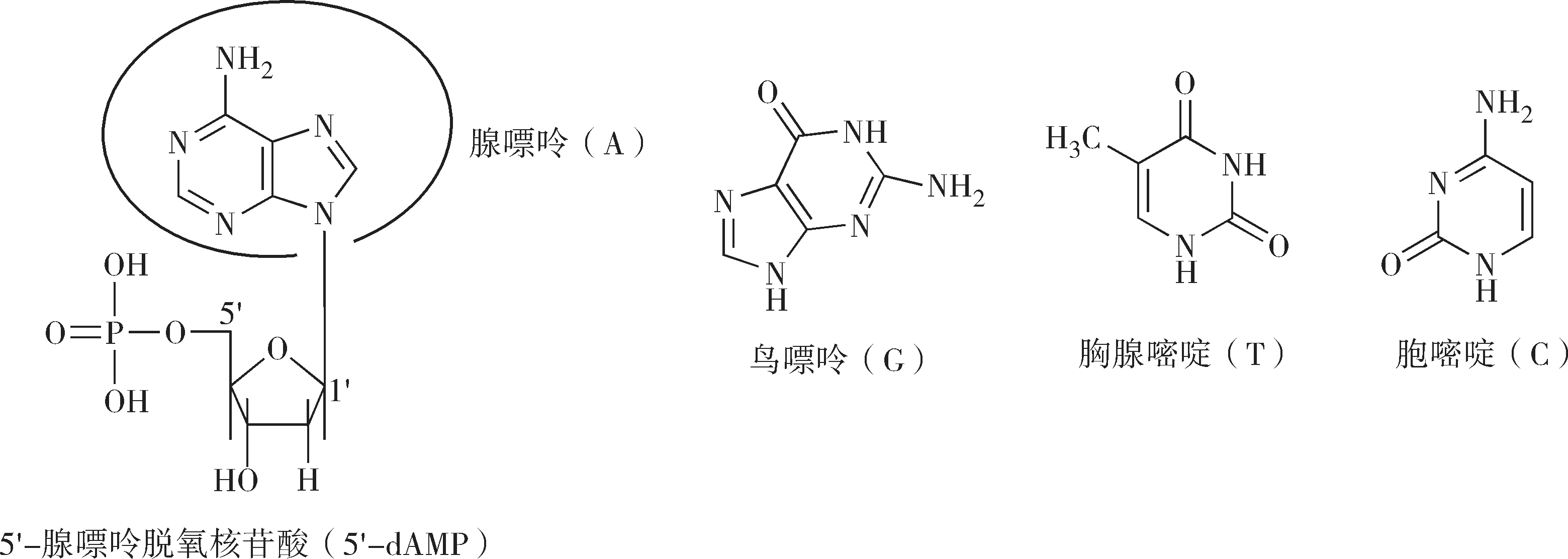
DNA是白色纤维状固体,为线性高分子。DNA微溶于水,呈酸性,易溶于碱性溶液,不溶于乙醇、乙醚和氯仿等有机溶剂。提取DNA时常用异丙醇或乙醇从溶液中沉淀DNA。DNA的黏度极大,当其变性或是降解后,黏度降低。
DNA既含有酸性的磷酸基团,又含有弱碱性的碱基,因此能够发生两性解离。溶液的pH值会影响DNA的解离状态。因为DNA中的磷酸基团酸性较强,使得整个分子相当于多元酸。DNA中的嘌呤、嘧啶都具有共轭双键,可以强烈吸收紫外光,在260nm处有最大吸收峰。
在过酸、过碱、加热等理化因素的作用下,DNA分子互补碱基对之间的氢键断裂,DNA双螺旋解链变成两条单链,即为变性(denaturation)。在DNA解链过程中,260nm处的吸光度增加,增加量与解链程度呈一定比例关系,称为DNA的增色效应(hypochromic effect)。增色效应能够衡量DNA变性的程度,当紫外光吸收值达到最大值50%时的温度称为DNA的解链温度(melting temperature, T m ), T m 值的大小与DNA分子中所含碱基的G+C含量相关,G+C含量越高, T m 值越高。
变性的DNA在适当条件下,两条互补链可重新恢复天然的双螺旋构象,称为复性(renaturation)。热变性的DNA在缓慢冷却时发生复性过程称为退火(annealing)。在复性的过程中,DNA溶液的 OD 260 值会减小,称为减色效应(hypochromic effect)。
DNA提取是中药分子鉴定中必不可少的步骤,从中药材中获取高质量DNA是后续分子鉴定的前提和基础。提取DNA的方法主要包括有机溶剂法、离心柱法和磁珠法。
1.有机溶剂法提取DNA的基本步骤和原理 有机溶剂法利用氯仿去除蛋白质和脂肪/脂肪油,用乙醇或异丙醇沉淀DNA,适用于大量DNA的提取(图2-1)。
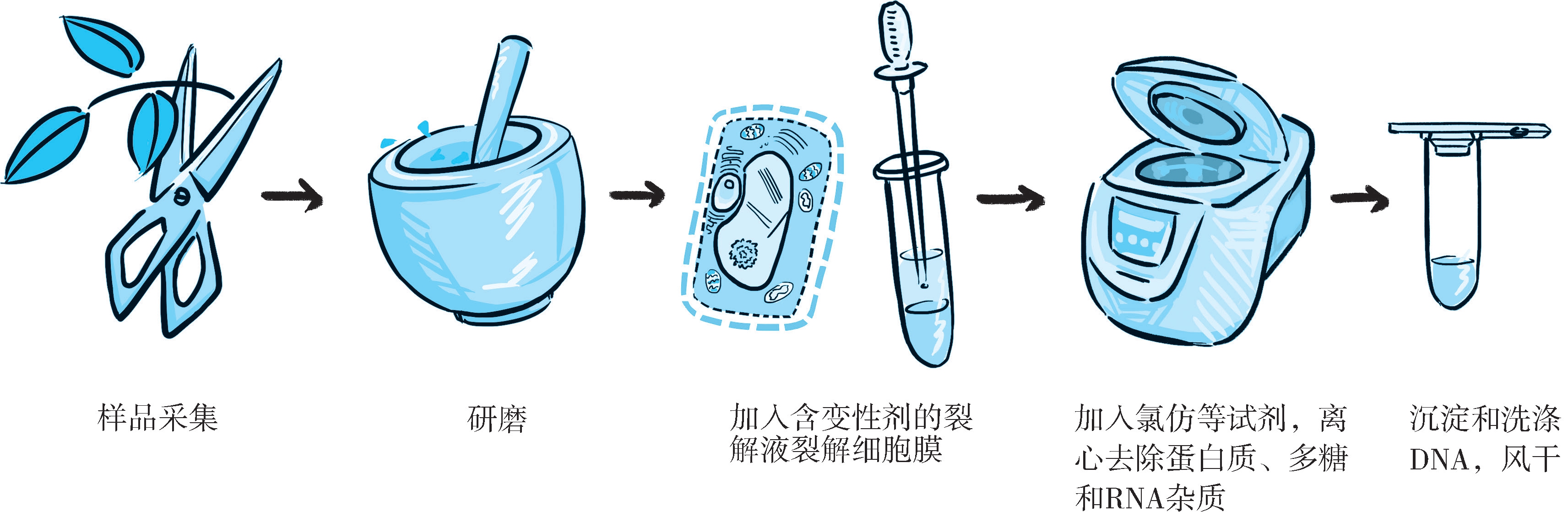
图2-1 DNA提取流程
(1)粉碎组织 样品材料进行破碎(及匀浆)可以提高裂解效率,组织破碎后可以充分与裂解液接触,利于裂解。不同来源的组织材料,根据组织成分的差异,样品处理的方式也有所不同。一般来说,样品的破碎方式主要有液氮研磨、匀浆和蛋白酶K消化。
(2)破坏细胞膜 有机溶剂提取法中,通常加入含溴化十六烷基三甲胺(cetyltriethyl ammnonium bromide,CTAB)或十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等表面活性剂的提取缓冲液温浴一段时间,破坏细胞膜,释放DNA到提取缓冲液中。CTAB和SDS这些表面活性剂还能够防止DNA被内源核酸酶降解,但不能去除蛋白质、多糖、酚类等杂质。因此,提取缓冲液中通常还包含乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA), β -巯基乙醇( β -mercaptoethanol)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)等成分用来去除杂质。动物组织还需加入蛋白酶K(proteinase K)进行消解。当DNA释放出来后,实验操作的动作要轻,因为剧烈震荡会打断溶液中的DNA,破坏其分子的完整性。
(3)去除杂质
①蛋白质和RNA的去除:温浴结束后,加入氯仿∶异戊醇(24∶1)混匀后离心,吸取上清液,以达到去除蛋白质和细胞碎片的目的,其中氯仿能够使蛋白质变性,还有助于水相与有机相分离,去除植物色素,加入的少量异戊醇则能够减少抽提过程中气泡的形成;还可以使用苯酚与氯仿混合液来去除蛋白质。此步骤可根据实际情况重复进行2~3次。如需去除RNA,可以在第一次吸取的上清液中加入RNA酶(RNase)。
②多糖和淀粉的去除:如果提取物中多糖和淀粉含量高,可以利用其与DNA在不同盐溶液中的溶解性差异,达到去除多糖类杂质的目的。如利用CTAB法提取DNA时,可以增加CTAB提取缓冲液中盐的浓度。高盐溶液可以增加多糖和淀粉在异丙醇或乙醇中的溶解度,从而使DNA优先沉淀,达到有效去除淀粉和多糖的目的,同时可延长破坏细胞膜步骤中的温浴时间,有助于DNA从细胞中释放。氯苯可以与多糖的羟基作用除去多糖,因此可以在DNA的提取缓冲液中加入0.5体积的氯苯;另一种方法是在氯仿和异戊醇(24∶1)抽提后的水相中加入一半体积的5mol/L NaCl,然后再加入异丙醇或乙醇沉淀DNA,使多糖仍溶解在高盐溶液中而被去除;还可以利用糖苷水解酶水解多糖以达到去除杂质的目的;而市售的DNA纯化试剂盒则多采用柱层析法去除多糖类杂质。
③去除酚类物质:在DNA提取缓冲液中加入防止酚类氧化的试剂,如 β -巯基乙醇、抗坏血酸、半胱氨酸、二硫苏糖醇等。这些试剂能够通过提供巯基和酚类物质竞争氧,防止酚氧化成醌。其中,最常用的是 β -巯基乙醇。在一些多酚含量高的样品中,加入的 β -巯基乙醇浓度可高达5%。同时还需要加入易于和酚类结合的试剂,如PVP、PEG(聚乙二醇)等,利用它们与酚类物质结合力强并能形成不溶性络合物的性质,达到去除杂质的目的。值得注意的是,所有抗氧化剂都要在研磨前单独加入,否则无效。
(4)沉淀和保存DNA 在吸取的上清液中加入异丙醇或乙醇沉淀DNA时,如能观察到白色的细纤丝及纤维团状的DNA,可用吸头将其轻轻绕住并取出洗涤,可得到比离心沉淀法纯度更高的DNA,更能有效地去除杂质。如果析出的DNA量少,则需要离心沉淀后洗涤。如果下游操作对DNA的纯度要求较高,还需要进行纯化,纯化的方法可以通过DNA纯化试剂盒或是氯化铯密度梯度离心的方法来完成。洗涤好的DNA风干后,可以溶解在去离子水或是TE缓冲液(含10mmol/L Tris-HCl和1mmol/L EDTA,pH8.0)中,-20℃保存。
除了上面的CTAB法和SDS法,快速简便的碱裂解法在中药材DNA提取中的应用也越来越广泛。药材粉末在0.2~1.0mol/L的NaOH或KOH溶液(含PVP、Triton X-100等添加剂)中裂解,蛋白质和DNA发生变性,当加入中和液(0.1mol/L Tris-HCl,pH8.0)后,DNA分子能迅速复性,呈溶解状态留于离心后的上清液中,然后可吸取上清液作为DNA模板溶液直接进行PCR。碱裂解法具有方法简单、操作步骤少、不需要使用苯酚等有毒试剂的特点,可用于中药材DNA的快速提取。
2.离心柱法提取DNA基本原理及过程 离心柱法提取DNA的原理是利用了DNA在高盐条件下能被离心柱中二氧化硅特异性吸附,在低盐溶液中与DNA解离的特征,可最大限度地去除杂质,不需要乙醇沉淀DNA,操作简便快速,适用于常规研究中适量DNA的提取。
(1)将样品进行充分研磨粉碎后,转移到装有预热裂解液的离心管中进行温浴。温浴过程中可多次颠倒离心管进行混合。
(2)温浴结束后加入氯仿并进行低温离心,取上清液加入含有适当盐溶液与pH值缓冲液的离心管中,使DNA吸附在离心柱上,反复重复此操作,以保证DNA完全吸附于柱中。
(3)使用漂洗液进行洗脱。
(4)溶解样品。
3.磁珠法 磁珠法的原理是在磁珠表面修饰对核酸有吸附作用的特定活性官能基团,同时利用磁珠自身的磁性,在外磁场的作用下可以方便地实现定向移动与富集,从而达到核酸与杂质分离的目的,进而实现对目标物质的分离纯化,获得纯化核酸。
以上方法在具体应用中,可根据生物样品的不同,对温浴时间和试剂浓度做一定的调整和改进,以便获得更好的结果。
1.新鲜的植物材料 新鲜采集的植物材料先用水快速清洗,去除表面的泥土和尘埃,用滤纸吸干表面水分,放入盛有液氮的研钵中研磨。体积较大和含水量较高的植物材料可用剪刀剪成小块再放到液氮中研磨,也可将小块样品直接放入离心管中,加入提取缓冲液、石英砂和抗氧化剂(如 β -巯基乙醇、PVP等),用研棒研碎后马上水浴提取。如样品采集地与实验室距离较远,可在采集袋中加入硅胶干燥剂快速干燥新鲜样品,防止DNA降解,然后带回实验室提取DNA。
2.干燥的植物药材 由于中药材多为干品,容易出现DNA降解严重等结果,相对新鲜样品更难提取。通常根和根茎组织中多酚、多糖含量高,在研磨时多酚极易氧化成醌类,使DNA带有一定颜色,在纯化过程中很难去除,影响后续的PCR,因此要注意多糖、多酚的去除。提取时水浴时间一般为90分钟,对于质地坚硬的,可以延长水浴时间并降低水浴温度,如56℃水浴8~12小时,使得DNA充分释放到缓冲溶液中。此外,根茎类药材富含纤维和淀粉等物质,需加大样品量才能提取到足量DNA,可用大容量离心管(5mL或15mL)抽提。皮类中药材组织中富含薄壁组织和纤维等,加液氮不易研磨成细粉,需适当增加样品量,同时应增加 β -巯基乙醇和PVP的使用量。叶、花、全草类药材如保存时间较久可适当增加水浴时间,降低水浴温度,如可以56℃水浴8~12小时。果实及种子类中药材中多富含油脂,研磨时易被氧化,且易黏着在研钵壁上,损失较大,提取时需增加样品量。另外,对研磨后的材料可用丙酮浸提,去除脂溶性酚类化合物。
3.动物类药材 肌肉类动物药材,如海龙、蛇类、蛤蚧等,需使用75%乙醇擦拭表面,消除外源性污染,待乙醇挥发后进行充分研磨。含有脂类较多的动物内脏器官,如蛤蟆油,首先用不含蛋白酶K和SDS的缓冲液浸泡药材,SDS在55~65℃条件下能裂解细胞,释放出核酸;然后在消化缓冲液中增加SDS含量,有利于脱去脂类。角甲类药材,如龟甲、鳖甲和鹿茸等,由于DNA含量较低,样品量要适当增大,也可用大容量离心管抽提。壳类药材,如石决明、瓦楞子、蛤壳等,由于存在共生或寄生生物,提取前需去除。
纯的DNA沉淀为白色,干后透明。若干后是白色,则说明蛋白质类杂质较多;若呈黄色至棕色,则含有多酚类杂质;若呈胶胨状则含有多糖类杂质。DNA质量检测方法通常有以下两种:
1.紫外分光光度法 DNA在260nm处有最大吸收峰,蛋白质在280nm处有最大吸收峰。测定DNA溶液在波长260nm和280nm处的吸光度,以 OD 260 / OD 280 比值判断其纯度,以 OD 260 值计算其浓度。在低盐的弱碱性缓冲液中(如10mmol/L Tris-HCl,pH7.5), OD 260 / OD 280 比值在1.8~2.0说明DNA纯度高,过高说明含有RNA杂质,过低则说明DNA中含有蛋白质杂质。对于双链DNA,在低盐的中性缓冲液中(如10mmol/L Tris-HCl,pH7.0), OD 260 =1.0时DNA溶液浓度为50μg/mL,DNA样品浓度(μg/μL)= OD 260 ×样品稀释倍数×50/1000。
2.琼脂糖凝胶电泳法 如果存在RNA或非核酸杂质的干扰,通过紫外分光光度法测算的数据可能和真实值差异较大。使用琼脂糖凝胶电泳法观察DNA条带则更加直观。将电泳后的凝胶放在凝胶成像系统中观察,可清楚观察到杂质的有无。凝胶分析软件还可比较样品DNA和DNA分子量标准(DNA marker)的亮度,并对样品DNA进行粗略定量。