




早在20世纪70年代,当伯格重组DNA获得成功之后,科学家就把基因工程开发研究的重点放在基因制药之上。由于生化药物往往对人体有特殊效力,而化学上又难以合成,传统上生产生化药物的原材料,一般都是取自生物体的细胞、组织、脏器、血液、尿液等,因而资源不足、分离提取产率低便成了某些生化药物供不应求的主要原因。有些生化物质由于在生物体内含量甚微,分离提取十分困难,无法形成商品出售。自从人类应用DNA重组技术生产生化药物之后,上述的难题就迎刃而解了。现在已上市或正在开发的基因药物品种都达到了十分可观的程度,而且也是市场上最大宗的生物技术产品。人类基因组计划取得了重要的进展,又极大地促进了基因制药业的发展,到2001年人类基因组计划研究就为人类提供了3 000多个可用于制药的基因。
制药行业本来就是日不落行业,只要世界上有人,就会有病,人就得吃药。据报道,自1982年美国研制的重组人胰岛素上市以来,基因药物在医药行业里所占的份额就在不断扩大。特别是20世纪90年代以来,全世界生物技术药物(其中主要是基因药物)的销售额就以年均30%的速度增长。1995年生物技术药物占整个医药行业销售份额尚不足4%,但是2000年就提高到9%,预计2003年会提高到10%以上。从全世界生物技术药物销售额来看,1992年销售额不足50亿美元,到2000年就猛升到300亿美元,预计到2003年将上升到600亿美元。正因为这些显而易见的原因,基因制药已成了人们投资、并购的新热点,也是各个国家经济发展新的增长点。
在基因制药的激烈竞争中,美国一直处于领先地位。由于美国在生命科学基础理论研究方面投资最多,因此他们出的基因药物原创性成果也是最多;每年在基因制药行业投入的资金达100亿美元以上;目前已批准上市的和正处于临床试验阶段的基因药物种类也最多。据报道,到2000年底FDA(美国食品和药品管理局)已批准了116种生物技术药品和疫苗上市,2001年上半年FDA又批准了27种,正在进行临床试验的有369种。而且美国无论是生物技术公司的数量还是生物技术药物和疫苗销售额,都占世界总量的2/3。2001年初其公司总数约2 000家;2000年生产的药物和疫苗价值200亿。同时,生物技术制药也是高新技术股中的领头羊,美国约有300家生物技术公司上市,2000年其市场资本总额已达3 308亿美元。
中国由于在基础理论研究方面投入资金不足,基因药物以仿制为主。据统计,全国有生产基因药物和疫苗能力的公司有60余家,2000年底上市的品种有21种,其中重组α-1b干扰素(IFNα-1b)、重组牛碱性成纤维细胞生长因子(γ-bFGF)和重组链激酶(γ-sk)三种产品具有自主知识产权;临床试验品种30余种,年产值30亿元人民币。自20世纪90年代中期以来,中国基因药物和疫苗的年销售增长速度也在30%以上,达到世界增幅平均值。
基因药物研发要经过外源基因制备、基因体外重组和引入受体细胞表达三个步骤,表达产物经过分离提纯后,就是人们所希望得到的基因产品。
1.外源基因就是指人们所希望得到的那种生化药物的基因,它可以通过人工合成或酶促合成方法获得。比如人胰岛素基因就是用人工化学方法合成的,科学家先把整个基因分成29个DNA片段分别合成,然后再把它们连接起来。当时由四位科学家工作了三个月就把整个基因合成出来了。酶促合成方法则是利用反转录酶在某种mRNA模板上合成出互补的DNA链,脱去mRNA后得到的单链DNA,在DNA聚合酶作用下,可合成出双螺旋的DNA链,即我们所希望得到的基因药物表达序列。
2.基因体外重组。把所得到的表达序列要与高效的表达元件(序列)相连之后,再与某一克隆载体连接,这样的“复合体”就能顺利地穿入宿主细胞内,并且能逃过宿主细胞内限制性内切酶的破坏。常用的克隆载体有质粒(细菌等染色体外环状DNA)和噬菌体(细菌的病毒)。1969年科学家所发现的限制性内切酶是一种基因剪刀,不同的限制性内切酶可以识别一定的碱基序列部位将DNA切开,把几个不同物种的DNA重组在一起。在基因制药中,高效表达元件的设计及其良好的调节控制系统显得十分重要,它决定了外源基因表达产物的数量。在近十几年来,我国科学家已成功研发出多种拥有自主知识产权的高效表达元件。
3.引入受体细胞表达。受体细胞就是外源基因表达载体,对它正确选择与否也关系到基因制药的成败。比如把人胰岛素基因导入大肠杆菌体内表达时,由于原核细胞内缺少二硫键异构酶,得到的基因表达产物还必须进行二硫键重构。此外,原核细胞中既不具备真核细胞的启动基因,也不具有剪切真核细胞基因中含有的非编码DNA片段的酶;新合成的肽往往要连接上寡糖链才具有生理活性,而原核细胞却不具有这种功能。因此,科学家就改为选择酵母菌、昆虫培养细胞或哺乳动物培养细胞等真核细胞作为表达载体。我国科学家现在已建立起了多种拥有自主知识产权的表达载体。
由于质粒本身具有自我复制能力,质粒复制时与它相连的外源DNA也就随着增殖。当然有的外源基因可能嵌入受体细胞染色体中共同复制。如果在1升培养液中接种入10万个大肠杆菌细胞,在37℃下培养400分钟,那么每毫升培养液中就含有10亿个大肠杆菌,即每升培养液中增殖106亿个大肠杆菌。要是一个大肠杆菌中的质粒,由一个增殖到3个,这就意味着总共可获得我们需要的基因3×106亿个,这种基因拷贝增殖称为基因克隆。如果外源基因插入的方向与载体上启动子作用方向一致,并且插入的位置又合适,那么外源基因在受体细胞中就能够得到表达,我们也就能得到相应的基因药物。(图3-1)
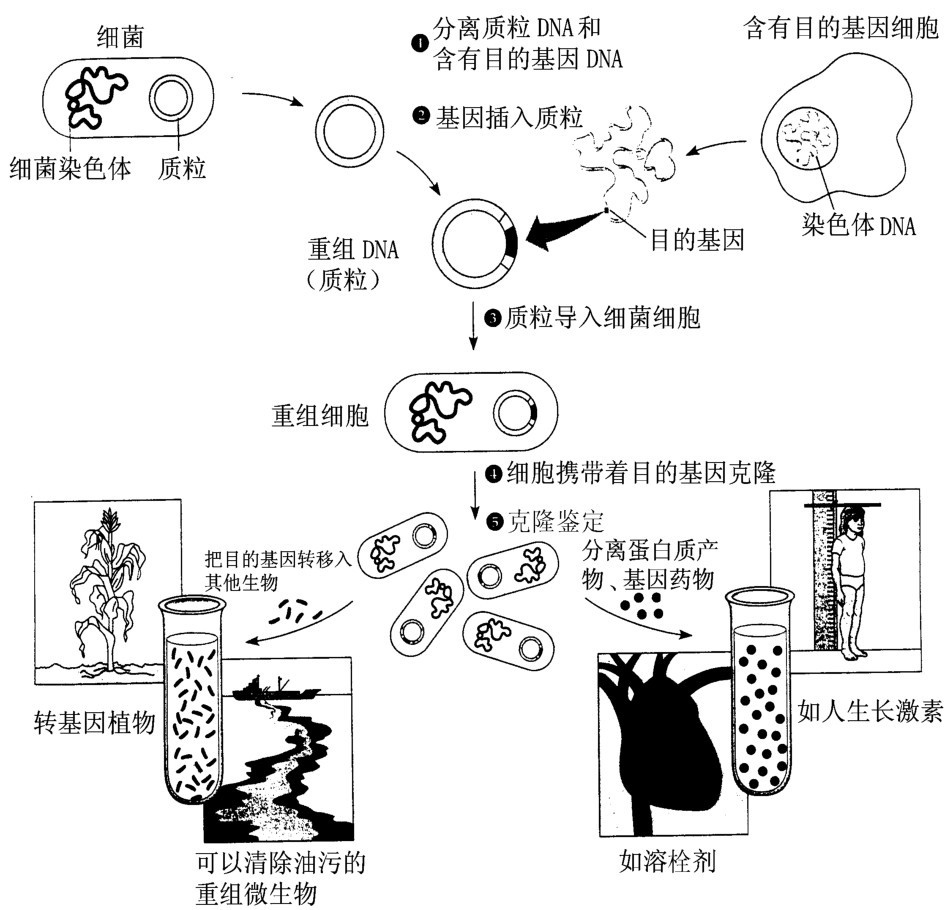
图3-1 基因制药及转基因生物
(引自campbell等,1999)
基因药物是基因工程开发研究的最早领域,也是市场上最大宗的生物技术产品。从20世纪70年代末以来,基因制药发展势头锐不可当,研制的药物几乎涉及到治疗所有疾病范畴。
1992年世界年销售额排前五位的基因药物分别是:EPO(促红细胞生成素),12.25亿美元;乙型肝炎疫苗,7.42亿美元;HuGH(人生长激素),6.25亿美元;HuIFN-α(人α-干扰素),6.05亿美元;CSF(细胞集落刺激因子),5.44亿美元。到1997年仍是这五种基因药物排在前5位。此后它们的销量仍是不俗。
EPO是一种糖基化的蛋白质。已知EPO是通过与祖红细胞表面受体蛋白结合,促进细胞内血红蛋白的合成,并进而使祖红细胞发育分化成红细胞。由于再生障碍性贫血症患者组织严重缺氧,因此患者血液中EPO含量要比正常人高上千倍。1975年科学家首次从再生障碍性贫血症患者的尿中分离纯化得到EPO。1985年人EPO基因被克隆出来了,并在表达体系中得到了EPO。1989年美国FDA批准人EPO可以投放市场。由于基因药物EPO对于因体内EPO下降的贫血病有特殊疗效,因此在临床上主要用于治疗肾衰所引起的肾性贫血。
目前全球乙型肝炎病毒携带者近4亿,其中25%~40%的患者将死于肝硬化或肝癌。中国是乙型肝炎高发区。现在全国约有1.3亿人已成为乙型肝炎病毒表面抗原携带者,约有1 500万人为慢性乙型肝炎患者,每年有30万人死于肝功能衰竭。中国每年用于肝炎和肝病的医疗、保健费用高达1 000多亿元。乙型肝炎病毒具有极大的传染性,因此用减毒的或灭活的病毒做疫苗,都是不安全的。临床试验已经证明,从乙型肝炎病毒携带者血清中分离出的乙肝病毒表面抗原(HbsAg),作为血清疫苗具有预防乙型肝炎的作用。若用这种办法制作乙型肝炎疫苗,由于血源有限,以及令人生畏的艾滋病等由血源传播的疾病流行,显然是既不安全,价格亦不菲,因此很难具有实用价值。现在科学家将控制乙型肝炎病毒表面抗原基因(一般是无毒性区域)插入到病毒基因组中,如家蚕核型多角体病毒,而构建起重组病毒,然后再用这种重组病毒感染表达体系(如大肠杆菌、家蚕细胞、酵母菌和哺乳动物培养细胞等),使HbsAg基因得到表达,这样在培养细胞中就可以得到重组的乙型肝炎病毒表面抗原基因表达产物,它是一种糖基化蛋白质,与病毒携带者血清中的乙型肝炎病毒表面抗原一样。把它注射入健康人体后,就可产生出相应的抗体,从而达到预防乙型肝炎的目的。现在这种乙型肝炎疫苗已在我国中、小学生和青年人群中有计划地接种。由于乙型肝炎疫苗的接种,我国每年新增的乙型肝炎感染病例已从1980年的26万人,降到2001年的7.8万人。中国科学家还发现,乙型肝炎表面抗原的特异性抗体二重复合物能有效消除乙型肝炎表面抗原的免疫耐受性,使人体产生免疫应答,消除病毒,达到治疗目的。这种治疗性乙型肝炎疫苗不仅已获得我国专利,而且已进入产业化开发和临床试验阶段。
人生长激素是由腺垂体分泌的、含有191个氨基酸的多肽。人生长激素可以促进骨骼、软骨的生长;促进软组织生长;对蛋白质、脂肪、糖的代谢都有调节作用。人幼年时如生长激素分泌不足,可能出现侏儒症状;若分泌过多时,由于全身各部分过度生长,则会出现巨人症。倘若成年后生长激素分泌过多时可能出现肢端肥大症和内脏肥大症。人生长激素是一种治疗侏儒症的有效药物。
由于生长激素具有高度的种属特异性,其他动物的生长激素对人体往往不产生生理效应,因此传统上生产人生长激素的惟一材料是人尸的脑下垂体。600具人尸的脑下垂体的提取物,大概只够治疗一位侏儒症患者。1979年科学家合成出了完整的人生长激素基因。随后他们把这段合成的基因与质粒连接,引入大肠杆菌中表达,结果在每升发酵液中可以提取到2毫克人生长激素,相当于在每一个大肠杆菌的细胞中可以合成出18.6万个人生长激素分子。
干扰素是细胞受到病毒感染后产生的一类蛋白质。由于干扰素在某些病毒RNA存在时,可以抑制细胞的蛋白质生物合成,从而使病毒的繁殖受到遏制,因此,干扰素在临床上就成了一种治疗病毒病的有效药物。特别是在某些病毒可诱发癌瘤的“病毒致癌学说”为相当一部分人接受之后,人们对干扰素寄予了更高的期望。研究证实,实际上病毒致癌要比人们所预料的要严重得多。临床上已经把干扰素当作广谱抗病毒、抗肿瘤的药物和免疫调节剂使用,比如α-干扰素-2a可应用于治疗慢性骨髓性白血病、艾滋病患者中的卡波济氏肉瘤、肾细胞癌、恶性黑色素癌、乙型及丙型肝炎等。α-干扰素-2b也在治疗肝炎中获得很大成功。
人干扰素有α、β、γ三种类型,同时它还具有种的特异性,由人细胞产生的干扰素只对人有效。由于人的α-干扰素主要是由人白细胞产生,β-干扰素主要由成纤维细胞产生,γ-干扰素由T细胞产生,所以过去人α-干扰素一直是从人血中提取,不但原料难得,而且产生率极低,从每升人血细胞中大约只能提取到0.5微克α-干扰素,因此它的价格十分昂贵。现在可以应用重组DNA技术,将人α-干扰素基因插入到质粒中,然后再将这种重组体导入大肠杆菌或酵母菌体内,进行大量增殖、表达。这样就可以获得与从人血细胞中所得到的同类型的干扰素,从而大幅度降低了成本。1986年美国FDA批准了干扰素αⅡa、αⅡb投入市场之后,现在已有近60个国家批准基因工程人干扰素上市。90年代初,我国研制的基因工程人α-干扰素αⅠb型和αⅡa型已实现了工业化生产。其中αIb型是我国首创,它更适合黄种人使用,主要用于治疗乙型肝炎、丙型肝炎等病毒性疾病,疗效显著,副作用低。α-干扰素也是中国第一个经国家批准生产的基因工程药物。
细胞集落刺激因子是一组重要的造血调控因子。它们在化学组成上都是糖蛋白,其中各个成员的差异就在于对造血祖细胞克隆增殖的作用不同。研究颇多的人粒细胞-巨噬细胞集落刺激因子(hGM-CSF)就是由T淋巴细胞分泌的活性因子,其主要作用是刺激造血祖细胞从静止期进入S期,并进而分化成粒细胞和巨噬细胞。显然天然的hGM-CSF来源是极其有限的,产量也甚微。现在将hGM-CSF基因在体外进行重组后,引入表达体系(细胞)中已可大量地生产出重组的hGM-CSF。近几年在用基因工程方法生产的药品市场上,重组hGM-CSF的销售额一直名列前茅。这是由于hGM-CSF在临床上可用于治疗由各种原因引起的白细胞减少症患者,比如艾滋病患者、接受化疗的癌症患者、接受骨髓移植的癌症患者、周期性白细胞减少症、先天性白细胞减少症、再生障碍性贫血等令人望而生畏的顽症。
心脑血管栓塞是严重威胁中老年人生命安全的疾病,因此溶栓剂的研究开发也一直是基因制药主攻方向之一。从溶栓剂开发至今可分为三代。
一般把链激酶(sk)和尿激酶(uk)称为第一代溶栓剂。这些药物疗效虽好,但是却缺乏纤维蛋白选择性,可造成纤溶酶过量激活,产生全身性出血危险,反复使用链激酶还可使患者出现过敏反应。由于副作用较大且难以克服,这类药物现在已被淘汰。
科学家进一步研究开发出第二代溶栓剂,如组织纤溶酶原激活剂(tPA)、尿激酶原(pro-UK)和纤溶酶原链激酶激活剂复合物(APSAC)。其中tPA最具代表性,它对血纤溶酶原具有特异的结合活性,此酶原被激活成血纤溶酶后,这种酶可以把新生成的血栓溶解掉,并且出血副作用小。此外,在某些病人的血液中,由于血纤溶酶原激活剂的抑制剂(PAI)含量过高,也可造成血栓,而tPA在一定程度上也可用于治疗这类病人。基因药物tPA上市伊始,好评如潮,认为重组tPA疗效最佳、最安全。1992年仅美国tPA产值就高达1.8亿美元。但人们发现它也有不尽人意之处,比如患者中出现死亡、中风或心脏病复发的比例高达23.2%,其中心脏损伤程度平均为19.4%,因此造成了销量下降,1997年比1992年大概下降了50%以上。
第二代溶栓剂虽然比第一代有所改进,但是仍然不理想。于是科学家又利用蛋白质工程(根据人类的应用目的,设计并生产出具有优于天然物功能的蛋白质)手段开发出第三代溶栓剂,比如重组tPA(rtPA)、重组型葡萄球菌激酶(STAR)和单链尿激酶型纤溶酶原激活剂(scu-PA)等。科学家对tPA分子中的某些特定氨基酸残基进行定点突变,该tPA突变体“对血纤维蛋白专一性竟增强了14倍,抗PAI-1能力提高了80倍,体内被清除速率降低了10倍,并减少了预凝集效应。”它不但提高了对血栓的选择性,并具有良好的抗凝血酶和抗纤溶酶能力。STAR通过定点突变后,其抗原反应性明显降低,但它高效、特异地溶解血栓的活性不变。科学家还用结构域拼接的办法构建起嵌合分子,如用tPA的A链部分结构域与scu-PA的B链构建tu-PA嵌合分子,在动物实验中这种新构建的嵌合分子(Kztu-PA)溶栓能力显著高于tPA和scu-PA。第三种办法是把tPA与单克隆抗体耦联,或者用膜连蛋白与u-PA(尿激酶纤溶酶原激活剂)连接,使其在体内导向溶栓的性能明显增强,有的还有一定抗栓能力。第四种办法是制造多种功能的溶栓剂。比如把水蛭素片段与scu-PA重组,使它不仅有很高的溶血栓选择性,而且有抑制凝血酶功能;或者把STAR与水蛭素片段、抗血小板聚集三肽重组起来,形成抗凝血酶、抗血小板聚集和溶栓活性分子等,既保留了原来分子的优点,又克服了其不足之处。
目前,糖尿病已成为一种常见病,它可引发视网膜疾病、冠心病、肾衰竭、糖尿病型神经疾病等并发症。根据新的分类法,将糖尿病分为Ⅰ型和Ⅱ型两种,并建议废除旧的胰岛素依赖型和非胰岛素依赖型名称。新分类的理论根据是以病因学为主,而不是以治疗学为主。研究发现,Ⅰ型糖尿病关键性基因大概有十几个;Ⅱ型糖尿病基因也正在揭示中,2002年中国已发现了Ⅱ型糖尿病易感基因。Ⅰ型糖尿病病人由于胰岛细胞不能产生足够量胰岛素以维持正常生命活动,所以必须定时地通过注射胰岛素补充之,否则将会造成昏迷,甚至死亡的严重后果。这类糖尿病经常发生在儿童及青少年中,但成年人发生此型糖尿病的趋势也在增加。目前,全世界所有糖尿病患者中有90%是属于Ⅱ型糖尿病,这种类型糖尿病主要发生在成年人中,其病因是由于胰岛素的受体细胞减少或敏感性降低所致。受体敏感性降低者,乃是患者血清中存在受体的抗体,抗体与胰岛素竞争跟受体结合,即等于抗体抑制了胰岛素与受体的结合。营养不良者也会出现这类糖尿病。Ⅱ型患者可以通过适当地控制高糖、高脂肪、高蛋白摄入,增加高纤维食品摄入,以及进行适当的体育锻炼、口服降糖药一般就能有效控制之,但严重者也得通过注射胰岛素维持生命。
据1995年在布鲁塞尔召开的世界糖尿病国际会议公布,糖尿病在成年人中发病率为6%。在中国,糖尿病发病率似乎没那么高,20世纪70年代末期发病率仅约为0.85%,到1996年就升至3.2%左右,现在估计在4%左右。目前全世界有糖尿病患者近2亿,其中一部分人必须使用惟一的“特效药”胰岛素治疗;估计到2025年糖尿病人将增加到3亿。在中国,I型糖尿病人已达400万,Ⅱ型糖尿病患者近4 000万,位居世界第三位,每年新增患者120万,每天至少增加3 000人。北京等经济比较发达地区患病率已高达5%,据统计北京有糖尿病患者110万。
传统生产胰岛素的方法,是从牛或猪的胰脏中提取,100公斤胰脏大约只能得到1克左右胰岛素,一位患者一年所使用的胰岛素的量,大约需要40头牛或50头猪的胰脏做原料。从这些数字中,人们就不难看出胰岛素供应不足的主要原因是动物胰脏的缺乏。1977年5月,美国加利福尼亚大学的科学家,把人工合成的鼠胰岛素基因整合到质粒上,并转移入大肠杆菌中,结果生产出了鼠的胰岛素,并能分泌到培养液中。1978年科学家把人工合成的人胰岛素基因引入大肠杆菌中得到了表达,所合成的胰岛素经测定,与在人体内产生的胰岛素具有相同的生理功能。当时利用这种重组DNA的细菌进行发酵生产时,在每一个大肠杆菌细胞中可以得到约10万个人胰岛素分子。由于原核细胞中缺少二硫键异构酶等原因,后来就改用酵母菌、蚕培养细胞等真核细胞作为表达载体。重组的人胰岛素,早在1982年就开始以“Humulin”商品名进入国际流通市场。近年来,中国科学家对胰岛素结构进行改造后,得到了速效单体胰岛素,获得国际专利。这种胰岛素不仅保留了天然胰岛素活性,而且大大加快了降血糖的起效时间。
天然状态的生长激素释放抑制因子是由哺乳动物下丘脑分泌,它是由14个氨基酸组成的短肽。这种因子不仅可以抑制生长激素的分泌,而且还可以抑制甲状腺素、胰岛素及胰高血糖素的分泌,在临床上是一种很有用的生化药物。过去每生产5毫克生长激素释放抑制因子就需要50万只绵羊下丘脑,由此可见这种药物是多么珍贵,一般患者决不敢问津。1975年科学家成功地合成出这种因子的基因。1977年美国科学家使用重组DNA技术,把生长激素释放抑制因子基因与质粒连接起来,引入大肠杆菌获得表达。他们从9升这种重组的大肠杆菌培养液中,生产出了5毫克生长激素释放抑制因子。
把转基因动物作为生物反应器,为人类生产某些特定药物或蛋白质,是又一个十分激动人心的研究开发领域。其具体做法就是把外源基因通过显微注射等方法直接转移入受精卵中,从而改变动物的遗传特性,使之能不断地生产出人类所需要的高价产品。由于其成本只及微生物生产方法的千分之一到百分之一,同时产量又大,产值也高,这样就将动物变成了一座活的廉价制药厂。目前,转基因动物反应器研究主要是集中在奶和蛋方面。让外源基因在动物乳腺中表达好处很多:(1)外源基因对动物整体影响小;(2)动物乳腺蛋白质合成能力非常强,而且对蛋白质的翻译和加工类似于人体,易得到天然活性高的产品;(3)对患者来说,通过直接饮用这类奶,既可增加营养又可达到治病目的;(4)倘若奶需要进一步纯化,其技术既简单又不会污染环境。现在,转基因动物反应器模型已由小动物改变成牛、羊等大型反刍动物,这样有利于提高奶的产量,降低成本。
转基因动物反应器已取得令人瞩目的进展。早在20世纪90年代初,美国和日本的公司就获得了一种在乳汁中含有人生长激素的转基因鼠。据计算,在每升鼠乳汁中人生长激素含量可高达0.5克,并且产品没有任何副作用。有报道说现在已有人将转基因鼠奶用于治疗类风湿。
英国爱丁堡一家药品公司,将人的α-1抗胰蛋白酶基因置于绵羊的β-乳球蛋白基因的调控成分控制之下,随后把它导入绵羊的受精卵中,结果培育出了转基因羊,从它的每升奶中可以得到35克人α-1-抗胰蛋白酶,价值约4 000英镑。人体如果缺乏这种酶,将引发肝衰竭、肺囊性纤维病变或肺气肿等疾病。在欧美大约有10万人体内不能产生这种酶。现在,这种转基因绵羊奶已用于治疗囊性纤维变性。英国卢斯林研究所培育的含有治疗血友病药物原料的转基因山羊,售价高达50万英镑。美国塔夫茨大学和马萨诸塞州剑桥的一家公司从转基因山羊的奶中得到了长效tPA。而转基因山羊奶也已用于治疗癌症。
用奶牛作为转基因动物反应器也是科学家十分感兴趣的研究课题,它明显的好处是产奶量大,成本会降得更低。美国加利福尼亚州的一家公司曾从转基因母牛的奶中得到了人的乳铁蛋白;澳大利亚科学家从转基因母牛奶中得到了人的EPO,每克价值高达17万美元。中国已成功地培育出多种乳腺能分泌医用蛋白质的动物,不久将来它会形成一个新兴的产业,造福于公众。让外源基因在家禽蛋中表达的研究也已取得重要进展,转基因蛋不仅成本低,而且生产周期短。现在已经有人报道用转基因鸡蛋治疗流感。
转基因动物吃的是草,挤出来的是药,这一成就固然令人振奋,但是也应该看到,现在转基因动物生物反应器产生的基因药物量往往太少;转基因技术基本上是基于同源基因的随机整合,外源基因转入后往往不能得到正确调控,会出现基因沉默或失活,或表达水平无法预料,或无法稳定地遗传给后代;同时也易导致内源有利基因结构的破坏和失活,或激活有害基因,因此转基因动物的生殖力、抗病能力常常发生严重下降。如果科学家能把外源基因准确地定点插入到动物基因组中,并提高整合效率,就可以使外源基因表达产物的数量提高10~100倍。
将动物或人的基因转移入植物中表达,这样就可以通过大面积种植转基因植物,以较低的成本生产出高附加值的基因药物。在这里,转基因植物就成为生产基因药物反应器。1988年比利时PGS公司把神经肽基因转入烟草中表达,结果在烟草中出现了神经肽产物,经测定每粒烟草种子中神经肽含量高达200纳摩。当时有的科学家还把抗体重链、轻链基因、血清白蛋白基因、白细胞介质素基因等转入马铃薯、烟草中均获得表达。
1990年,柯蒂斯和卡迪诺以专利形式发表了制作转基因疫苗文献。1992年,梅森等人报道了乙型肝炎表面抗原疫苗在植物中获得表达,并提出了利用转基因植物安全地和经济地生产疫苗的想法。此后,这项被称为转基因植物基因工程疫苗的研究就进入了快速发展阶段,并逐渐形成了将疫苗与食物融为一体的思想,这样人们通过正常饮食就可以达到预防疾病的目的。开发人类喜欢的、可生食的水果等植物种类作为转基因宿主,将来公众可以做到通过吃水果收到与注射疫苗一样的效果。对于动物疫苗来说,可以选择苜蓿、玉米和豆类等作物作为转基因宿主,动物吃了这样的饲料就等于打了预防针。目前,在转基因植物中成功地表达出动物或人类疫苗的品种有几十种,世界上各个国家科学家开发的含有疫苗成分的食品真可谓五花八门,比如含乙型肝炎疫苗的马铃薯、含霍乱疫苗的香蕉、含麻疹疫苗的莴苣等。而中国科学家研发转基因基因工程疫苗基本上与世界同步。中国农科院的科学家经过十几年努力,把乙型肝炎病毒抗原蛋白基因重组后转移入西红柿内,结果表达出乙型肝炎病毒重组抗原蛋白,经过多代繁殖、培育,使转入的基因能稳定地遗传。这种含有抗乙型肝炎疫苗的西红柿经过试验田种植和安全性评价之后,就可以成为公众的一种新型药用食品,当然它应由专业医药人员指导使用,不能作为传统食品在超市出售。以后当人们食用了这种西红柿,就可以在体内产生对抗乙型肝炎病毒的抗体。此外,中国科学家还研究开发出治疗血友病的转基因植物,患者食用后可以使出血现象得到遏制;转移降钙素蛋白基因的植物也正得到开发,人们食用后可使血液中钙容易沉积在骨头里,从而使骨质疏松症得到缓解或治疗。转基因植物中这些功能成分也可以通过加工,加入到各种饮料或食品中使之成为一类真正意义上的功能食品。
转基因植物基因工程疫苗优点很突出,科学家把它总结为:(1)使用转基因植物制作方法即可;(2)可以大面积栽种,生产成本低;(3)易获多价疫苗,即一种植物可以同时表达几种抗原;(4)重组的抗原蛋白可以在植物体内得到正确的翻译加工,使其生物活性能得以维持;(5)安全,无病源污染,因为植物的病原体只危害植物,不会对人造成伤害;(6)存在于水果等转基因植物中疫苗稳定,它不必低温保存条件,便于运输、贮存;(7)食用水果,获得免疫,十分经济方便;(8)无须提纯、加工。
但是,它的缺点也不少:(1)表达量少,一般大约只占转基因植物中可溶性蛋白总量0.01%~0.37%;(2)免疫原性差,在人和小鼠试验中,黏膜分泌性抗体检出率分别为50%和10%;(3)成功率不高,转入基因会发生基因沉默或失活;(4)如果转入基因中包含有病原体DNA,那么随着花粉或种子传播可能会造成基因逃逸,从而给人类带来新的病原、毒素、过敏原及未知的危险;(5)重组抗原蛋白经过消化、吸收,或者煮熟变性,可能就失去它的效力;(6)具有口服耐受性,通过肠道吸收这些蛋白质,可能会导致人体停止对这些蛋白质产生应答反应。总之,问题不少,但是科学研究的目的就是为了解决问题,人类的幻想终将会变成现实。