水玻璃是各种硅酸盐(包括硅酸钠、硅酸钾、硅酸锂等)水溶液的总称。水玻璃通常的化学表达式为M 2 O· m SiO 2 · n H 2 O。其中,M为Na + 、K + 、Li + 等, m 、 n 为M 2 O、SiO 2 、H 2 O三个组成物质的量的相互比例。
钠水玻璃是铸造生产中最常用的水玻璃,又称“泡花碱”,它来源丰富、价格便宜。钠水玻璃的化学表达式为Na 2 O· m SiO 2 · n H 2 O,表达式中的 m 俗称为“模数”,它为SiO 2 与Na 2 O的摩尔比。钠水玻璃的结构形态还不太清楚,一般认为,不同模数 m 和含水量 n 的水玻璃具有不同的化学结构形态。铸造水玻璃砂用水玻璃的模数 m 一般为1.5~3.0,水玻璃的质量浓度一般为1.3~1.6g/cm 3 ,而含水量 n 决定了水玻璃的质量浓度。
硅酸钠是弱酸强碱盐,其干态时为白色或灰白色的团块或粉末,溶于水时,纯的钠水玻璃外观为无色黏稠液体,pH值为11~13。铸造用水玻璃中通常含少量的杂质(如Fe 2 O 3 、Al 2 O 3 、CaO等),故其外观呈灰色或绿色。
1.钠水玻璃的制备方法
钠水玻璃的制备工艺过程较为简单,其制备方法通常有干法(固相法)和湿法(液相法)两种。
1)干法制备钠水玻璃。首先,将石英粉或硅砂(SiO 2 )和纯碱(Na 2 CO 3 )按一定比例混合后,在反应炉中加热到1300~1500℃,生成熔融的硅酸钠,即:
m SiO 2 +Na 2 CO 3 =Na 2 O· m SiO 2 +CO 2
然后,经过冷淬或凝固后制成块状或粉碎状,碎块状的硅酸钠(Na 2 O· m SiO 2 )与一定量的水一起加热溶解(在约5×10 5 Pa压力和150℃温度下),再经过滤、浓缩等工序,即得到成品水玻璃(Na 2 O· m SiO 2 · n H 2 O)。
2)湿法制备钠水玻璃。将烧碱(NaOH)溶液和石英粉或硅砂一起在带有搅拌器的高压(0.5~0.7MPa)热反应釜内加热到160℃左右,经真空吸滤或蒸发浓缩,即可制得成品水玻璃,即:
m SiO 2 +2NaOH=Na 2 O· m SiO 2 +H 2 O
由湿法制得的钠水玻璃的模数 m 通常小3,可以满足铸造厂的使用要求。此工艺耗能相对较低。
2.钠水玻璃的技术指标及其铸造行业标准
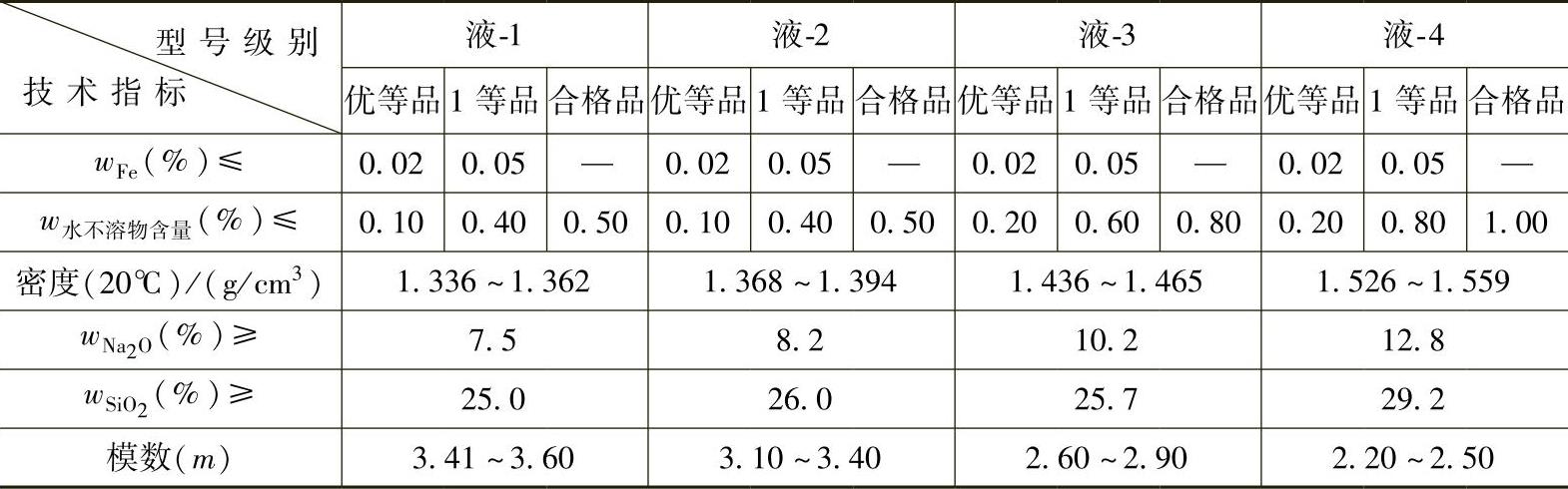
钠水玻璃的技术指标见表2-1,它是2008年修订的工业钠水玻璃商品的国家标准。其中液-1和液-2型钠水玻璃产品主要用作黏结剂、填充料和化工原料等,液-3型钠水玻璃产品主要用于建材业,铸造行业可采用液-4型钠水玻璃产品(也可采用液-3型钠水玻璃产品)。
表 2-1 工业钠水玻璃商品的技术指标(GB/T 4209—2008)
注:表中含量是指其质量分数。
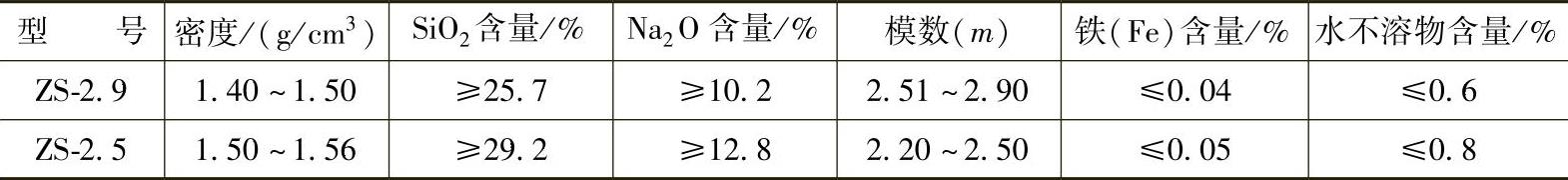
砂型铸造用钠水玻璃的铸造行业标准如表2-2所示。近年来,为了解决水玻璃再生砂可使用时间短的问题,常采用超低模数( m =1.5~2.0)的“改性”水玻璃来延长水玻璃再生砂的可使用时间。铸造用低模数水玻璃的行业标准有待确定。
表 2-2 砂型铸造用钠水玻璃的行业标准(JB/T 8835—2013)
注:表中含量是指其质量分数。
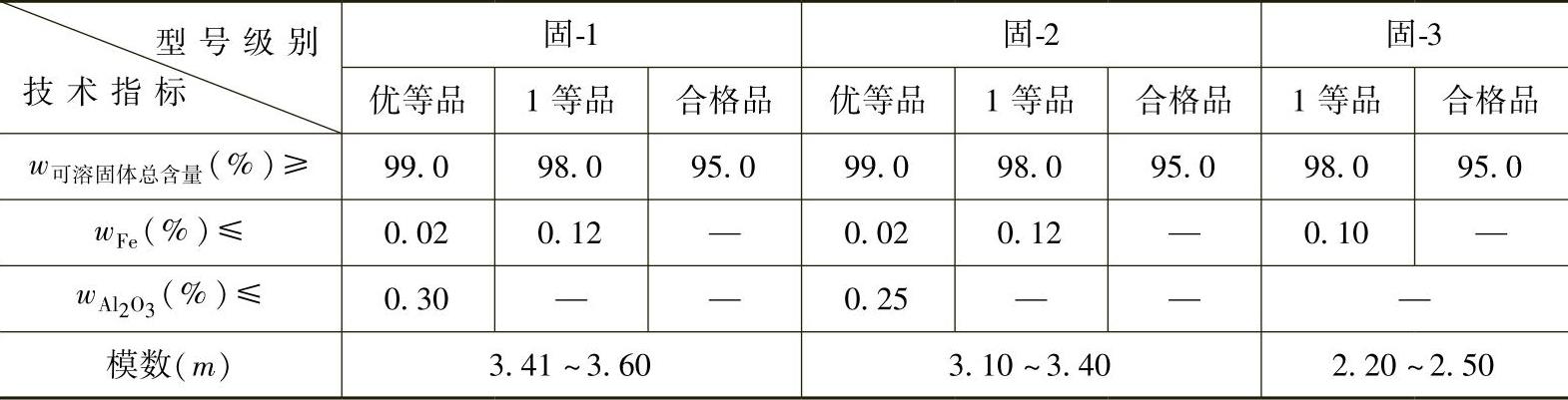
目前,供应铸造工厂的不少中、小型水玻璃生产厂,通常是向大型硅酸钠生产厂购买块状或粉粒状固体硅酸钠原料,然后对固体硅酸钠原料进行加热溶解等加工手段来生产铸造用水玻璃。工业固体硅酸钠的技术标准见表2-3,其中固-3适用于铸造行业。
应该特别指出的是,铸造行业也要提倡采用高品质的水玻璃。总体上看,采用高品质的水玻璃和高质量的原砂,可以较大地降低水玻璃的加入量,这样不仅不会增加铸件的制造成本,对解决水玻璃砂溃散性差的问题也会取到事半功倍的效果。
表 2-3 工业固体硅酸钠的技术指标(GB/T 4209—2008)
注:表中含量是指其质量分数。
3.钠水玻璃的性能参数
钠水玻璃的主要性能参数为模数、密度及杂质含量等。
1)模数。对钠水玻璃作化学分析,可得出钠水玻璃中SiO 2 和Na 2 O的质量分数。模数( m )为SiO 2 和Na 2 O的摩尔比值,可由下式计算:
m =SiO 2 物质的量/Na 2 O物质的量 (2-1)
由于Na 2 O的相对分子质量为62,SiO 2 的相对分子质量为60,则:
m =(SiO 2 质量分数/Na 2 O质量分数)×1.033
即:
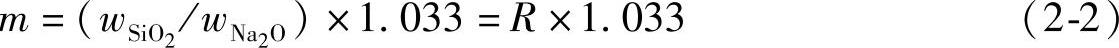
式中,
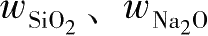 分别为SiO
2
、Na
2
O的质量分数;
R
称为硅碱比,在欧美国家,常用
R
来表示水玻璃的性能。
分别为SiO
2
、Na
2
O的质量分数;
R
称为硅碱比,在欧美国家,常用
R
来表示水玻璃的性能。
模数由固体硅酸钠的成分决定,它对水玻璃的各项性能都有重大影响。水玻璃模数的测定方法详见第9章。
图2-1为Na 2 O-SiO 2 二元相图。从图2-1中可看出:硅酸钠的成分当 m =1时为Na 2 O·SiO 2 ; m =2时为Na 2 O·2SiO 2 ; m =1~2时为Na 2 O·SiO 2 与Na 2 O·2SiO 2 的混合物; m >2时为Na 2 O·2SiO 2 与游离的SiO 2 组成的混合物。
2)密度。密度能间接表示水玻璃中硅酸钠的浓度或固体硅酸钠的含量。密度越大,则固体硅酸钠的含量越高。密度可用密度计来计量,用密度或波美度(°Be)表示。密度 ρ (g/cm 3 )与波美度之间的关系如式(2-3)所示。
ρ =144.3/(144.3-波美度) (2-3)
或
波美度=144.3-144.3/ ρ
一般认为,钠水玻璃为Na 2 O-SiO 2 -H 2 O三元组成,但钠水玻璃的具体结构与组成,目前仍无法有效测定,因为钠水玻璃的结构随其模数的变化而变化。
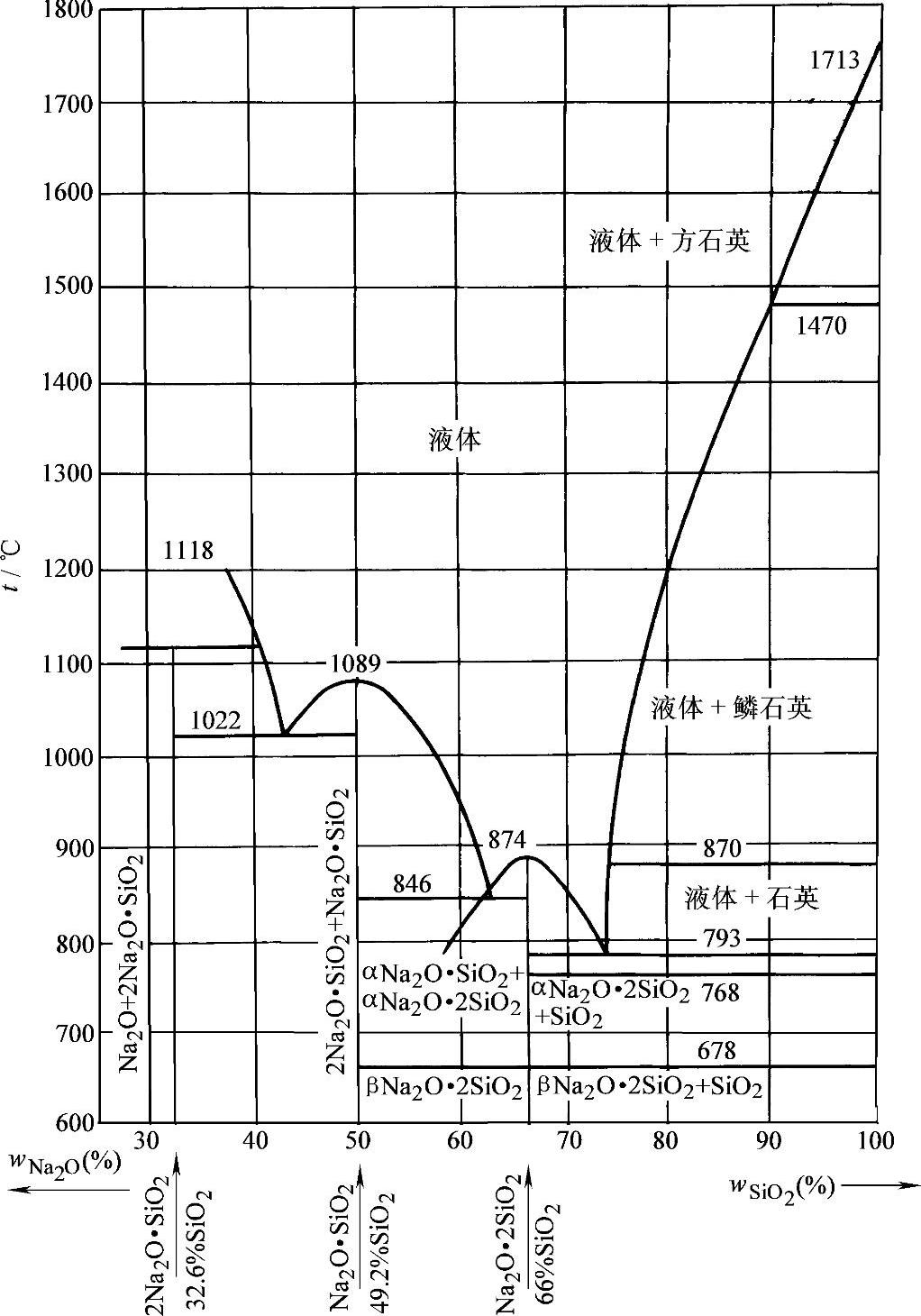
图2-1 Na 2 O-SiO 2 二元相图
许多文献资料将水玻璃在常温下的三元相图表示为图2-2所示。普通工业用钠水玻璃的成分约在图2-2中画阴影线的范围内,此时,模数 m =2.0~3.3,密度 ρ =1.2~1.7g/cm 3 (即波美度=24.0~59.5°Be)。
钠水玻璃的
 模数、密度之间的关系如图2-3所示,知道其中的任意两个,另外两个指标就可由图2-3求出。水玻璃密度的测定方法详见第9章。
模数、密度之间的关系如图2-3所示,知道其中的任意两个,另外两个指标就可由图2-3求出。水玻璃密度的测定方法详见第9章。
3)杂质含量。纯净的钠水玻璃外观为无色黏稠液体,含有Fe 2 O 3 、Al 2 O 3 、CaO等杂质时则会带有灰色、绿色甚至黑色。另外,钠水玻璃中还含有杂质盐,如NaCl、Na 2 SO 4 、Na 2 CO 3 等。上述水玻璃的杂质对水玻璃的密度、黏度、硬化速度、黏结强度、老化速度、表面张力等都有明显的不良影响,因此,应尽量减少水玻璃中的杂质含量,这对减少水玻璃的加入量、提高水玻璃的黏结强度和型砂的溃散性都有重大意义。
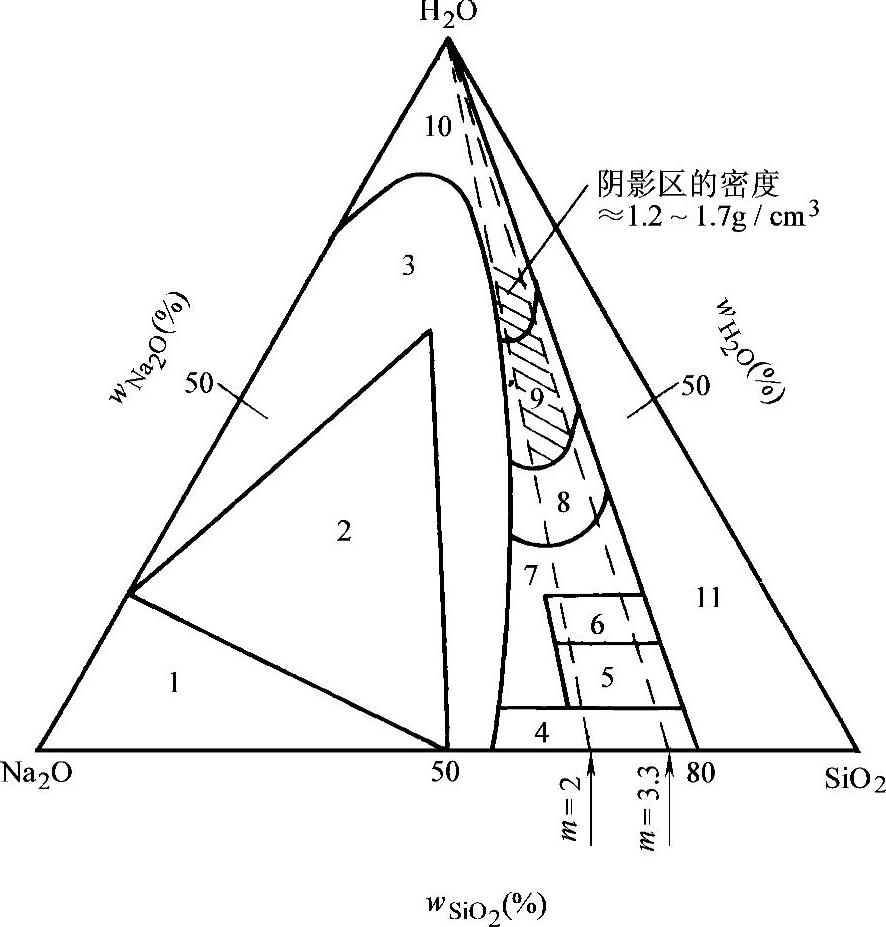
图2-2 Na 2 O-SiO 2 -H 2 O三元相图(20℃)
1—无水原硅酸钠(Na 4 SiO 4 )和NaOH的混合物 2—硅酸钠晶体 3—带有部分硅酸钠晶体的混合物 4—玻璃体 5—水解玻璃 6—脱水玻璃 7—半固体 8—黏稠液体 9—普通液体 10—稀淡液体 11—不稳定液体和凝胶
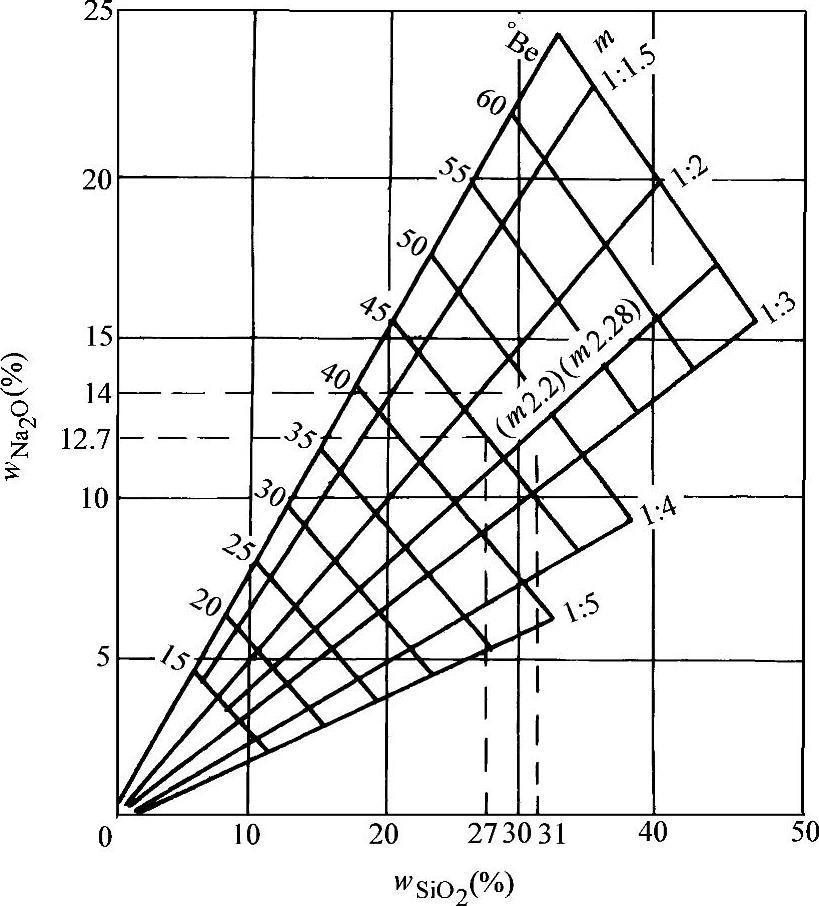
图2-3 钠水玻璃
 、模数、密度之间的关系(20℃)
、模数、密度之间的关系(20℃)
4)钠水玻璃溶液的性质。钠水玻璃是一种复杂的分散体系,既有离子溶液的性质也有胶体溶液的性质。溶液的性质由水玻璃的模数决定。
当 m <2时,水玻璃溶液基本上是一种单纯的离子溶液,几乎不存在胶体粒子;当 m >2时,水玻璃溶液中开始出现SiO 2 胶体粒子,并随着模数的增大胶体粒子的比例增加;当 m =4时,钠水玻璃基本上已硅溶胶化。因此,高模数水玻璃易凝结而不稳定,既有微弱的电泳现象和丁泽尔效应(离子溶液的性质),又有胶体溶液的特性。而水玻璃溶液中,自发地生成胶粒聚合的现象称为“老化”,将在第3章详细介绍。
4.钠水玻璃模数及密度的调整方法
如购入的水玻璃模数不合适,可加入NaOH水溶液或稀盐酸(氯化铵水溶液),使模数降低或提高。加入量的计算如下:
1)降低模数。往钠水玻璃中加入氢氧化钠(NaOH),中和钠水玻璃中的部分SiO 2 ,可以降低钠水玻璃的模数,其反应如下:
m SiO 2 +2NaOH→Na 2 O· m SiO 2 +H 2 O
上式中, m 为要求达到的水玻璃模数。
首先测定原水玻璃中SiO 2 、Na 2 O的质量分数 w SiO2 、 w Na2O 。如在100g的钠水玻璃中加入氢氧化钠(NaOH) x g,则钠水玻璃的模数便降低至 m :
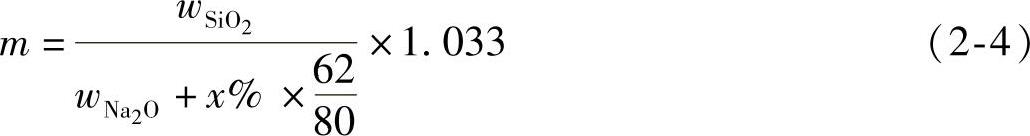
即:
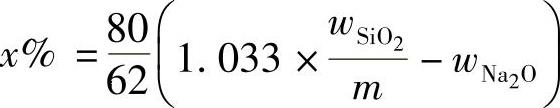
式(2-4)中,62/80表示分别80gNaOH中含有62gNa 2 O。
2)提高模数。提高水玻璃模数的方法通常有:加入盐酸(HCl)或氯化铵(NH 4 Cl),加入无定形SiO 2 等方法,使之与水玻璃中的部分Na 2 O作用,以减少与SiO 2 结合的Na 2 O的量,来提高水玻璃的模数。用加入NH 4 Cl来提高模数的反应为:
Na 2 O· m SiO 2 +2NH 4 Cl→ m SiO 2 +2NaCl+2NH 3 ↑+H 2 O
NH
4
Cl用量的计算方法为:首先,测定原水玻璃中SiO
2
、Na
2
O中的质量百分数
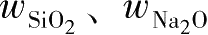 ;然后根据所需的模数,计算出处理后的水玻璃中Na
2
O含量;再根据要中和的Na
2
O的数量,计算出所需的NH
4
Cl用量。要注意的是:1mol的Na
2
O与2mol的NH
4
Cl起反应,它们的相对分子质量之比为1.73。即所用的NH
4
Cl量是需中和的Na
2
O量的1.73倍。
;然后根据所需的模数,计算出处理后的水玻璃中Na
2
O含量;再根据要中和的Na
2
O的数量,计算出所需的NH
4
Cl用量。要注意的是:1mol的Na
2
O与2mol的NH
4
Cl起反应,它们的相对分子质量之比为1.73。即所用的NH
4
Cl量是需中和的Na
2
O量的1.73倍。
部分学者认为,加入无定形SiO 2 ,是提高水玻璃模数的最好方法。而加入盐酸(HCl)或氯化铵(NH 4 Cl),都会产生NaCl,它对水玻璃性能有害。
3)模数调中。利用两种高、低模数的水玻璃调配模数的方法为:在100g低模数水玻璃中加入高模数水玻璃 x g。此时,混合水玻璃的模数为 m :
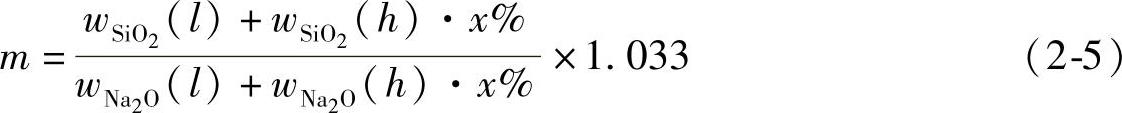
式(2-5)中,
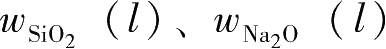 为低模数水玻璃中SiO
2
、NaO
2
的质量分数;
为低模数水玻璃中SiO
2
、NaO
2
的质量分数;
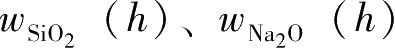 为高模数水玻璃中SiO
2
、NaO
2
的质量分数。
为高模数水玻璃中SiO
2
、NaO
2
的质量分数。
商品钠水玻璃的模数一般由水玻璃生产厂根据铸造厂的使用要求进行调定,铸造厂一般不进行模数的调整。
密度不合适时,可通过加入纯净水稀释或加热浓缩来进行调整。
钾水玻璃是硅酸钾的水溶液。硅酸钾在水中的溶解度比硅酸钠高得多,当它溶解于水时,产生水解而呈碱性反应;硅酸钾具有很强的吸湿性,吸收空气中的水分而在短时间内潮解。
硅酸钾可分为原硅酸钾(K 4 SiO 4 或2K 2 O·SiO 2 )、偏硅酸钾(K 2 SiO 3 或K 2 O·SiO 2 )和多硅酸钾(如二硅酸钾K 2 O·2SiO 2 ,四硅酸钾K 2 O·4SiO 2 等),分子通式为K 2 O· m SiO 2 。
在高温下硅酸钾(如二硅酸钾K 2 O·2SiO 2 )容易与SiO 2 、KOH及NaOH反应生成固熔体,因此钾水玻璃含量较高的型砂溃散性较钠水玻璃型砂要差。
图2-4为K 2 O·SiO 2 二元相图。从图中可看出:偏硅酸钾的熔点为976℃,二硅酸钾的熔点为1045℃,四硅酸钾的熔点为770℃;而组成约45%SiO 2 的偏硅酸钾和二硅酸钾混合物的熔点为780℃,约含67%SiO 2 的二硅酸钾和四硅酸钾低共熔混合物的熔点为742℃,SiO 2 含量为74%的四硅酸钾与二氧化硅的混合物767℃。
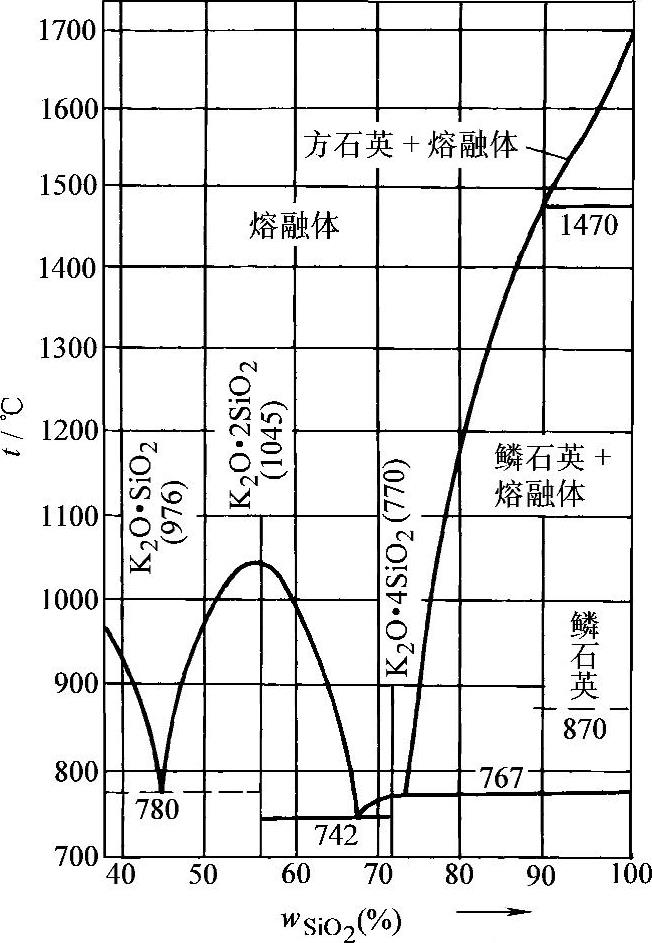
图2-4 K 2 O·SiO 2 二元相图
K 2 O·SiO 2 系的基本性质与Na 2 O·SiO 2 系相似,区别只是含量、熔点和低共熔混合物等有所不同而已,但K 2 O·SiO 2 二元相图中看不到原硅酸钾。
1.钾水玻璃的制备方法
钾水玻璃的制备方法与钠水玻璃基本相同,也有干法和湿法两种工艺[4]。
干法是用碳酸钾与石英粉(或硅砂)共熔来制取,再与一定量的水加热溶解成液态钾水玻璃。湿法生产钾水玻璃与湿法生产钠水玻璃的设备及工艺相同,只是用KOH取代NaOH与石英粉(或硅砂)进行反应。适于铸造使用的低模数的钾水玻璃可采用湿法生产。
2.钾水玻璃的性能参数及特征
钾水玻璃的性能参数与钠水玻璃相同,主要为模数和密度。由于SiO 2 的相对分子质量为60.1,K 2 O的相对分子质量为94.2,所以钾水玻璃的模数 m 为:
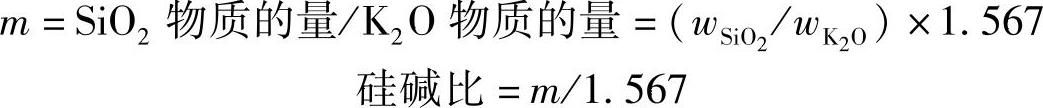
钾水玻璃的
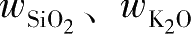 、模数、密度之间的关系如图2-5所示,知道其中的任意两个,另外两个指标就可由图求出。
、模数、密度之间的关系如图2-5所示,知道其中的任意两个,另外两个指标就可由图求出。
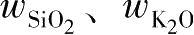 分别为钾水玻璃中SiO
2
、K
2
O的质量分数,数值25~40°Be为以波美度表示的密度(括号内为相应的密度),数值1:1.5~1:3.0为硅碱比。
分别为钾水玻璃中SiO
2
、K
2
O的质量分数,数值25~40°Be为以波美度表示的密度(括号内为相应的密度),数值1:1.5~1:3.0为硅碱比。
除商品钾水玻璃外,还有商品钾钠水玻璃,钾钠比为1:1、2:1、3:1、4:1,模数为2.5~3.7。钾水玻璃的价格比钠水玻璃的价格高。目前,钾水玻璃、钾钠水玻璃多用于电子行业的显像管荧光材料的黏结剂或电焊条焊药的黏结剂,而在铸造工业中的应用较少。
我们初步的试验研究表明,往铸造钠水玻璃中加入一定量的钾水玻璃或钾钠水玻璃(即复合水玻璃改性),可以提高水玻璃的黏结强度,但会降低水玻璃砂的溃散性。钾水玻璃或钾钠水玻璃在铸造工业中的应用有待于深入研究开发。
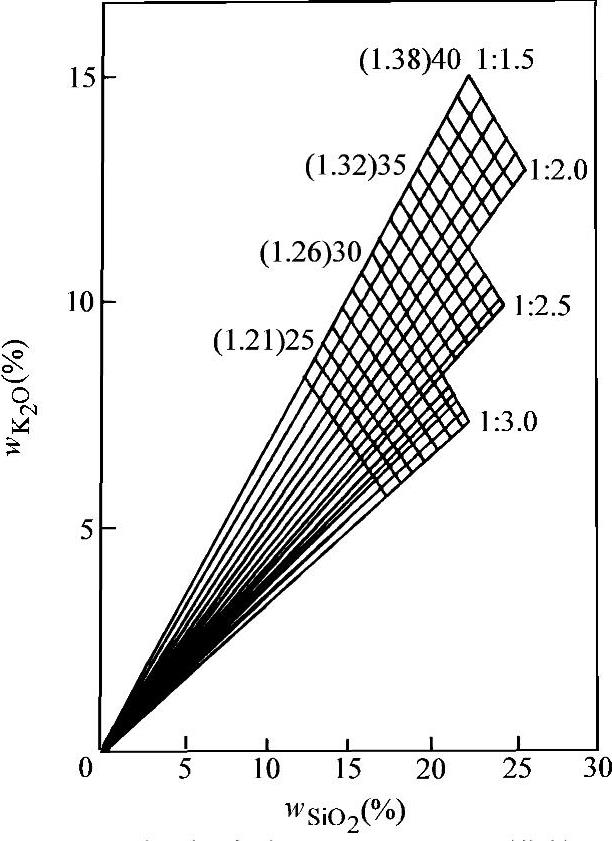
图2-5 钾水玻璃 w SiO2 、 w K2O 、模数、密度之间的关系(20℃)
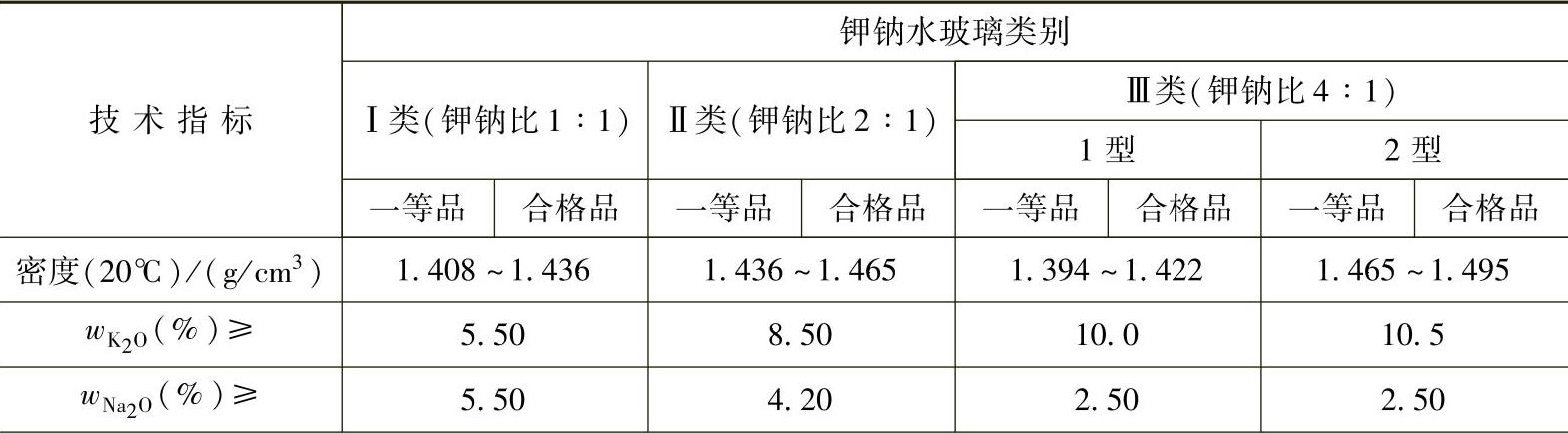
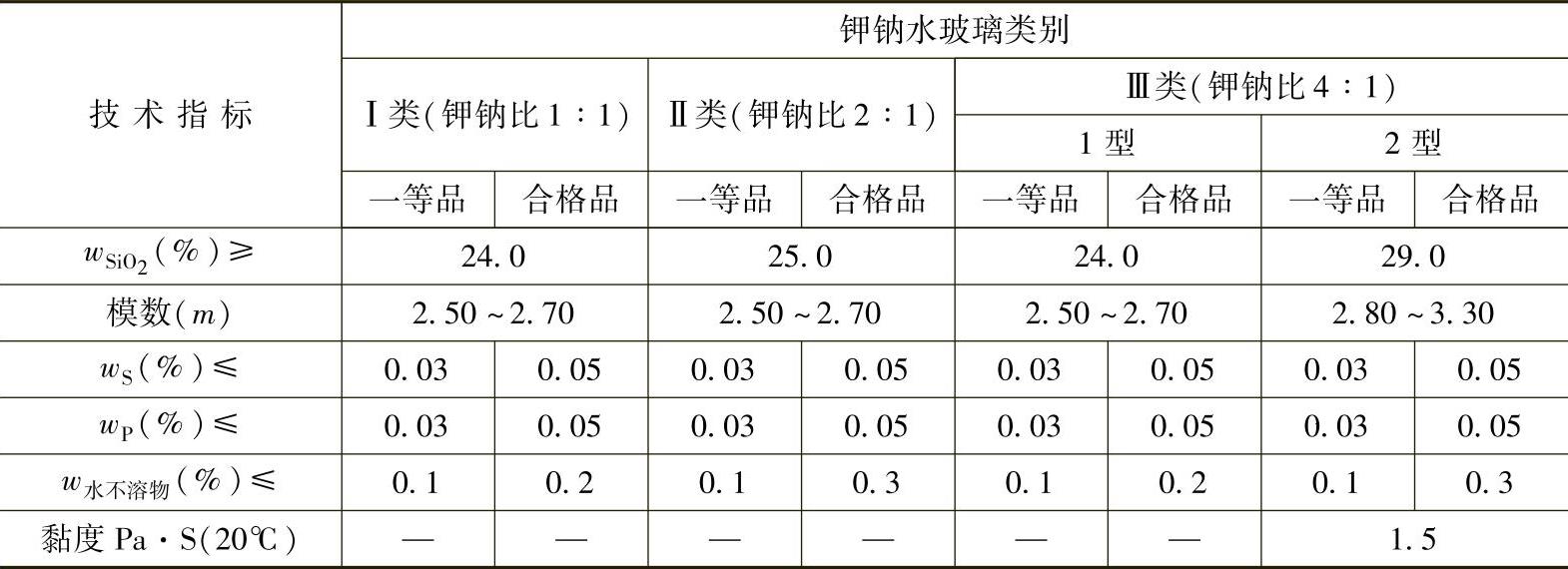
钾水玻璃还没有制订出国家标准,只有某些企业(如青岛泡花碱厂等)的标准,钾钠水玻璃的行业标准见表2-4。
表 2-4 钾钠水玻璃的行业标准(HG/T 2830—2009)
(续)
锂水玻璃的分子式为Li 2 O· m SiO 2 · n H 2 O,其中 m 和 n 分别表示锂水玻璃的模数和水合程度, n 是可变的,由模数、浓度、pH值、温度等因素决定水合程度(即 n 的大小)。
硅酸锂的分子与同类的硅酸钠和硅酸钾截然不同,锂原子序数为3,相对原子质量为6.94,原子半径很小,电荷密度特别高,在溶液中,锂水合离子就阻碍二氧化硅相互靠拢、接触发生聚合。所以硅酸锂可制得很稳定的高模数溶液。一旦使溶液脱水干燥,锂离子的水合层消失,很小的锂离子又不会阻碍二氧化硅靠拢、接触,故而脱水后,二氧化硅很快聚合成链形的无定形高分子聚合物或生成不溶于水的硅酸锂沉淀。
固体硅酸锂不能溶于水,因此不能用碳酸锂与石英粉共热的固相法来制取锂水玻璃;晶态的石英粉也不容易溶解于氢氧化锂溶液中,因此也不能用一般的液相法制取锂水玻璃。
1.锂水玻璃的制备方法
目前锂水玻璃的制备方法有:硅溶胶法、硅胶法、离子交换法等。
1)硅溶胶法。硅酸钠经H—型离子交换树脂起交换反应后,得到多聚硅酸(即硅溶胶),然后再与氢氧化锂起中和反应生成硅酸锂。反应如下:
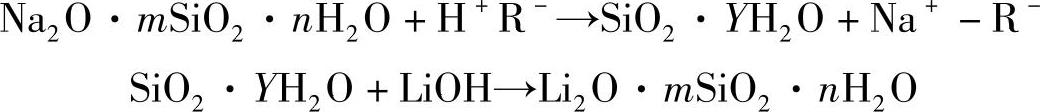
2)硅胶法。硅酸钠与硫酸起置换反应,生成水合硅酸与硫酸钠,取其水合硅酸再与氢氧化锂进行中和反应,即生成硅酸锂和水。反应式如下:
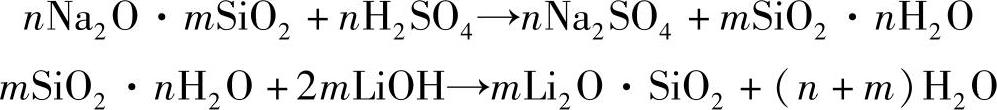
3)离子交换法。采用碳酸锂、硫酸锂等锂盐为原料溶液,通过阳离子型交换树脂作用,生成Li型树脂,再与5%的硅酸钠溶液接触交换,可制得硅酸锂溶液产品。
2.锂水玻璃的性能特征
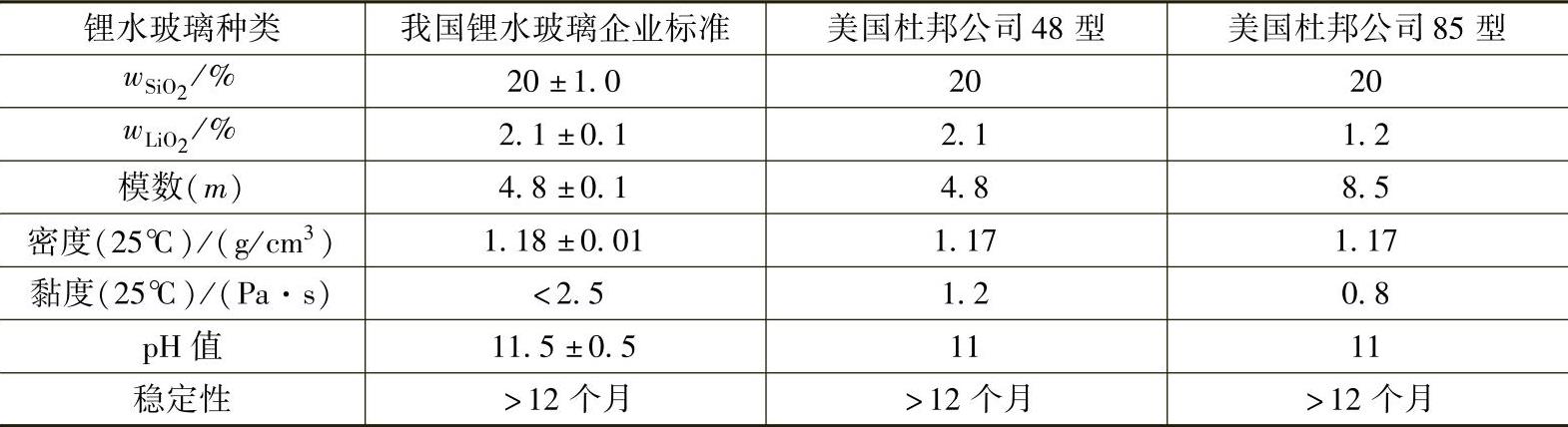
锂水玻璃为无色、无味、透明或半透明微浑浊液体,呈弱碱性,pH值为11左右,产品的密度和黏度随型号而不同,密度在1.16~1.19g/cm 3 之间(25℃),黏度在1Pa·s以下(25℃)。质量高的锂水玻璃,黏度低,在0.4Pa·s左右。
锂水玻璃可用水无限稀释,通常呈多分子团状分散的均匀溶液。如果浓缩至很高浓度时,会发生聚合,进一步蒸发失水,即成固体硅酸锂,它不溶于水及有机溶剂。但与其他碱性水溶液可以互溶,遇酸则起化学反应,生成二氧化硅凝胶。
由于硅酸锂只能在生成的同时制成分散的溶液状态,一旦失去水分而析出沉淀,便不能重新分散或溶解,所以锂水玻璃硬化后具有很好的抗吸湿性。
锂水玻璃价格昂贵,目前多用于建筑物外层的耐水性涂料或耐腐蚀涂层等特殊用途,以及抗吸湿的电焊条焊药的黏结剂。用硅酸锂制造的特种涂料,经涂布后,可产生耐水、耐热、防火的坚固涂层,对金属防腐蚀都有很好的作用。
锂水玻璃用作铸造型砂的黏结剂很少,但我们的初步研究表明,在钠水玻璃中加入少量的锂水玻璃可提高水玻璃砂抗吸湿性,并改善水玻璃砂的其他性能。锂水玻璃在铸造工业中的应用还有待于深入研究开发。
锂水玻璃产品的质量标准见表2-5。
表 2-5 锂水玻璃产品的质量标准