




制备药物的反应大多数都是在溶剂中进行的。溶剂可以帮助反应体系散热或传热,使反应分子均匀分布,增加分子间碰撞、接触的机会,进而加速反应进程。溶剂可直接影响反应速率、方向、浓度及产物晶型、构型等。此外,采用重结晶法精制反应产物时,也需要溶剂。因此,在药物合成中,对溶剂的选择和使用是十分重要的内容,也是在药物工艺路线反应条件研究内容中较为重要的部分。本节主要对反应溶剂、重结晶溶剂及pH值这几方面进行分析研究。
溶剂的极性主要用偶极矩和介电常数两个物理常数来表示。溶剂主要分为有机溶剂和无机溶剂,有机溶剂经常用于药物合成工艺中,其永久偶极矩值为(0~18.5)×10 -30 cm(0~5.5D)。
介电常数是衡量溶剂极性的重要参数之一。它是分子的永久偶极矩和可极化性的函数,它随分子的偶极矩和可极化性增大而增大。有机溶剂的介电常数值为2~190;介电常数大的溶剂可以解离,被称为极性溶剂;介电常数小的溶剂被称为非极性溶剂。研究溶剂的极性,目的在于了解其总的溶剂化能力,得到最适合药物合成工艺的溶剂。
偶极矩和介电常数小的溶剂,其溶剂化作用也很小,一般将介电常数在15以上的溶剂称为极性溶剂,小于15的溶剂称为非极性溶剂或惰性溶剂。
溶剂的分类方法有很多种,可按照溶剂的化学结构、物理常数、酸碱性和极性等依据进行分类。其中,按溶剂发挥氢键给体作用的能力,可将溶剂分为质子性溶剂(protic solvent)和非质子性溶剂(aprotic solvent)两大类。
质子性溶剂是指分子中含有可形成氢键的氢原子的溶剂,如水、醇类、质子酸(硫酸、磷酸、乙酸等)及胺类衍生物等。该类溶剂既可以与含负离子的反应物发生氢键结合,产生溶剂化作用,也可与负离子的孤对电子进行配位,或与中性分子中氧原子(或氮原子、氟原子等)形成氢键,亦或由于偶极矩的相互作用而产生溶剂化作用。
非质子溶剂不含有易取代的氢原子,主要靠偶极矩或范德华力的相互作用而产生溶剂化作用。非质子性溶剂可以分为以下几类:①醚类,如乙醚、四氢呋喃、二氧六环等。②卤代烃,如三氯甲烷、四氯化碳等。③芳香烃,如甲苯、氯苯、硝基苯等。④酰胺类,如 N , N -二甲基甲酰胺(DMF)、N-甲基吡咯烷酮(NMP)、六甲基磷酰胺(HMPA)等。⑤酮类,如丙酮、丁酮等。⑥硝基烷类,如硝基甲烷。⑦其他类,如吡啶、二甲基亚砜(DMSO)、乙腈等。
通常情况下,有机化学反应需在溶液状态下进行。那么,为什么该类反应要在溶剂中进行呢?一个重要的原因就是溶液中分子间作用力比在气相或固相条件下更强些,更容易变化,并可以多种方式影响反应物的性质。溶剂不仅为化学反应提供了进行的场所,还可影响化学反应的反应速率、反应方向、平衡状态及产物构型等。
1.溶剂对化学反应速率的影响 有机反应按其机理可分为两大类:一类是游离基型反应,游离基型反应一般在气相或非极性溶剂中进行;另一类是离子型反应,该类反应中溶剂的极性对反应的影响很大。离子或极性分子处于极性溶剂中时,溶质和溶剂之间能通过静电引力而发生溶剂化作用,在此过程中,物质放出热量而降低位能。溶剂化作用系指每一个被溶解的分子或离子被一层或松或紧地受束缚的溶剂分子所包围的现象。在电解质溶液中,溶剂分子和离子之间的分子间相互作用尤为重要,这是由于离子对溶剂分子的作用力特别强的缘故。静电相互作用的粗略计算表明,被溶解的离子最邻近的溶剂分子,其所受到的电场强度为10 3 ~10 7 V/cm。
溶剂化自由能是溶剂化能力的量度。物质的溶解不仅需要克服溶质分子间的相互作用能,还需要克服溶剂分子本身的相互作用能。这些所需的能量可通过溶剂化自由能Δ E solv而得到补偿。化合物的溶解热可以看作是溶剂化自由能和晶格能之间的差值,如图3-10所示。如果释放出的溶剂化自由能高于晶格能,那么溶解的全过程是放热的;反之,如果需要向体系提供能量,溶解的过程便是吸热的。
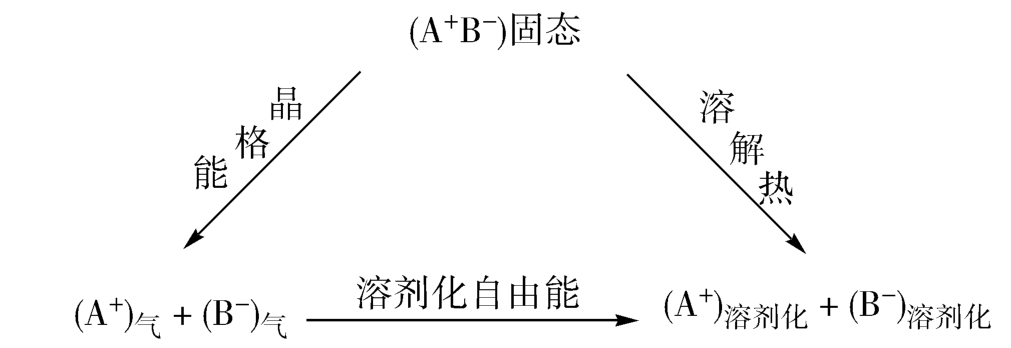
图3-10 晶格能、溶剂化自由能和溶解热之间的关系
化学反应速率由反应物和过渡态之间的能量差(活化能 E )决定。化学反应中,如果反应物比过渡态更容易发生溶剂化,反应物位能降低Δ H 。相应地,活化自由焓增加Δ H ,降低了反应速率,见图3-11(a);当过渡态更容易发生溶剂化时,过渡态位能降低Δ H ,反应速率加快,溶剂极性加大对反应有利见图3-11(b)。
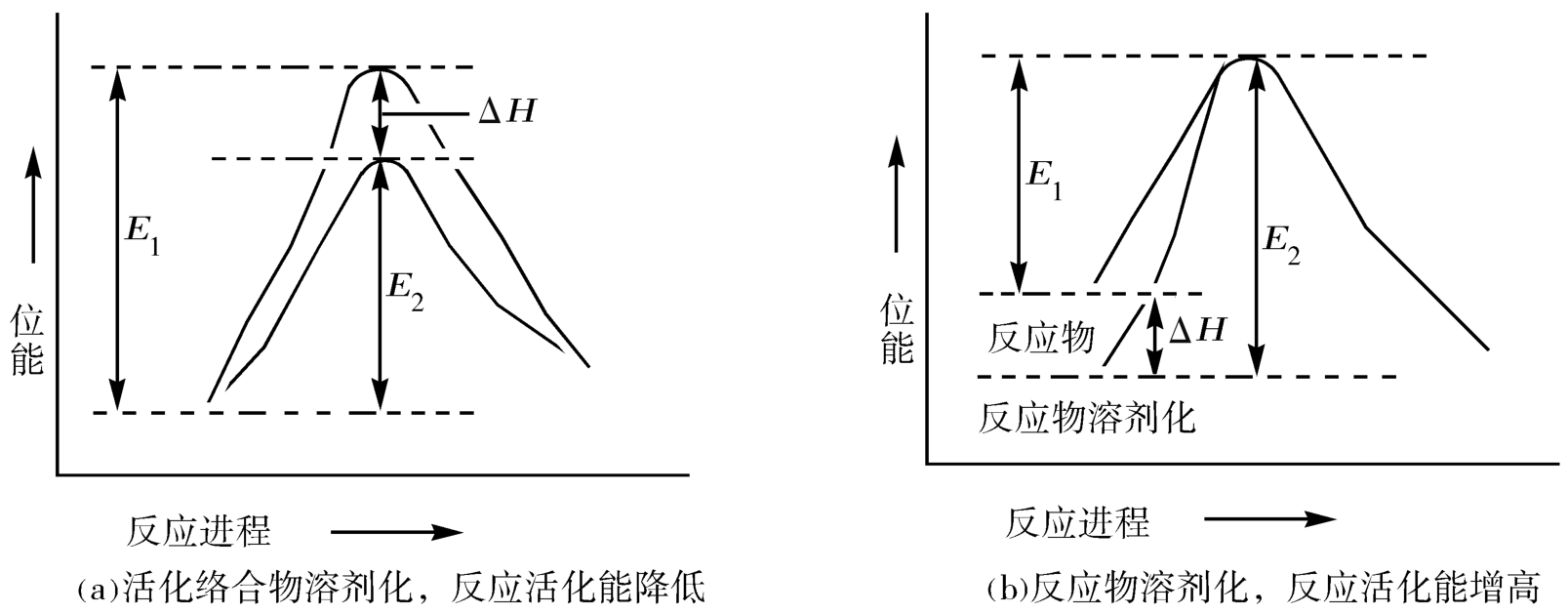
图3-11 溶剂化与活化能关系示意图
极性溶剂可以促进离子反应,溶剂的改变会显著地改变均相化学反应的速率和级数,溶剂的合理选择可以使化学反应速率显著地增加或减小。如碘甲烷和三丙胺反应生成季铵盐的反应,活化过程中产生电荷分离,因此溶剂极性增强,使电荷分散、体系稳定,反应速率明显加快(图3-12)。研究结果表明,其反应速率随着溶剂的极性变化而显著改变。
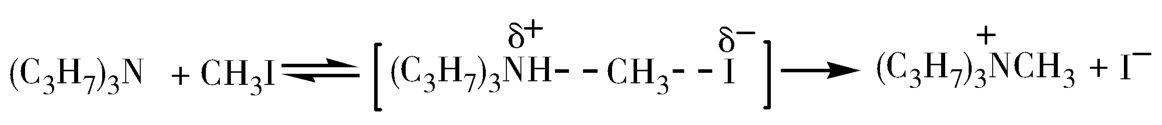
图3-12 碘甲烷与三丙胺生成季铵盐的反应
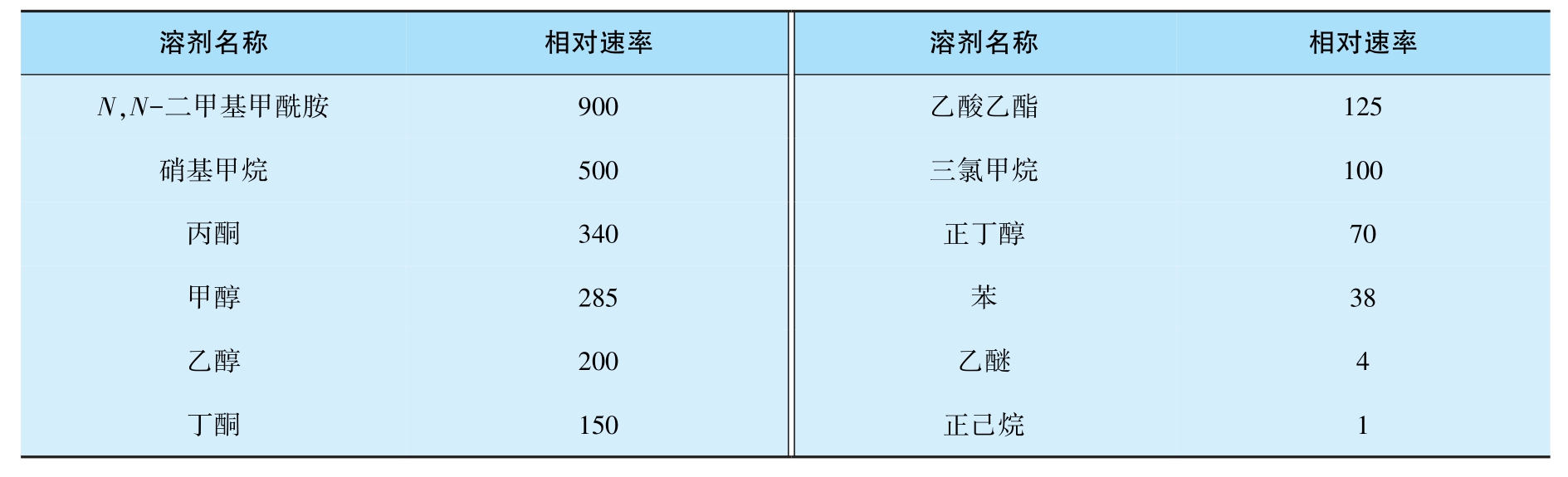
若以应用正己烷为溶剂时的反应速率为1,则应用其他溶剂时的相对反应速率如表3-1所示。可以看出,溶剂的极性增大,反应速率也加快,而极性的非质子性溶剂更有利于反应。
表3-1 溶剂与相对速率的关系
在合成药物工艺研究中,选择适当的溶剂可以加快或减缓化学反应速率。然而,溶剂对反应影响的原因非常复杂,目前还不能从理论上十分可靠地找出某反应的最适宜溶剂,通常只能根据实验结果来确定。
如果比较反应物分子和活化络合物分子内部的电荷分布情况,那么就可根据分子内电荷分布的改变,大体上推测极性溶剂对化学反应速率的影响。在反应物转变为活性络合物的过程中,如果分子内电荷分布改变结果是使电荷增加,则极性溶剂将大大增加反应速率;反之,若电荷分布改变结果是使电荷分散,则极性溶剂将使反应速率减慢;若电荷分布改变结果是使部分电荷中和,则极性溶剂会大大降低反应速率。
2.溶剂对化学反应方向的影响 溶剂除可影响化学反应速率外,还可影响化学反应的方向。例如,甲苯(3-20)与溴素进行溴代反应时,不同极性的溶剂决定了反应进行的方向,得到完全不同的取代反应产物。当以二硫化碳为溶剂时,取代反应发生在侧链上;当以硝基苯为溶剂时,取代反应发生在苯环上,如图3-13所示。
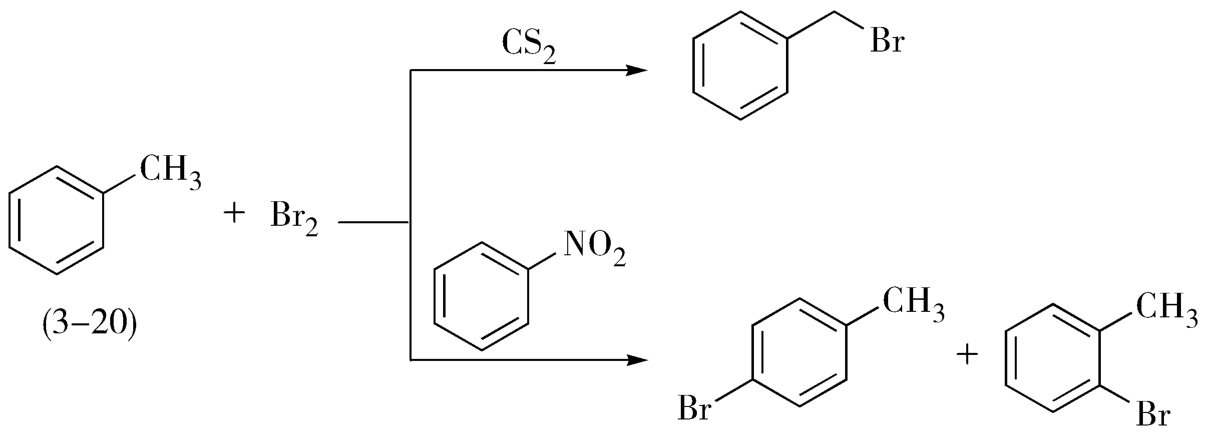
图3-13 甲苯与溴素进行取代反应
重氮基的取代反应是按照自由基的反应机理进行的,但该反应过程中可能有两个副反应发生。如图3-14所示,氯化重氮苯(3-21)发生取代反应时,在氯化亚铜的催化下可得到取代产物氯化苯(3-22),两个副产物分别为:按S N1 机理反应机理进行得到水解副产物——苯酚,以及按芳烃的亲电取代反应得到的偶合副产物——2-(苯基二氮烯基)苯酚(3-23)。其中,取代反应和水解反应都是在水中进行的,与有机溶剂的加入与否无关;但对于氯代反应和偶合反应的竞争,有机溶剂的加入有利于酚离开水相向有机相转移,相当于降低了酚的浓度,有利于氯代反应而不利于偶合反应,即在该类反应中,有机溶剂的加入会使反应更多地向着取代反应方向进行。
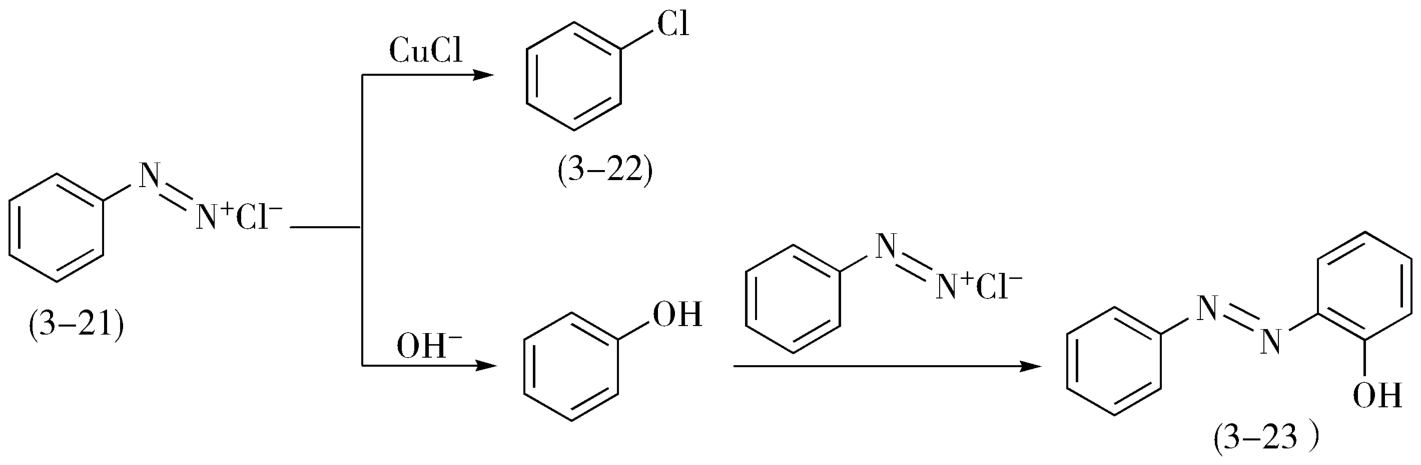
图3-14 氯化重氮苯的取代反应及水解与偶合副反应
3.溶剂对产物构型的影响 溶剂对产品的构型也有影响。由于溶剂极性的不同,某些反应产物中顺、反异构体的比例也不同。例如,在C 2 H 5 ONa作用下的Wittig反应中,顺式产物(3-24)的含量随溶剂的极性增大而增加,按溶剂的极性次序(Et 2 O<THF<EtOH<DMF)顺式产物的含量由31%增加到65%(图3-15)。
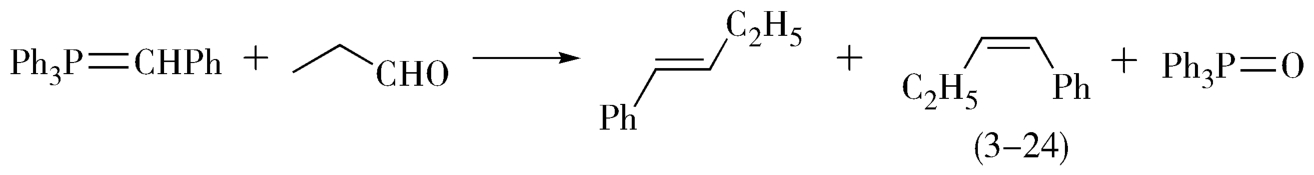
图3-15 Wittig反应
梨小食心虫性外激素由顺反异构体组成,当反式占10%左右时,诱蛾活性最高。中国科学院北京动物研究所采用新工艺,应用维蒂希反应合成此昆虫激素,通过应用极性的非质子性溶剂DMSO,产物中的顺式占88%,田间试验表明具有最大诱蛾活性(图3-16)。
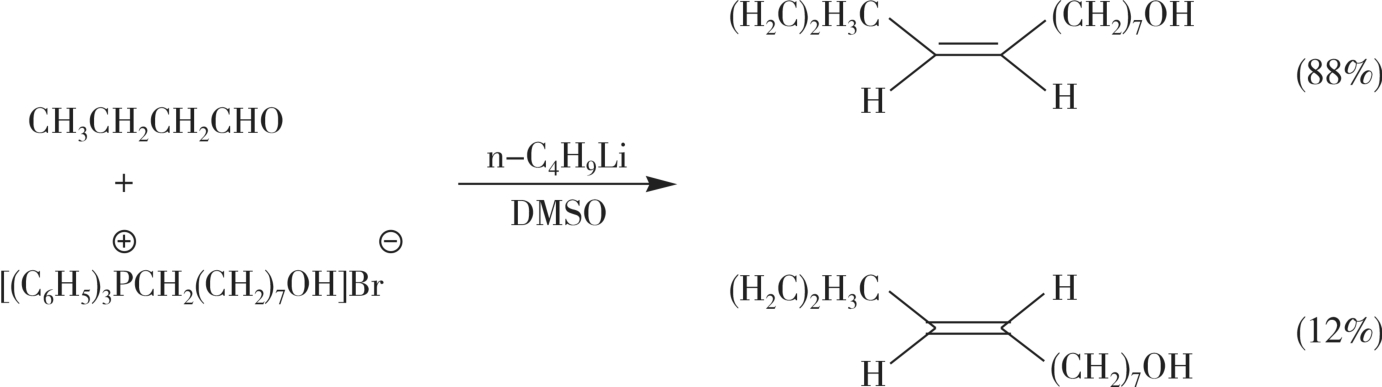
图3-16 梨小食心虫性外激素的合成
光学活性的2-正辛醇用氯化亚砜在不同溶剂中进行反应,得到不同构型的相应氯化物,若添加氯化锌为催化剂,反应速率明显加快,S N2 机理转化为S N1 机理,得到外消旋产物(图3-17)。
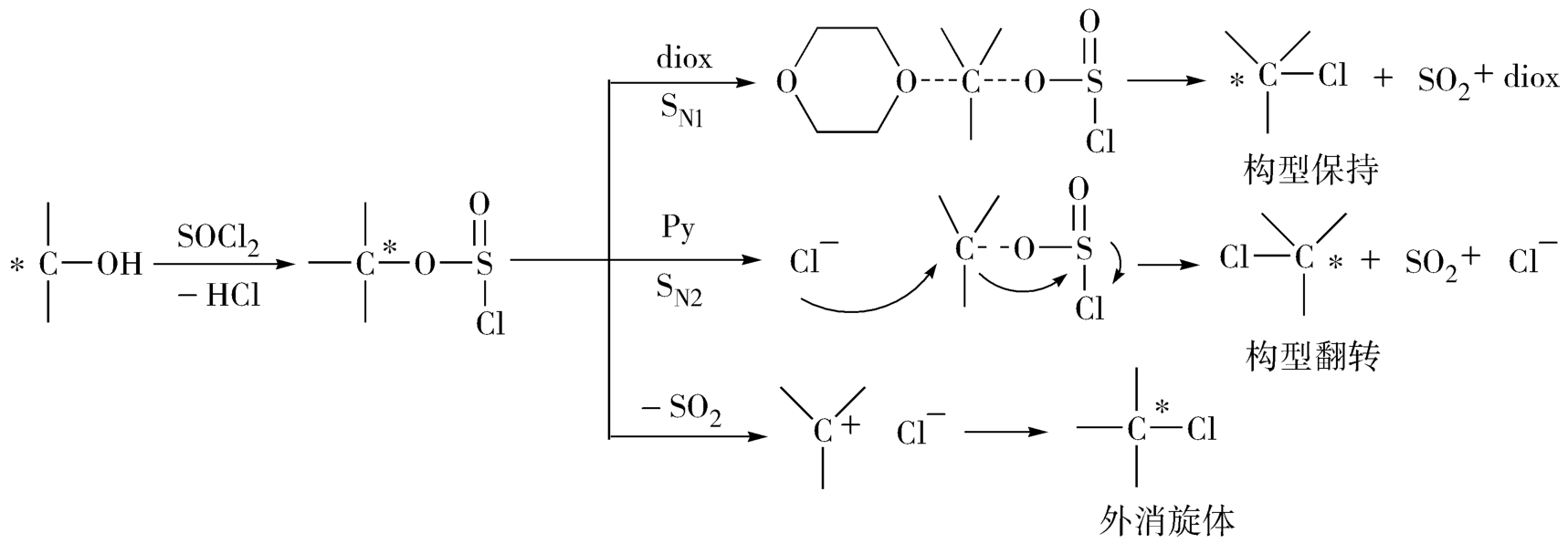
图3-17 2-正辛醇与氯化亚砜在不同溶剂中的反应
除上述几种溶剂效应可影响的因素外,溶剂效应对酸碱平衡、互变异构平衡、价键异构化及电离平衡等也有着一定的影响。
如前所述,溶剂对反应的结果起着决定性作用。因而,合适的溶剂对药物合成工艺的优化有着举足轻重的地位。首先,所选用的溶剂需能够溶解所用的反应物或试剂,并确保反应能够进行。例如,需用极性溶剂来溶解氰化钾等离子型的试剂。有时候,尽管对反应物仅是微溶的溶剂也会被选用,因为已溶解的反应物将会转化为产物,并将打破在溶解和不溶解状态之间的平衡。结果,更多的反应物被不断溶解并最终转化为产物。
产物的溶解度是一个棘手的问题。假如产物是不可溶的,并从溶液中沉淀出来,那么,它会有助于平衡向右移动并增加收率。另一方面,沉淀也会带来一些问题,如沉淀黏附在催化剂上会使反应停止。然而,溶解度并不是选择溶剂时唯一要考虑的因素。对于不同的反应类型,需根据其作用机理选择合适的反应溶剂。
对于S N1 亲核取代反应,与非质子性溶剂相比,质子溶剂有较高的反应速率,这是因为质子性溶剂在速率决定步骤中有利于阴离子基团的离去;但在S N2 亲核取代反应中,质子性溶剂不利于反应的进行,这是由于阴离子在速率决定步骤中充当了亲核试剂,如果阴离子被溶剂化,它的活性降低。非质子性极性溶剂如二甲基亚砜有利于S N2 亲核取代反应,没有被溶剂化的阴离子会有较高的活性。例如,以二甲基亚砜为溶剂时,氰化钠与伯卤代烷发生S N2 亲核取代反应,0.5~2小时后就可得到腈;而在乙醇水溶液中,反应需进行1~4天。伯卤代烷发生亲核取代反应如下(图3-18)。

图3-18 伯卤代烷发生亲核取代反应
在氯霉素制备的胺化工艺中,卤代烃和乌洛托品先反应成盐,而后在乙醇中盐酸作用下水解得伯胺。成盐反应的反应物是卤代烃、产物是季铵盐,两者极性差别大,在三氯甲烷中反应物是可溶的,而产物可以结晶出来,通常不需要纯化(图3-19)。
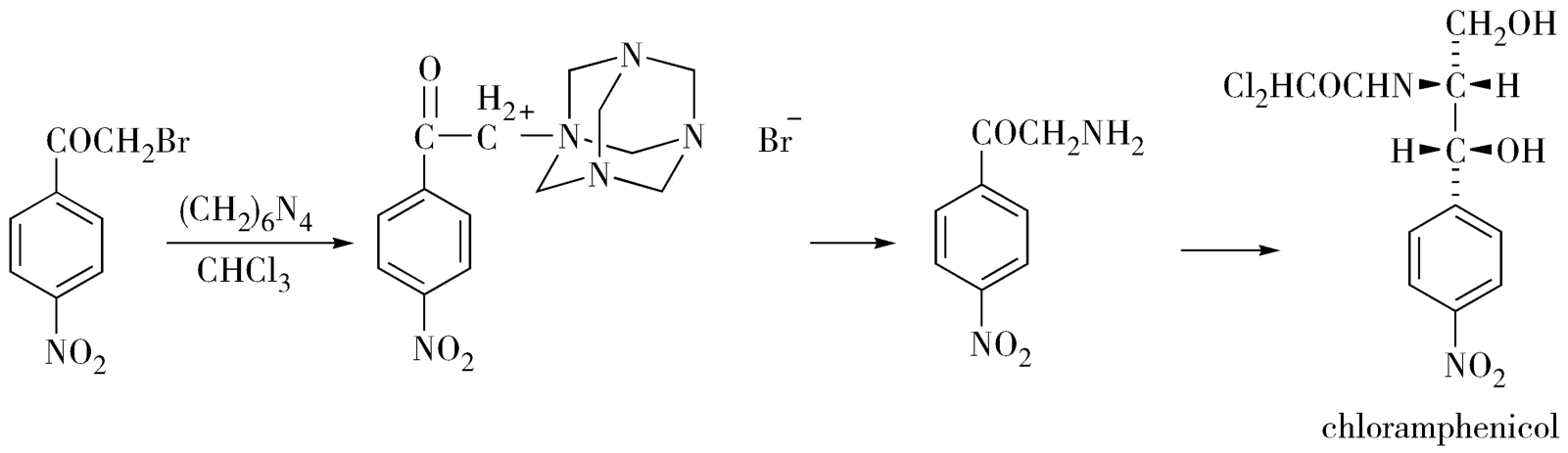
图3-19 氯霉素生产中的成盐反应
药物合成工艺的研究最终是为药物的工业化生产而服务的,因而,选择合适的溶剂对该研究是十分重要的,需考虑的除了前面提及的溶剂的性质及用量,还应考虑溶剂的安全性等。溶剂的燃点、闪点、蒸气压、蒸气密度及溶剂与空气混合可燃的比例范围等物理性质都决定着溶剂的安全性。因此,许多用于实验室小试阶段的溶剂在大规模生产时都会更换。如乙醚可用乙二醇二甲醚替换,后者的沸点及热容量都较高,且不易燃烧。
药品必须符合《中国药典》及相关的质量标准的规定,对其外观、物理常数、相关物质、含量都有严格要求。成品一般都需经过精制,目的是要除去由原辅料或副反应所引入的杂质。精制除杂的方法有很多,如蒸馏、精馏、萃取和柱层析等。对于固体产品来说,重结晶是最为常用的方法。溶剂的合适与否是重结晶成败的关键所在,理想的重结晶溶剂应是室温下产品仅微溶,而在该溶剂的沸点却相当易溶,且该溶剂应对杂质具有良好的溶解性。然而,在实际生产中很难找到理想的溶剂,通常应从以下几方面考虑重结晶溶剂的选取与应用。
1.相似相溶 重结晶溶剂选择的经验规则是“相似相溶”,即极性大的溶质就选用极性大的溶剂,极性小的溶质就选用极性小的溶剂。结构中含有易形成氢键的基团(如羟基、氨基、羧基等)的化合物在水或醇等溶剂中比在苯或烷烃等溶剂中的溶解度要好。如果功能基团并非分子的主要部分,那么其溶解度可能有很大变化。如正十二醇几乎不溶于水,它所具有的十二碳链使其性质更类似于烷烃。在生产实践中,经常应用两种或两种以上混合溶剂作为重结晶溶剂。其中一种溶剂为较易溶解欲纯化的化合物,另一种溶剂为较难溶解欲纯化的化合物。一般常用的混合溶剂有乙醇和水、乙醇和乙醚、乙醇和丙酮、乙醇和氯仿、二氧六环和水、乙醚和石油醚、氯仿和石油醚等,最佳混合溶剂的选择必须通过预试验来确定。
2.晶体状态 在选取重结晶溶剂时还应考虑所析出晶体的形状、大小等性质,因为它们对药物的溶解、给药剂量、疗效、体内吸收和代谢等诸多方面有着重要的影响。如利尿药螺内酯微晶化处理后得到较小的晶体,可使其服用剂量减少80%。又如泌尿系统药物呋喃妥因微晶化后会引起一些胃肠道的副反应,故要用较大结晶制成的剂型以降低药物的溶解速率,提高胃肠道的耐受性。
3.溶剂化 选择重结晶溶剂时还应考虑结晶产物与溶剂间的溶剂化问题。如果溶剂为水,药物就可能与水结合,形成结晶水合物,含有不同量的结晶水。如氨苄西林及阿莫西林既有三水合物,又有无水物,其中,前者的稳定性较好。同样,药物与有机溶剂形成溶剂化物,在水中的溶解度和溶解速率与非溶剂化物不同,其剂量和疗效就可能产生差别。
此外,药物是一类特殊的化学品,《中国药典》(2020年版)按ICH的规定,在药物的制备及纯化过程中一般避免使用第一类溶剂(表3-2),控制使用第二类溶剂(表3-3)。有毒的第一类溶剂对环境有害,并且有不可接受的毒性,应使用第三类溶剂代替,即低毒溶剂,限度为5000ppm,如我们常用的乙醇、丙酮、庚烷和异丙醇等。替代溶剂可能会对反应速率和结果产生影响,因此,优化过程中需用不同的溶剂做实验,测试它们对反应的影响。
表3-2 生产中避免使用的第一类溶剂

表3-3 生产中限制使用的第二类溶剂
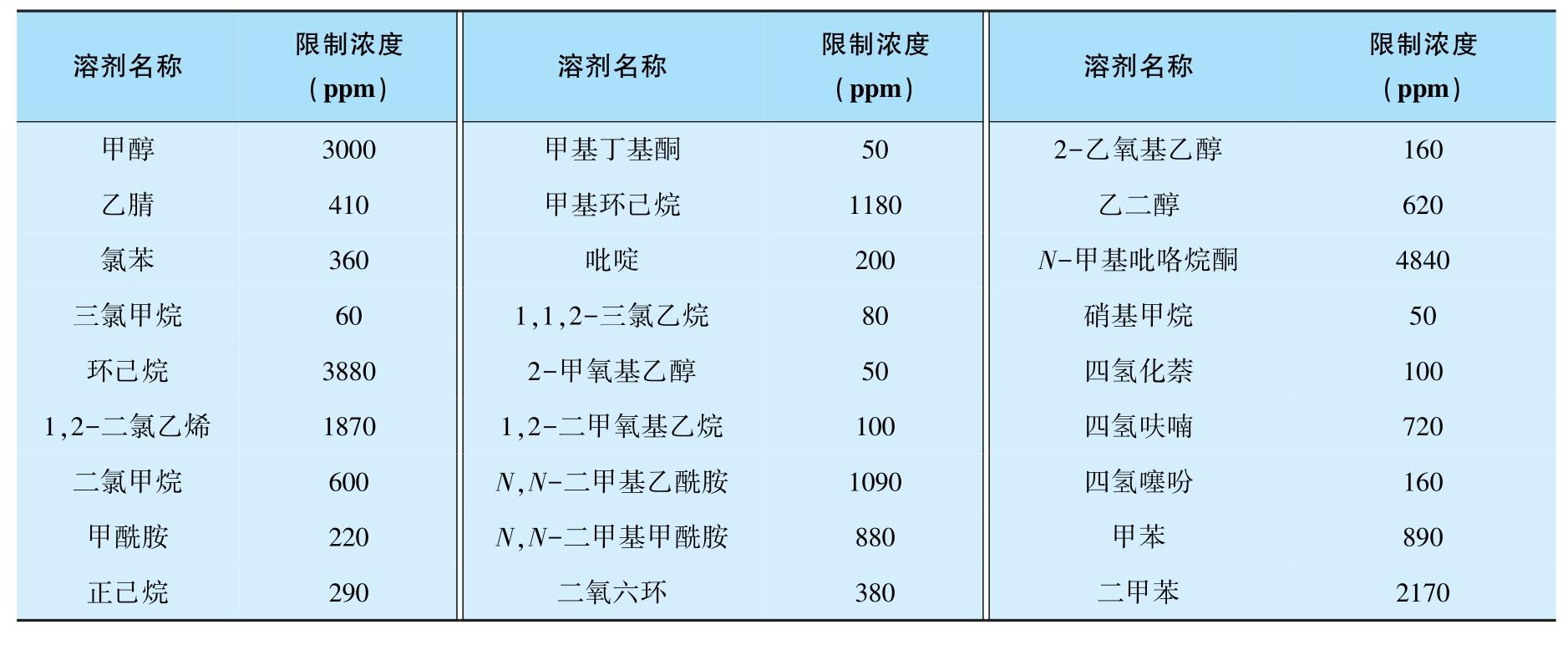
对于原料药,如果工艺中使用了第一类溶剂,需要提供充分的研究资料或文献资料予以说明第一类溶剂在工艺中使用的不可替代性。总之,要根据GMP相关规定,在工艺开发阶段应优先选择使用第三类溶剂,控制使用第二类溶剂,尽量避免使用第一类溶剂。
反应液的pH值对化学反应的结果有着较为重要的影响,也是药物合成工艺研究中不可缺少的内容。如制备红霉素二级降解产物红霉素A 6,9,12-螺缩酮的过程中,使用盐酸可以成功制得降解产物,而使用酸性较弱的醋酸时就得不到相应的降解产物(图3-20)。另外,某些化学反应需要在特定的pH值下才能发生,如当溶液pH值≤5时,任何浓度的甲酸溶液都难以发生银镜反应;而当9≤pH值≤12时,可产生较好的银白色致密银镜。
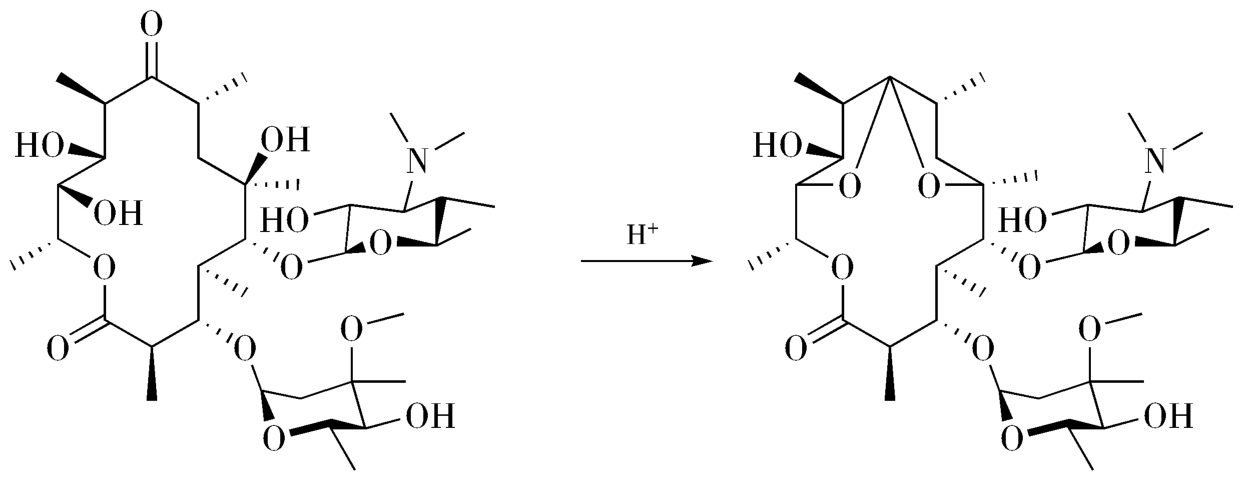
图3-20 红霉素酸性条件下的降解