




反应物浓度的改变对反应影响比较大。高浓度即溶剂量少时,反应物之间碰撞接触并发生化学反应的概率相应增加,反应速率也可能随之加快。然而,在高浓度的条件下很容易发生副反应,低浓度即溶剂量较大时,反应速率可能随之减慢,但溶剂可吸收热量,有利于控制快速放热反应的温度。因此,反应物的配料比与浓度的改变值是值得深入研究的。
反应物的配料比是指参加反应的各物质间量的比例关系,即反应物的浓度问题。利用质量作用定律可以计算出浓度对反应速率影响的程度,这种影响又因反应类型的不同而异。根据化学反应进行的过程,反应类型可分为简单反应和复杂反应两大类。
反应物分子经碰撞一步转化为生成物分子的反应称为基元反应。只包含一个基元反应的化学反应称为简单反应。基元反应是机理最简单的反应,它是以反应分子数或反应级数来分类的,如单分子反应、双分子反应、三分子反应等。
1.单分子反应 只有一个分子参与的基元反应称为单分子反应,其反应速率与反应物浓度的一次方成正比,故又称一级反应。多数一级反应为单分子反应,它的反应速率与反应物浓度成正比,速率方程式为:

式中: t 为反应时间; k 为速率常数; C 为浓度。
属于单分子反应类型的反应:①热分解反应,如烷烃的裂解。②某些水解反应,如叔卤代烷碱液的水解。③异构化反应,如顺反异构化。④某些重排反应,如Beckmann重排、克莱森重排、联苯胺重排。⑤酮式-烯醇式互变异构等。
例如,叔卤代烷的单分子E1消除反应,反应速率只与卤代烷的浓度有关,属于一级反应,其反应方程式及速率方程式如下:
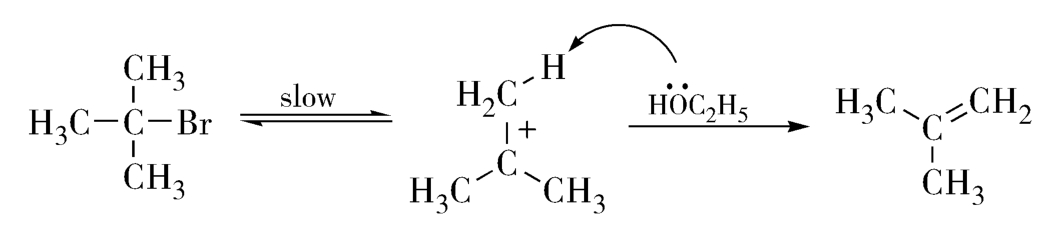
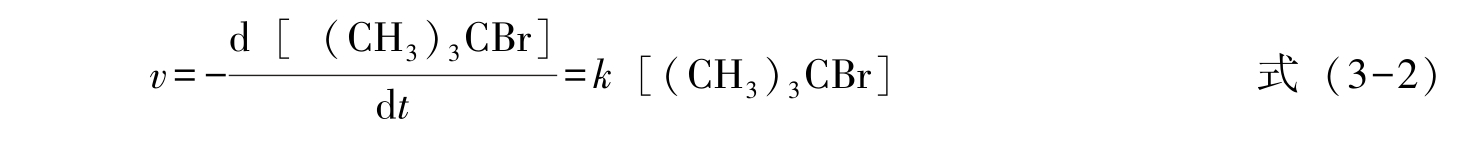
2.双分子反应 当两个分子相互碰撞而发生的反应称为双分子反应,即二级反应,它的反应速率与反应物浓度的乘积成正比。在溶液中进行的多数有机化学反应都属于这种类型,如取代反应(亲电取代、亲核取代)、加成反应及E2消除反应等,其反应速率方程为:

式中: t 为反应时间; k 为速率常数; C A 为反应物A的浓度; C B 为反应物B的浓度。
例如,伯卤代烃在碱性溶液中的水解属于二级反应。
3.零级反应 反应速率与反应物浓度无关的,仅受光强度、催化剂表面状态及酶活性等因素的影响的反应为零级反应,如某些生物降解反应、聚合反应、表面催化反应及电解反应等,其速率方程为:

式中: t 为反应时间; k 为速率常数; C 为浓度。
由两个或两个以上基元反应构成的化学反应称为复杂反应,主要包括可逆反应、平行反应及相连续反应等。
1.可逆反应 可逆反应是一种常见的复杂反应,即正方向的反应和逆方向的反应是同时进行的,质量作用定律同样适用。该类反应的特点是正反应进行的速率随时间延长而逐渐减小,逆反应速率随时间延长而逐渐增大,直至正逆反应速率相等,此时,反应物和生成物的浓度不再随时间变化而变化。为提高收率,可通过增加某一个反应物的浓度,以利于平衡向正方向移动,使产物量增加。此处,过量的反应物一般是廉价易得,并易于从反应混合物中分离除去。例如,醋酸和乙醇的酯化反应:
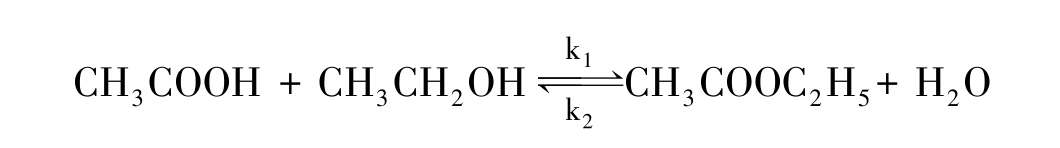
若醋酸和乙醇的起始浓度各为 C A 及 C B ,经过 t 时间后,产物乙酸乙酯及水的浓度为 x ,则醋酸的浓度为 C A - x ,乙醇的浓度为 C B - x ,依据质量作用定律,可知:
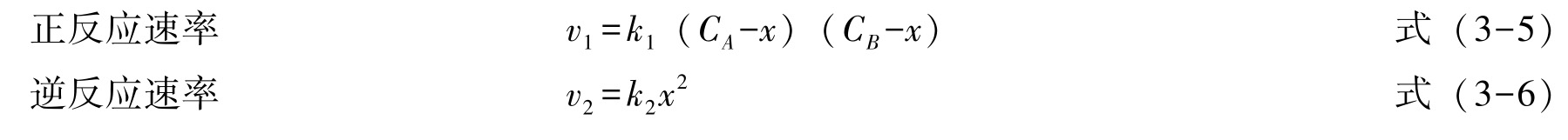
那么,总反应速率为:
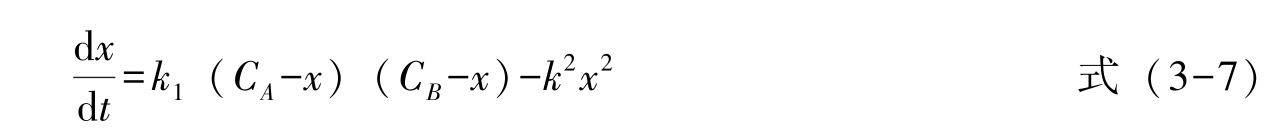
该可逆反应中,为提高正反应产物乙酸乙酯的收率,可采用移动化学平衡的方法,如除去生成物之一或增加反应物之一(通常为乙醇)的浓度,以利于正反应的进行。
在局麻药丁卡因(tetracaine,3-3)的合成过程中(图3-1),为提高其收率而增大反应物β-二甲基氨基乙醇(3-2)的用量,同时蒸出反应生成的乙醇。
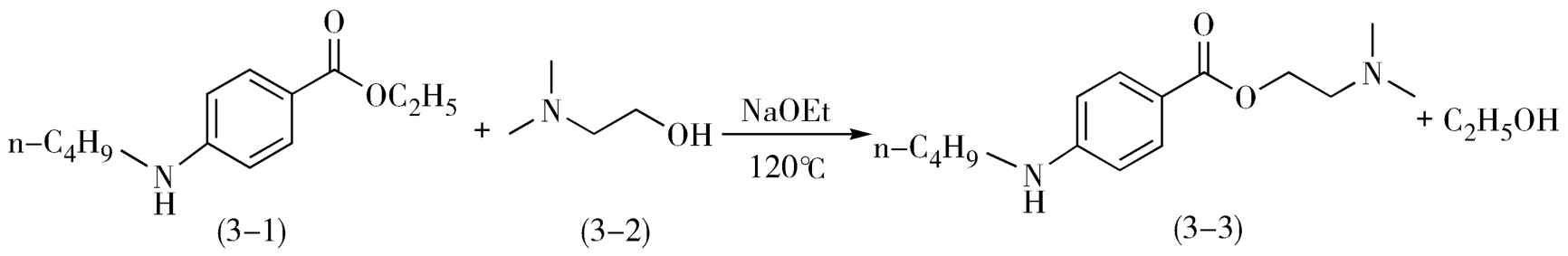
图3-1 局麻药丁卡因的合成
2.平行反应 平行反应又称竞争性反应,也是一种复杂反应,即在同一个反应物系统中同时进行着几种不同的化学反应,生成不同的产物。在生产上将目标反应称为主反应,其余的称为副反应,该类反应在有机反应中经常遇到,如氯苯(3-4)的硝化(图3-2):
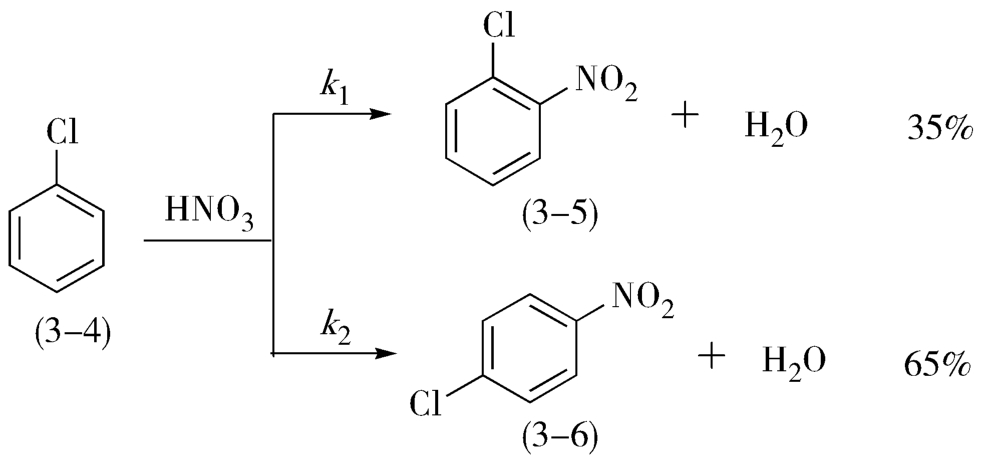
图3-2 氯苯的硝化
若反应物氯苯的初始浓度为 a ,硝酸的初始浓度为 b ,经过 t 时间后,生成邻硝基氯苯(3-5)和对硝基氯苯(3-6)的浓度分别为 x 、 y ,则其速率分别为:
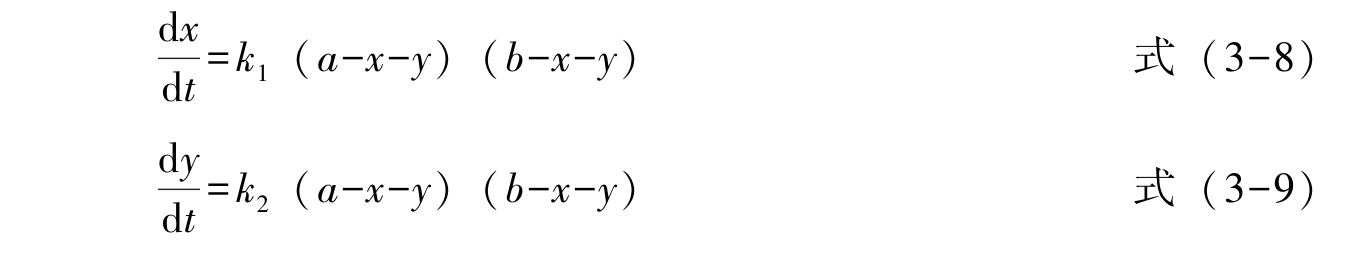
反应总速率为:
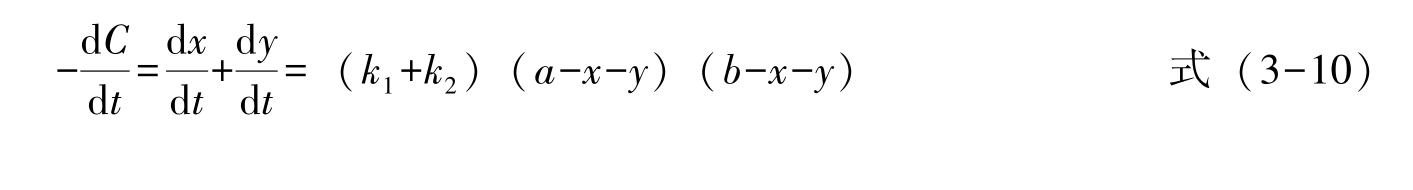
式中:
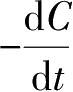 为反应物氯苯或硝酸的消耗速率。
为反应物氯苯或硝酸的消耗速率。
将两式相除得:

将上式积分得:

由式3-12可知,级数相同的平行反应,其反应速率之比为一常数,与反应物的浓度和反应时间无关。不论反应时间的长短,各生成物之间的比例是不变的。换言之,对于此类反应,不能采用改变反应物的摩尔比或反应时间的方法来改变各生成物间的比例。但是,我们可以通过改变温度、溶剂或催化剂等条件来调节生成物的比例。
通常情况下,增加反应物的浓度,对加快反应速率、提高设备使用能力及减少溶剂使用量等都是有利的。但是,绝大多数有机反应都是主、副反应共存的。因此,采用增加反应物浓度来加快反应速率的方法,也会使副反应速率提高。所以,应选择最适宜的浓度,以兼顾化学反应的整体因素。当遇到此类问题时,通常可从以下几方面考虑:
1.当反应为可逆反应时,增加一种反应物的浓度或从反应体系中不断移走生成物之一,可以提高正反应速率并增加产物的收率。
例如,制备用于合成甲磺酸艾瑞布林(eribulin mesylate)的中间体(3-8)的过程中,采用缩酮的结构对醇羟基进行保护(图3-3)。此反应中,采用甲苯为溶剂(沸点为110℃),将该反应中生成的水从反应体系中移走,促使平衡向右移动。
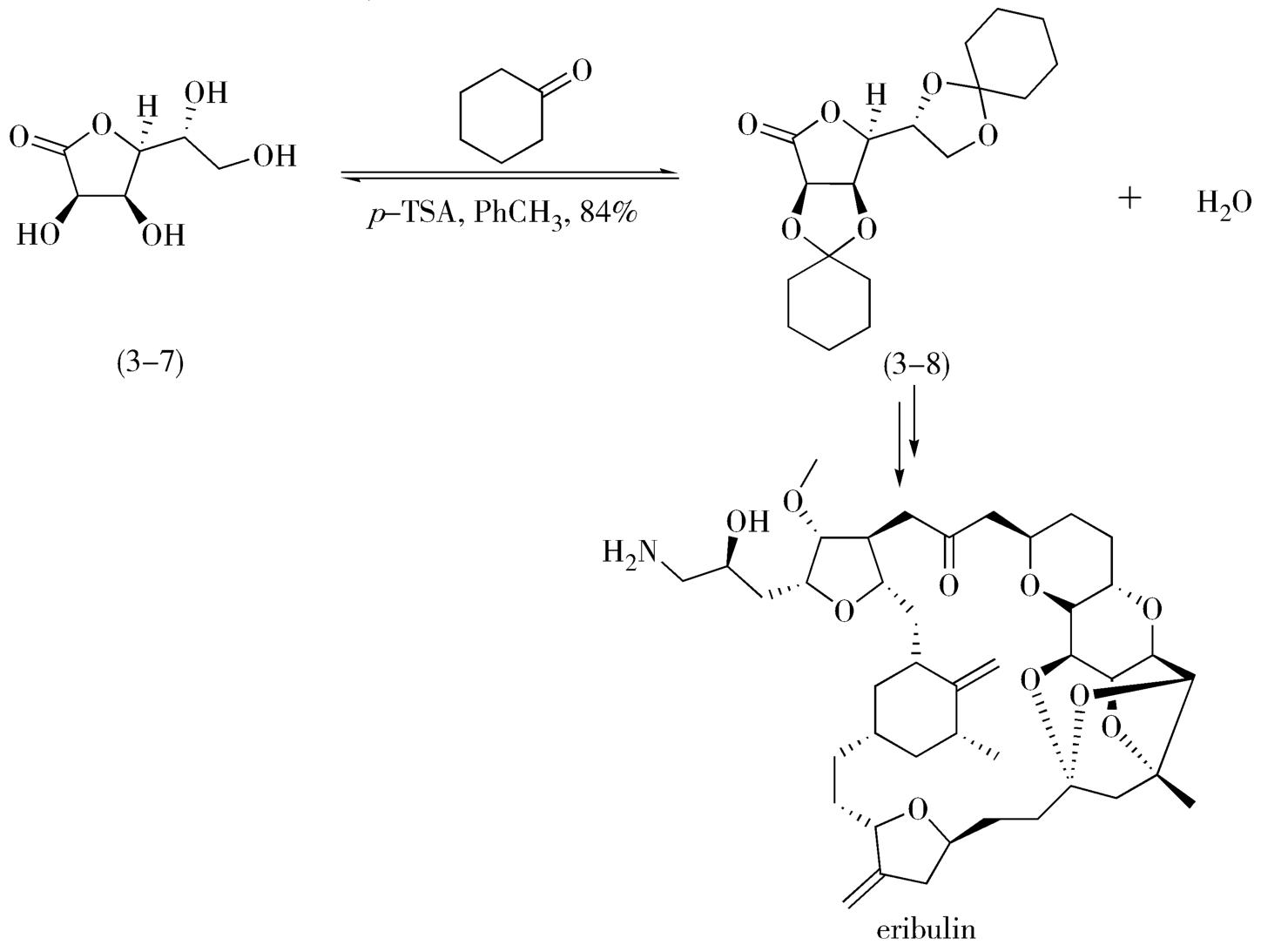
图3-3 甲磺酸艾瑞布林合成中间体的制备
2.当产物的生成量取决于反应液中某一反应物的浓度时,则应增加其配比。此时,应考虑到经济效益等因素,最佳配料比是在使主产物收率较高的同时,又能节约原料(即降低单耗)的配比。
在某些反应中,使某一试剂或原料过量来获得更多的目标产物的方法是非常必要的。例如,阿立哌唑(aripiprazole)是一个第三代抗精神病药,单醚产物(3-10)是其合成工艺中的一个中间体(图3-4),它是由7-羟基-3,4-二氢-2(1H)-喹啉酮(3-9)与1,4-二溴丁烷反应制得的。除(3-10)外,还可得到二醚产物(3-11),单独考虑减少二醚产物的生成量,应使用等量的反应物。但是,由于单醚产物(3-10)与1,4-二溴丁烷竞争喹啉酮(3-9),结果得到的产物应是混合物。因此,为了提高单醚产物的比例,应使用过量的1,4-二溴丁烷。
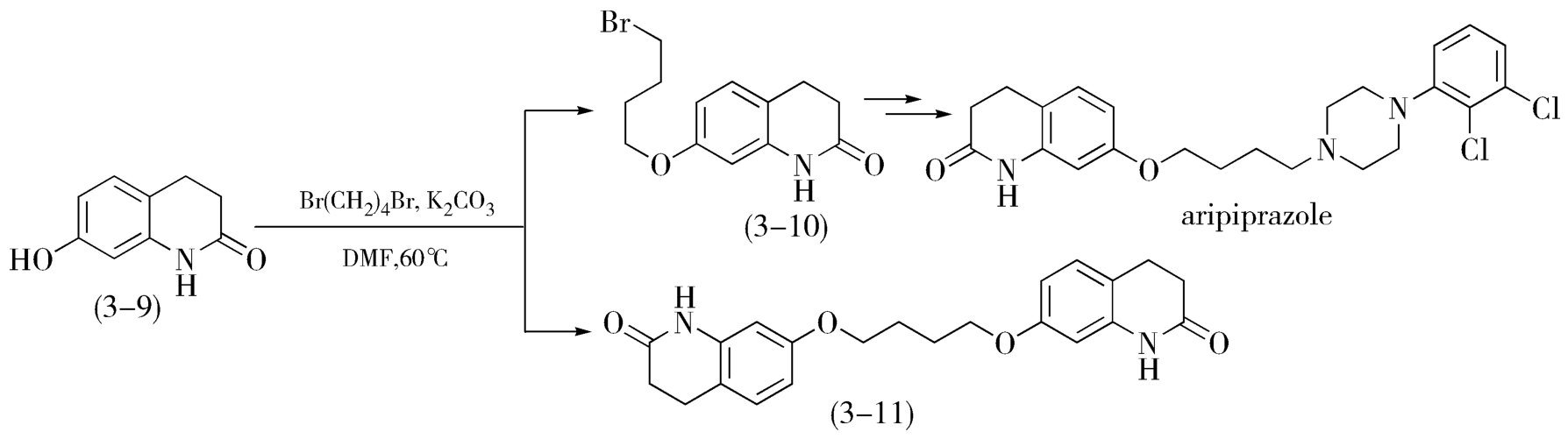
图3-4 阿立哌唑合成中间体的制备
又如磺胺的合成过程中,乙酰苯胺的氯磺化反应产物对乙酰氨基苯磺酰氯(3-12,简称ASC)的收率取决于反应液中氯磺酸与硫酸两者的浓度关系(图3-5):
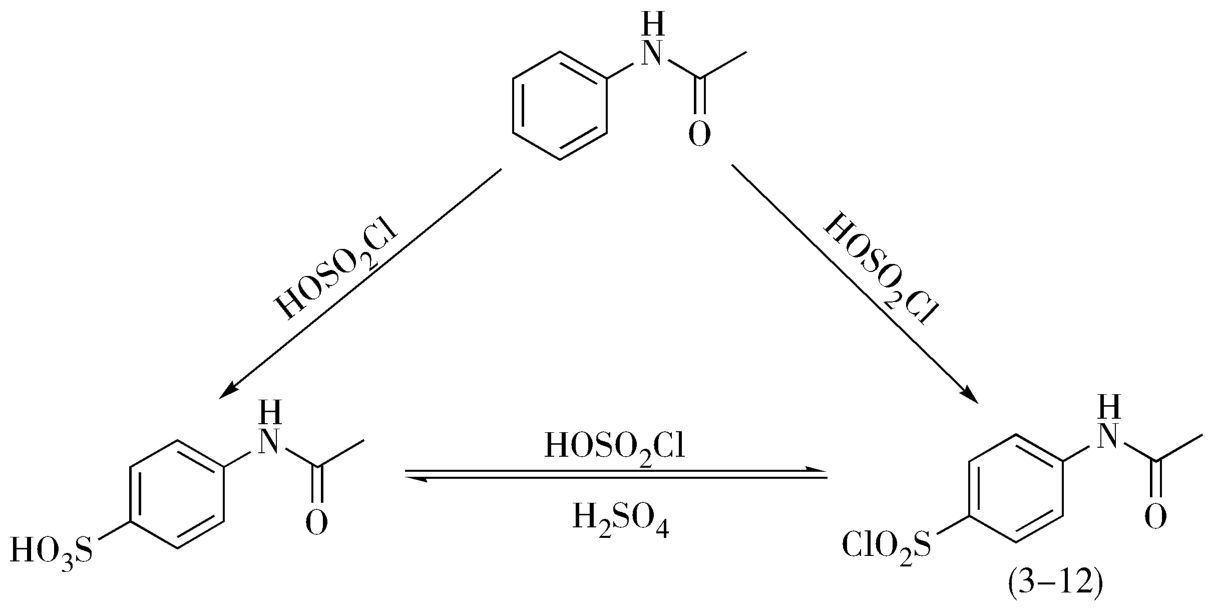
图3-5 乙酰苯胺的氯磺酰化反应
当乙酰苯胺与氯磺酸的投料量为理论量(1∶2)时,ASC的收率为7%;当摩尔比为1∶4.8时,ASC的收率为84%;当摩尔比增加至1∶7时,收率可达87%。氯磺酸的用量越多,与硫酸的浓度比越大,对ASC的生成越有利。在生产实际中,考虑到氯磺酸的有效利用率、生产安全及经济核算等因素,采用了较为经济合理的配比,即1∶4.5~1∶5。
3.当反应中有一种反应物不稳定时,则需增加其用量,以保证其有足够的量参与反应。如合成巴比妥类药物(3-14),其最后一步环合反应通常是用取代的丙二酸二乙酯(3-13)与尿素环合(图3-6)。在碱性条件下,尿素受热易分解,所以必须要用过量的尿素(生产上一般过量60%左右)。
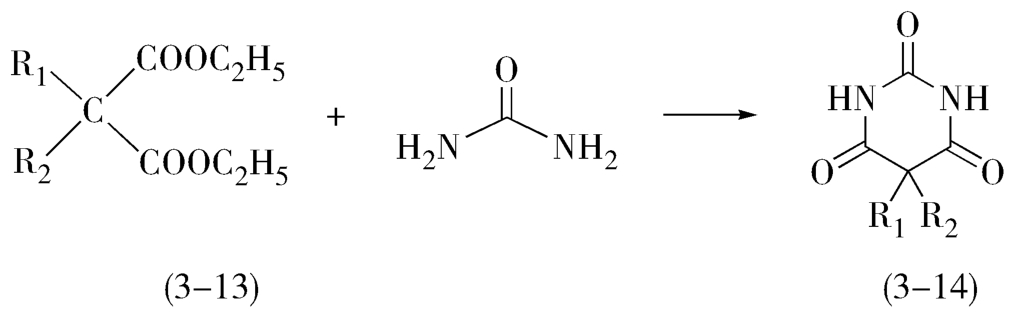
图3-6 巴比妥类药物的合成
4.当参与主、副反应的反应物不尽相同时,应利用这一差异,增加某一反应物的用量,以增强主反应的竞争力。例如,制备氟哌啶醇过程中的中间体4-对氯苯基-1,2,3,6-四氢吡啶(3-16)可由对氯 a -甲基苯乙烯(3-15)与甲醛、氯化铵作用,再经酸性重排而得(图3-7)。
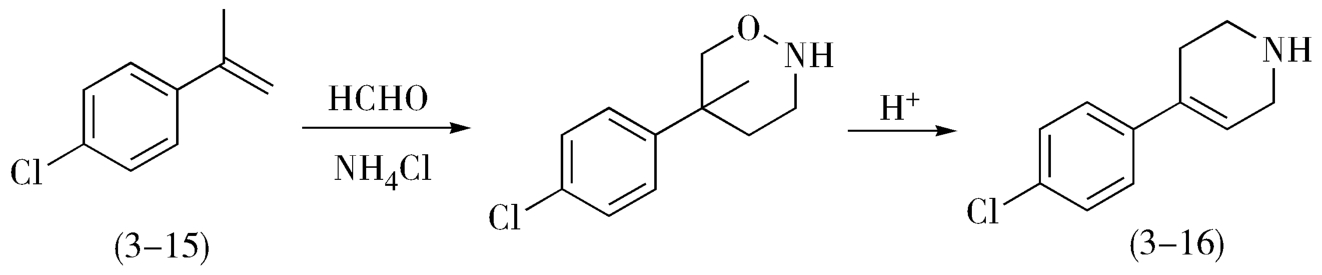
图3-7 氟哌啶醇的中间体的合成
然而,对氯 a -甲基苯乙烯(3-15)与甲醛会发生副反应(图3-8),生成1,3-二氧六环衍生物(3-17)。这个反应可以看作是正反应的一个平行反应,为了抑制此副反应,投料时可适当增加氯化铵的用量,生产上氯化铵的用量超过理论量的100%。
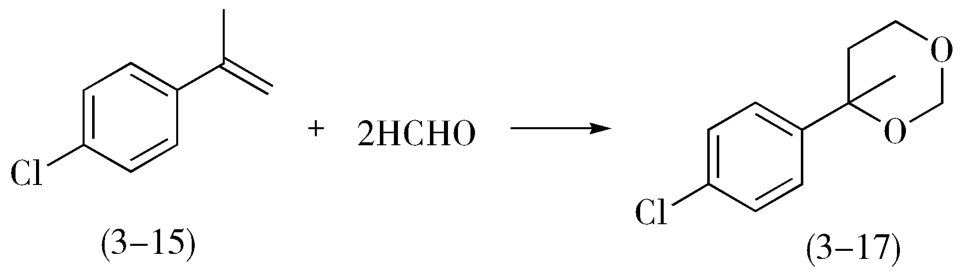
图3-8 氟哌啶醇的中间体合成过程中的副反应
5.为了防止连续反应(副反应)的发生,有些反应物的配料比宜小于理论量,使反应进行到一定程度后就终止了。例如,在无水AlCl 3 催化下,将乙烯通入苯(3-18)中制得乙苯(3-19)。由于乙基的给电子效应,使苯环活化,更容易发生亲电取代反应而引入第二个乙基,如有足够量的乙烯,最终将得到多取代的苯。所以,生产上一般控制乙烯与苯的摩尔比为0.4∶1左右,这样乙苯的收率高(图3-9)。
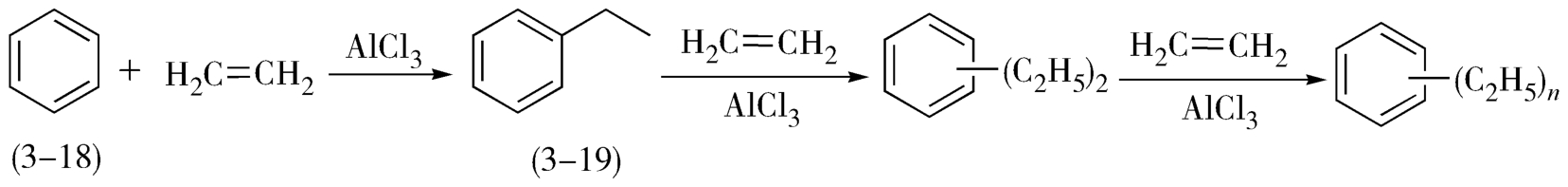
图3-9 苯的乙基化
此外,如果反应物兼作溶剂时,其配量要相应增加。
6.当开始一个新反应时,主辅料的摩尔比一般为1∶1.2,反应物浓度10%开始进行反应条件的探索,再根据实验的实际情况加以调整。