




医药商品在我国种类繁多,品种复杂,其在生产、技术、销售和消费方面的特点各不相同。为了科学合理地使用和管理临床应用的数以万种错综复杂的医药商品,控制产品的使用风险,减少管理成本,提高管理效率,有必要对医药商品进行分类管理。对医药商品实行正确的分类,可以帮助医药企业针对自己所生产和经营的产品类别正确掌握其生产、经营上的特征、特点,从而更有效地选择销售渠道,确定适宜的价格策略和促销措施,制定出最佳的市场营销组合。同时有利于医药企业提高经营管理能力、改善服务水平。药品编码是建立在药品分类和药品目录编制工作基础上的,是药品的“身份证”。
药品分类是指为满足某种需要,根据不同的目的,选择不同的分类标志或者特征,将药品集合总体科学、系统地划分为不同的大类、中类、小类、品类或者品目、品种乃至规格、等级等的过程,在此基础上再进行系统的编排,进而形成有层次、逐级展开分类体系的过程。或者是指根据药品的属性或特征,按照一定的原则和方法,将药品进行区分和归类,并建立一定的分类系统和排列顺序,以满足某种需要。
药品分类的原则是建立药品科学分类体系的重要依据。为了使药品分类能满足特定的目的和要求,在药品分类时应遵循以下五项原则。
1.系统性原则 指依据药品的某些共性进行分类,从而构成分类体系。在进行系统分类时,应充分考虑新产品可能不断涌现,在分类体系中应设计新产品出现的位置。如片剂中后来出现的泡腾片、分散片等。
2.简明性原则 指在药品分类时方法应该科学、合理;标记应该有明显的特征,能够一目了然;术语应该通俗易懂;层次应该清晰明了,从而使得管理手段简便、快速、准确。如植物类中药材的分类按照入药部位可分为根及根茎类、茎木类、叶类、花类、皮类、果实种子类、全草类等。
3.专一性原则 指药品在分类后,一种药品不允许同时出现在两个或者多个类别中,即只能出现在一个类别中。这就是要求在选择分类标志时,能从本质上明显区别各类药品之间的差异,保证分类清楚。如抗真菌药分为抗生素类抗真菌药、唑类抗真菌药、其他抗真菌药。某一具体的抗真菌药品只能在这三种类别的某一类别里,而不能同时出现在两个类别中。
4.稳定性原则 指药品分类除考虑现实状况,也要符合药品发展的客观规律,即使分类的目录发生改变,整个分类结构也不会遭到破坏,进而保持相对稳定。
5.协调性原则 指药品分类体系具有适用性和协调性,让分类的结构更合理。
药品分类的方法有多种,按照不同的分类目的有不同的分类方法,几乎药学的每一个学科都有按照本学科特点的分类方法,各有侧重点,很难找到一个为药品生产企业、药品经营企业、临床医生及患者共同能接受的分类方法。
药品按照来源和性状不同可分为三大类:中药(天然药物)、化学合成药物和生物制品。
1.中药(天然药物) 指以自然界中动物、植物和矿物三大类天然资源加工而成的药物,在我国已经有数千年的使用历史。可分为中药材、中药饮片、中成药和中药提取物。
(1)中药材 指未经加工或仅经过产地简单加工的中药原料。
(2)中药饮片 指药材经过炮制后可直接用于中医临床或制剂生产使用的处方药品。
(3)中成药 以中药饮片为原料,是在中医理论指导下,为了预防及治疗疾病的需要,按规定的处方和制法大批量生产,具特有名称,并标明适应证或功能主治、用法用量和规格,实行批准文号管理的药品。
中药按照不同的分类方法又可以分成很多种,如按来源、按入药部位、按药物的功能主治等进行分类。
(4)中药提取物 指经过一定的提取方式从植物、动物、矿物中获得的挥发油、油脂、浸膏、流浸膏、干浸膏、有效成分、有效部位等,均为中药提取物。
2.化学合成药 指以化学理论为指导,依据化学规律研究和生产的合成药物。特点是对疾病治疗效果明显,显效快,但常常有不同的毒副作用。又分为全人工合成品,如对乙酰氨基酚等;半人工合成品,如琥乙红霉素等。
3.生物制品 指以微生物、细胞、动物或人源组织和体液等为初始原材料,用微生物学技术制成,用于预防、治疗和诊断人类疾病的制剂,如疫苗、血液制品、生物技术药物、微生态制剂、免疫调节剂、诊断制品等。
生物制品按用途可分为预防类生物制品、治疗类生物制品和诊断类生物制品三类。
剂型是指将原料药加工制成适合于医疗或预防应用的形式,是药品施于机体前的最后形式。剂型选择恰当与否直接关系到药物防病治病的速度和效果。良好的剂型能最大限度地发挥药物的疗效,减少毒副作用。
《中国药典》2020年版四部(制剂通则0100)收载37种剂型。制剂通则中原料药物指用于制剂制备的活性物质,包括中药、化学药、生物制品原料药物。中药原料药物指饮片、植物油脂、提取物、有效成分或有效部位;化学原料药物指化学合成、或来源于天然物质或采用生物技术获得的有效成分(即原料药);生物制品原料药物指生物制品原液或将生物制品原液干燥后制成的原粉。
本制剂通则适用于中药、化学药和治疗用生物制品;预防类生物制品,应符合《中国药典》2020年版三部相应品种项下的有关要求。
1.片剂 指原料药物或与适宜的辅料制成的圆形或异形的片状固体制剂。中药还有浸膏片、半浸膏片和全粉片等。片剂以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、泡腾片、阴道片、缓释片、控释片、包衣片、肠溶片与口崩片等。
(1)普通片 即素片,指原料药物或与适宜的辅料制成的片剂。
(2)含片 指含于口腔中而缓慢溶化产生局部或全身作用的片剂。含片中的原料一般是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部麻醉等作用。
(3)舌下片 指置于舌下能迅速溶化,药物经舌下黏膜吸收发挥全身作用的片剂。舌下片中的原料药物应易于直接吸收,主要适用于急症的治疗。
(4)口腔贴片 指贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
(5)咀嚼片 指于口腔中咀嚼后吞服的片剂。
(6)分散片 指在水中能迅速崩解并均匀分散的片剂。分散片中的原料药物应是难溶性的。分散片可加水分散后口服,也可含于口中吮服或吞服。
(7)可溶片 指临用前能溶解于水的非包衣片或薄膜包衣片剂。可溶片应溶解于水中,溶液可呈轻微乳光,可供口服、外用、含漱等用。
(8)泡腾片 指含有碳酸氢钠和有机酸,遇水可产生气体而呈泡腾状的片剂。泡腾片不得直接吞服。泡腾片中的原料药物应是易溶性的,加水产生气泡后应能溶解。有机酸一般用枸橼酸、酒石酸、富马酸等。
(9)阴道片与阴道泡腾片 指置于阴道内使用的片剂。阴道片与阴道泡腾片的形状应易置于阴道内,可借助器具将片剂送入阴道。阴道片在阴道内应易溶化、溶散或融化、崩解并释放药物。具有局部刺激性的药物,不得制成阴道片。
(10)缓释片 指在规定的释放介质中缓慢地非恒速释放药物的片剂。
(11)控释片 指在规定的释放介质中缓慢地恒速释放药物的片剂。
(12)肠溶片 指用肠溶性包衣材料进行包衣的片剂。为防止原料药物在胃内分解失效、对胃的刺激或控制原料药物在肠道内定位释放,可对片剂包肠溶衣;为治疗结肠部位疾病等,可对片剂包结肠定位肠溶衣。除说明书标注可掰开服用外,一般不得掰开服用。
(13)口崩片 指在口腔内不需要用水即能迅速崩解或溶解的片剂。
2.注射剂 指原料药物或与适宜的辅料制成的供注入体内的无菌制剂。注射剂可分为注射液、注射用无菌粉末与注射用浓溶液等。
(1)注射液 指原料药物或与适宜的辅料制成的供注入体内的无菌液体制剂,包括溶液型、乳浊液型或混悬型等注射液。中药注射剂不宜制成混悬型注射液。乳状液型注射液,不得用于椎管内注射。混悬型注射液不得用于静脉注射或椎管内注射。
(2)注射用无菌粉末 指原料药物或与适宜的辅料制成的供临用前用无菌溶液配制成注射液的无菌粉末或无菌块状物,一般采用无菌分装或冷冻干燥法制得。可用适宜的注射用溶剂配制后注射,也可用静脉输液配制后滴注。以冷冻干燥法制备的生物制品注射用无菌粉末,也可称为注射用冻干制剂。
(3)注射用浓溶液 指原料药物与适宜的辅料制成的供临用前稀释后静脉滴注用的无菌浓溶液。
3.胶囊剂 指原料药物或与适宜辅料充填于空心胶囊或密封于软质囊材中制成的固体制剂。分为硬胶囊和软胶囊,根据释放特性不同还有缓释胶囊、控释胶囊、肠溶胶囊等。
(1)硬胶囊(通称为胶囊) 指采用适宜的制剂技术,将原料药物或加适宜辅料制成的均匀粉末、颗粒、小片、小丸、半固体或液体等,充填于空心胶囊中的胶囊剂。
(2)软胶囊 指将一定量的液体原料药物直接包封,或将固体原料药物溶解或分散在适宜的辅料中制备成溶液、混悬液、乳状液或半固体,密封于软质囊材中的胶囊剂。
(3)肠溶胶囊 指用肠溶材料包衣的颗粒或小丸充填胶囊而制成的硬胶囊,或用适宜的肠溶材料制备而得的硬胶囊或软胶囊。肠溶胶囊不溶于胃液,但能在肠液中崩解而释放活性成分。
(4)缓释胶囊 指在规定的释放介质中缓慢地非恒速释放药物的胶囊剂。
(5)控释胶囊 指在规定的释放介质中缓慢地恒速释放药物的胶囊剂。
4.颗粒剂 指原料药物与适宜的辅料混合制成具有一定粒度的干燥颗粒状制剂。分为可溶颗粒(通称为颗粒)、混悬颗粒、泡腾颗粒,根据释放特性不同还有缓释颗粒等。
(1)混悬颗粒 指难溶性原料药物与适宜的辅料混合制成的颗粒剂。临用前加水或其他适宜的液体振摇即可分散成混悬液。
(2)泡腾颗粒 指含有碳酸氢钠和有机酸,遇水可放出大量气体而呈泡腾状的颗粒剂。泡腾颗粒中的原料药物应是易溶性的,加水产生气泡后应能溶解。有机酸一般用枸橼酸、酒石酸等。
(3)肠溶颗粒 指采用肠溶材料包裹颗粒或其他适宜方法制成的颗粒剂。肠溶颗粒耐胃酸而在肠液中释放活性成分或控制药物在肠道内定位释放,可防止药物在胃内分解失效,避免对胃的刺激。
(4)缓释颗粒 指在规定的释放介质中缓慢地非恒速释放药物的颗粒剂。
5.眼用制剂 指直接用于眼部发挥治疗作用的无菌制剂。眼用制剂分为液体制剂、半固体制剂和固体制剂。眼用液体制剂可以固态形式包装,另备溶剂,在临用前配成溶液或混悬液。
(1)滴眼剂 指由原料药物与适宜的辅料制成的供滴入眼内的无菌液体制剂。
(2)洗眼剂 指由原料药物制成的无菌澄明水溶液,供冲洗眼部异物或分泌液、中和外来化学物质的眼用液体制剂。
(3)眼内注射溶液 指由原料药物与适宜的辅料制成的无菌液体,供眼部周围组织或眼内注射的无菌眼用液体制剂。
(4)眼膏剂 指由原料药物与适宜基质均匀混合,制成溶液型或混悬型膏状的无菌眼用半固体制剂。
(5)眼用乳膏剂 指由原料药物与适宜基质均匀混合,制成乳膏状的无菌眼用半固体制剂。
(6)眼用凝胶剂 指原料药物与适宜辅料制成的凝胶状的无菌眼用半固体制剂。
(7)眼膜剂 指原料药物与高分子聚合物制成的无菌药膜,可置于结膜囊内缓慢释放药物的眼用固体制剂。
(8)眼丸剂 指原料药物与适宜辅料制成的球形、类球形的无菌眼用固体制剂。
(9)眼内插入剂 指原料药物与适宜辅料制成的适当大小和形状、供插入结膜囊内缓慢释放药物的无菌眼用固体制剂。
6.鼻用制剂 指直接用于鼻腔,发挥局部或全身治疗作用的制剂。鼻用制剂分为液体制剂、半固体制剂和固体制剂。鼻用液体制剂也可以固态形式包装,配套专用溶剂,在临用前配成溶液或混悬液。
(1)滴鼻剂 指由原料药物与适宜辅料制成的澄明溶液、混悬液或乳状液,供滴入鼻腔用的鼻用液体制剂。
(2)洗鼻剂 指由原料药物制成符合生理pH值范围的等渗水溶液,用于清洗鼻腔的鼻用液体制剂,用于伤口或手术前使用者应无菌。
(3)鼻用气雾剂 指由原料药物和附加剂与适宜抛射剂共同装封于耐压容器中,内容物经雾状喷出后,经鼻吸入沉积于鼻腔的制剂。
(4)鼻用喷雾剂 指由原料药物与适宜辅料制成的澄明溶液、混悬液或乳状液,供喷雾器雾化的鼻用液体制剂。
(5)鼻用软膏剂 指由原料药物与适宜基质均匀混合,制成溶液型或混悬型膏状的鼻用半固体制剂。
(6)鼻用乳膏剂 指由原料药物与适宜基质均匀混合,制成乳膏状的鼻用半固体制剂。
(7)鼻用凝胶剂 指由原料药物与适宜辅料制成的凝胶状的鼻用半固体制剂。
(8)鼻用散剂 指由原料药物与适宜辅料制成的粉末,用适当的工具吹入鼻腔的鼻用固体制剂。
(9)鼻用粉雾剂 指由原料药物与适宜辅料制成的粉末,用适当的给药装置喷入鼻腔的鼻用固体制剂。
(10)鼻用棒剂 指由原料药物与适宜基质制成棒状或类棒状,供插入鼻腔用的鼻用固体制剂。
7.栓剂 指原料药物与适宜基质制成供腔道给药的固体制剂。栓剂因施用的腔道不同,可分为直肠栓、阴道栓和尿道栓。直肠栓为鱼雷形、圆锥形或圆柱形等;阴道栓为鸭嘴形、球形或卵形等;尿道栓一般为棒状。
8.丸剂 指原料药物与适宜的辅料制成的球形或类球形的固体制剂。丸剂包括蜜丸、水蜜丸、水丸、糊丸、蜡丸、浓缩丸、滴丸和糖丸等。
(1)蜜丸 指饮片细粉以炼蜜为黏合剂制成的丸剂。其中每丸重量在0.5g(含0.5g)以上的称为大蜜丸,每丸重量在0.5g以下的称为小蜜丸。
(2)水蜜丸 指饮片细粉以炼蜜和水为黏合剂制成的丸剂。
(3)水丸 指饮片细粉以水(或根据制法用黄酒、醋、稀药汁、糖液、含5%以下炼蜜的水溶液等)为黏合剂制成的丸剂。
(4)糊丸 指饮片细粉以米粉、米糊或面糊为黏合剂制成的丸剂。
(5)蜡丸 指饮片细粉以蜂蜡为黏合剂制成的丸剂。
(6)浓缩丸 指饮片或部分饮片提取浓缩后,与适宜的辅料或其余饮片细粉,以水、炼蜜或炼蜜和水为黏合剂而制成的丸剂。根据所用黏合剂的不同,分为浓缩水丸、浓缩蜜丸、浓缩水蜜丸等。
(7)滴丸 指原料药物与适宜的基质加热熔融混匀,滴入不相混溶、互不作用的冷凝介质中制成的球形或类球形制剂。
(8)糖丸 指以适宜大小的糖粒或基丸为核心,用糖粉和其他辅料的混合物作为撒粉材料,选用适宜的黏合剂或润湿剂制丸,并将原料药物以适宜的方法分次包裹在糖丸中而制成的制剂。
9.软膏剂、乳膏剂
(1)软膏剂 指原料药物与油脂性或水溶性基质混合制成的均匀的半固体外用制剂。因原料药物在基质中分散状态不同,分为溶液型软膏剂和混悬型软膏剂。溶液型软膏剂为原料药物溶解(或共熔)于基质或基质组分中制成的软膏剂;混悬型软膏剂为原料药物细粉均匀分散于基质中制成的软膏剂。
(2)乳膏剂 指原料药物溶解或分散于乳状液型基质中形成的均匀半固体制剂。
10.糊剂 指大量的原料药物固体粉末(一般25%以上)均匀地分散在适宜的基质中所组成的半固体外用制剂。可分为含水凝胶性糊剂与脂肪糊剂。
11.喷雾剂 指原料药物或与适宜辅料填充于特制的装置中,使用时借助手动泵的压力、高压气体、超声振动或其他方法将内容物呈雾状物释出,用于肺部吸入或直接喷至腔道黏膜、皮肤等的制剂。
喷雾剂按内容物组成分为溶液型、乳状液型或混悬型。按用药途径分为吸入喷雾剂、鼻用喷雾剂及用于皮肤、黏膜的非吸入喷雾剂。按给药定量与否,喷雾剂可分为定量喷雾剂和非定量喷雾剂。
12.气雾剂 指原料药物或原料药物和附加剂与适宜的抛射剂共同封装于具有特制阀门系统的耐压容器中,使用时借助抛射剂的压力将内容物呈雾状物喷出,用于肺部吸入或直接喷至腔道黏膜、皮肤的制剂。
按用药途径分为吸入气雾剂、非吸入气雾剂。按处方组成可分为二相气雾剂和三相气雾剂。按给药定量与否,可分为定量气雾剂和非定量气雾剂。
(1)吸入气雾剂 指原料药物或原料药物和附加剂与适宜抛射剂共同装封于具有定量阀门系统和一定压力的耐压容器中,形成溶液、混悬液或乳液,使用时借助抛射剂的压力,将内容物呈雾状物喷出而用于肺部吸入的制剂。
(2)鼻用气雾剂 指经鼻吸入沉积于鼻腔的制剂。揿压阀门可定量释放活性物质。
13.凝胶剂 指原料药物与能形成凝胶的辅料制成的具有凝胶特性的稠厚液体或半固体制剂。除另有规定外,凝胶剂限局部用于皮肤及体腔,如鼻腔、阴道和直肠。
14.散剂 指原料药物或与适宜的辅料经粉碎、均匀混合制成的干燥粉末状制剂,分口服散剂和局部用散剂。
(1)口服散剂 指溶于或分散于水、稀释液或其他液体中服用,也可直接用水送服。
(2)局部散剂 指可供皮肤、口腔、咽喉、腔道等处应用;专供治疗、预防和润滑皮肤的散剂也可称为撒布剂或撒粉。
15.糖浆剂 指含有原料药物的浓蔗糖水溶液。
16.搽剂 指原料药物用乙醇、油或适宜的溶剂制成的液体制剂,供无破损皮肤揉擦用。
17.涂剂 指含原料药物的水性或油性溶液、乳浊液、混悬液,供临用前用消毒纱布或棉球等柔软物料蘸取或涂于皮肤或口腔与喉部黏膜的液体制剂。也可为临用前用无菌溶剂制成溶液的无菌冻干制剂,供创伤面涂抹治疗用。
18.涂膜剂 指原料药物溶解或分散于含成膜材料的溶剂中,涂搽患处后形成薄膜的外用液体制剂。
19.酊剂 指将原料药物用规定浓度的乙醇提取或溶解而制成的澄清液体制剂,也可用流浸膏稀释制成。供口服和外用。
20.贴剂 指原料药物与适宜的材料制成的供粘贴在皮肤上的可产生全身性或局部作用的一种薄片状制剂。
21.贴膏剂 指将原料药物与适宜的基质制成膏状物、涂布于背衬材料上供皮肤贴敷、可产生全身性或局部作用的一种薄片状柔性制剂。包括凝胶贴膏(原巴布膏剂或凝胶膏剂)和橡胶贴膏(原橡胶膏剂)。
(1)凝胶贴膏 指原料药物与适宜的亲水性基质混匀后涂布于背衬材料上制成的贴膏剂。
(2)橡胶贴膏 指原料药物与橡胶等基质混匀后涂布于背衬材料上制成的贴膏剂。
22.口服溶液剂、口服混悬剂与口服乳剂
(1)口服溶液剂 指原料药物溶解于适宜溶剂中制成的供口服的澄清液体制剂。
(2)口服混悬剂 指难溶性固体原料药物分散在液体介质中制成的供口服的混悬液体制剂。也包括浓混悬剂或干混悬剂。非难溶性药物也可以根据临床需求制备成干混悬剂。
(3)口服乳剂 指用两种互不相溶的液体将药物制成的供口服等胃肠道给药的水包油型液体制剂。
23.植入剂 指原料药物与辅料制成的供植入人体内的无菌固体制剂。植入剂一般采用特制的注射器植入,也可以手术切开植入。植入剂在体内持续释放药物,并应维持较长的时间。
24.膜剂 指原料药物与适宜的成膜材料经加工制成的膜状制剂,供口服或黏膜用。
25.耳用制剂 指原料药物与适宜辅料制成的直接用于耳部发挥局部治疗作用或用于洗耳用途的制剂。耳用制剂分为液体制剂、半固体制剂和固体制剂。耳用液体制剂也可以固态形式包装,另备溶剂,在临用前配成溶液或混悬液。
(1)滴耳剂 指由原料药物与适宜辅料制成的水溶液,或由甘油或其他适宜溶剂制成的澄明溶液、混悬液或乳状液,供滴入外耳道用的液体制剂。
(2)洗耳剂 指由原料药物与适宜辅料制成的澄明水溶液,用于清洁外耳道的液体制剂。通常是符合生理pH值范围的水溶液,用于伤口或手术前使用者应无菌。
(3)耳用喷雾剂 指由原料药物与适宜辅料制成的澄明溶液、混悬液或乳状液,借喷雾器雾化的耳用液体制剂。
(4)耳用软膏剂 指由原料药物与适宜基质均匀混合制成的溶液型或混悬型膏状的耳用半固体制剂。
(5)耳用乳膏剂 指由原料药物与适宜基质均匀混合制成的乳膏状耳用半固体制剂。
(6)耳用凝胶剂 指由原料药物与适宜辅料制成凝胶状的耳用半固体制剂。
(7)耳塞 指由原料药物与适宜基质制成的用于塞入外耳道的耳用半固体制剂。
(8)耳用散剂 指由原料药物与适宜辅料制成粉末状的供放入或吹入外耳道的耳用固体制剂。
(9)耳用丸剂 指由原料药物与适宜辅料制成的球形或类球形的用于外耳道或中耳道的耳用固体制剂。
26.洗剂 指清洗无破损皮肤或腔道的液体制剂,包括溶液型、乳状液型和混悬型洗剂。
27.冲洗剂 指用于冲洗开放性伤口或腔体的无菌溶液。
28.灌肠剂 指以治疗、诊断或提供营养为目的供直肠灌注用液体制剂,包括水性或油性溶液、乳剂和混悬液。
29.合剂 指饮片用水或其他溶剂,采用适宜的方法提取制成的口服液体制剂(单剂量灌装者也可称“口服液”)。
30.锭剂 指饮片细粉与适宜黏合剂(或利用饮片细粉本身的黏性)制成不同形状的固体制剂。
31.煎膏剂(膏滋) 指饮片用水煎煮,取煎煮液浓缩,加炼蜜或糖(或转化糖)制成的半流体制剂。
32.胶剂 指将动物皮、骨、甲或角用水煎取胶质,浓缩成稠胶状,经干燥后制成的固体块状内服制剂。
33.酒剂 指饮片用蒸馏酒提取制成的澄清液体制剂。
34.膏药 指饮片、食用植物油与红丹(铅丹)或宫粉(铅粉)炼制成膏料,摊涂于裱褙材料上制成的供皮肤贴敷的外用制剂。前者称为黑膏药,后者称为白膏药。
35.露剂 指含挥发性成分的饮片用水蒸气蒸馏法制成的芳香水剂。
36.茶剂 指饮片或提取物(液)与茶叶或其他辅料混合制成的内服制剂,可分为块状茶剂、袋装茶剂和煎煮茶剂。
(1)块状茶剂 分为含糖块状茶剂和不含糖块状茶剂。含糖块状茶剂指提取物、饮片细粉与蔗糖等辅料压制成块状的茶剂;不含糖茶剂指饮片粗粉、碎片与茶叶或适宜的黏合剂压制成块状的茶剂。
(2)袋装茶剂 指茶叶、饮片粗粉或部分饮片粗粉吸收提取液经干燥后,装入袋的茶剂,其中装入饮用茶袋的又称袋泡茶剂。
(3)煎煮茶剂 指将饮片适当碎断后,装入袋中,供煎服的茶剂。
37.流浸膏剂与浸膏剂 指饮片用适宜的溶剂提取,蒸去部分或全部溶剂,调整至规定浓度而成的制剂。除另有规定外,流浸膏剂指每1mL相当于饮片1g。浸膏剂分为稠膏和干膏两种,每1g相当于饮片或天然药物2~5g。
这种分类方法是建立在以药品剂型分类的基础上,以医药商品的陈列和仓储保管的习惯为依据,将品种繁多的医药商品简单地分为针剂类、粉剂类、水剂类、片剂类这四大类。该分类方法虽然较牵强,不够严谨,如将胶囊剂归入片剂。但其优点是可以根据医药商品的外观简单地进行分类;这四大类商品每类都有很多共同点,所以在包装、运输、保管和销售等方面提供了很多便利;此种分类的方法还具有能适应企业计划、统计、财会账目登记的需要等优点,故在医药商业中被普遍采用。
1.针剂类 包括注射液、注射用无菌粉末和大输液。
2.粉剂类 包括原料药、颗粒剂及散剂等。
3.水剂类 包括液体制剂、栓剂、半固体制剂和气雾剂。
4.片剂类 包括片剂、丸剂及胶囊剂。
按药品的特殊性可以将药品分为普通药品和特殊管理的药品,特殊管理药品包括麻醉药品、精神药品、医用毒性药品、放射性药品。
1.普通药品 是指毒性较小、安全范围较大、不良反应较少的药品,如沙丁胺醇、葡萄糖、氯雷他定等。
2.特殊管理药品 指国家规定有特殊管理办法的医疗用诊断或治疗药品。
(1)麻醉药品 指连续使用后易使身体产生依赖性、能成瘾的药品,如吗啡类、哌替啶、布桂嗪等。
(2)精神药品 指对中枢神经系统有不同程度的兴奋或抑制作用,从而影响人的精神活动,连续使用能使人产生生理依赖性和精神依赖性的药品。依据联合国《1971年精神药物公约》使人体产生的依赖性的潜力和危害人体健康的程度,可将这类药品分为第一类和第二类精神药品。
国务院药品监督管理部门会同国务院公安部门和卫生主管部门分别于2007年10月和2013年11月两次统一发布《麻醉药品和精神药品品种目录》,继续保持麻醉药品和第一类、第二类精神药品统一、分类管理的制度。2015年9月,多部门联合发布《非药用类麻醉药品和精神药品管制品种增补目录》,首次规定我国“麻醉药品和精神药品按照药用类和非药用类分类列管”,之后进行常态化增列。截至2022年7月,我国现已列管449种麻醉品、精神物质(121种麻醉药品、154种精神药品、174种非药用类麻醉药品和精神药品),整类列管芬太尼类物质、合成大麻素类物质。第一类精神药品如马吲哚、司可巴比妥、丁丙诺啡等不能在药店零售。第二类精神药品如异戊巴比妥、地西泮、曲马多、咖啡因、艾司唑仑等,在零售药店应凭执业医师开具的处方,按规定剂量购得。
(3)毒性药品 指毒性剧烈、治疗剂量与中毒剂量相近,使用不当会致使人中毒或者死亡的药品,如阿托品、毛果芸香碱等。
(4)放射性药品 指用于临床诊断或治疗的放射性核制剂或者其他标记药品。包括裂变制品、推照制品、加速器制品、放射性核素发生器及其配套药盒、放射免疫分析药盒等。
3.新药与仿制药 我国《药品管理法》指出:“国家鼓励研究和创制新药。”
(1)新药 指未在中国境内外上市销售的药品。根据物质基础的原创性和新颖性,将新药分为创新药和改良型新药。
(2)仿制药 仿制药是指仿制的与原研药品质量和疗效一致的药品。
1.处方药和非处方药 《药品管理法》规定:国家对药品实行处方药与非处方药分类管理。
(1)处方药 指凭执业医师和执业助理医师的处方才可调配、购买,在医师、药师或其他医疗专业人员监督或指导下方可使用的药品,这类药品一般专属性强或副作用大。
(2)非处方药 指不需要凭执业医师和执业助理医师处方,消费者可以自行判断、购买和使用的药品。在国外,非处方药称为“柜台药”,英文写作over-the-counter drugs,简称OTC药。
被列为非处方药的药品具有以下特点。①药品适应证可自我诊断、自我治疗,通常限于自身疾病。②药品的毒性在公认的安全范围内,其效用-风险比值大。③药品滥用、误用的潜在可能性小。④药品作用不掩盖其他疾病。⑤药品不致细菌耐药性。⑥一般公众能理解药品标签的忠告性内容,无须医师监督和实验监测即可使用。
此外,根据药品的安全性,非处方药又分为甲、乙两类。非处方药的包装、标签、说明书上均有其特有标识OTC。红色为甲类,必须在医疗机构、药店出售。绿色为乙类,除医疗机构、药店外,还可在药监部门批准的宾馆、商店等商业企业中零售。相对而言,乙类比甲类更安全。
处方药与非处方药之间的关系不是一成不变的,非处方药来源于处方药。一般情况下,处方药如果经过较长时间(通常是6~12年)临床实践被证明是应用安全、疗效确切、质量稳定、使用方便,即使是非医疗专业人员也能按照说明书自行使用,经国家药品监督管理局批准即可转为非处方药。当处方药转为非处方药后,在适应证及剂量等方面都会有所变化,甚至同一药品由于剂型与剂量的不同也可分为处方药与非处方药。
2.国家基本药物、基本医疗保险用药
(1)国家基本药物 世界卫生组织于1975年开始推荐一些国家制定基本药物,并将此做法作为该组织药品政策的战略任务,目的是使其成员国特别是发展中国家绝大多数人口得到基本的药品供应,促进合理用药,从而降低医疗费用。
基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。政府举办的基层医疗卫生机构全部配备和使用基本药物,其他各类医疗机构也都必须按规定使用基本药物。国家基本药物制度是对基本药物的遴选、生产、流通、使用、定价、报销、监测评价等环节实施有效管理的制度,与公共卫生、医疗服务、医疗保障体系相衔接。国家基本药物制度的建立和实施,对健全药品供应保障体系、保障群众基本用药、减轻患者用药负担发挥了重要作用。
(2)基本医疗保险用药 为保障参保人员基本用药需求,提升基本医疗保险用药科学化、精细化管理水平,提高基本医疗保险基金使用效益而规定的基本医疗保险用药药品。
基本医疗保险用药范围通过制定《基本医疗保险药品目录》(以下简称《药品目录》)进行管理。包括化学药、生物制品、中成药(民族药),以及按国家标准炮制的中药饮片,并符合临床必需、安全有效、价格合理等基本条件。符合《药品目录》的药品费用,按照国家规定由基本医疗保险基金支付。
国家《药品目录》中的化学药和中成药分为“甲类药品”和“乙类药品”。“甲类药品”是临床治疗必需、使用广泛、疗效确切、同类药品中价格或治疗费用较低的药品。“乙类药品”是可供临床治疗选择使用,疗效确切、同类药品中比“甲类药品”价格或治疗费用略高的药品。协议期内谈判药品纳入“乙类药品”管理。各省级医疗保障部门按国家规定纳入《药品目录》的民族药、医疗机构制剂纳入“乙类药品”管理。中药饮片的“甲乙分类”由省级医疗保障行政部门确定。参保人使用“甲类药品”按基本医疗保险规定的支付标准及分担办法支付;使用“乙类药品”按基本医疗保险规定的支付标准,先由参保人自付一定比例后,再按基本医疗保险规定的分担办法支付。“乙类药品”个人先行自付的比例由省级或统筹地区医疗保障行政部门确定。
这种分类方法将药品分为作用于神经系统、心血管系统、血液系统、内分泌系统、呼吸系统、免疫系统、消化系统、泌尿系统等的药物以及抗微生物药物、诊断用药等,即按药理学分类的方法。这种分类方法的优点是方便指导患者使用,使治疗不同疾病的药品名目清晰,更重要的是便于消费者在用药的基础上学习医药商品知识;缺点是各类药品剂型复杂,给贮存与保管带来诸多不便。
医疗器械的安全有效直接关系人民群众身体健康和社会和谐稳定,是重大的民生和公共安全问题。《医疗器械监督管理条例》(2021年6月)规定:“医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件”。医疗器械的效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与,但是只起辅助作用。其目的是:①疾病的诊断、预防、监护、治疗或者缓解。②损伤的诊断、监护、治疗、缓解或者功能补偿。③生理结构或者生理过程的检验、替代、调节或者支持。④生命的支持或者维持。⑤妊娠控制。⑥通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
医疗器械的种类多,规格更多,从一把普通刀片到磁共振成像装置之间,按照技术特性分类,存在千种以上产品,这些产品的预期用途、结构组成以及产品的风险各不相同。
1.预期目的 指产品说明、标签或宣传资料载明的,使用医疗器械应当取得的作用。
2.无源医疗器械 不依靠电能或者其他能源,但是可以通过由人体或者重力产生的能量,发挥其功能的医疗器械。
3.有源医疗器械 任何依靠电能或者其他能源,而不是直接由人体或者重力产生的能量,发挥其功能的医疗器械。
4.侵入器械 借助手术全部或者部分通过体表侵入人体,接触体内组织、血液循环系统、中枢神经系统等部位的医疗器械,包括介入手术中使用的器材、一次性使用无菌手术器械和暂时或短期留在人体内的器械等。本规则中的侵入器械不包括重复使用手术器械。
5.重复使用手术器械 用于手术中进行切、割、钻、锯、抓、刮、钳、抽、夹等过程,不连接任何有源医疗器械,通过一定的处理可以重新使用的无源医疗器械。
6.植入器械 借助手术全部或者部分进入人体内或腔道(口)中,或者用于替代人体上皮表面或眼表面,并且在手术过程结束后留在人体内30日(含)以上或者被人体吸收的医疗器械。
7.接触人体器械 直接或间接接触患者或者能够进入患者体内的医疗器械。
8.使用时限
(1)连续使用时间 医疗器械按预期目的、不间断的实际作用时间。
(2)暂时使用 医疗器械预期的连续使用时间在24小时以内。
(3)短期使用 医疗器械预期的连续使用时间在24小时(含)以上、30日以内。
(4)长期使用 医疗器械预期的连续使用时间在30日(含)以上。
9.皮肤 指未受损皮肤表面。
10.腔道(口) 口腔、鼻腔、食管、外耳道、直肠、阴道、尿道等人体自然腔道和永久性人造开口。
11.创伤 各种致伤因素作用于人体所造成的组织结构完整性破坏或者功能障碍。
12.组织 人体体内组织,包括骨、牙髓或者牙本质,不包括血液循环系统和中枢神经系统。
13.血液循环系统 血管(毛细血管除外)和心脏。
14.中枢神经系统 脑和脊髓。
15.独立软件 具有一个或者多个医疗目的,无须医疗器械硬件即可完成自身预期目的,运行于通用计算平台的软件。
16.具有计量测试功能的医疗器械 用于测定生理、病理、解剖参数,或者定量测定进出人体的能量或物质的医疗器械,其测量结果需要精确定量,并且该结果的准确性会对患者的健康和安全产生明显影响。
17.慢性创面 各种原因形成的长期不愈合创面,如静脉性溃疡、动脉性溃疡、糖尿病性溃疡、创伤性溃疡、压力性溃疡等。
医疗器械风险程度应当根据医疗器械的预期目的,通过结构特征、使用形式、使用状态、是否接触人体等因素综合判定。
基于产品使用风险的管理分类是当前世界各国最主要的医疗器械分类方法,以确保医疗器械的临床安全性和有效性。该分类一般由各国和地区的医疗器械监管部门执行。多数国家对医疗器械按照风险程度进行分类,其中美国药品监督管理局、我国国家药品监督管理局均将医疗器械分为三类,分别为第一类、第二类、第三类。这种分类方法是目前最常见、也是最有效的分类方式。欧盟将医疗器械分为四类,即Ⅰ类、Ⅱa类、Ⅱb类、Ⅲ类。全球协调任务力量组织(GHTF)也将医疗器械分为四类。
我国对医疗器械按照风险程度实行分类管理,由国务院药品监督管理部门负责制定医疗器械的分类规则和分类目录。医疗器械按照风险程度由低到高,管理类别依次分为第一类、第二类和第三类。第一类是指风险程度低,实行常规管理可以保证其安全、有效的医疗器械。第二类是指具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。第三类是指具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素。《医疗器械注册与备案管理办法》规定,第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。《医疗器械经营监督管理办法》规定,经营第一类医疗器械不需许可和备案,经营第二类医疗器械实行备案管理,经营第三类医疗器械实行许可管理。
基于风险分类制度主要是从有效监管的角度出发而建立的,但上述分类方法不能提供各种产品的共性技术特征,不适用于医疗器械的产业技术创新活动组织。
2022年9月,国家药品监督管理局综合司发布关于加强医疗器械生产经营分级监管工作的指导意见(药监综械管〔2022〕78号),要求各级药品监督管理部门认真贯彻落实《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》,按照“风险分级、科学监管,全面覆盖、动态调整,落实责任、提升效能”的原则,开展医疗器械生产经营分级监管工作。
(1)监管级别划分原则 ①对风险程度高的企业实施四级监管,主要包括生产本行政区域重点监管品种目录产品,以及质量管理体系运行状况差、有严重不良监管信用记录的企业。②对风险程度较高的企业实施三级监管,主要包括生产除本行政区域重点监管品种目录以外第三类医疗器械,以及质量管理体系运行状况较差、有不良监管信用记录的企业。③对风险程度一般的企业实施二级监管,主要包括生产除本行政区域重点监管品种目录以外第二类医疗器械的企业。④对风险程度较低的企业实施一级监管,主要包括生产第一类医疗器械的企业。涉及多个监管级别的,按照最高级别进行监管。
(2)分级监管检查原则 ①对实施四级监管的企业,每年全项目检查不少于一次。②对实施三级监管的,每年检查不少于一次,其中每两年全项目检查不少于一次。③对实施二级监管的,原则上每两年检查不少于一次。④对实施一级监管的,原则上每年随机抽取本行政区域25%以上的企业进行监督检查,并对新增第一类医疗器械生产企业在生产备案之日起3个月内开展现场检查,必要时对生产地址变更或者生产范围增加的第一类医疗器械生产企业进行现场核查。监督检查可以与产品注册体系核查、生产许可变更或者延续现场核查等相结合,提高监管效能。
依据影响医疗器械风险程度的因素,医疗器械的分类可以有以下几种情形。
1.按医疗器械结构特征分类 分为无源医疗器械和有源医疗器械。
2.按医疗器械是否接触人体分类 分为接触人体器械和非接触人体器械。
3.按医疗器械使用形式分类 根据不同的结构特征和是否接触人体,医疗器械的使用形式如下。
(1)无源接触人体器械 液体输送器械、改变血液体液器械、医用敷料、侵入器械、重复使用手术器械、植入器械、避孕和计划生育器械、其他无源接触人体器械。
(2)无源非接触人体器械 护理器械、医疗器械清洗消毒器械、其他无源非接触人体器械。
(3)有源接触人体器械 能量治疗器械、诊断监护器械、液体输送器械、电离辐射器械、植入器械、其他有源接触人体器械。
(4)有源非接触人体器械 临床检验仪器设备、独立软件、医疗器械消毒灭菌设备、其他有源非接触人体器械。
4.按医疗器械使用状态分类 根据不同的结构特征、是否接触人体以及使用形式,医疗器械的使用状态或者其产生的影响包括以下情形。
(1)无源接触人体器械 根据使用时限分为暂时使用、短期使用、长期使用;接触人体的部位分为皮肤或腔道(口)、创伤或组织、血液循环系统或中枢神经系统。
(2)无源非接触人体器械 根据对医疗效果的影响程度分为基本不影响、轻微影响、重要影响。
(3)有源接触人体器械 根据失控后可能造成的损伤程度分为轻微损伤、中度损伤、严重损伤。
(4)有源非接触人体器械 根据对医疗效果的影响程度分为基本不影响、轻微影响、重要影响。
5.按医疗器械预期用途分类 医疗器械最终是为人体使用的,因此按其用途分类是一种广泛采用并具实用价值的分类方法,这种分类方法因其分类的简明、通用和科学得到了最普遍的认同,见表3-1。
表3-1 按医疗器械预期用途分类

6.按临床应用分类 许多医疗机构特别是医院常根据其医院管理的模式和方便性把医疗器械按设备所适用的临床科目进行分类,见表3-2。
表3-2 按临床应用分类

续表

由表3-2可见,根据临床科目进行分类对医疗机构来说十分方便,可按科室对设备进行管理。但由于这种分类方法过于机械和简单,分类范畴重叠性大,不能明确医疗器械种类,适合一些中小型医疗机构。
医疗器械的分类应当根据医疗器械分类判定表进行分类判定,见表3-3。有以下情形的,还应当结合下述原则进行分类。①如果同一医疗器械适用两个或者两个以上的分类,应当采取其中风险程度最高的分类;由多个医疗器械组成的医疗器械包,其分类应当与包内风险程度最高的医疗器械一致。②可作为附件的医疗器械,其分类应当综合考虑该附件对配套主体医疗器械安全性、有效性的影响;如果附件对配套主体医疗器械有重要影响,附件的分类应不低于配套主体医疗器械的分类。③监控或者影响医疗器械主要功能的医疗器械,其分类应当与被监控、影响的医疗器械的分类一致。④以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。⑤可被人体吸收的医疗器械,按照第三类医疗器械管理。⑥对医疗效果有重要影响的有源接触人体器械,按照第三类医疗器械管理。⑦医用敷料如果有以下情形,按照第三类医疗器械管理。包括预期具有防组织或器官粘连功能,作为人工皮肤,接触真皮深层或其以下组织受损的创面,用于慢性创面,或者可被人体全部或部分吸收的。⑧以无菌形式提供的医疗器械,其分类应不低于第二类。⑨通过牵拉、撑开、扭转、压握、弯曲等作用方式,主动施加持续作用力于人体、可动态调整肢体固定位置的矫形器械(不包括仅具有固定、支撑作用的医疗器械,也不包括配合外科手术中进行临时矫形的医疗器械或者外科手术后或其他治疗中进行四肢矫形的医疗器械),其分类应不低于第二类。⑩具有计量测试功能的医疗器械,其分类应不低于第二类。⑪如果医疗器械的预期目的是明确用于某种疾病的治疗,其分类应不低于第二类。⑫用于在内窥镜下完成夹取、切割组织或者取石等手术操作的无源重复使用手术器械,按照第二类医疗器械管理。
对新研制的尚未列入分类目录的医疗器械,申请人可以直接申请第三类医疗器械产品注册,也可以依据分类规则判断产品类别并向国家药品监督管理局申请类别确认后,申请产品注册或者进行产品备案。
表3-3 医疗器械分类判定表
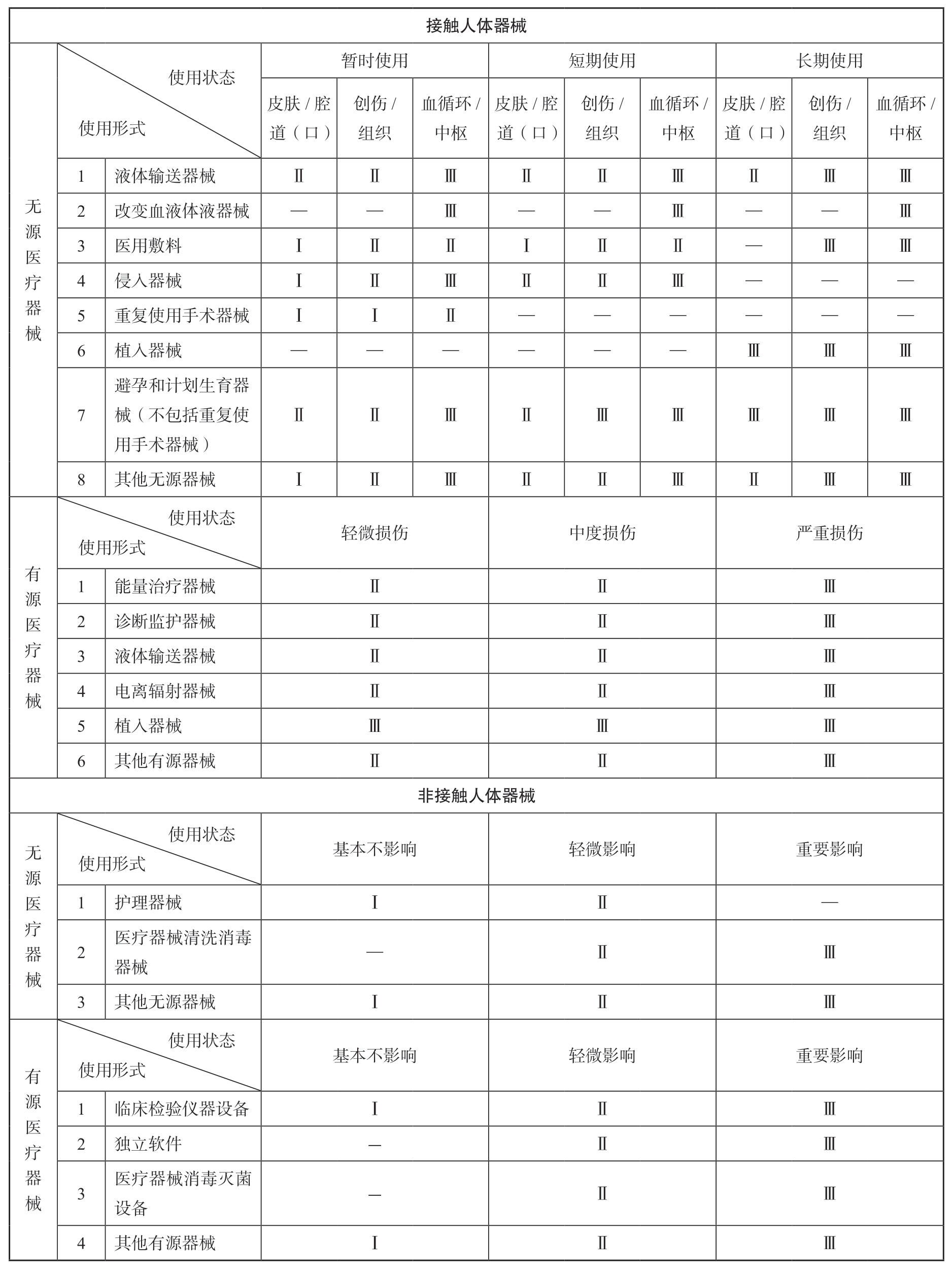
注:1.本表中“Ⅰ”“Ⅱ”“Ⅲ”分别代表第一类、第二类、第三类医疗器械。
2.本表中“-”代表不存在这种情形。
根据《医疗器械分类规则》规定,《医疗器械分类目录》是将部分已上市产品按《医疗器械分类规则》规定的分类原则进行划分。医疗器械行业经过10余年的高速发展,产品种类增长迅速,技术复杂的产品不断涌现,2018年在2002版目录基础上新版《医疗器械分类规则》发布实施,主要以技术领域为主线,更侧重从医疗器械的功能和临床使用的角度划分产品归属,分为22个子目录,子目录由一级产品类别、二级产品类别、产品描述、预期用途、品名举例和管理类别组成,见表3-4。由于医疗器械产品本身品种繁多,因此不可能将已上市产品全部罗列出来,《医疗器械分类目录》只能采用产品列举法。根据医疗器械风险变化情况,参考国际经验,遵循符合最新科学认知、立足监管实际、鼓励创新、推动产业高质量发展的原则进行动态调整。随着科学技术水平的日益发展和医疗器械监督管理能力的不断提高,预示着第一类、第二类管理产品比重不断增加和第三类产品不断减少将是一个必然的趋势。
表3-4 医疗器械分类目录

药品编码是指在药品研制、生产、经营、使用和监督管理中由计算机使用的表示特定信息的编码标识。它以数字或数字与字母组合的形式体现,是药品的“身份证”。
实施药品编码有利于药品的分类实现通用性、标准化和科学化。药品编码应遵循以下原则。
1.唯一性原则 药品编码必须实行一品一码、一码一品的唯一性原则,即药品编码能且只能有唯一的一个。
2.稳定性原则 药品编码必须稳定,不应频繁变动,否则不仅造成人力、物力及财力的浪费,而且给管理部门带来诸多不便。因此,药品编码时应考虑其最小变化的可能性,一旦确定后就不宜变更。
3.可识别性原则 药品编码时必须有明显的识别标志,以便于识别、查询,即按药品的类别、属性进行分项编码。
4.可扩性原则 负责药品编码的机构在编制编码结构设计、分配编码时,要充分考虑到药品的更新换代和新产品的开发,为新类目的增加留有余地。
5.简明性原则 药品编码时应简明,编码长度应最短,以便于阅读、操作,尽可能减少计算机处理时间和储存空间,达到减少差错、提高工作效率的目的。
6.层次性原则 药品编码时层次要清楚,要做到准确地反映药品分类体系的并列与从属关系及药品目录的层次性,使编码具有一定规律性。
7.自检能力原则 药品编码是一项复杂而又十分精细的工作,要求必须做到编码校验、校正的方便性,同时要求计算机做到有自动检测差错的核对性能。
药品编码包括本位码、监管码和分类码。
本位码是药品唯一的身份标识,用于国家药品注册信息管理,在药品包装上不体现。国家药品监督管理局发布的《关于实施国家药品编码管理的通知》,确定了国家药品编码本位码编制规则。国家药品编码本位码共14位,由药品国别码、药品类别码,药品本位码和校验码依次连接组成,不留空格,见图3-1。
图3-1药品编码为86900001000016。其中,国别码为“86”,代表在中国境内生产、销售的所有药品;国家药品编码本位码类别码为“9”,代表药品;国家药品编码本位码本体码的前5位为药品企业标识,根据《企业法人营业执照》《药品生产许可证》,遵循一照一证的原则,按照流水的方式编制;国家药品编码本位码本体码的后5位为药品产品标识,是指前5位确定的企业所拥有的所有药品产品。药品产品标识根据药品批准文号,依据药品名称、剂型、规格,遵循一物一码的原则,按照流水的方式编制。国家药品本位码由药品监督管理部门授权的维护管理机构统一编制赋码。校验码是国家药品编码本位码中的最后一个字符,通过特定的数学公式来检验国家药品编码本位码中前13位数字的正确性,计算方法按照“GB 18937”执行。
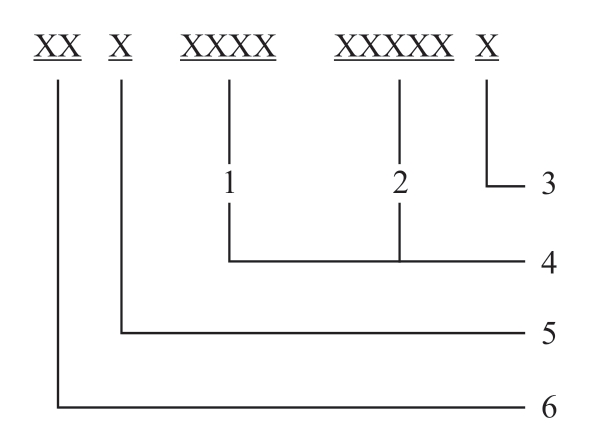
图3-1 国家药品编码本位码
1.企业标识;2.产品标识;3.校验码;4.药品本体码;5.药品类别码(9);6.药品国别码(86)。示例 86900001000016
监管码用于药品监控追溯系统,通过条码的形式标记,直接体现于药品包装上。监管码被激活后可以在该产品进入流通或使用过程中进行查询、管理。通过扫描识读或肉眼识读并反映相关产品信息。
1.药品追溯码 药品追溯码用于唯一标识药品各级销售包装单元的代码,由一系列数字、字母和(或)符号组成。在国家药品监督管理局药品注册司、药品监管司的指导下,国家药监局信息中心组织编制了《药品追溯码标识规范》(NMPAB/T 1011-2022)《药品追溯消费者查询结果显示规范》(NMPAB/T 1012-2022)两个标准。《药品追溯码标识规范》规定了药品追溯码标识的原则、一般要求、样式要求、位置要求和质量要求,适用于规范和指导药品上市许可持有人和生产企业在中国境内销售和使用药品的各级销售包装单元上以印刷、粘贴等方式进行药品追溯码的标识。
(1)药品追溯码标识原则 药品追溯码应做到易识别,清晰、显著性原则。
1)易识别性 药品追溯码标识应保证能够被使用者和相关设备方便、准确地识读。
2)清晰性 药品追溯码标识应保证图像清晰、颜色与底色对比分明。
3)显著性 药品追溯码应标识在明显可见之处,便于使用者快速寻找和定位。
(2)药品追溯码标识的一般要求 ①药品追溯码标识应符合国家相关法律法规和标准的要求。②药品追溯码标识应清晰可读,可被扫码设备和人眼识读。
(3)药品追溯码标识样式要求 ①药品追溯码标识的内容应包括“药品追溯码”字样、药品追溯码人眼识读的字符和药品追溯码设备识读的符号(包括一维条码或二维码),药品追溯码标识见图3-2、图3-3。②应在药品追溯码设备识读符号临近位置标识“药品追溯码”字样,最小字高不宜低于1.8mm。③应在药品追溯码标识位置附近增加有关查询方式的说明。
(4)药品追溯码标识位置要求 ①应在药品各级销售包装单元上标识药品追溯码(另有规定的除外)。②应在药品包装明显可见之处标识药品追溯码,且在同级销售包装单元的标识位置应相对统一,并与其他条码有一定间隔。③应确保药品追溯码标识不遮挡药品包装上的药品通用名称、批准文号、生产日期、有效期等药品相关信息。④应在药品包装上选择合理的药品追溯码标识位置,以确保药品追溯码能够被正常扫描和识别;在透明包装上标识药品追溯码时,应采取相应措施,确保本级药品追溯码识别的准确性,不得与相邻级别包装单元上的药品追溯码相重叠。⑤药品追溯码条码符号与药品包装邻近边缘的间距不宜过小,以避免由于药品包装印制、模切的偏差等原因造成药品追溯码不完整。⑥在药品大包装标识药品追溯码时,宜在两个及以上的平面上标识,以方便产品堆放时的扫码作业。

图3-2 一维条码的药品追溯码标识图

图3-3 二维条码的药品追溯码标识图
(5)药品追溯消费者查询结果相关要求 《药品追溯消费者查询结果显示规范》规定了通过药品追溯码在药品追溯系统查询到的药品追溯信息结果的总体要求、显示方式要求和显示内容要求。消费者通过手机淘宝扫码或支付宝扫码即可直接显示药品追溯信息,药品追溯消费者查询结果应包含“药品追溯信息”字样。药品追溯信息包括药品的基本信息、生产信息、类别属性、厂商信息等。
2.条形码 条形码是商品的识别标识,是由一组按一定编码规则排列的条、空符号,用以表示一定的字符、数字及符号组成的商品信息的符号,又称商品代码。目前世界上常用的码制有EAN(European article number)条形码、二五条形码、三九条码和128条码等,国际上使用最广泛的一种商品条码就是EAN商品条形码。EAN商品条码亦称“通用商品条码”,是国际通用的商品代码。它能反映出该商品的有关资料,如商品注册的国家和地区、生产厂商的名称等。商品采用条形码是企业进入国际市场的必备条件。
每一种物品的条形码都是唯一的,故EAN-13通用商品条形码一般由前缀部分、制造厂商代码、商品代码和校验码共13位数码组成。第1~12位为商品代码,第13位为校验码,是为了防止误入而设置的。商品条形码中前3位是国别码亦称前缀码,是用来标识国家或地区的代码,赋码权在国际物品编码协会,690~696代表商品在中国大陆注册。
3.药品追溯码与条形码的区别 药品追溯码为药品的最小销售包装赋予的标识是“一物一码”;而同种规格同种商品对应同一个条形码,即“一类一码”。例如,同种规格同种药品最小包装的药品追溯码各不相同,但它们的条形码是完全一样的。
分类码用于医保、药品临床研究、药品供应及药品分类管理等,在药品包装上不体现。
复习思考题
1.名词解释:药品追溯码。
2.按照不同的生产方式,药品可以分为哪几类?
3.按照风险程度,第一类、第二类、第三类医疗器械分别指的是什么?
4.国家药品编码本位码的组成有哪些?