醛、酮的 α -氢原子在酸、碱催化下可以被卤素原子取代。
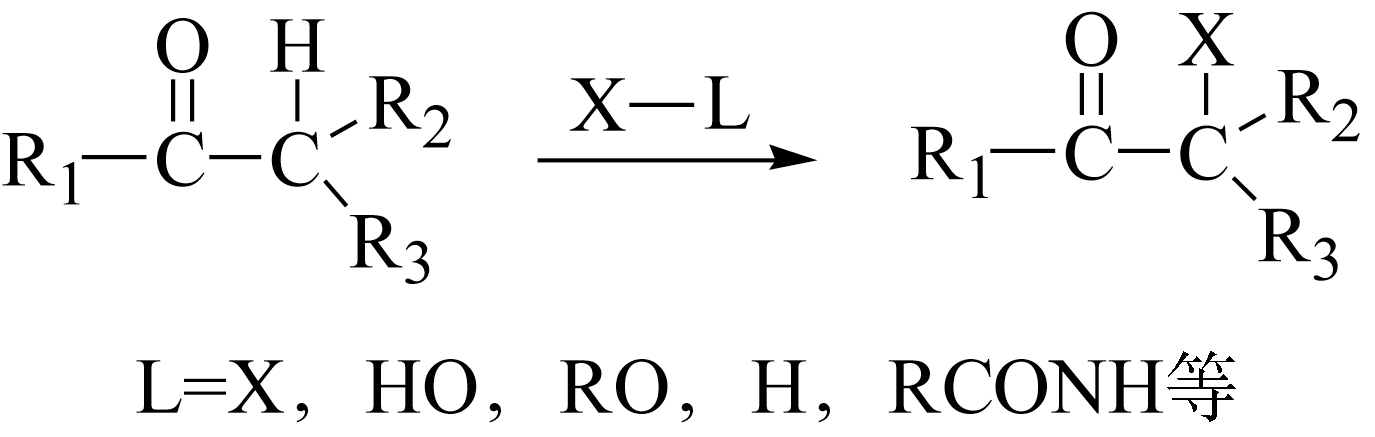
一般来说,羰基化合物在酸(包括Lewis酸)或碱(无机或有机碱)催化下,转化为烯醇或其氧负离子形式才能和亲电的卤化剂进行反应。
酸催化机理如下:
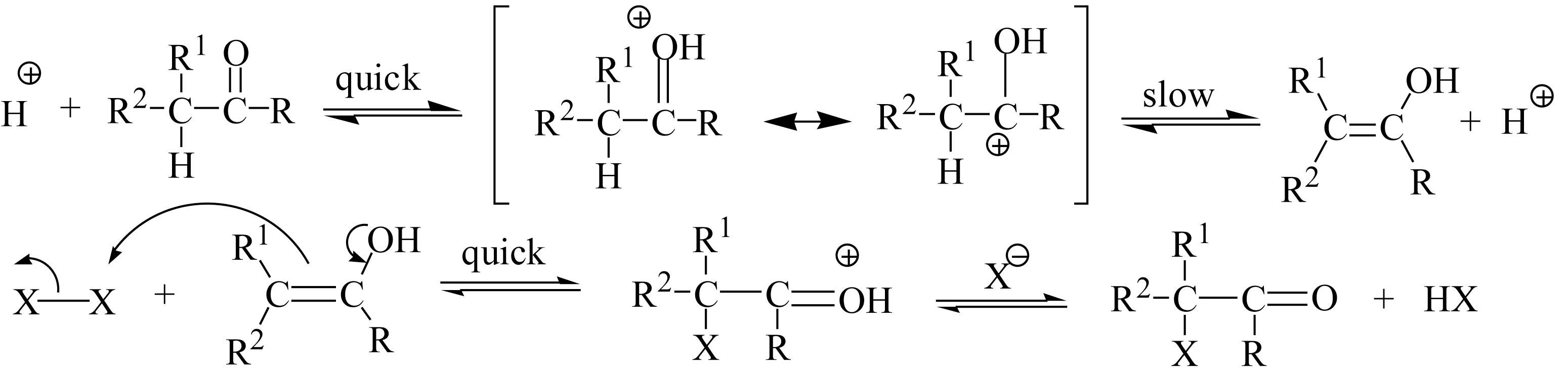
羰基在酸介质中先质子化,然后异构成烯醇式,决定反应速度的步骤是生成烯醇的一步,生成烯醇后,卤素作为亲电试剂与烯醇的双键发生亲电加成,反应中生成卤化氢,所以酸催化常常是自催化。
碱催化过程机理如下:
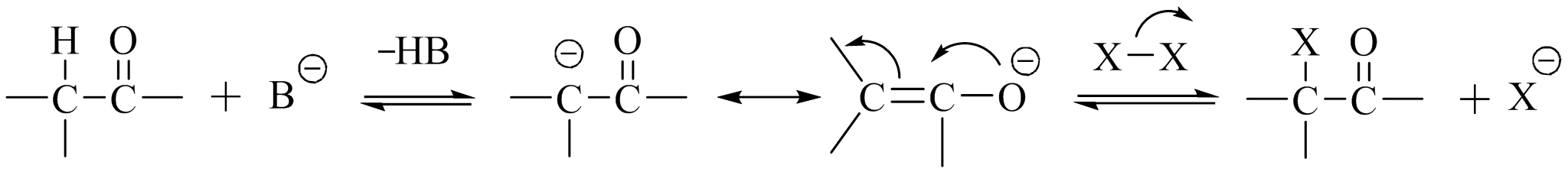
碱首先夺取一个 α -氢原子,生成碳负离子,然后异构为烯醇负离子,后者与卤素分子迅速发生亲电加成反应,生成 α -卤代产物。
酸催化使用的催化剂有质子酸和Lewis酸。反应开始时常有一个诱导期,烯醇化速度较慢,但随着反应的进行,卤化氢浓度增大,烯醇化速度加快,反应也相应加快。因此,在反应初期加入少量氢卤酸可以缩短诱导期,光照也常起到明显的催化效果。Lewis酸对某些反应有催化作用,例如苯乙酮的溴化,在催化量的三氯化铝存在下生成 α -溴代苯乙酮,而三氯化铝过量时生成间溴苯乙酮。
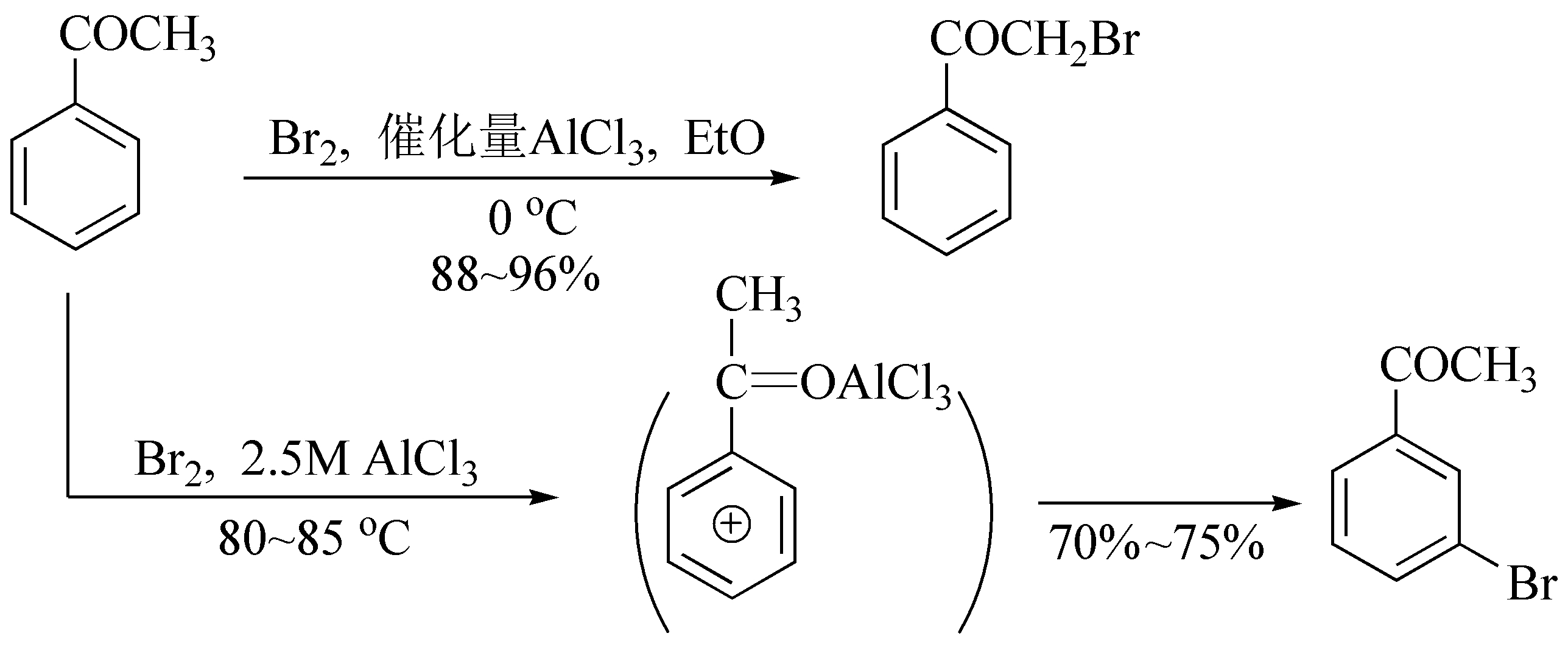
若羰基的 α -位有给电子取代基,则有利于酸催化下烯醇化及提高烯醇的稳定性,卤素主要取代这个 α -碳上的氢,例如:
由于烯醇式a比烯醇式b稳定,生成的相应产物产率高。
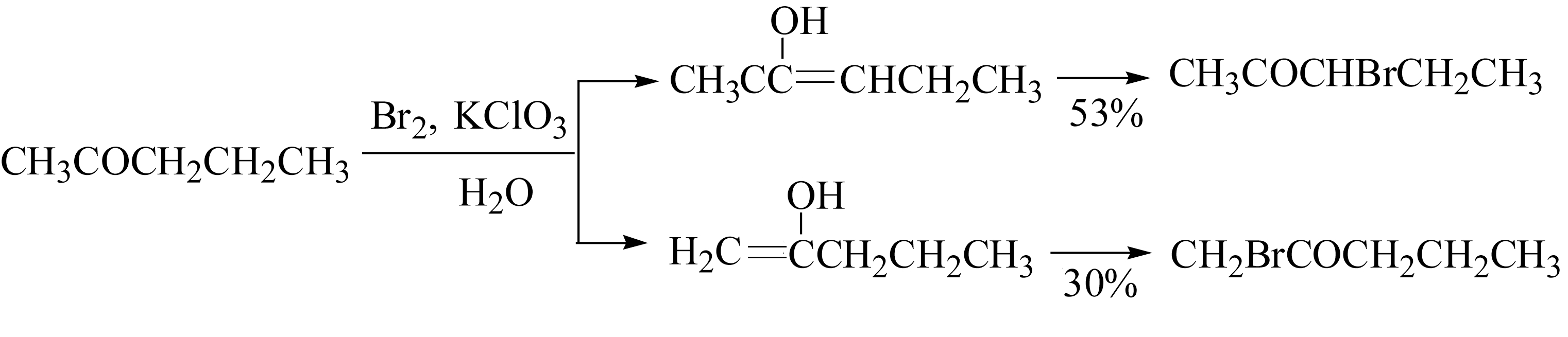
若羰基 α 位上具有吸电子基,卤代反应受到阻滞,故在同一碳原子上不容易引入第二个卤原子。如果在羰基的另一个 α 位上具有活性氢,则第二个卤素原子优先取代另一边 α 位的氢原子,例如:
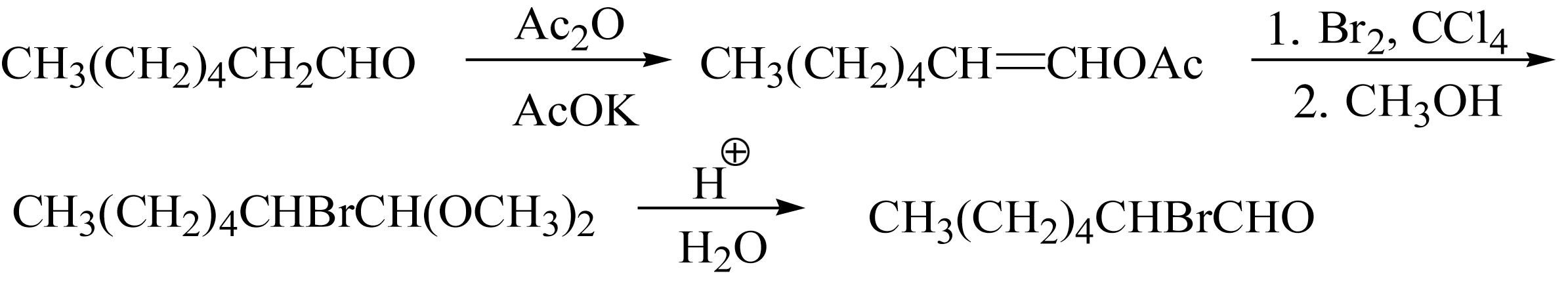
脂肪醛的 α -氢和醛基氢在酸或碱催化下都可被卤素原子取代,生成 α -卤代醛和酰卤,但醛 α -卤代的收率往往不高。若将醛转化为烯醇酯然后再卤代,可得到预期的卤代醛,例如 α -溴代醛的合成:
脂肪醛在 N -甲酰吡咯烷盐酸盐催化下进行氯代反应,可高收率地生成 α -氯代醛,例如:
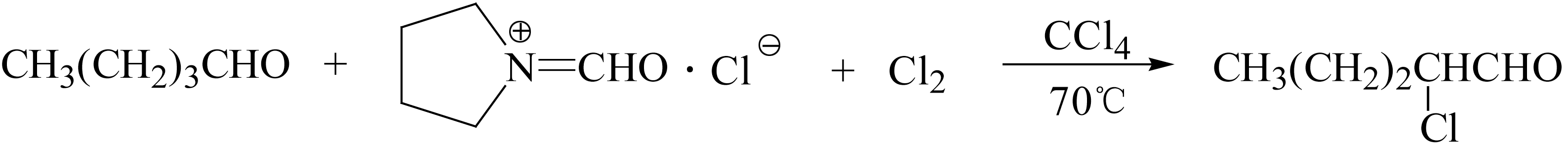
采用溴单质反应时,反应中生成的溴化氢既有加快烯醇化速度的作用,又兼有还原作用,它能消除 α -溴酮中溴原子,由于反应是可逆的,因此 α -溴化产物的收率不可能是定量的。

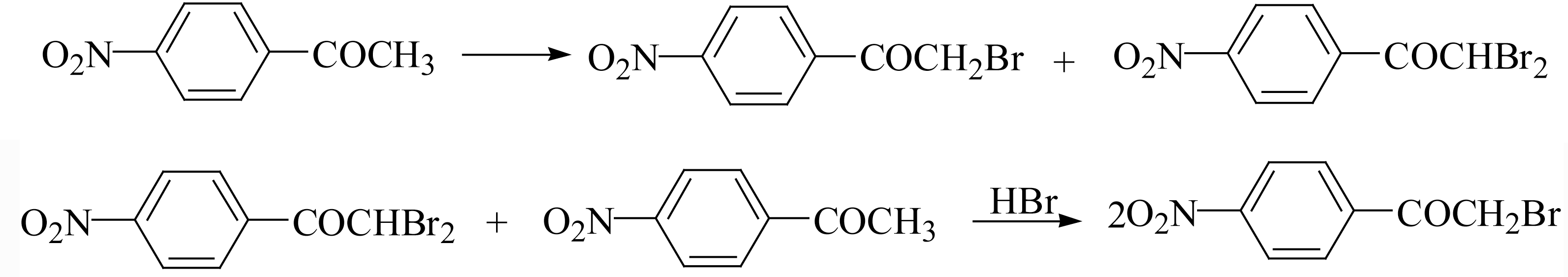
在氯霉素的合成中,可利用此性质,将对硝基苯乙酮溴化后生成的少量二溴化酮可重用于下次溴化,以提高一溴代酮的收率。
溴化氢对 α -溴化的反应是可逆的,由此可使某些脂环酮的溴化产物中的溴原子构型转化或发生位置异构,从而得比较稳定的异构体。
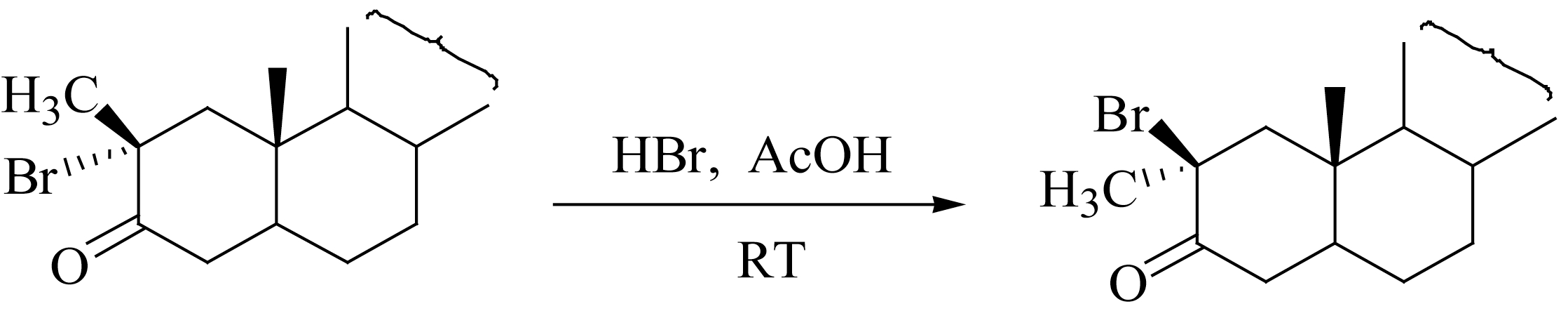
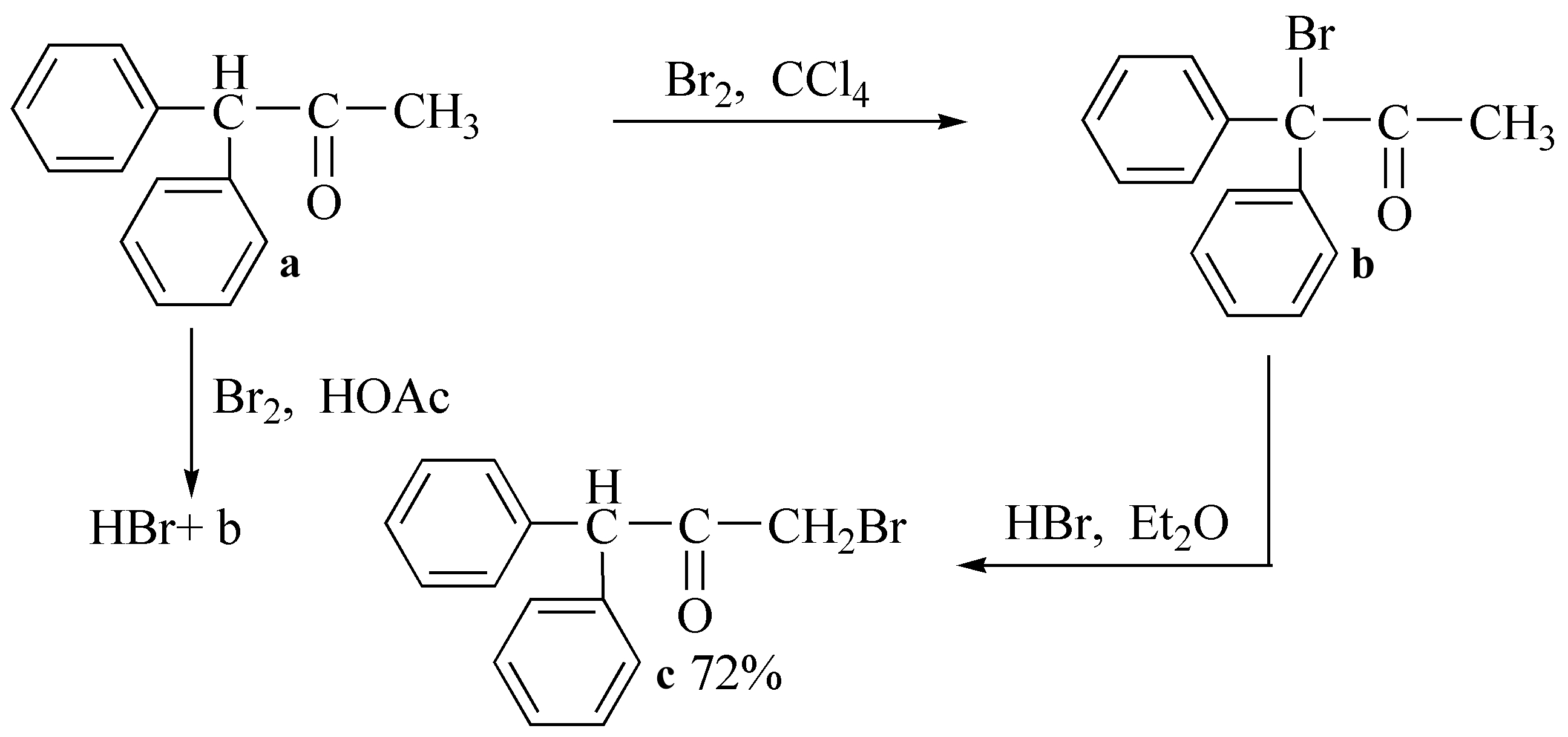
异构化作用与溶剂的极性有关,如a在极性溶剂(乙酸)中溴化,由于溴化氢的溶解度大,异构化能力强,结果生成的溴取代产物b经异构而得较稳定的c;而在非极性的四氯化碳中溴化,生成的溴化氢在该溶剂中溶解度非常小,易从反应液中除去,异构化倾向很小,因而得b。
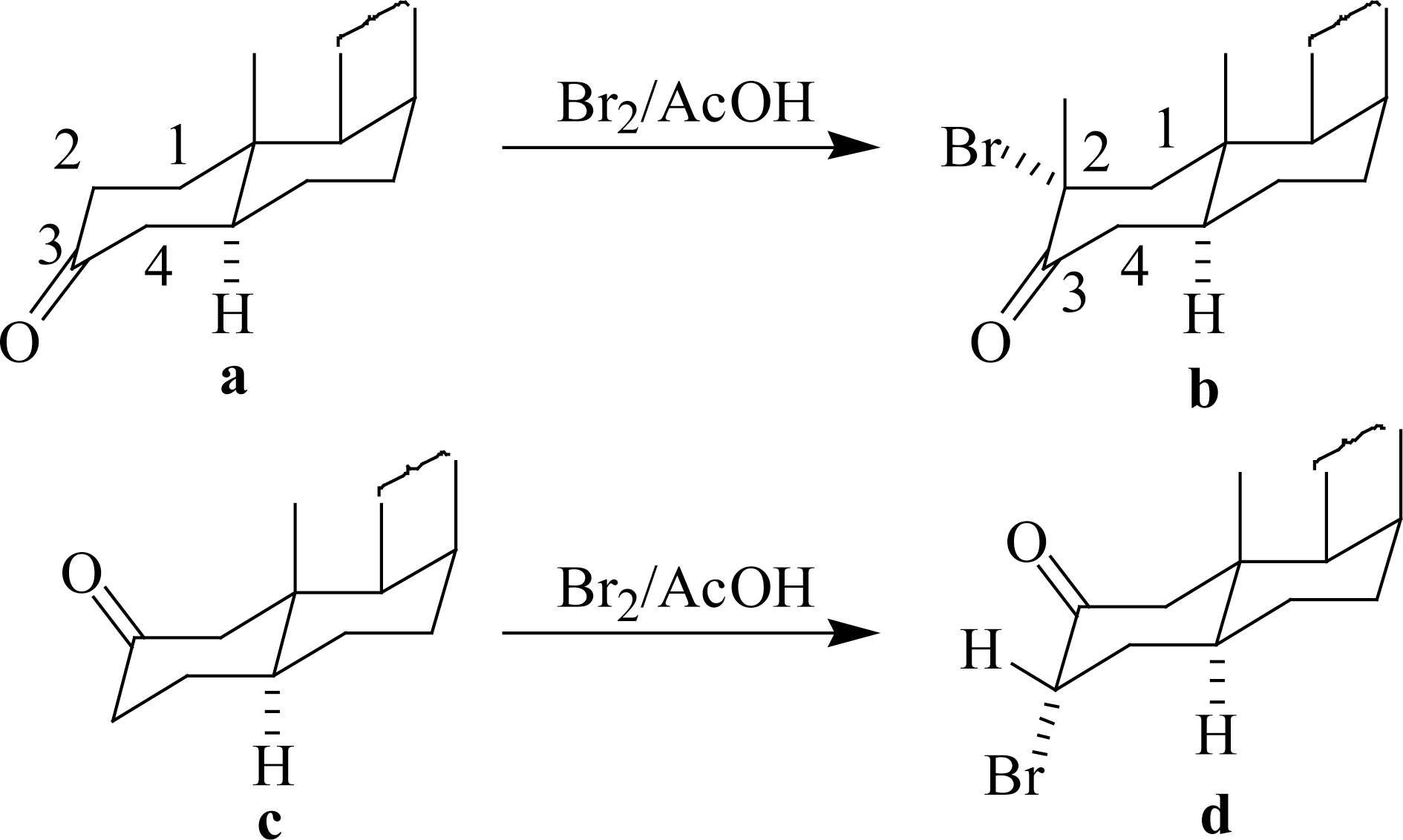
脂环酮的卤代位置受立体因素影响。以下式为例:在别系的3-酮-甾体脂环a中,溴化在2位,而别系的2-酮基衍生物c溴化在3位。其原因在于别系结构的立体化学中,Δ 2,3 -烯醇式中的双键比之Δ 3,4 -和Δ 1,2 -双键稳定(Δ 3,4 -和Δ 1,2 -双键对B环的扭力较大)。因此,3-酮衍生物a的溴化,先得2- β -溴代产物,其中 β -溴原子因1,3-位阻再异构为 α -横键,得b;在2-酮基衍生物c的溴化中,得到的是3- α -溴代产物d。
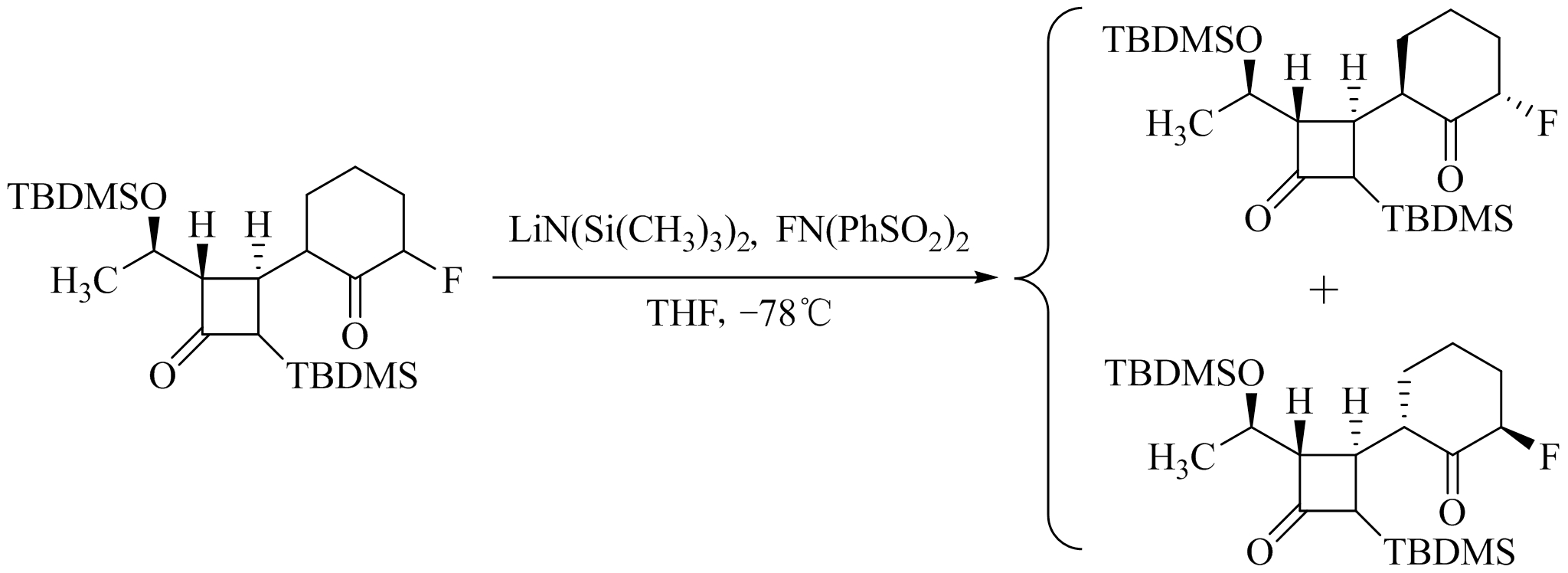
对于不对称脂环酮的 α -位卤代反应,产物通常为非对映异构体混合物。如果是含有 β -内酰胺取代的环己酮,在强碱LHMDS(六甲基二硅胺锂)存在下,用 N -氟代双苯磺酰亚胺进行羰基 α -位的氟代反应,将得到95%产率的非对映异构体混合物;而且用手性磺酰胺进行同样的反应时,反应具有较高的立体选择性。
碱催化常用的催化剂有氢氧化钠(钾)、氢氧化钙以及有机碱类。
碱催化的 α -卤代反应与上述酸催化的情况截然相反。 α -卤代易于发生在有吸电子基团的 α -碳原子上,因为吸电子基团有利于碱催化下 α -碳负离子的形成; α -碳上有给电子基团时,降低了 α -氢原子的酸性,不利于碱性条件下失去质子。所以在碱性条件下,卤素过量存在时,同一碳上容易发生多元取代,例如卤仿反应。
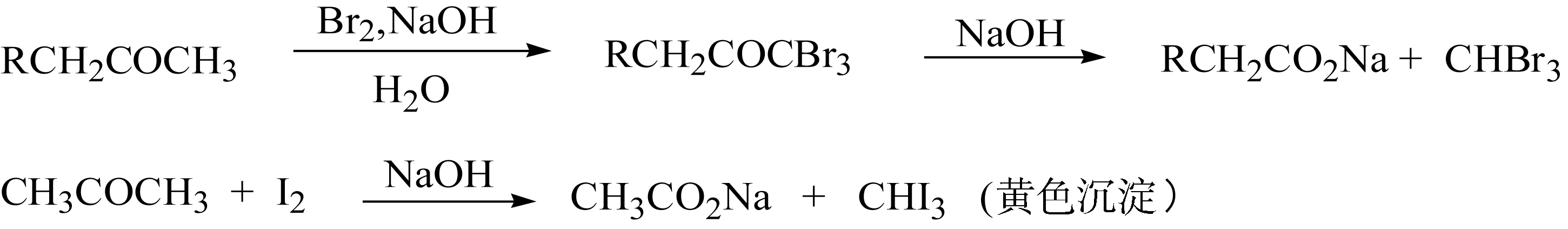
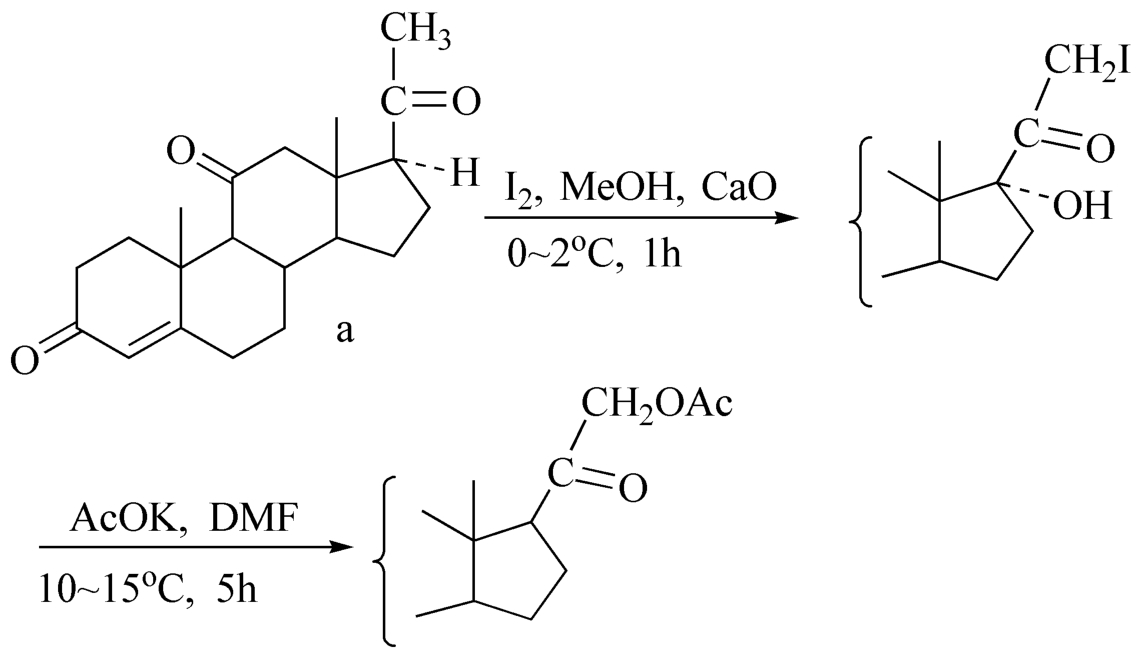
羰基的 α 位碘代反应,常用碘和氧化钙或氢氧化钠在有机溶剂中反应。生成的 α -碘代酮性质很不稳定,不宜贮存。其不经纯化直接和乙酸钾反应,可得氢化可的松的中间体。
脂肪醛先用强碱如NaH、KH等转化为烯醇负离子,而后再与碘在低温下反应,可得到 α -碘代醛例如:
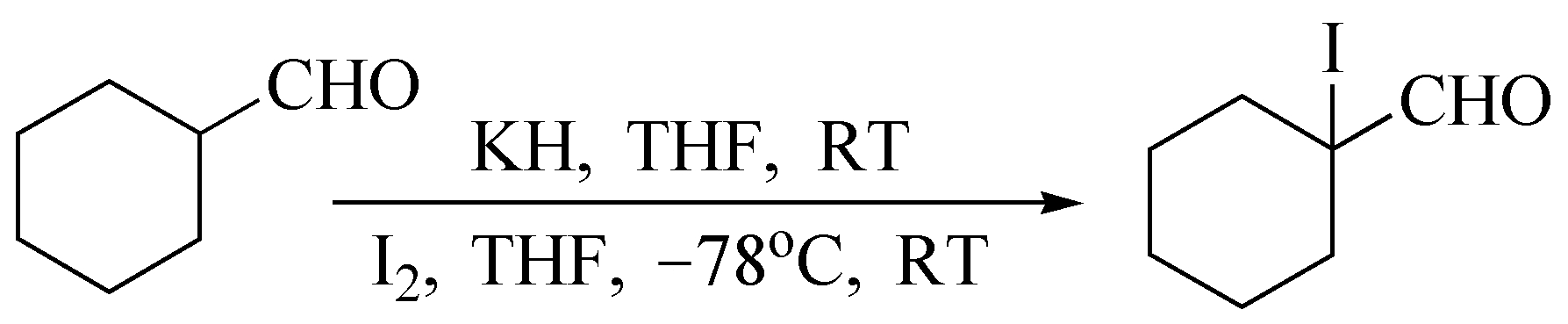
对称酮或只有一个取代方向的酮卤代时,可以良好收率(80%~90%)生成 α -卤代酮。不对称酮卤代,往往生成 α -卤代酮及 α' -卤代酮的混合物。由于酮卤代的决定步骤是酮的稀醇化,因此,易形成稀醇的方向优先卤代。若将不对称酮首先转化变成一定构型的稀醇盐,继而卤代,则是区域定向卤代的新方法。
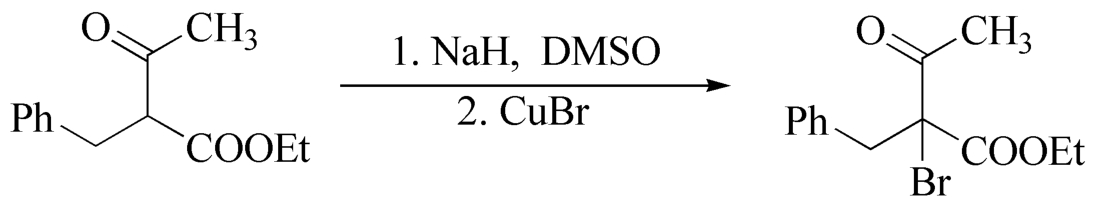
5,5-二溴-2,2-二甲基-4,6-二羰基-1,3-二
 烷及其类似物5,5-二溴丙二酰脲是新型卤化剂,其特点是亲电活性高,反应中不需任何催化剂,反应条件温和,只得到一溴代物。由于反应中不生成卤素和卤化氢,特别适用于对酸、碱敏感的酮,而且溴代主要发生在烷基取代较多的
α
-位,
α
,
β
-不饱和酮可得到高收率的
α'
-溴代物。
烷及其类似物5,5-二溴丙二酰脲是新型卤化剂,其特点是亲电活性高,反应中不需任何催化剂,反应条件温和,只得到一溴代物。由于反应中不生成卤素和卤化氢,特别适用于对酸、碱敏感的酮,而且溴代主要发生在烷基取代较多的
α
-位,
α
,
β
-不饱和酮可得到高收率的
α'
-溴代物。
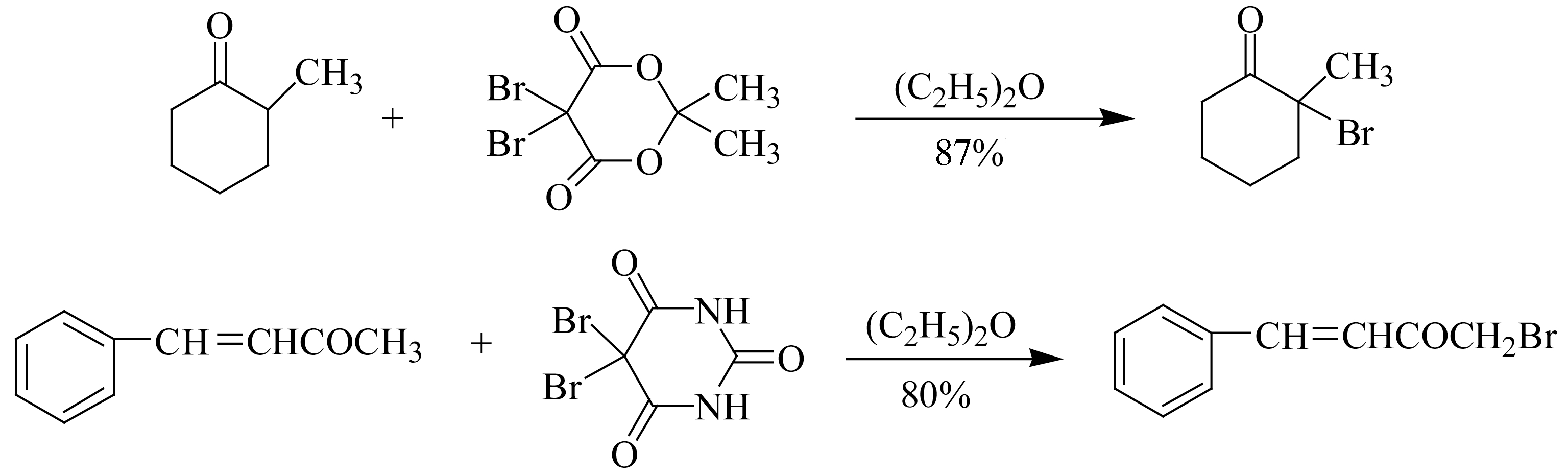
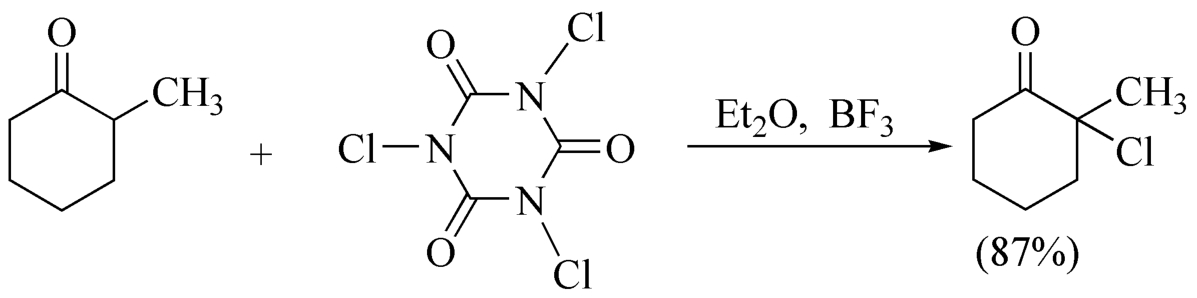
三氯氰尿酸的活性比NCS强,可在温和的条件下使羰基 α -位及苄基位、烯丙基位氯代,区域选择性高,主要发生在烷基取代较多的 α -位。
在药物合成中广泛应用酮的 α -氢卤代反应,如麻醉药氯胺酮(ketamine)中间体的合成:
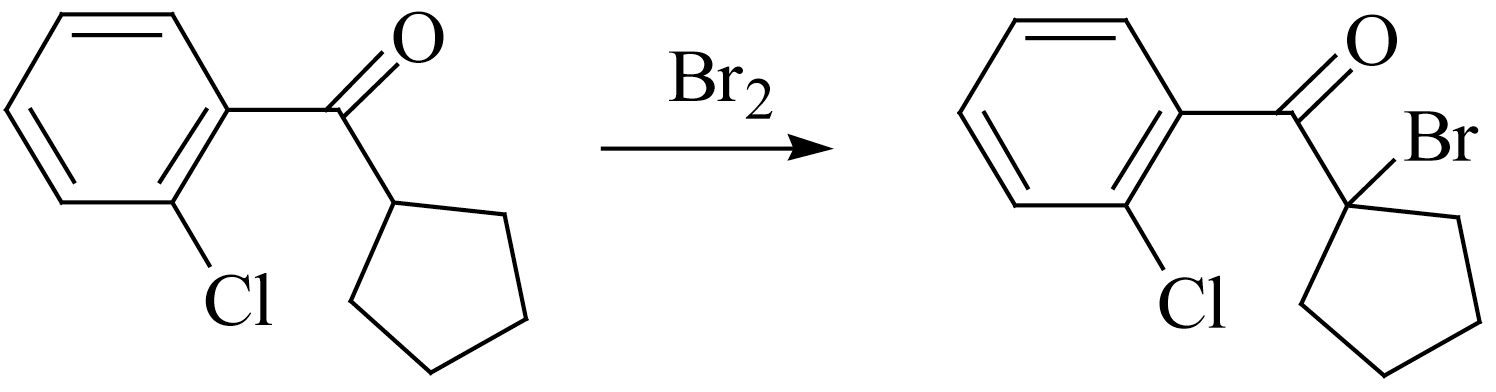
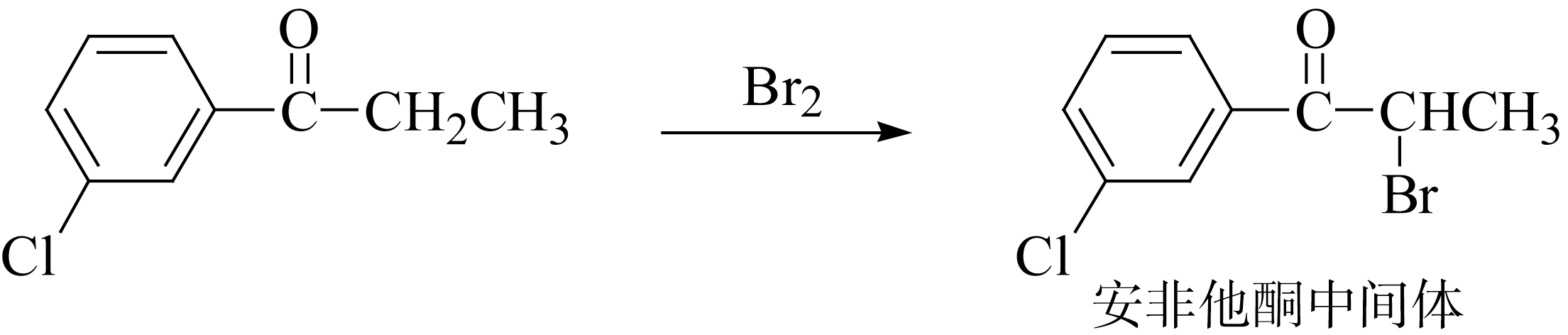
抗抑郁药安非他酮(bupropion)中间体合成:
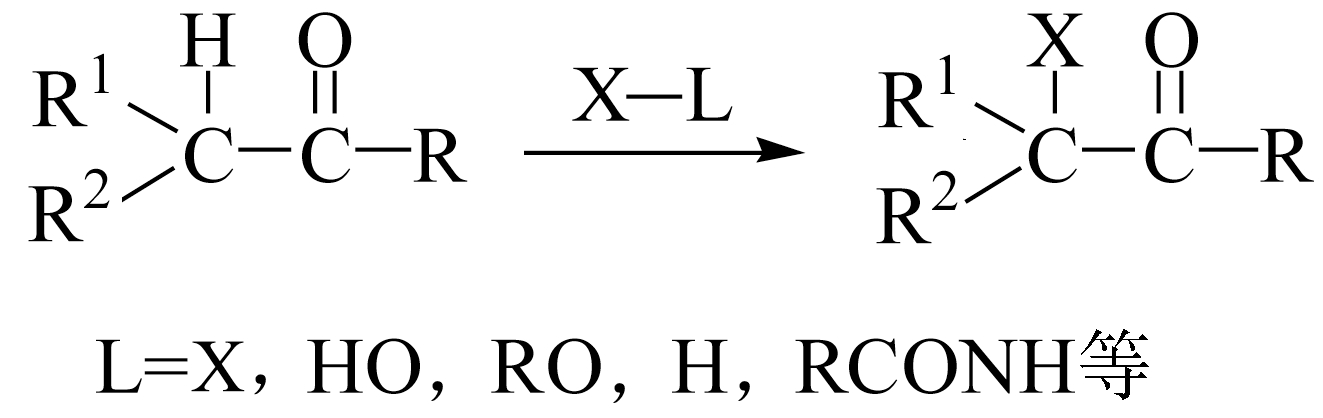
羧酸酯、酰卤、酸酐、腈、丙二酸及其酯等羧酸衍生物可以用卤正离子的卤化剂进行 α -卤取代反应。
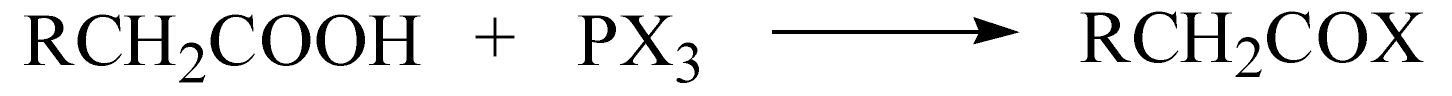
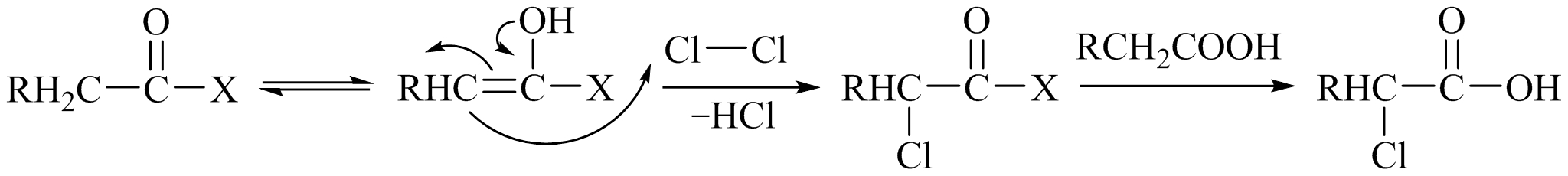
羧酸的 α -H不够活泼,一般先将其转化为 α -H活性较大的酰卤或酸酐,在用卤化剂对其进行 α -卤代,最后生成的酰卤可继续与卤反应,因而少量的三卤化磷即可催化卤化反应的顺利进行。红磷可以与卤素作用生成三卤化物,因此加入少量红磷能催化反应。
在羧酸衍生物 α -卤代的实际操作中,制备酰卤和卤代两步反应常同时进行,即在反应中加入催化量的三卤化磷或磷,反应结束,倒入水中或加入醇而制得相应的卤代羧酸或卤代羧酸酯,此反应称为Hell-Volhard-Zelisky反应,例如:
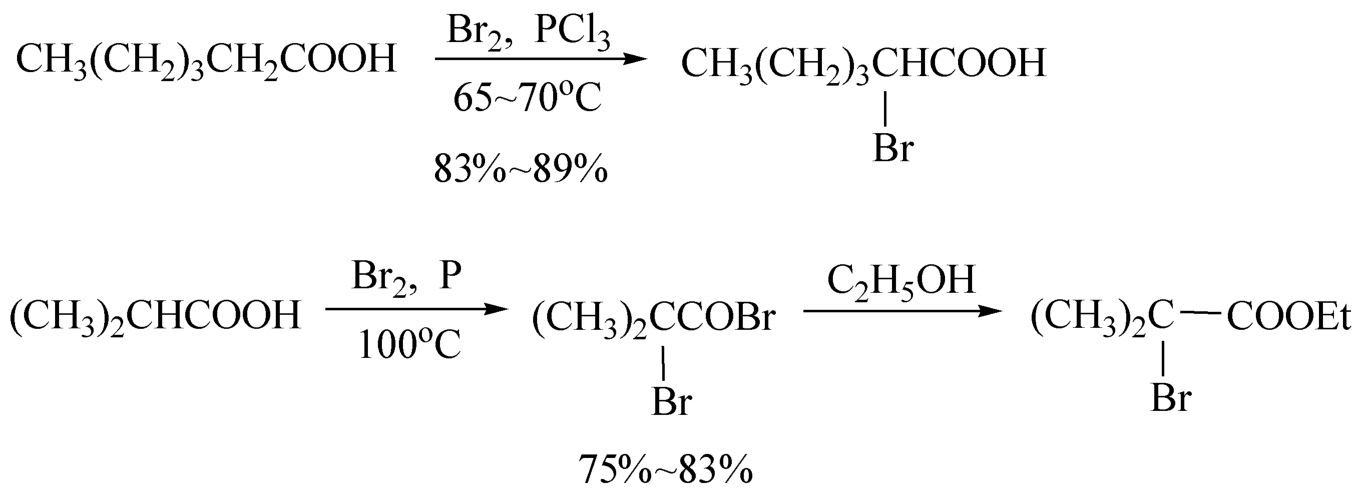
酰氯、酸酐、腈、丙二酸及其衍生物的 α -氢活泼,可直接用卤素等各种卤化剂进行 α -卤代反应。例如:
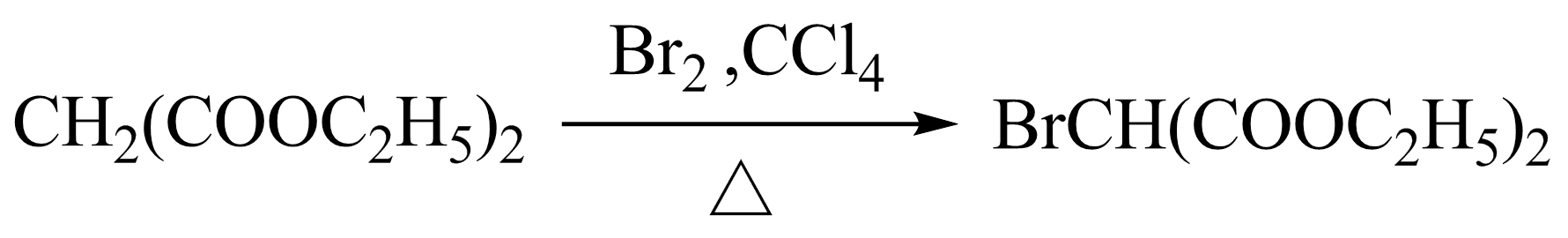
饱和脂肪酸酯在强碱作用下与卤素反应,可生成α-卤代酸酯。
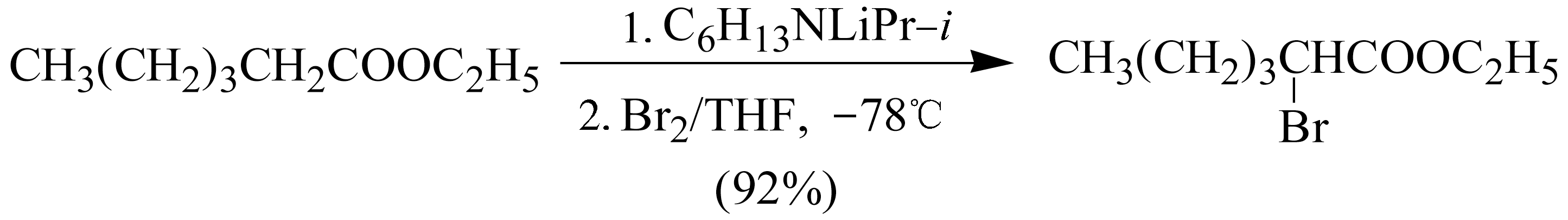
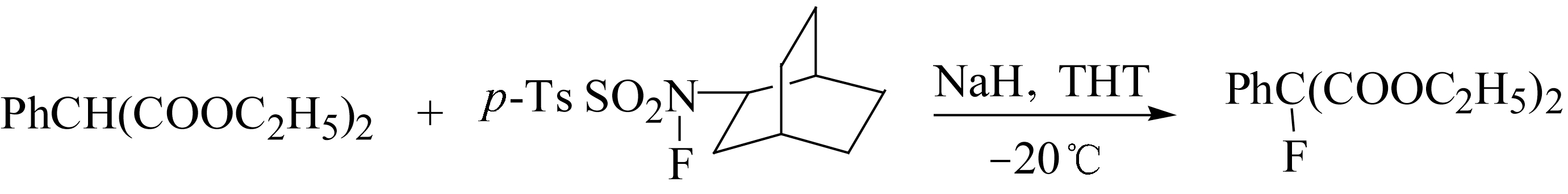
α -氟代相对比较困难,但在强碱NaH作用下与 N -氟代对甲苯磺酸酰仲胺类化合物反应可生成 α -氟代苯基丙二酸酯。