




蛋白质由氨基酸组成,其理化性质和氨基酸的理化性质有相同或相关性,如两性电离、等电点及紫外吸收的特性等。蛋白质是生物大分子,也具有特有的理化性质,如胶体性质、沉降与沉淀、变性及复性等。
蛋白质分子除两端的氨基和羧基可分别解离带电荷外,分子内部氨基酸残基的R侧链中某些基团,如天冬氨酸、谷氨酸残基中的β-和γ-羧基,赖氨酸残基中的ε-氨基,精氨酸残基中的胍基和组氨酸残基中的咪唑基等,都是一些可以解离的基团,在一定的pH条件下有的带正电荷,有的带负电荷。因此蛋白质和氨基酸一样,都是两性电解质,在溶液中的解离和带电状态受溶液pH值的影响。当溶液处于某一pH值时,蛋白质分子所带的正负电荷相等,呈兼性离子状态,净电荷为零,此时溶液的pH值称为该蛋白质的等电点(pI)。
蛋白质分子量为1~100万道尔顿,分子大小已达到胶粒1~100nm范围之内。与低分子物质比较,蛋白质分子扩散速度慢,不易透过半透膜,黏度大。如血浆蛋白质等大分子胶体物质不能通过毛细血管壁,成为影响血管内外两侧水平衡的重要因素。球状蛋白质的表面多为亲水基团,在溶液中具有强烈的吸引水分子作用,使蛋白质分子表面被水分子包围形成水化膜,从而将蛋白质分子相互隔开。同时亲水R侧链的大多数基团可以解离,使蛋白质分子表面带有一定量的同种电荷,相互排斥,防止相互聚集,因而分散在水溶液中的蛋白质是一种稳定的胶体溶液。若破坏蛋白质胶体颗粒表面的水化膜和电荷两种稳定因素,可使蛋白质从溶液中析出。
蛋白质分子相互聚集而从溶液中析出的现象称为蛋白质沉淀(precipitation)。沉淀蛋白质的方法有以下几种。
在蛋白质溶液中加入高浓度的中性盐溶液(如硫酸铵、硫酸钠、氯化钠等),破坏蛋白质分子表面的水化膜和电荷,破坏蛋白质在水溶液中的稳定因素而使其从溶液中析出,称为盐析(salt precipitation)。各种蛋白质盐析时所需的盐浓度及pH值均不同。一般蛋白质分子量越大,所需中性盐的浓度越小,利用这种差异来分离不同大小蛋白质,称为分段盐析法。如可用半饱和的硫酸铵沉淀血清球蛋白,饱和的硫酸铵分离血清蛋白。盐析时溶液的pH值越接近蛋白质的pI,效果越好。盐析法一般不引起蛋白质的变性,是分离蛋白质的常用方法之一。
可与水混溶的乙醇、丙酮等有机溶剂都是脱水剂,能破坏蛋白质分子表面的水化膜,使蛋白质易于从溶液中析出。在常温下,有机溶剂沉淀蛋白质往往引起变性,如酒精可以消毒灭菌。若在低温(0~4℃)条件用乙醇或丙酮沉淀蛋白质,只要快速分离,一般不易变性。此法也可用于分离蛋白质,如果适当调整溶剂的pH值和离子强度,分离效果更好。
重金属离子(如银、汞、铜、铅等)可与带负电荷的蛋白质结合形成不溶性盐而沉淀。沉淀条件是溶液pH值大于pI。重金属盐沉淀蛋白质往往会使蛋白质变性。临床上抢救误服重金属盐的中毒患者,常常灌服大量蛋白质如牛奶、豆浆等,与重金属离子形成不溶性络合物,从而减轻重金属离子对机体的损害。长期从事重金属作业的人员,提倡多吃高蛋白食物,以防止重金属离子被人体吸收而造成损害。
生物碱试剂如苦味酸、鞣酸、磷钨酸、磷钼酸、三氯乙酸等的酸根离子可与带正电荷的蛋白质结合形成不溶性盐而沉淀。沉淀条件是溶液pH值小于pI。在临床检验中,常用三氯乙酸和磷钨酸沉淀血液中蛋白质以制备去蛋白滤液,或者用苦味酸检验尿蛋白。生物碱试剂可引起蛋白质变性。
蛋白质在某些理化因素的作用下,使特定的空间结构遭到破坏,从而导致其理化性质的改变和生物学活性的丧失,这种现象称为蛋白质变性(denaturation)。很多因素都会使蛋白质变性,如高温、高压、紫外线、超声波、强酸、强碱、重金属离子、生物碱试剂等。蛋白质变性的实质是维系蛋白质空间结构的次级键断裂,使有序的空间结构变为无序的松散状态,分子内部的疏水基团暴露出来,使其在水中的溶解度降低并丧失生物学活性。因此,蛋白质变性后,理化性质发生明显变化,如溶解度降低、黏度增加、结晶能力消失、易被蛋白酶降解和原有的生物学活性丧失。
有些蛋白质变性后,采用一定条件去除变性的因素,能恢复或部分恢复原来的空间构象,并恢复其生物学活性,这种现象称为蛋白质复性(renaturation)。如在核糖核酸酶溶液中加入尿素和β-巯基乙醇,维持核糖核酸酶空间结构的四个二硫键被破坏,失去催化活性。当用透析法去除尿素和β-巯基乙醇以后,二硫键重新形成,其原有的空间结构及催化活性又得以恢复(图2-18)。蛋白质变性后的复性,与蛋白质种类、分子结构改变的程度等都有关。一般情况下,大多数蛋白质变性是不可逆的。
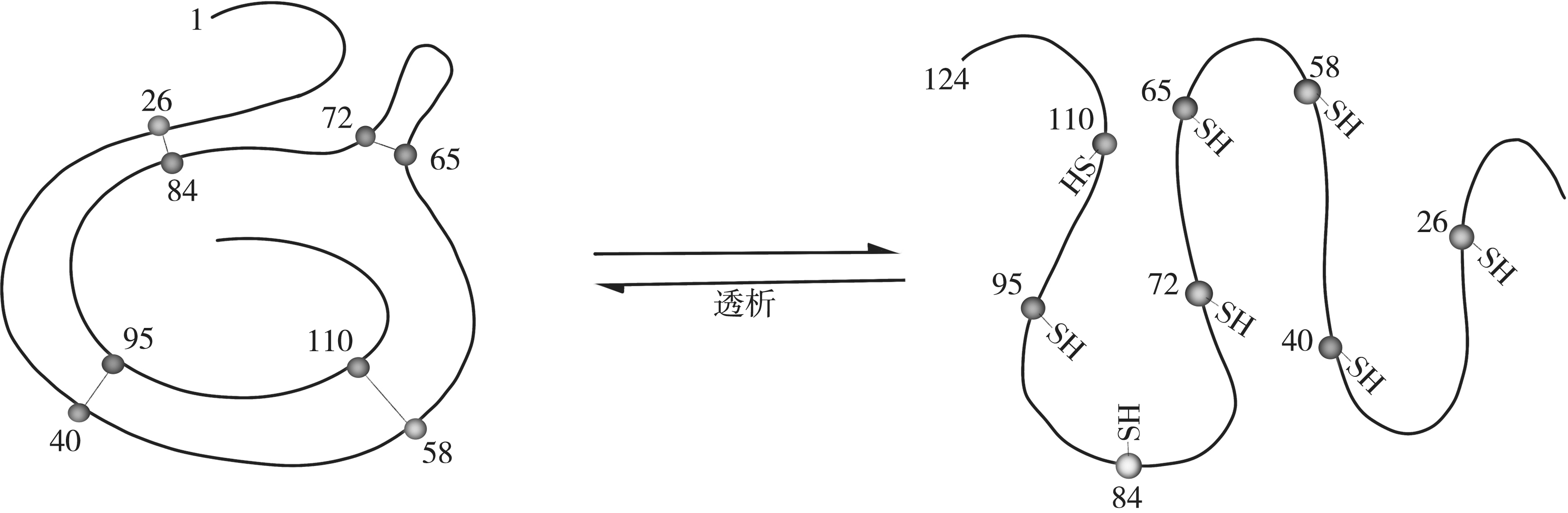
图2-18 核糖核酸酶的变性与复性示意图
蛋白质变性具有重要的临床及科研应用价值,如用乙醇、紫外线、高温、高压等消毒灭菌;低温条件下制备和保存疫苗、酶、血清等蛋白制剂,防止变性失活。
大多数蛋白质分子中含有酪氨酸和色氨酸残基,因此,蛋白质在280nm波长处有特征性吸收峰。在一定条件下,蛋白质A 280 与浓度呈正比,利用此特性可用紫外分光光度法进行蛋白质的定量分析。
蛋白质分子中的肽键及氨基酸残基侧链的某些化学基团能与特定试剂作用呈色,常被用于蛋白质的定性、定量分析。
1.双缩脲反应 凡是含有两个或两个以上肽键的化合物在碱性溶液中与硫酸铜反应生成紫红色螯合物。此反应可用于蛋白质和多肽的定量测定,氨基酸和二肽不出现此反应,因此可用于检测蛋白质的水解程度。
2.酚试剂反应 先用碱性铜溶液与蛋白质反应生成紫红色螯合物,再加入酚试剂(磷钼酸与磷钨酸),将螯合物中的酪氨酸和色氨酸还原生成蓝色化合物。此反应的灵敏度比双缩脲反应高100倍,可用于微量蛋白质的定量测定。