




蛋白质的一级结构包含了形成特定空间结构所需的全部信息,是其空间结构的物质基础,而蛋白质的空间结构决定蛋白质的生物学活性,因此蛋白质的一级结构对其生物活性的发挥起关键作用。
存在于不同生物体内,具有相同或者相似生物活性的蛋白质称为同源蛋白质(homologous protein)。在同源蛋白质的一级结构中,有些位置的氨基酸残基对所有种属都是相同的,称为不变残基;有些位置的氨基酸残基在不同种属之间差异很大,称为可变残基。
不同种属来源的胰岛素分子由两条多肽链组成,其中约有22个氨基酸残基的种类与位置完全相同,其空间结构也相似。虽然A链第8、9、10位和B链第30位氨基酸均为可变残基,差异较大,但功能不变,都具有调节物质代谢、降低血糖的作用。
如果蛋白质分子中关键部位的氨基酸残基发生变化,从而会影响空间结构引起功能发生改变,甚至导致疾病的发生。如镰刀状红细胞贫血(sickle-cell anemia),血红蛋白分子中β链的N-端第6位氨基酸残基,由酸性亲水的谷氨酸突变成中性疏水的缬氨酸,仅此一个氨基酸残基的改变,使正常水溶性的血红蛋白溶解度下降,聚集成棒状析出,导致红细胞扭曲成镰刀状。这种由于基因突变导致的蛋白质分子中某个氨基酸残基发生变异引起的疾病,称为分子病(molecular disease)。
蛋白质的功能发挥有赖于其特定的空间构象,当构象发生变化时,其功能随之也发生变化。
血红蛋白(hemoglobin,Hb)在人体内的主要生理功能是运输O 2 。Hb是α 2 β 2 组成的四聚体,α亚基含有141个氨基酸残基,β亚基含有146个氨基酸残基,每个亚基含有一个能与O 2 结合的血红素辅基。1分子Hb能结合4分子O 2 。
人Hb和昆虫Hb的一级结构存在较大差异,但空间结构十分相似,与血红素相连的氨基酸都是组氨酸和苯丙氨酸,这说明一级结构差异较大的多肽链可以形成相似的空间结构,相似的空间结构赋予不同种属同源蛋白质相同的生物活性。
当Hb未与O 2 结合时,其四级结构为紧张构象(tense state,T态),与O 2 亲和力小。
O 2 与Hb第一个亚基的结合使Hb的四级结构由紧张构象转变为松弛构象(relaxed state,R态),与O 2 的亲和力大。
Hb结合O 2 的能力依赖于分子中的血红素。血红素由原卟啉Ⅸ和Fe 2+ 构成。Fe 2+ 可形成6个配位键,其中4个与原卟啉环的4个氮原子形成,第5个与位于原卟啉平面一侧的组氨酸形成,第6个与位于原卟啉平面另一侧的O 2 形成,非氧合状态时与H 2 O形成(图2-16)。
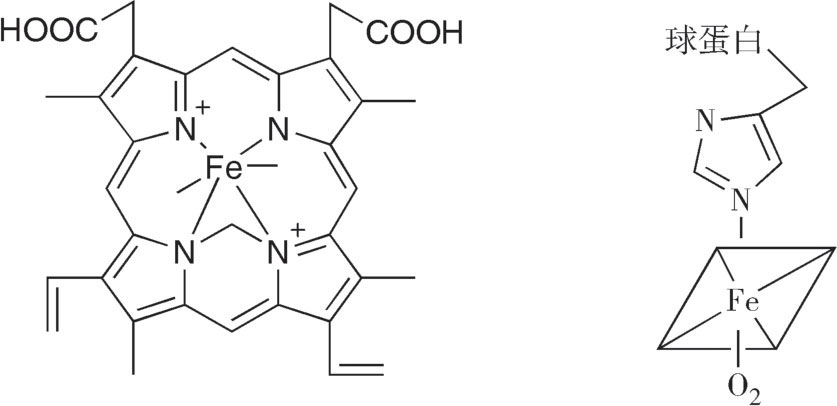
图2-16 铁卟啉
多亚基蛋白分子中,一个亚基与其配体的结合影响其他亚基与配体的结合,这种现象称为协同效应(cooperativity)。若这种影响是促进其他配体的结合则称为正协同效应;反之,称为负协同效应。
如果多肽链的折叠发生错误,尽管一级结构不变,但蛋白质的构象发生改变,也可影响其功能,严重时可导致疾病,常将此类疾病称为蛋白质构象疾病。有些蛋白质错误折叠后相互聚集,可形成抗蛋白水解酶的淀粉样纤维沉淀,产生毒性而致病,这类疾病包括人纹状体脊髓变性病、阿尔茨海默病、亨廷顿舞蹈病、疯牛病等。
疯牛病是由朊病毒蛋白(prion protein,PrP)引起的人和动物神经退行性病变,这类疾病具有传染性、遗传性或散在发病的特点。朊病毒是一类能引起同种或异种蛋白质构象改变而使其功能改变或致病的蛋白质。
朊病毒蛋白质的三级结构有两种构象:一种是正常的PrPc构象,以α-螺旋为主;另一种是致病的PrPSc构象,以β-折叠为主(图2-17)。富含α-螺旋的PrPc在某种未知蛋白质的作用下,可转变成分子中大多数为β折叠的PrPSc。PrPc和PrPSc的一级结构完全相同,可见PrPc转变成PrPSc涉及蛋白质分子α-螺旋重新折叠成β-折叠的过程。PrPSc对蛋白酶不敏感,水溶性差,对热稳定,可以相互聚集,最终形成淀粉样纤维沉淀而致病。
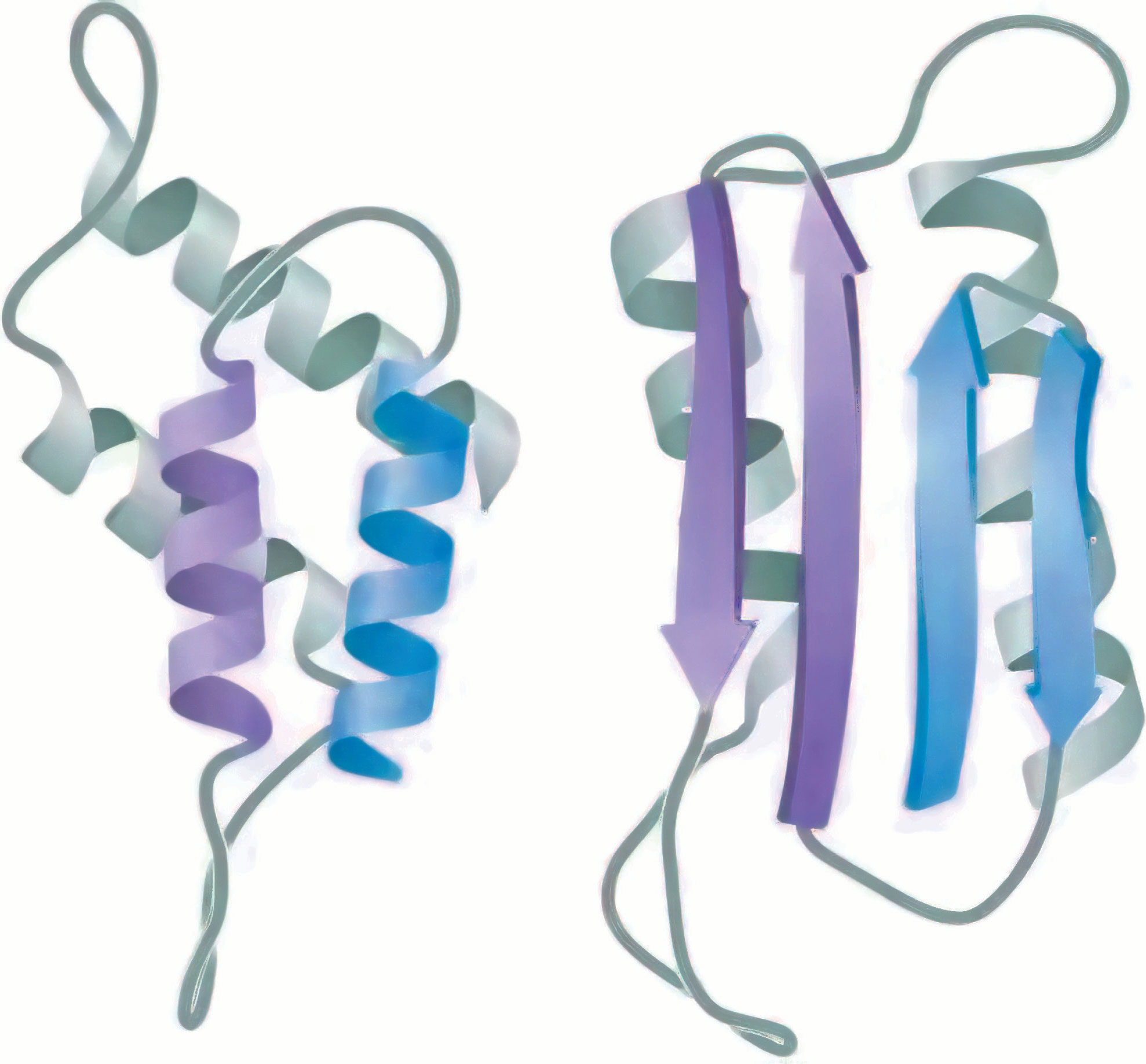
图2-17 朊病毒