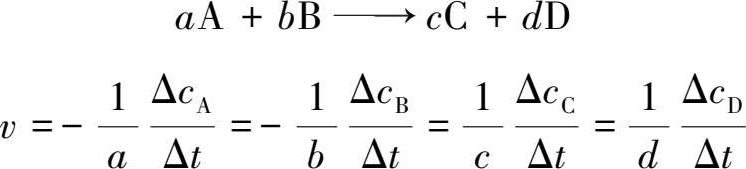化学反应速率是用来衡量化学反应进行快慢的一个物理量。对于气体反应和溶液反应而言,在反应体系体积不变的情况下,化学反应速率定义为单位时间内反应物或生成物浓度改变量的正值。表达式为

固体和纯液体由于浓度几乎固定不变,因此一般不用来表示化学反应速率。
例如,在某给定条件下,1 mol N 2 与3 mol H 2 在2 L的密闭容器中合成氨气,在2 s末,测得容器中含有0.4 mol NH 3 ,则此时各物质浓度的变化如下:
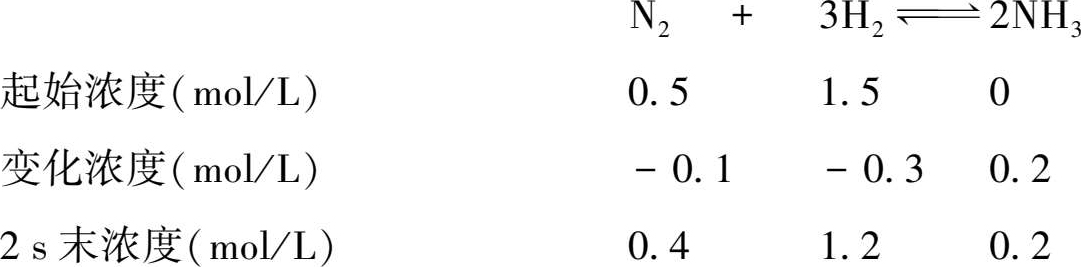
如果用氮气浓度的改变来表示反应速率,则有
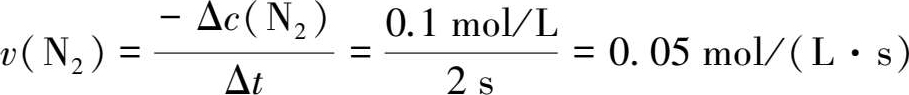
如果用氨气浓度的改变来表示反应速率,则有:
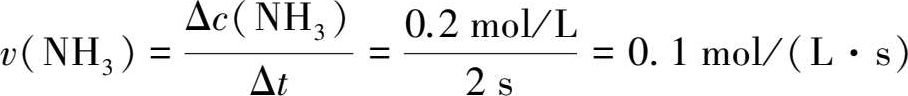
由于参加反应的各物质的浓度随着反应进行而不断变化,故反应速率也将不断变化。上例中所求得的反应速率实际上是该段时间间隔Δ t 内的平均反应速率 v .。时间间隔越短,越能反映某一时刻的反应速率。若将时间间隔无限缩小,平均速率的极限值即为化学反应在 t 时的瞬时速率(还有作图法也可以求出瞬时速率,在这不多做介绍)。
反应速率的表达式有两点需要注意:
(1)从以上表达式可以看出,反应速率的单位是用浓度单位除以时间单位,通用的速率单位一般是mol/(L·s)和mol/(L·min)。
(2)在同一个反应内(不同物质的化学计量系数不同的情况下),用不同物质的浓度变化量的正值来表示的反应速率其数值是不同的,因此需要注明是由哪种物质的浓度变化值表示的,不然容易混淆。不同物质表示的速率除以反应方程式中该物质在方程式中的系数,就得到一个相同数值。该数值即为该反应的统一反应速率,这样一个反应就只有一个反应速率值,使用更方便。如