




摘要 :高血压是一种严重危害人类健康的心血管疾病,近年来发病率不断增高,但其发病机制尚不十分清楚。大量研究表明,原发性高血压是一种多基因遗传性疾病,肾素—血管紧张素系统(RAS)中的基因与高血压的发生关系最为密切,其中血管紧张素原(AGT)和肾素(REN)基因是非常关键的两个基因。为了建立可用于研究高血压发病机制和治疗方法的动物模型,本研究首先将引进的人AGT和REN转基因杂合子小鼠与野生型小鼠交配,通过聚合酶连反应(PCR)鉴定,将同胞阳性仔鼠再交配,筛选纯合子小鼠;其次,将两种纯合子小鼠交叉交配,建立AGT⁃REN双转基因小鼠模型;最后,利用生物机能实验系统和病理组织学技术观察野生型、单纯杂合子和双转基因小鼠的血压和肾组织形态变化。
关键词 :血管紧张素原 肾素 转基因小鼠 高血压 动物模型
1.1 实验材料
1.1.1 动物
由中国医科院实验动物研究所引进的人AGT和人REN杂合子转基因小鼠在华北煤炭医学院清洁级动物房进行繁殖。清洁级基础饲料和繁殖饲料喂养小鼠。
1.1.2 试剂
(1)鼠尾裂解液:称取Tris 12.1g,EDTA 2g,NaCl 11.7g,SDS 2g溶于 800ml蒸馏水中,用浓盐酸调pH至 8.0,最后定容至 1000ml。
(2)TE缓冲液:10mmol/LTris·Cl(pH8.0),1mmol/L EDTA(pH8.0)。
(3)3mol/L NaAc(pH5.2):50ml水中溶解 40.81g NaAc·3H2O,用冰醋酸调pH至 5.2,加水定容至 100ml,121℃高压灭菌 20 分钟。
(4)蛋白酶K购自上海生工生物科技有限公司,用前配成 20mg/ml浓度。
(5)PCR试剂盒包括Taq酶、含Mg 2+ 反应缓冲液和dNTP混合物购自大连宝生物工程有限公司。
(6)10%水合氯醛
(7)1:10000 肝素钠
1.1.3 仪器设备
实验过程中所用到的主要仪器设备见表 1。
表 1 实验所用仪器设备
1.2 实验方法
1.2.1 转基因小鼠的繁殖及筛选
将引进的人AGT和REN杂合子转基因小鼠作为F1 与野生型C57 小鼠交配(见图 1),仔鼠生后 10—14 天剪趾编号、剪鼠尾,-20℃冰箱保存备用。

图 1 人AGT转基因(A图)和人REN转基因小鼠(B图)的繁育
将两种转基因小鼠的后代F2 进行同胞交配繁育至F3,筛选纯合子小鼠,再将两种不同纯合子的小鼠进一步配对杂交,以获得双转杂合子小鼠(图2)。同样,每窝小鼠生后 10—14 天剪趾和鼠尾编号并进行PCR检测 [8,9] 。
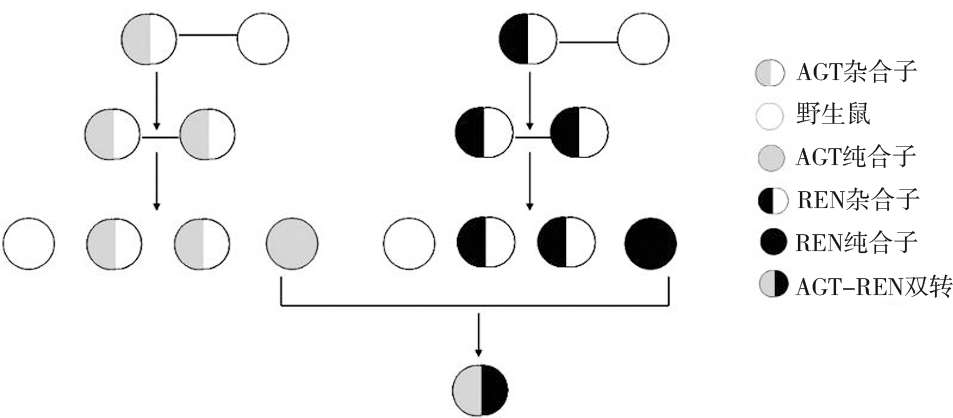
图 2 纯合子和双重转基因小鼠的筛选
1.2.2 鼠尾基因组DNA的提取
实验采取饱和盐法提取鼠尾基因组DNA [10] 。具体步骤如下:
(1)剪鼠尾0.5cm,加入0.5ml裂解液和13μL 20mg/ml蛋白酶K,55℃恒温水浴振摇过夜消化。
(2)加入 300μL饱和氯化钠,摇匀后冰上静置 15 分钟。
(3)室温,14000rpm离心 15 分钟。
(4)取上清 600μL,加入等体积异丙醇。
(5)室温,12000rpm离心 10 分钟。
(6)弃去上清,加入 70%乙醇洗涤沉淀,将沉淀室温干燥 15 分钟。
(7)加入 100μL TE吹打混匀,4℃过夜将DNA完全溶解。

图 3 DNA提取实验
1.2.3 PCR扩增
PCR是一种体外核酸扩增技术,在一个试管内将所要研究的目的基因于数小时内扩增至十万乃至百万倍,使肉眼能直接观察和判断,它具有特异、敏感、产率高、快速、重复性好等突出优点,是目前基因型鉴定最常用的方法 [10] 。
表 2 转基因小鼠PCR鉴定所用引物、反应体系和反应条件
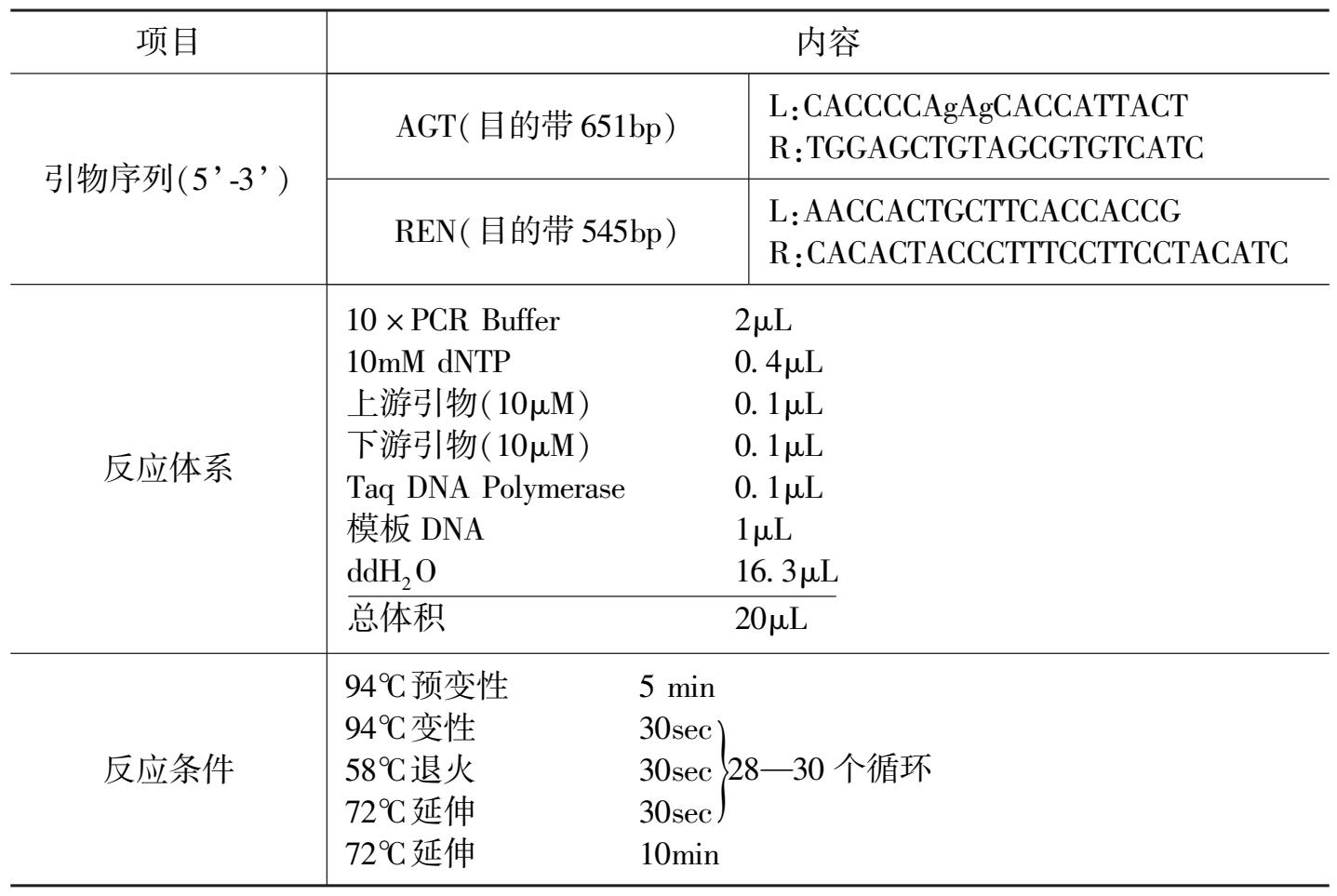
本研究针对人AGT和REN基因利用引物设计软件Primer5.0 设计特异性的引物,由上海生物工程有限公司合成。两种转基因小鼠PCR鉴定所用反应体系和反应条件相同,具体内容见表 2。
1.2.4 琼脂糖凝胶电泳
(1)用水、70%乙醇、去离子水冲洗灌胶模具,晾干。
(2)用电泳缓冲液配制 1%的琼脂糖,倒入模具里。
(3)待胶凝后(约 30min)小心移出梳子,将胶放入电泳槽内,倒入电泳缓冲液,使缓冲液没过胶孔。
(4)在第一个胶孔内加入 5μL Marker,其余依次加入 10μL混合了Loading Buffer的PCR反应后的产物,连接电源,80V电泳 30min。
(5)电泳结束,取下凝胶在紫外灯下观察并拍照记录。
1.2.5 转基因鼠和野生鼠血压测定
选择月龄相同的AGT阳性杂合子小鼠、REN杂合子阳性小鼠、AGT⁃REN双转阳性鼠以及野生型小鼠各 3 只,进行颈动脉插管检测血压 [11] 。步骤如下:
(1)称重:将小鼠分别称重。
(2)麻醉:10%的水合氯醛按 0.3ml/100g体重腹腔注射。
(3)固定:待小鼠被麻醉之后,将其用橡皮筋固定在手术平台上。
(4)分离小鼠左侧颈总动脉:颈总动脉位于气管的两侧,其腹面被肌肉所覆盖。分离肌肉之间的结缔组织,在气管的左侧可看到有波动迹象的粉红色血管,即为颈总动脉。它与颈部的神经束在一起,用镊子顺着血管和神经的走向分离出颈总动脉,注意不要损伤血管周围的神经。
(5)插管:在分离的颈动脉之下穿 2 根线,一根结扎动脉远心端,另一根线打一活结置于动脉夹与远心端结扎线之间,用动脉夹夹住近心端。插管时以左手拇指及中指拉住远心端结扎线头,用眼科剪在动脉上呈 45°角剪一小口,约为管径的 1/3,然后插入动脉插管,插入后结扎固定。最后小心松开动脉夹。
(6)将动脉插管连接BL⁃420 生物信号采集系统,进行血压检测,观察小鼠血压 1h。
1.2.6 形态学的方法观察小鼠肾组织病理改变
血压测定完成后,颈动脉放血处死小鼠,取肾脏组织,放入 10%的甲醛溶液中固定。固定 48 小时后,进行脱水、透明、石蜡包埋、切片、HE染色、封片等处理,显微镜下观察肾脏组织结构形态。
2.1 PCR对转基因小鼠的基因型鉴定
2.1.1 杂合子转基因小鼠的筛选
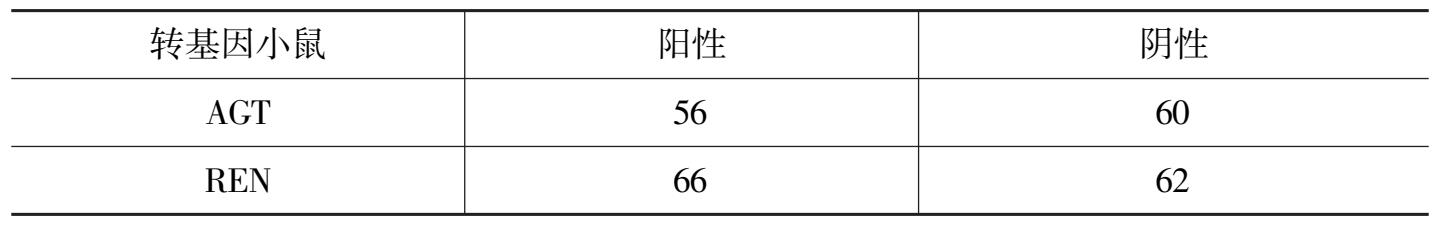
将人AGT和REN雌性杂合子转基因小鼠分别与相同遗传背景的雄性小鼠杂交,通过PCR鉴别阳性杂合子小鼠和阴性小鼠。根据孟德尔定律,杂合子小鼠可产生两种基因型不同的生殖细胞,而野生型小鼠只产生一种基因型生殖细胞,假设生殖细胞的结合是完全自由组合的话,那么产生阴性和阳性后代的比例应为 1:1。本研究引进两种转基因杂合子小鼠各 2 只,繁殖了 3 代后仔鼠总数量见表 3,阳性小鼠约占 1/2,结果与预期值相符,符合孟德尔遗传规律,初步证明外源基因稳定遗传给后代。部分PCR鉴定结果见图 4,图中M为分子量标记,从上向下依次为 2000bp、1000bp、750bp、500bp、250bp、100bp;H2O为不加模板DNA空白对照;W为野生鼠DNA作为阴性对照;T为引进的阳性鼠DNA作为阳性对照;其余为样本。
表 3 人AGT和REN杂合子转基因小鼠的筛选结果
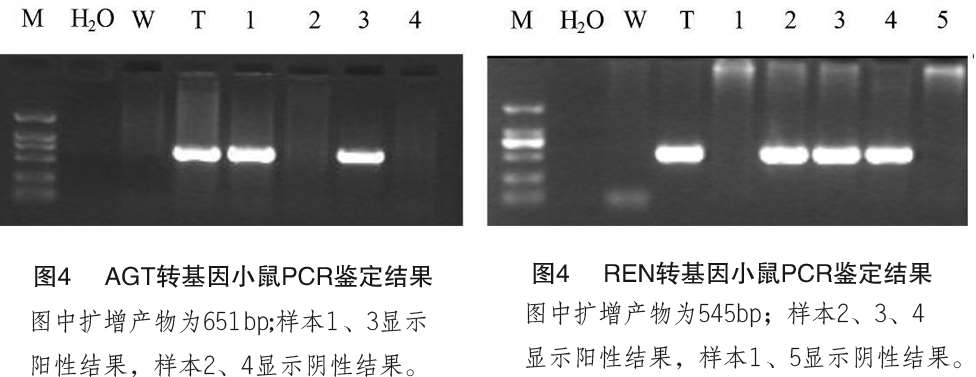
2.1.2 纯合子转基因小鼠的筛选
通过对两组转基因小鼠组内阳性小鼠配种,筛选得到纯合子(AGT1♀1♂、REN1♀1♂),纯合子小鼠与野生小鼠交配所产后代均为阳性小鼠,结果见图 5。
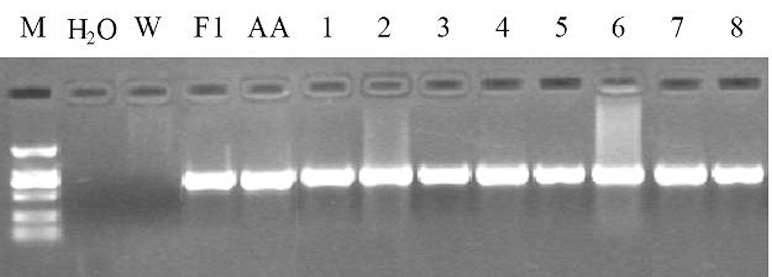
图 5 筛选AGT纯合子小鼠PCR检测结果
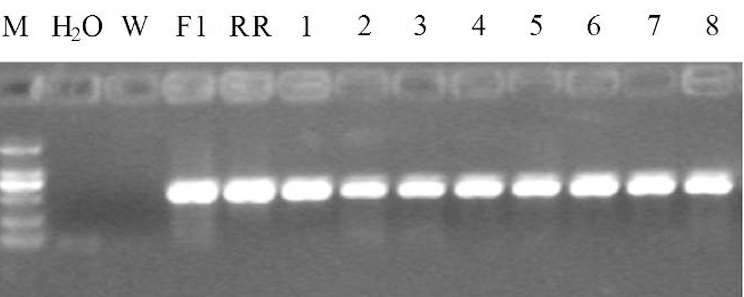
图 5 筛选REN纯合子小鼠PCR检测结果
图中F1 为亲本AGT杂合子小鼠;AA为子代纯合子小鼠;1 ~ 8 为AA的后代即子代单纯杂合子小鼠
图中F1 为亲本REN杂合子小鼠;RR为子代纯合子小鼠;1 ~ 8 为RR的后代即子代单纯杂合子小鼠
2.1.3 双转基因小鼠的筛选
通过将两种纯合子转基因小鼠的组间配种,筛选得到 6 只双重转基因小鼠(AGT⁃REN3♀3♂),PCR检测AGT和REN基因均为阳性。
2.2 血压测定结果
利用BL⁃420 生物信号采集系统对筛选出的AGT杂合子小鼠、REN杂合子小鼠、AGT⁃REN双重转基因小鼠和相同背景的野生型小鼠各 6 只进行血压监测发现,AGT和REN杂合子小鼠平均动脉压分别为 84.37 ± 6.32mmHg和 74.69 ±8.12mmHg,与野生小鼠平均动脉压(87.21 ± 3.56mmHg)相比无明显差异;而AGTREN双重转基因小鼠平均动脉压为 140 ±5.68mmHg,明显高于正常野生小鼠平均动脉压。部分血压测定结果见图 6。
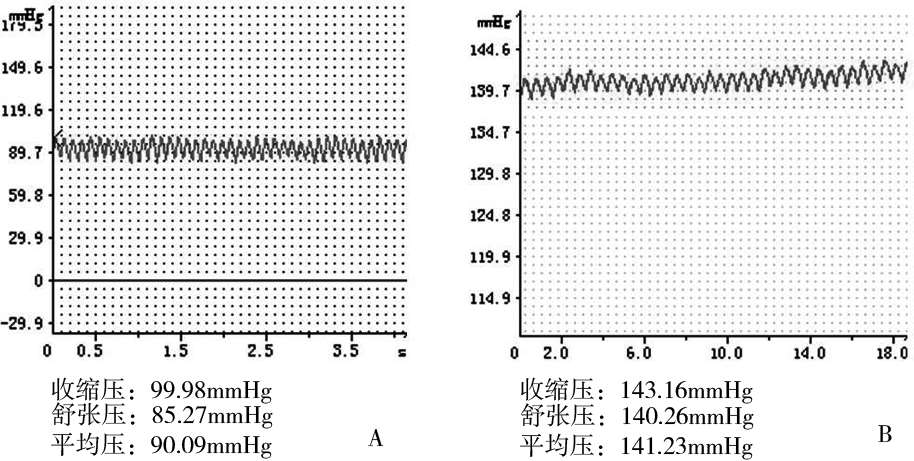
图 6 正常野生小鼠(A图)和AGT⁃REN双转基因小鼠(B图)血压
2.3 肾脏组织病理变化
显微镜下观察各组 10 月龄小鼠的肾脏组织病理变化,结果显示,AGT和REN杂合子小鼠与野生鼠相比较,组织结构无明显差异,未见异常组织形态改变。 AGTREN双转基因鼠则出现明显的恶性高血压肾脏病理改变,可见肾小动脉管壁增厚、官腔狭窄;肾小球纤维化、玻璃样变;肾小管代偿性扩张,可见大量透明管型;间质内有大量炎细胞浸润。部分肾组织病理变化结果见图 7。
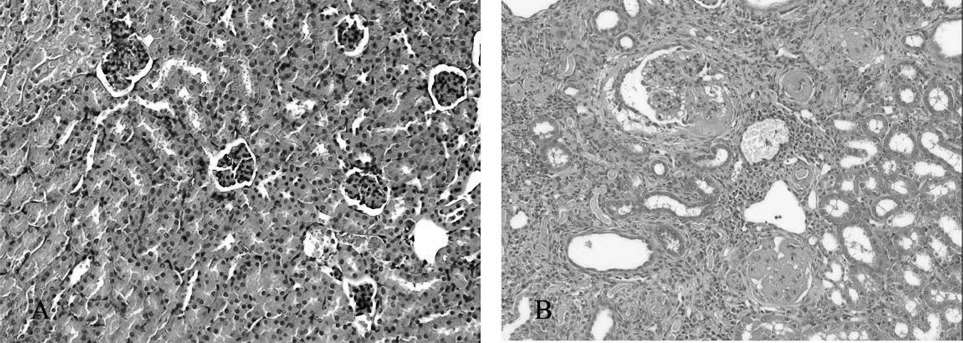
图 7 正常野生小鼠(A图)和AGT⁃REN双转基因小鼠(B图)肾组织
3.1 转基因阳性小鼠的PCR法基因型鉴定
目前,国内外的转基因的技术已经基本成熟,人们所面临的最大挑战是外源基因能否在动物体内表达并出现一定的基因表型。由于转基因的随机插入,外源基因在转基因动物体内的表达主要决定于外源基因的整合位点。目前用于检测外源基因是否在小鼠染色体基因组中整合的方法主要有:PCR法、Southern杂交法和荧光原位杂交法等 [13] 。由于后两种方法比较费时费力,而PCR检测方法快速、简便,因此本研究根据孟德而遗传规律对小鼠进行同胞交配,结合PCR法对AGT和REN转基因小鼠进行繁育和纯合子的筛选。
对AGT和REN单纯杂合子小鼠进行的PCR筛选结果发现,杂合子转基因小鼠与野生型小鼠交配,后代经PCR检测阳性鼠与阴性鼠的比例大约为 1:1,结果符合孟德尔遗传定律,证明外源基因能稳定遗传给后代。
纯合子筛选是本模型建立的重要步骤之一。从F1 起,如果采用全同胞交配到F3,按照孟德尔遗传理论,在F2 便有 1/4 的仔鼠成为纯合子。为了增加获得纯合鼠的机会,在F2 中选出若干对转基因小鼠进行配种,如果F3 中一窝仔鼠全部为阳性,则这一窝的双亲中有可能有一个或两个是纯合子,再将这两只鼠分别与野生小鼠交配,后代连续 3 窝全部为阳性,则证实亲本转基因小鼠为纯合子。由于转基因小鼠在外貌表型上和正常小鼠并无差异,本研究通过这种经典方法结合系谱分析及PCR检测,筛选出AGT和REN纯合子各一对。近年来有文献报道,在不伤害小鼠的情况下,可通过全血间期核或皮肤成纤维细胞的原位免疫荧光(FISH)实验筛选纯合子,极大地缩短了纯合子的筛选进程,但需借助于高级的实验设备 [12] 。本研究待实验条件具备后,可对筛选出的纯合子进行FISH验证实验。
3.2 AGT⁃REN双转基因高血压小鼠的表型分析
国内外研究证实,RAS的激活在高血压中起着重要的作用。为了深入研究RAS中各成分在高血压发病中的作用以及相互关系,国外研究者将人AGT或REN基因单独导入小鼠的基因组中,结果发现,尽管单独携带人REN基因或AGT基因的转基因小鼠体内血浆ANGⅡ的水平比阴性小鼠升高1 ~2 倍,外源基因表达也增高,但血压未见明显升高;而同时携带人REN基因和AGT基因的双转基因小鼠体内血浆ANGⅡ的水平升高 5 ~ 6 倍,其血压明显升高30 ~40mmHg。这些研究提示,人肾素或血管紧张素原不能与小鼠内源性的RAS系统发生酶促反应,即人的肾素不能水解小鼠的血管紧张素原,而小鼠的肾素不能水解人的血管紧张素原,而肾素催化血管紧张素原的反应是整个RAS系统中酶促反应的限速步骤,因此,人REN或AGT转基因小鼠有可能不表现明显的血压升高(图 8) [7] 。本研究中,经PCR鉴定为人REN或AGT杂合子转基因小鼠,其血压与野生型小鼠比较未见明显异常,而AGT⁃REN双转基因小鼠血压明显增高,与文献报道的结果一致。实验结果表明,本研究成功建立了AGT⁃REN双转基因高血压小鼠模型。
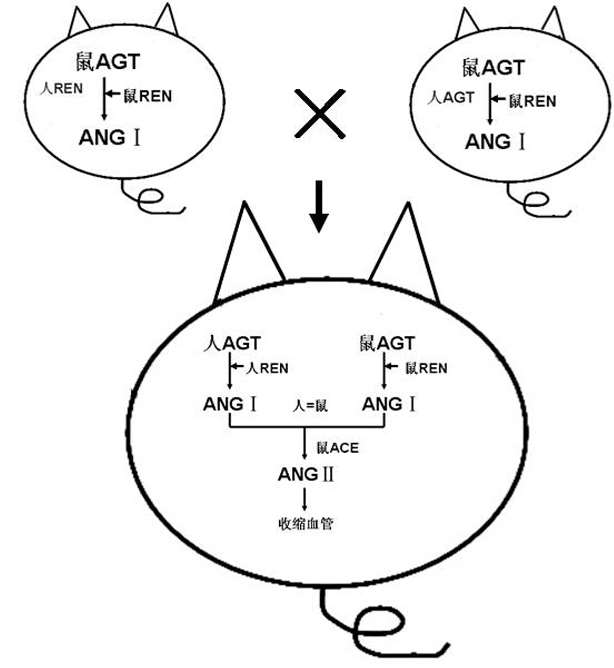
图 8 AGT⁃REN双转基因小鼠体内RAS反应
高血压患者随病情的发展,多年后可引起全身的小动脉硬化病变包括肾小动脉硬化,管壁增厚,管腔变窄,引起肾脏缺血损伤,严重时可导致肾功能衰竭,而肾脏的结构和功能发生改变又会进一步恶化高血压的发展 [14] 。原发性高血压继发肾脏损害的机理至今不清 [15] 。
本研究利用PCR的方法鉴定了AGT、REN转基因小鼠并筛选出两种转基因小鼠的纯合子,然后对两种转基因小鼠进行了交配,得出如下结论:
(1)转基因小鼠是指用实验的方法把外源性基因导入小鼠染色体,在体内得到表达并能遗传给后代的小鼠。本研究AGT和REN杂合子转基因小鼠与野生型小鼠交配,后代经PCR检测,结果符合孟德尔遗传定律,初步证明人AGT与REN基因能稳定遗传给后代。
(2)利用BL⁃420 生物信号采集系统和病理组织学技术观察杂合子和纯合子小鼠的血压和肾组织形态,外源性的人AGT或REN基因单独整合到小鼠体内对小鼠的血压和肾组织未见明显影响,而AGT⁃REN双转基因小鼠血压明显增高并出现典型的高血压性肾损伤变化,可作为研究高血压发病机制和治疗方法的动物模型。
[1]段书,肖晶,赵水平,朱熊兆.心理社会因素在高血压中的作用及其研究进展[J].中华高血压杂志,2008,16(12):1065 ~ 1067.
[2]董伟,杨志伟,曹兴水,姚璐,张旭,高珊,张海涛,张连峰.不同鼠龄的人多巴胺D5 F173L突变基因转基因高血压小鼠血压及心脏结构与功能分析[J].中国比较医学杂志,2010,20(8):1 ~ 5.
[3]彭澍,彭健,龚五星,方明,赵艳,罗礼云.不同性别高血压病患者肾素—血管紧张素系统多基因多态性关联研究[J].中西医结合心脑血管病杂志,2010,8(6):643 ~ 645.
[4]姚丽,王力宁,焦亚彬,魏丹丹,刘美娜.血管紧张素Ⅱ在内皮素诱导的大鼠高血压中的作用[J].实用药物与临床,2010,13(3):164 ~ 166.
[5]张艳荣,张连峰,杨志伟.高血压实验动物模型[J].中华高血压杂志,2008,16(3):205 ~ 207.