




一般选用单胎绵羊(总孕程145±5天),根据需要选择不同妊娠阶段,饲养于室内研究专用的不锈钢笼中,灯光照明,明暗各12小时。自由饮水、进食,术前一天禁食。所有实验方案均须符合实验动物保护和管理规定并获得许可。
手术采用严格无菌操作。怀孕母羊肌内注射盐酸氯胺酮(ketaminehydrochloride,20mg/kg)和硫酸阿托品(50 μg/kg)进行麻醉诱导,之后气管插管,呼吸机通以1 L/min 氧气和 3% 异氟烷(isoflurane)进行麻醉维持。母羊一侧股动脉和股静脉插管(ID = 1.8mm,OD = 2.3mm),分别至腹主动脉和下腔静脉。
腹部正中切口,暴露子宫。子宫内手术主要分三部分进行,图2-1为胎羊子宫内手术示意图:
(一)胎羊后肢和腹部手术:选取合适位置,切开子宫,取出胎羊后肢,做一侧股动脉和股静脉插管(ID = 1.0mm,OD = 1.8mm),并放置子宫内导管测定羊水压力;缝合子宫切口;
(二)胎羊头部手术:再次选取适当位置,切开子宫,暴露胎羊头部。侧脑室插管(18 gauge),位置:矢状缝旁开1cm,人字缝前0.5cm,硬脑膜下约0.8cm,当进入侧脑室后可见脑脊液流出;颅骨钻于颅骨上打洞,于顶骨硬脑膜安装脑电极,用螺丝固定,用于皮层电图(electrocorticogram,ECoG)的监测;之后将插管和脑电极用牙科水泥固定于颅骨上;缝合子宫(图2-2A);
(三)胎羊颈部手术:颈部正中切口,进行吞咽电极安装(型号:AS632,Cooner Wire,Chatsworth,CA)于甲状腺部位,食道平滑肌上、下各安装一对电极,用于监测胎儿肌电图,反映胎羊的吞咽状况。
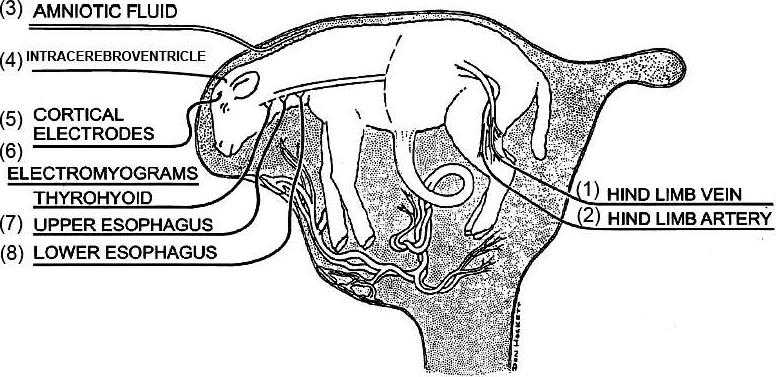
图2-1 子宫内绵羊胎儿插管示意图
(1)一侧股静脉插管(用于外周给药);(2)一侧股动脉插管(用于血压监测、采血);(3)羊水插管(监测羊水压力);(4)侧脑室插管(用于侧脑室给药);(5)脑电极安装(监测皮层电图);(6-8)食道平滑肌三对肌电电极安装(监测胎儿吞咽活动)。
所有插管从母羊一侧腹部打洞穿出,置于固定于腹侧的小包内,术后即刻及3-4天内于静脉内给予抗菌素。母羊每日70mg庆大霉素和1g苯甲异噁唑青霉素(新青二);胎羊每日5mg庆大霉素和30mg新青二。术后恢复四至五天,开始测试。
所有实验在动物清醒状态下进行,妊娠母羊静立于笼中,自由饮水进食(图2-2B)。随机分为对照组和实验组,每组n至少为5。实验采取连续监测,一般先记录1h基础状态(-60~0min),然后进行药物干预(静脉注射或侧脑室注射),之后继续记录1.5~2h(0~90或0~120min)。药物剂量根据文献及前期实验选定。
胎儿体重根据公式推测(Robillard et al.,1979):
胎儿体重(kg)= 0.0961 × 妊娠天数-9.228
实验中,采用生理记录系统连续监测母亲、胎儿的收缩压和舒张压,羊水压力和心率采样频率为500 Hz(图2-3)。胎儿平均动脉压(mean arterial pressure,MAP)由羊膜腔压力校准。于不同时间点(如-30min、0min、15min、30min、60min、90min)分别由母亲和胎儿的股动脉插管采血约3.5ml。取0.5ml用于测定PO 2 、PCO 2 、血红蛋白(hemoglobin,Hb)及pH,仪器为Nova analyzer(Nova Biochemical,Model pHOx Plus L,Waltham,MA),校正于绵羊深部温度39°C。剩余血液低温离心,分离出血浆,除用于血浆渗透压和电解质浓度的测定外,均于-20°C冻存,以便用于血浆激素测定。所采胎儿血液用等量滤过后母亲血液(测试前抽取)替代,所采母亲血液用等量生理盐水替代。
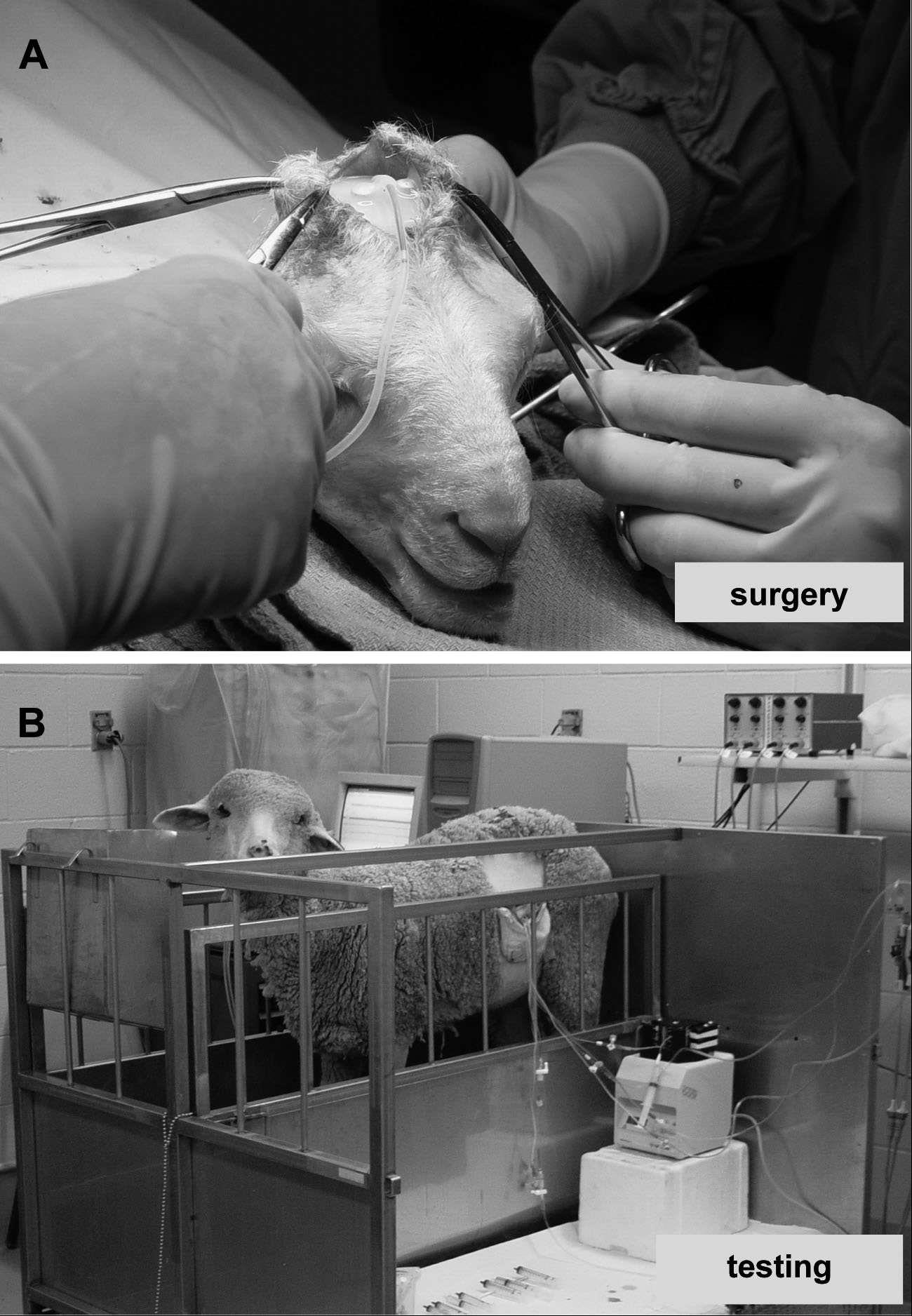
图2-2 子宫内绵羊胎儿侧脑室插管及功能测试
A:绵羊胎儿侧脑室插管,可见脑脊液流出。B:清醒无麻醉状态下的功能监测。
实验中根据需要动态连续监测ECoG和食道平滑肌肌电图。手术中在胎羊颈部由上而下在甲状腺部位及食道平滑肌上埋设的三对电极可以记录食道平滑肌的肌电图(electromyography,EMG),EMG电活动的出现从上至下有时间上的先后关系(图2-4)。胎儿的ECoG可以分为高电压(high-voltage,HV)低频和低电压(low-voltage,LV)高频时相。大约有5%左右的区域既不属于HV,也不属于LV,被认为是中间ECoG活动。发生在HV和LV时相的吞咽活动,用此时相的吞咽总个数除以其时间段,以每分钟LV或HV的吞咽个数表示。
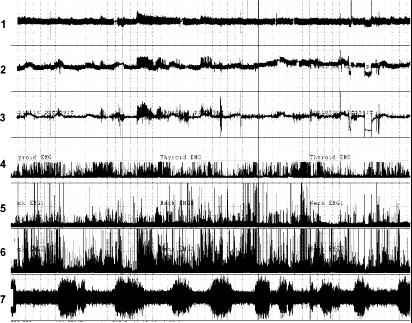
图2-3 孕羊母亲及胎儿动态生理功能监测
图中所示1-7为7道生理信号连续记录。1,母羊血压;2,胎羊血压;3,羊水压力;4-6,胎羊食管平滑肌肌电图(上,中,下);7,胎羊皮层电图。
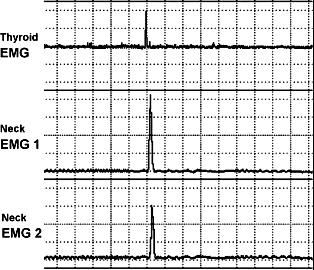
图2-4 食管平滑肌肌电图反映的胎羊吞咽活动
图中上、中、下三条曲线分别代表胎羊颈部由上至下(甲状腺部位、颈部食道平滑肌的上和下)埋设的三对电极记录到的食道平滑肌的EMG,EMG电活动的出现从上至下有时间上的先后关系。
实验中收集的母亲和胎儿的血浆采用放射免疫测定方法测定精氨酸加压素(arginine vesoprssin,AVP)和催产素(oxytocin,OT)的浓度。血浆AVP和OT采用Sep-pak C 18 层析柱提取(Waters Associates,Milford,MA)测定。主要步骤如下:血浆样品用1NHCl酸化,慢慢加入层析柱;用0.1%三氟乙酸(trifluoroacetic acid,TFA))淋洗,去除部分杂质;用洗脱剂(含50% 甲醇和0.1% TFA)将吸附在层析柱上的生物活性肽洗脱下来,收集在塑料指形管中;将洗脱液吹干,低温保存待测。测定时加入一定量的缓冲液溶解,所有样本同时测定。
实验结束后,麻醉动物,方法如前所述。母羊腹部正中切口,切开子宫,暴露胎儿头颈部,做一侧颈动脉插管(16gauge),0.01M磷酸盐缓冲液(PBS)和4%多聚甲醛(paraformaldehyde,PFA)灌流5~7min。取出胎脑,用PFA固定12h后,置于20%蔗糖过夜。低温下从前脑到后脑进行冠状切片,厚度20μm。采用亲和素-生物素-过氧化物酶复合物技术(avidin-biotin-peroxidase complex technique,简称ABC法)进行FOS蛋白免疫活性(FOS-immunoreactivity,FOS-ir)检测。脑片先在4℃于第一抗体(1∶15000,Santa Cruz Biotechnology,Santa Cruz,CA)中孵育过夜,轻摇。FOS蛋白的第一抗体为多克隆抗体,来自兔(或小鼠),其作用为抗FOS蛋白的N端序列。继而在第二抗体羊抗兔(或抗鼠)血清(1:400)中孵育1h,之后用Vectastain ABC kit室温下作用1h(Vector Labs,Burlingame,CA),加入1mg/ml盐酸-3,3'-二氨基联苯胺(3,3'-diaminobenzidine tetrahydrochloride,Sigma)(0.02%H 2 O 2 )。所有脑片铺于载玻片上,用乙醇脱水,加盖玻片并胶水固定。FOS-ir阳性细胞采用盲法于显微镜下计数。
为检测下丘脑视上核(supraoptic nuclei,SON)和室旁核(paraventricular nuclei,PVN)的AVP和OT神经元的FOS免疫活性,有时还需进行FOS-ir和AVP-ir(或OT-ir)的双重免疫染色。基本方法有两种,第一种为FOS蛋白免疫采用普通方法(DAB显色),在进行上述FOS蛋白免疫染色后,将此脑片用AVP或OT抗体(1:5000,Diasorin,USA)孵育过夜,然后给予结合有异硫氰酸荧光素(fluorescein-isothiocyanate)的抗兔抗体(1:200,Vector Laboratories,USA)。另一种方法为,FOS-ir的检测也采用荧光抗体,AVP-ir或OT-ir检测同上,亦采用荧光抗体。最后脑片铺于载玻片上,乙醇脱水,加盖玻片并胶水固定。使用荧光抗体的脑组织切片需在荧光显微镜下观察。
除此之外,部分实验还可进行了FOS-ir和AT1R-ir双重免疫染色,AT 1 R-ir和OT-ir双重免疫染色,AT 1 R抗体1:100(Santa Cruz,CA,USA)。
检测胎脑内的某基因表达水平。以ACE基因在胎羊脑内的mRNA表达谱为例,首先组织研磨后酚氯仿-乙醇沉淀法提取总RNA,用Eppendorf紫外分光光度计测量OD 260 与OD 280 。以OD 260 /D 280 的比值确定RNA的完整性与纯度,以OD 260 值确定RNA的浓度(μg/μl)。用Invitrogen公司试剂盒(SUPERSCRIPTTM First-Strand Synthesis System,Invitrogen,CA)进行逆转录和PCR过程。用Primer3软件设计引物,引物设计时跨越至少两个内含子以保证PCR产物中没有基因组DNA的污染。PCR反应设计两个对照:一是阴性对照(无模板);二是用DNAase处理RNA以确定有无基因组DNA污染的对照组。引物序列如下:
上游引物:5’CTGCAGTACAAGGACCAGCA 3’
下游引物:5’CGTCAAAGTGGGTTTCGTTT 3’(扩增产物349bp)
ACE基因的PCR反应条件:预变性,94℃×5min;变性94℃×1min,复性60℃×1min,延伸72℃×1min,循环数35;延伸,72℃×7min。内参18S的PCR反应的循环数为28,其余同上。1.5%琼脂糖凝胶电泳记录结果,用IS-1000 数字成像系统(version 2.00,Alpha Innotech,CA)扫描定量。