




半导体被大于其禁带宽度的光能激发后产生电子和空穴,如式(1-7)所示,随后电子和空穴迁移至颗粒表面,空穴与电子分别与吸附在粒子表面的水分子[如式(1-4)]、溶解氧[如式(1-5)]以及其他物质发生反应,如式(1-8)、(1-9)、(1-12)、(1-14)和(1-15)所示的反应等,传递出自身的能量,最终形成具有高活性和强氧化性的羟基自由基·OH和超氧自由基·
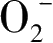 等强氧化基团,进而形成一系列的活性物质
[5]
,光生电子和空穴也有可能在迁移的过程中或者在光催化剂的表面发生复合,释放出本身的能量,如式(1-17)所示。主要的反应过程有
等强氧化基团,进而形成一系列的活性物质
[5]
,光生电子和空穴也有可能在迁移的过程中或者在光催化剂的表面发生复合,释放出本身的能量,如式(1-17)所示。主要的反应过程有

其中·OH具有很强的氧化性,通过实验和理论的方法均可以确定光催化过程中·OH的存在。电子顺磁共振(EPR)和荧光光谱法(PL)是检测·OH自由基的常用手段 [6-7] 。如图1-4所示是TiO 2 在紫外光照射下DMPO(5,5-二甲基-1-吡咯啉-N-氧化物)捕获的EPR信号,在光照下样品出现DMPO-·OH加合物的EPR特征信号,即1∶2∶2∶1的四重峰,且信号的强度随着光照时间的延长不断增强,从而证明·OH的浓度在光照下不断增加。化学法检测·OH主要是利用有机物本身无荧光性能,但和·OH加合后具有较强的荧光性能这一特性,常用的有机物为香豆素和对苯二甲酸 [9] ,式(1-18)、(1-19)所示为香豆素和对苯二甲酸的分子结构式以及与羟基自由基加合后的产物,所得的加合产物具有较强的光致发光特性,光致发光的强度与羟基自由基的浓度呈线性关系,可以定性地检测羟基自由基的浓度变化。普遍认为·OH自由基的形成机理是空穴氧化机制,也就是说空穴与催化剂表面的羟基[式(1-9)]或水分子反应而得,然而最近也有研究证明,空穴不能直接氧化水分子得到·OH自由基,而可能是空穴通过亲核攻击氧化晶格氧得到·OH自由基 [10] 。·OH自由基具有能氧化大部分的有机污染物及部分无机污染物的能力,并可将污染物最终降解为CO 2 、H 2 O等无害物质。由于·OH对反应物几乎没有选择性,因而在光催化氧化中起着关键性的作用。表1-3给出了各个氧化物质的氧化能力对比和氧化电势电位,从表中可以看出·OH的氧化电位为2.80V,比作为消毒杀菌剂被广泛使用的次氯酸、过氧化氢和臭氧等具有更强的氧化能力。
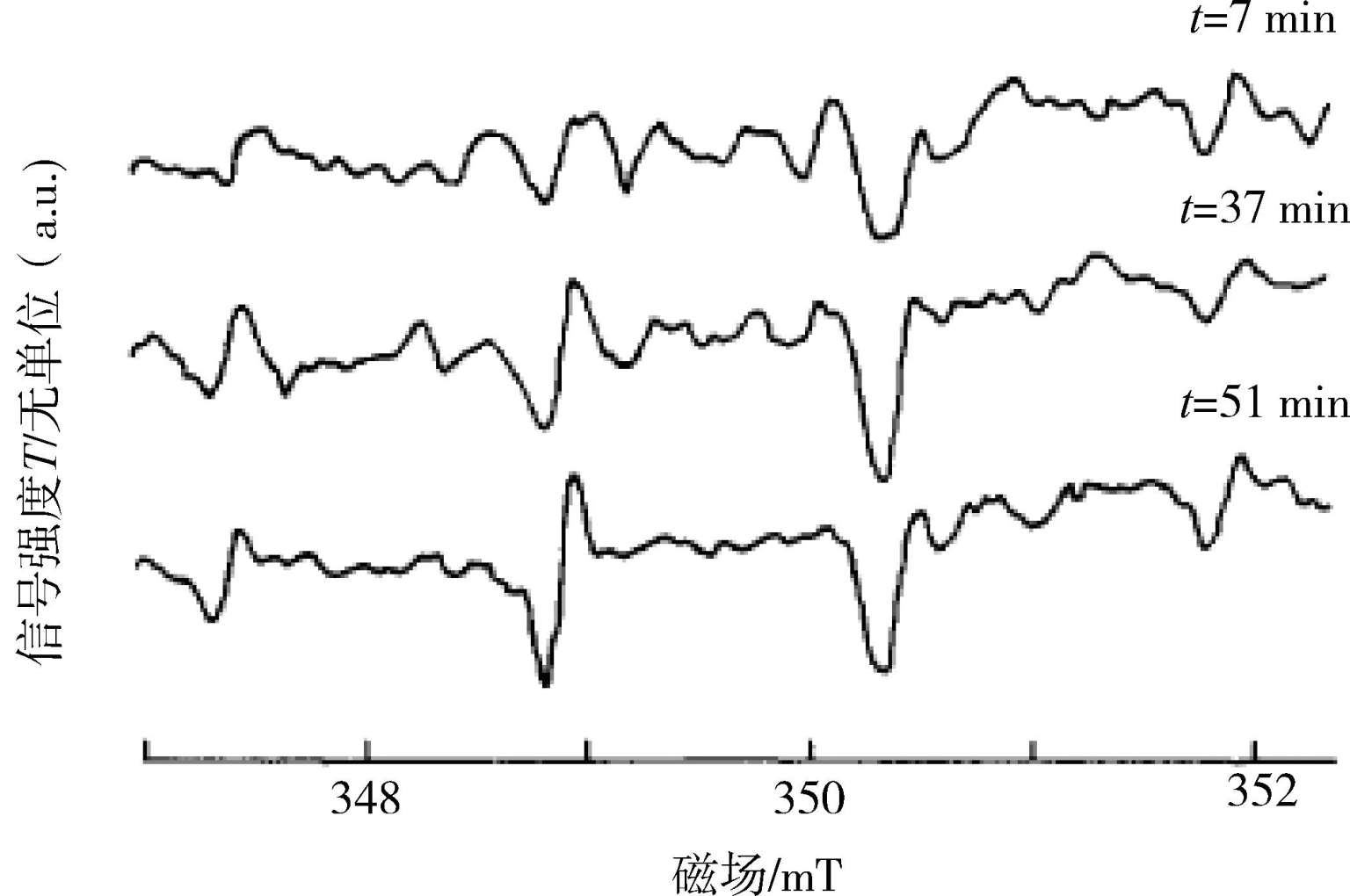
图1-4 PHOTOPERM CPP/313标准薄膜在UV照射过程中DMPO-·OH自旋加合物的EPR信号,TiO 2 的量为30±3wt.%,DMPO溶液的浓度为50mol/L。EPR测试仪的测试条件为中心场=349.5mT,扫描步长=10.0mT,扫描时间大约60s [8]
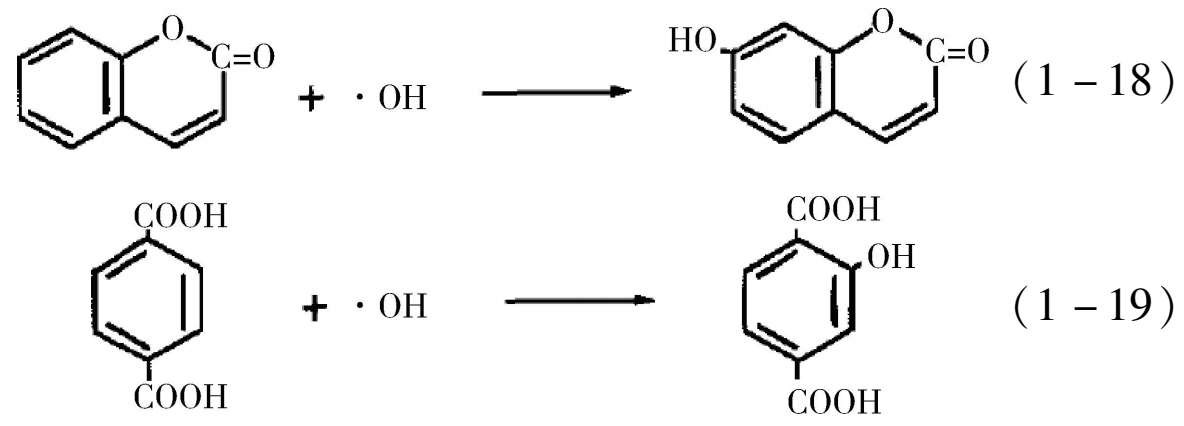
表1-3 各种氧化剂的氧化电位
其次空穴也是最为主要的强氧化物质之一,其迁移速度为价带顶空带所对应的电子移动速度,氧化电位与半导体的价带位置密切相关。光生的空穴可在ns内被捕获,在TiO
2
表面,空穴有深和浅两种捕获位存在,其中浅捕获位的空穴容易热激发回价带,与自由空穴建立转化平衡,浅捕获空穴和自由空穴具有较强的迁移性和反应活性,而深捕获空穴的氧化性较弱。浅捕获的空穴可以将表面的污染物直接氧化,也可以与其他物质,比如HO
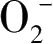 等,进一步形成其他自由基基团。空穴无特定选择性,可氧化大多数有机污染物。
等,进一步形成其他自由基基团。空穴无特定选择性,可氧化大多数有机污染物。
另外,研究表明超氧自由基·
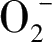 也是光催化过程中的非常重要的一类氧化物质
[11]
。通常认为,由溶解氧和光生电子相互作用产生,还可以继续与水溶液中的水分子[如(式1-11)],氢离子[如(式1-6)])和H
2
O
2
[如(式1-16)]等形成强氧化基团。·
也是光催化过程中的非常重要的一类氧化物质
[11]
。通常认为,由溶解氧和光生电子相互作用产生,还可以继续与水溶液中的水分子[如(式1-11)],氢离子[如(式1-6)])和H
2
O
2
[如(式1-16)]等形成强氧化基团。·
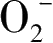 自由基在水溶液中的多少取决于溶解氧的量,其氧化电位为1.70V,如表1-3所示,其氧化能力次于过氧化氢。此外在氧化物半导体中,也可在半导体表面形成晶格氧自由基
[12]
。超氧自由基可以通过DMPO进行捕获并在顺磁共振上检测,由于超氧自由基在水溶液体系中不稳定
[13]
,会发生如式(1-11)所示的歧化反应,转化为
自由基在水溶液中的多少取决于溶解氧的量,其氧化电位为1.70V,如表1-3所示,其氧化能力次于过氧化氢。此外在氧化物半导体中,也可在半导体表面形成晶格氧自由基
[12]
。超氧自由基可以通过DMPO进行捕获并在顺磁共振上检测,由于超氧自由基在水溶液体系中不稳定
[13]
,会发生如式(1-11)所示的歧化反应,转化为
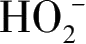 和氧气,因此需要在有机溶剂,如甲醇中进行捕获和检测。图1-5显示了TiO
2
溶液中紫外光照下DMPO捕获的ESR信号,如图中所示,在无光照的情况下120s后仍没有任何信号,而在紫外光照射下,TiO
2
和N掺杂的TiO
2
均出现DMPO-·OOH/·
和氧气,因此需要在有机溶剂,如甲醇中进行捕获和检测。图1-5显示了TiO
2
溶液中紫外光照下DMPO捕获的ESR信号,如图中所示,在无光照的情况下120s后仍没有任何信号,而在紫外光照射下,TiO
2
和N掺杂的TiO
2
均出现DMPO-·OOH/·
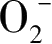 加合物的ESR的特征信号峰,即一个连续的六重特征峰
[14]
,以此来证明·
加合物的ESR的特征信号峰,即一个连续的六重特征峰
[14]
,以此来证明·
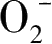 的存在。在光催化过程中,·
的存在。在光催化过程中,·
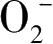 是仅次于·OH自由基和空穴的活性氧化物种,可攻击中性底物和表面吸附的自由基和自由基离子,尤其是表面吸附的有机物过氧自由基。·
是仅次于·OH自由基和空穴的活性氧化物种,可攻击中性底物和表面吸附的自由基和自由基离子,尤其是表面吸附的有机物过氧自由基。·
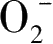 可直接与有机物过氧自由基反应将有机污染物彻底矿化降解或发生歧化反应生成具有更高氧化能力的物质H
2
O
2
,或者捕获空穴生成单线态氧
1
O
2
[15-16]
。单线态氧
1
O
2
在大气、生物和医学领域作为活性氧物质被广泛研究,而在光催化领域,由Nosaka等人首次通过近红外磷光的方法发现
[17]
。对四种有机物的研究表明,在TiO
2
体系的水溶液中,有机物分子吸附在光催化剂表面,在脉冲照射下可以快速生成单线态氧
1
O
2
,这说明,单线态氧
1
O
2
的存在有利于有机物的光催化降解
[16]
。
可直接与有机物过氧自由基反应将有机污染物彻底矿化降解或发生歧化反应生成具有更高氧化能力的物质H
2
O
2
,或者捕获空穴生成单线态氧
1
O
2
[15-16]
。单线态氧
1
O
2
在大气、生物和医学领域作为活性氧物质被广泛研究,而在光催化领域,由Nosaka等人首次通过近红外磷光的方法发现
[17]
。对四种有机物的研究表明,在TiO
2
体系的水溶液中,有机物分子吸附在光催化剂表面,在脉冲照射下可以快速生成单线态氧
1
O
2
,这说明,单线态氧
1
O
2
的存在有利于有机物的光催化降解
[16]
。
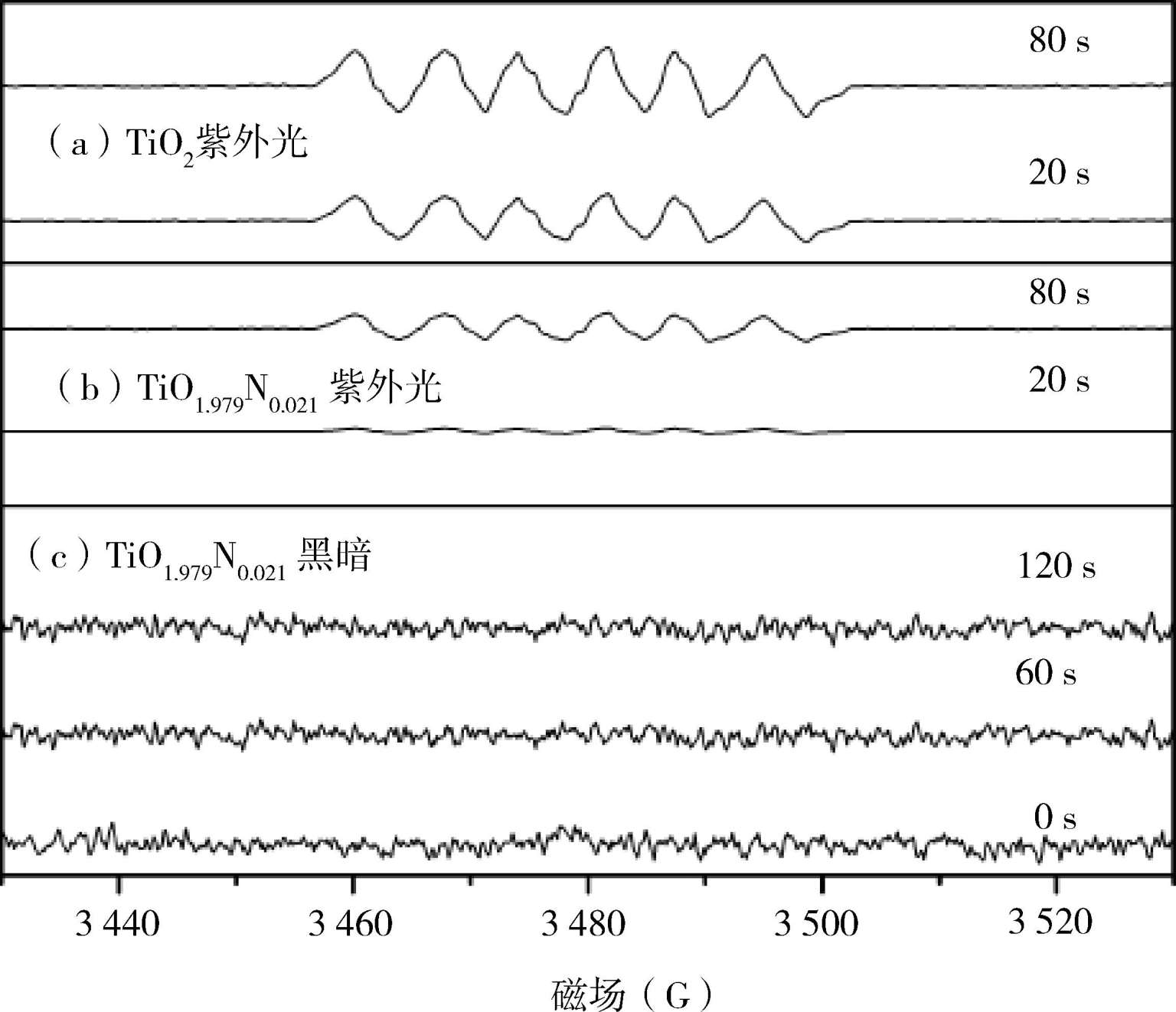
图1-5在含有4-CP/TiO 1 .979 N 0 .021 的乙醇溶液中UV照射下DMPO自旋捕获的ESR信号:催化剂用量为0. 5g L- 1 ;4-CP浓度为10mg L- 1 ;DMPO浓度为1.6 × 10 -2 mol/L [14]
H 2 O 2 俗称双氧水,是一种强氧化剂,也是光催化过程中的中间产物,Oya等人专门研究了H 2 O 2 的作用机制 [18] 。其氧化电位为1.77V,并可通过式(1-15)和(1-16)生成更强的氧化基团羟基自由基。
目前已经确定的氧化性基团有未捕获或者已经被捕获的空穴、·OH、·
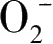 、H
2
O
2
、单线态
1
O
2
、O
2
和受到攻击后的有机物自由基中间产物等。
、H
2
O
2
、单线态
1
O
2
、O
2
和受到攻击后的有机物自由基中间产物等。
此外需要注意的是,在降解不同的有机物时,由于有机物自身性质以及降解条件的差异,使得光催化反应中起主要作用的活性物种会有不同。研究工作者在研究过程中为了更好地了解其机理,可在实验中额外加入活性物种的捕获剂,使特定活性基团更有效地参与目标反应,加快反应速度或者达到研究反应中活性物种的作用
[19,20]
。常用的捕获剂有空穴捕获剂、羟基自由基捕获剂或者电子捕获剂,而常用的空穴或者羟基自由基捕获剂有EDTA、甲醇、异丙醇、KI、
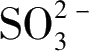 等,常用的电子捕获剂有C(NO
3
)
4
、SF
6
、Ag
+
、H
2
O
2
、O
3
等。
等,常用的电子捕获剂有C(NO
3
)
4
、SF
6
、Ag
+
、H
2
O
2
、O
3
等。