




约翰·道尔顿(John Dalton,1766—1844)
将原子学说
 引入主流科学,是19世纪早期英国科学家道尔顿的卓越贡献。几乎完全靠自学成才的他,在这项工作中提供了关键性的思想,使得自他那个时代以来化学领域的巨大进步成为可能。
引入主流科学,是19世纪早期英国科学家道尔顿的卓越贡献。几乎完全靠自学成才的他,在这项工作中提供了关键性的思想,使得自他那个时代以来化学领域的巨大进步成为可能。
与许多系统地提出伟大科学构思的人物一样,道尔顿并不是提出所有物质都是基于原子微粒的第一人。早期的原子理论中,没有一个是用定量方法表达思考的,它们多数只是出于哲学的考量,并没有被用在实际的科学研究中。最重要的一点是,没有人能看出有关原子的哲学推断与实实在在的化学表现之间有什么联系。正是道尔顿引入的思想体系,给出了一种清晰的、采用定量分析的方式。这一理论能够用来解释化学实验中的各种过程和表象,并能予以精确的检验。
虽然道尔顿当时所使用的图标、术语等与我们今天所看到的略有不同,但他清晰地给出了原子、分子、元素和化合物等概念的表达。他认为,虽然自然世界原子的总量巨大,但其种类却非常之少——其最初著作的列表中只排出了20余种元素、原子,而今天我们已知的元素种类却已过百。
道尔顿坚持认为相同种类的任何两个原子的特性是完全相同的,质量也相同。不过现代复杂的实验指出,这一规律也存在例外(如同位素)——它们在质量上略有差异,但化学特性几乎完全相同。道尔顿在他的著作中给出了一张表格,上面列出了不同种类原子的相对质量。这张史无前例的表格呈现了定量原子理论的关键特征。早在1804年,道尔顿就已完成了这种定量理论,不过他治学严谨,其著作《化学哲学的新体系》从1808年起才陆续出版,成为近代化学史上的经典学术专著。
道尔顿阐明了任何相同化合物的两个分子都是由相同原子组成的。例如,一个水分子(H 2 O)由两个氢原子和一个氧原子构成。当两种元素所组成的化合物有两种以上时,在这些化合物中,如果一种元素的量一定,那么与它化合的另一种元素的量总是与之成倍数地变化——这就是“倍比定律”。道尔顿令人信服地提出他的量化思想,后来的几十年,大多数科学家都采纳了这一理论。化学家遵循他书中建议的步骤:精确测定原子的相对质量;通过质量来分析化合物;测定每一类分子包含的精确原子组合。
顺便提及,道尔顿21岁时开始对气象学产生兴趣,6年后他出版了有关这一内容的著作——对空气和大气层的研究激发起他对气体一般特性的兴趣。通过一系列的实验,他提出了道尔顿定律 [1] 。道尔顿一直受着色盲的折磨,这曾使他对色盲机制产生了好奇——他研究了这一专题,并最终发表了有史以来这方面的第一篇论文。
多数具有伟大贡献的科学家,不止有一种成果呈现。如果将道尔顿引入化学的定量原子理论比作光彩照人的花朵,那他发现的支配气体行为的定律、分压定律、倍比定律,以及有史以来关于色盲的第一篇论文,则可比作相关领域的勃发绿叶。
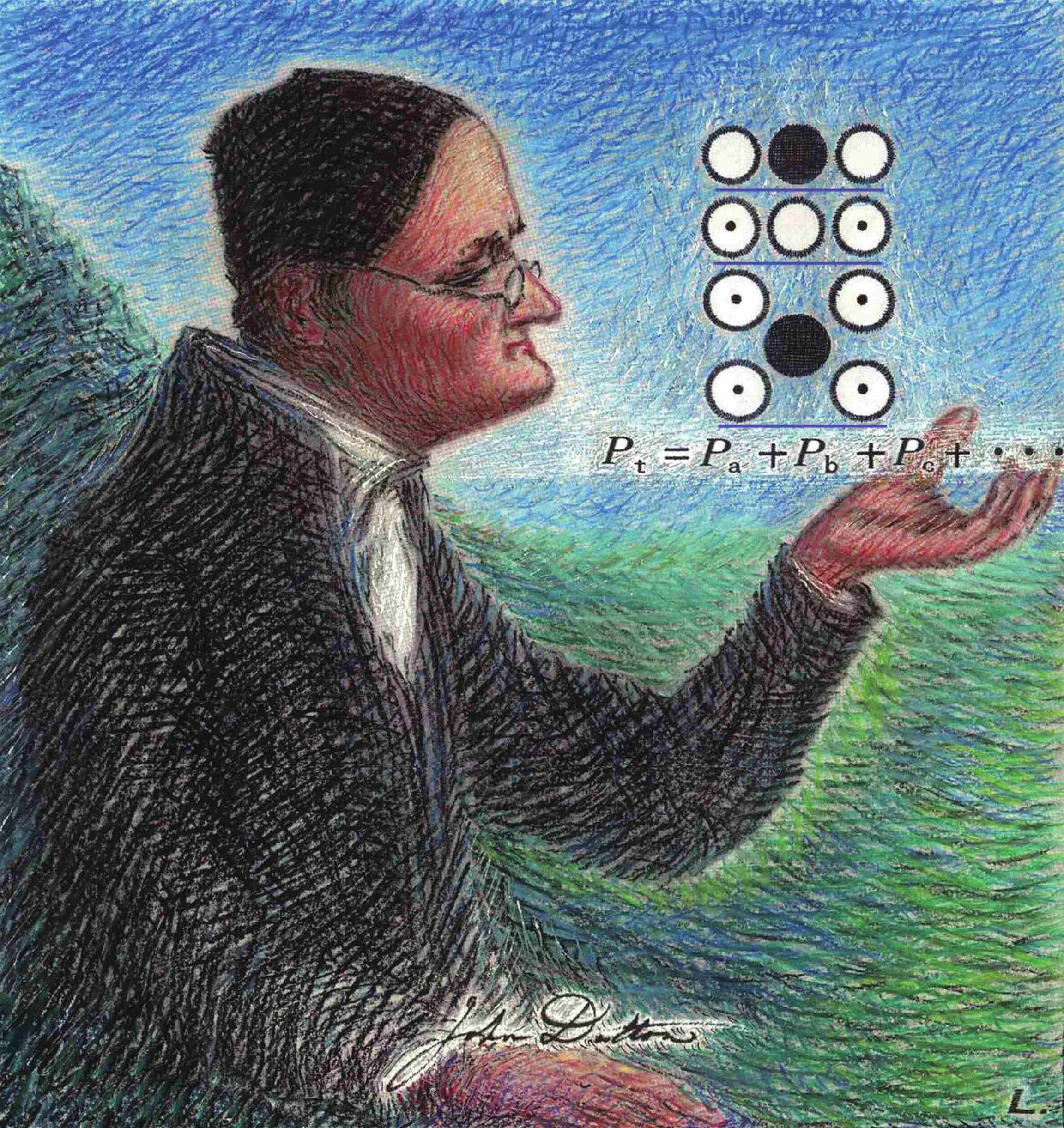
在题图的创作中,道尔顿的科学肖像描绘的是他“玩转”原子科学元素的思想与气体分压定律的图景。其中,右上角的☉代表氢,〇代表氧,●代表碳,皆为道尔顿自己发明的符号,从上至下分别表示二氧化碳、水和甲烷。他在草绿天蓝的大自然怀抱中,将原子学说引入了化学领域,使其升华为真正意义上的科学思想理论……
[1] 即理想气体混合物的总压强等于各组元气体分压强之和(如题图的道尔顿手掌上的方程: P t = P a + P b + P c +…),它也被称作道尔顿分压定律。