




由于高聚物结构复杂、
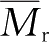 巨大,其溶解过程有以下特点:溶解之前都会发生溶胀,线型高分子溶胀后可以进一步溶解,网状高分子则只能达到溶胀平衡。
巨大,其溶解过程有以下特点:溶解之前都会发生溶胀,线型高分子溶胀后可以进一步溶解,网状高分子则只能达到溶胀平衡。
溶胀是指溶剂分子扩散进入高分子内部使其体积膨胀的现象。它是高分子化合物特有的现象,其原因在于溶剂分子与高分子尺寸相差悬殊,分子运动速度相差很大,溶剂小分子扩散速度较快,溶剂分子进入高分子内部以后,借助其与分子链间的作用力(溶剂化作用)而使分子链段逐渐舒展,彼此间的距离逐渐增加,宏观上表现为高分子体积逐渐溶胀。当溶胀过程进行到高分子所有的链段都能够扩散运动的时候,溶胀的聚合物逐渐分散成真溶液(图2-14)。只有在良溶剂中高分子最终才能舒展开,否则,分子链呈蜷曲状,链段之间的空隙小。高分子的溶解性能与高分子所处的状态有关。
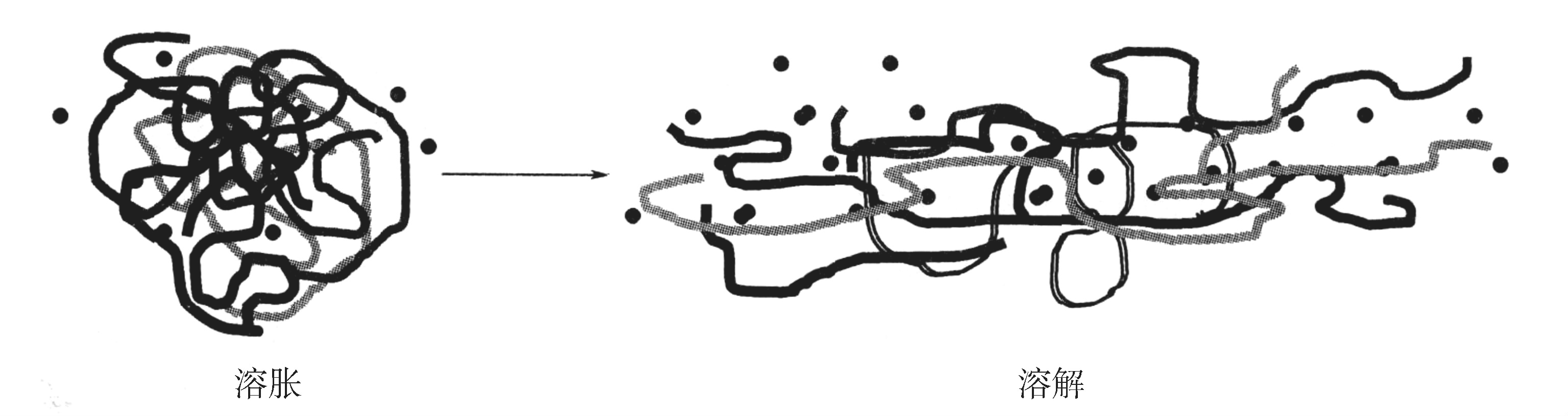
图2-14 高分子材料的溶胀和溶解
(注:·代表溶剂分子)
1.结晶聚合物的溶解 对于晶态的高分子,由于分子间排列规整,堆砌紧密,分子间相互作用力较强,溶剂分子较难渗入晶相,因此晶态聚合物的溶解要比非晶态聚合物困难。结晶聚合物可分为以下两类。
(1)极性结晶聚合物 在适宜的强极性溶剂中,往往此类聚合物在室温下即可溶解。如聚酰胺可溶于甲酸、冰醋酸、浓硫酸、苯酚等强极性溶剂,原因在于极性结晶聚合物的非晶相部分与强极性溶剂产生溶剂化作用,发生放热效应,破坏晶格,使之溶解。
(2)非极性结晶聚合物 此类化合物溶解往往需要将体系加热到熔点附近,例如高密度聚乙烯(PE,熔点为135℃)溶解在四氢萘中,温度为120℃左右;间同立构聚丙烯(PP,熔点为134℃),溶解在十氢萘中,温度为130℃。
2.非晶态聚合物溶解 由于分子间堆砌比较松散,分子间相互作用力较弱,溶剂分子比较容易渗入聚合物内部使之发生溶胀或溶解(相对于结晶态聚合物而言)。交联聚合物由于三维交联网的存在而不会发生溶解。其溶胀程度部分取决于聚合物的交联度,交联度增大,溶胀度降低。
药物制剂制备过程中,经常需要配制高分子溶液。高分子化合物从溶胀到溶解,一般需要较长的时间,可采用适当工艺使其分散,避免黏结成团,还可通过加热和搅拌等方法加快溶解。但不同高分子化合物溶胀所需的条件不同,配制成溶液的方法也不一样。市售药用高分子材料大多呈粒状、粉末状,与溶剂接触时易于聚结成团,应注意材料的分散,使之充分溶胀。水溶性的药用高分子大多易溶于热水,可先用冷水润湿,使颗粒高度分散,然后加热使之溶解。对于像羟丙甲纤维素等在冷水中更易溶解的聚合物,可先用热水润湿和分散,然后用冷水使其溶解。
高分子的溶解过程是溶质分子和溶剂分子相互混合的过程,恒温恒压条件下,该过程能自发进行的必要条件是吉布斯自由能变化( ΔG m )小于零,计算式如(2-15)所示。

式(2-15)中, ΔS m 为混合熵, ΔH m 为混合热, T 为溶解时的热力学温度。
因为溶解过程是分子排列趋于混乱的过程,即 ΔS m >0,因此 ΔG m 的正负取决于 ΔH m 的正负和大小。
极性高分子在极性溶剂中溶解时,由于高分子与溶剂分子的强烈作用而放热,即 ΔH m <0,则 ΔG m <0,高分子可以溶解。
非极性高分子溶解过程一般是吸热的,即
ΔH
m
>0,所以要使非极性高分子溶解,即
ΔG
m
<0,必须满足
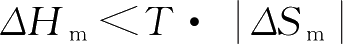 ,也就是说升高温度
T
或减小
ΔH
m
才有可能使体系自发进行。根据Hildebrand溶度公式:
,也就是说升高温度
T
或减小
ΔH
m
才有可能使体系自发进行。根据Hildebrand溶度公式:

式(2-16)中, V 1,2 为溶液的总体积(mL), δ 为溶度参数(J/cm 3 ) 1/2 , φ 为体积分数;下标1和2分别表示溶剂和溶质。此式只适用于非极性的溶质和溶剂的相互混合。
由式(2-16)可知道,混合热 ΔH m 是由于溶质和溶剂的溶度参数不等而引起的, ΔH m 总是正值,如果溶质和溶剂的溶度参数越接近,则 ΔH m 越小,也更能满足自发进行的条件,一般 δ 1 和 δ 2 的差值不宜超过1.5。
溶度参数数值等于内聚能密度的平方根,内聚能密度就是单位体积的内聚能。公式如(2-17)所示。
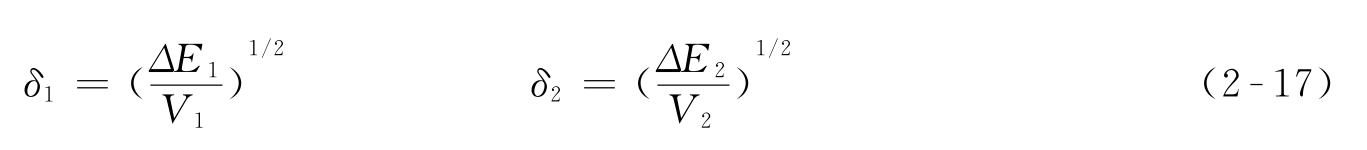
式(2-17)中, ΔE 为内聚能(J); V 为体积(cm 3 )。
内聚能是克服分子间作用力,把1摩尔凝聚体气化所需要的能量。溶剂的溶度参数通过Clapeyron和热力学第一定律算出溶剂的摩尔气化能 ΔE ,然后由式(2-18)求得。

式(2-18)中, ΔH vap 为气化热, RT 为转化为气体的膨胀功。
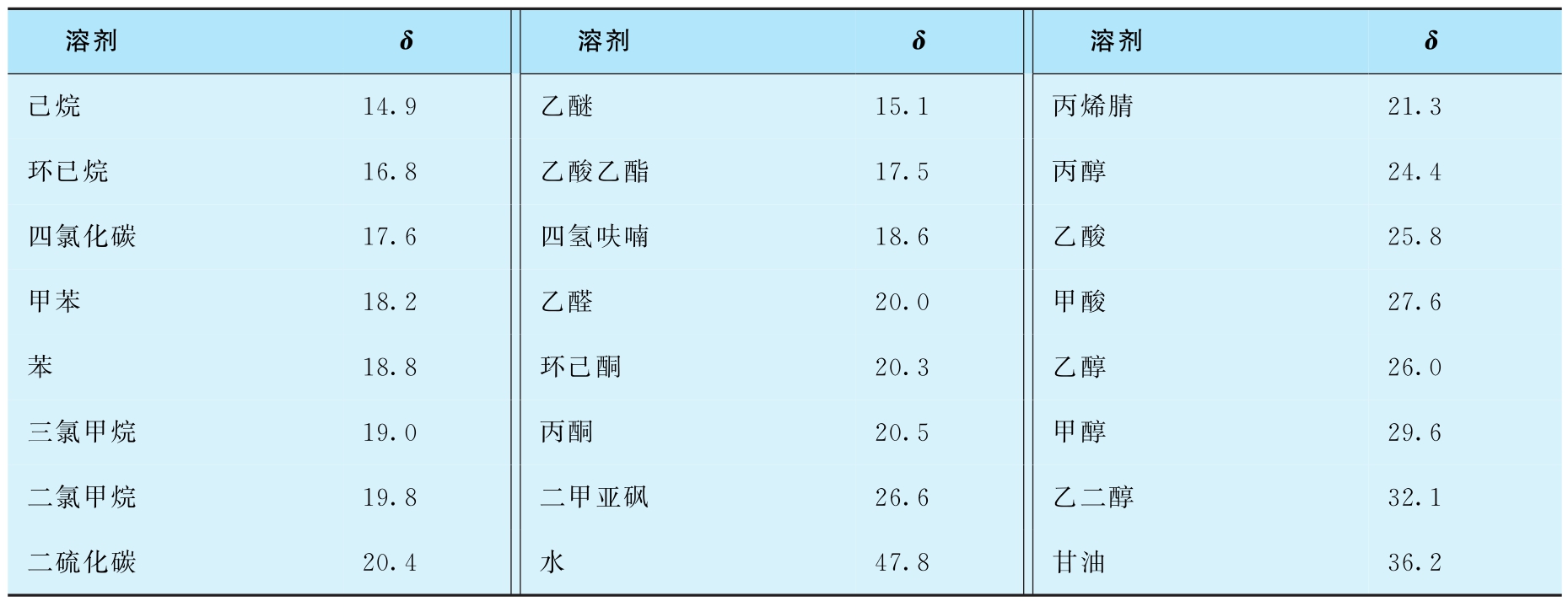
聚合物的溶度参数可用黏度法或溶胀度法测定,黏度法是将聚合物溶解在各种溶度参数与聚合物相近的溶剂中,分别在同一浓度、同一温度下测定这些聚合物溶液的特性黏度,因聚合物在良溶剂中舒展最好时,其特性黏度最大,故把特性黏度最大时所用的溶剂的 δ 值看作该聚合物的溶度参数。溶胀度法是在一定温度下,将交联度相同的高分子分别放在一系列溶度参数不同的溶剂中使其溶胀,测定平衡溶胀度。聚合物在溶剂中溶胀度不同,只有当溶剂的溶度参数与聚合物溶度参数相等时,溶胀最好,溶胀度最大。因此,可把溶胀度最大的溶剂所对应的溶度参数作为该聚合物的溶度参数。表2-2和2-3分别是一些高分子和溶剂的溶度参数。
表2-2 一些高分子的溶度参数(J/cm 3 ) 1/2
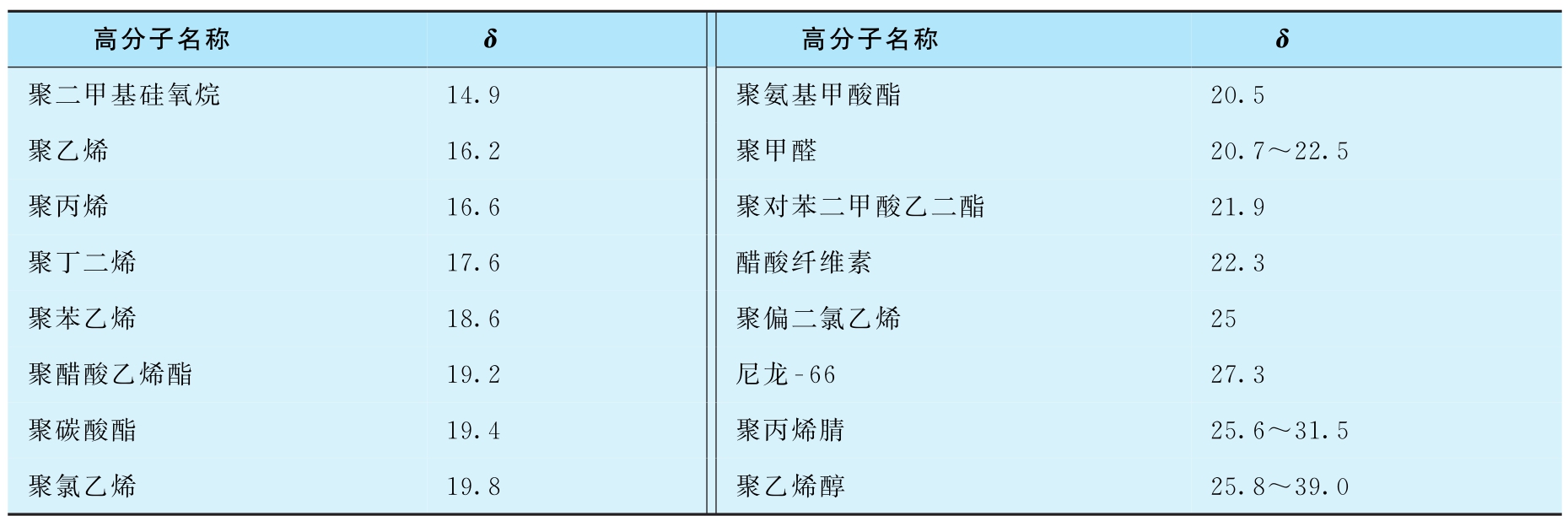
表2-3 溶剂的溶度参数(J/cm 3 ) 1/2
配制高分子溶液首先遇到的问题是如何选择溶剂。相似相溶原则、溶度参数相近原则和溶剂化(氢键)原则是选择高分子溶剂的三个基本原则。
1.极性相似相溶原则 极性高分子化合物可溶于极性溶剂中,非极性高分子则可能溶于非极性溶剂中,两者的极性大小越接近,相溶的可能性越大。例如,强极性的聚丙烯腈能够溶解于二甲基甲酰胺等强极性溶剂中;非极性的天然橡胶和丁苯橡胶都能很好地溶解于汽油、苯和甲苯等非极性溶剂。
2.溶度参数相近原则 由式(2-16)可知, δ 1 和 δ 2 的差越小, ΔH m 越小,越有利于溶解,这就是溶度参数相近原则。天然橡胶[ δ =17.0(J/cm 3 ) 1/2 ]可溶于甲苯[ δ =18.2(J/cm 3 ) 1/2 ]和四氯甲烷[ δ =17.6(J/cm 3 ) 1/2 ]中,但不溶于乙醇[ δ =26.0(J/cm 3 ) 1/2 ];醋酸纤维素[ δ =22.3(J/cm 3 ) 1/2 ]可溶于丙酮[ δ =20.5(J/cm 3 ) 1/2 ]而不溶于甲醇[ δ =29.6(J/cm 3 ) 1/2 ]。此规律适用于非极性或弱极性非晶态聚合物。通常,聚合物与溶剂两者的溶度参数相差值在1.5以内时常常可以溶解。有时在单一溶剂中不能溶解的聚合物可在混合溶剂中发生溶解,混合溶剂的溶度参数 δ 可由下式计算。

式(2-19)中, φ 1 和 φ 2 分别为两种纯溶剂的体积分数; δ 1 和 δ 2 分别为两种纯溶剂的溶度参数。
3.溶剂化原则 若溶剂与高分子之间有强偶极作用或有生成氢键的情况时,应该按照溶剂化原则判断其溶解性。例如聚氯乙烯的[ δ =19.8(J/cm 3 ) 1/2 ]与三氯甲烷[ δ =19.0(J/cm 3 ) 1/2 ]及环己酮[ δ =20.3(J/cm 3 ) 1/2 ]均相近,但聚氯乙烯可溶于环己酮而不溶于三氯甲烷,究其原因,是因为聚氯乙烯是亲电子体,环己酮是亲核体,两者之间能够产生类似氢键的作用。而三氯甲烷与聚氯乙烯都是亲电子体,不能形成氢键,所以不相溶。高分子按官能团可分为弱亲电子性高分子、给电子性高分子、强亲电子性高分子及氢键高分子(表2-4),同样溶剂按其极性不同也可分成弱亲电子性溶剂、给电子性溶剂、强亲电子性溶剂或强氢键溶剂三类(表2-5)。亲电子性溶剂能和给电子性高分子进行“溶剂化”而易于溶解;同理,给电子溶剂能和亲电子性高分子“溶剂化”而利于溶解。
表2-4 一些高分子的极性分类

表2-5 一些溶剂的极性分类

实际上溶剂的选择相当复杂,按以上原则从理论上进行筛选后,符合三个原则的那些溶剂并不一定就能溶解该高分子化合物,因为,除以上原则外,还涉及溶剂对于聚合物的化学惰性,所以,最终能否作溶剂仍需通过实验来确定。即使能溶解,也还需考虑其安全性(低毒、不易挥发、不易燃烧等)和经济成本(资源充足、易于回收等)。
1.凝胶的基本特征 凝胶(gel)是指溶胀的三维网状结构高分子,即聚合物分子间相互连接,形成空间网状结构,而在高分子链段间隙中又填充了液体介质(在干凝胶中介质可以是气体),这样一种分散体系称为凝胶。
凝胶是介于固体和液体之间的一种特殊状态,它既显示出某些固体的特征,如无流动性,有一定的几何外形,有弹性、强度等。但另一方面它又保留某些液体的特点,例如离子的扩散速率在以水为介质的凝胶(水凝胶)中与水溶液中相差不多。
2.凝胶的分类 根据高分子交联键性质的不同,把凝胶分为两类,即化学凝胶和物理凝胶。大分子通过共价键连接形成网状结构的凝胶叫化学凝胶,一般在合成高分子时加入交联剂进行聚合,或者通过线型或支化型高分子链中官能团相互反应形成这种共价键。以化学键交联的凝胶不能熔融更不会溶解,结构非常稳定,称为刚性凝胶,大多数合成凝胶属这一类型。大分子间通过非共价键(通常为氢键或范德华力)相互连接形成的凝胶叫物理凝胶,因这类凝胶具有弹性,又叫弹性凝胶。大多数天然凝胶是依靠高分子链段相互间可形成氢键而交联的,如多糖类、蛋白质凝胶等,这种氢键会因加热、搅拌等而被破坏,使凝胶变成溶胶,冷却或停止搅拌后溶胶又可变回凝胶,所以说,物理凝胶是可逆的。
另外,根据凝胶中液体介质含量的多少又分为冻胶(jelly)和干凝胶(xerogel)两类。冻胶指液体含量很多的凝胶,含液量常在90%以上,冻胶多数由柔性大分子构成,具有一定的柔顺性,网状结构中的溶剂不能自由流动,呈弹性半固体状态,平常所说的凝胶实际指的就是冻胶。液体含量少的凝胶称为干凝胶,其主要成分是固体。干凝胶很容易转化为冻胶,干凝胶在吸收极性相似的液体溶胀后即可转变为冻胶,如明胶能吸收水而不能吸收苯,橡胶能吸收苯而不能吸收水。
3.凝胶的制备 制备凝胶主要是高分子溶液胶凝,即取一定量的高分子物质置于适当的溶剂中溶解、静置、冷却,使其自动胶凝,生成凝胶。
4.胶凝作用及其影响因素
高分子溶液在适当条件下转变为凝胶的过程称为胶凝作用(gelation)。如明胶水溶液、琼脂水溶液,在温热条件下为黏稠性流动液体,当温度降低时,高分子溶液即形成立体网状结构,分散介质(多数是水)被包含在网状结构中,形成了不流动的半固体状物。影响胶凝作用的因素主要有浓度、温度和电解质。每种高分子溶液都有一个形成凝胶的最低浓度,低于此浓度则不能形成凝胶,高于此浓度可加速胶凝。利用升、降温来实现胶凝过程是常用的一种方法,如明胶水溶液。也有的高分子溶液在升温时分散相发生交联而形成凝胶,低温变成溶液,如泊洛沙姆的胶凝就属于这种情况。与前两种因素相比,电解质对胶凝的影响比较复杂,有促凝作用,也有阻凝作用,其中阴离子起主导作用,规律显示,当盐的浓度较大时,Cl
-
和
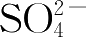 一般会加速胶凝,而I
-
和SCN
-
的作用相反,起阻滞胶凝作用。
一般会加速胶凝,而I
-
和SCN
-
的作用相反,起阻滞胶凝作用。
(1)溶胀性 凝胶最显著的特征是溶胀。凝胶吸收液体或蒸气使体积或重量明显增加的现象称为凝胶的溶胀。溶胀后重量、体积明显增加,高吸水树脂吸水以后体积可以膨胀几百倍,乃至上千倍。凝胶的溶胀分为有限溶胀和无限溶胀两种类型。凝胶吸收液体后,凝胶网状结构被撑开,体积膨胀,凝胶吸收越来越多的液体,网状结构最终碎裂并完全溶解于液体之中成为溶液,这种溶胀称为无限溶胀。若凝胶只吸收有限量的液体,凝胶的网状结构只被撑开而不解体,这种溶胀称为有限溶胀。溶胀进行的程度可用溶胀度来衡量,一定温度下,单位质量或体积的凝胶所能吸收液体的最大量称为溶胀度(swelling capacity)。
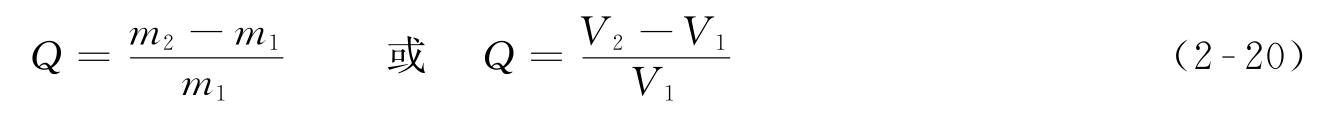
式(2-20)中, Q 代表溶胀度; m 1 、 m 2 代表溶胀前后凝胶的质量; V 1 、 V 2 代表溶胀前后凝胶的体积。
溶胀度受以下主要因素影响:液体的性质、温度、电解质及pH值。液体的性质不同,溶胀度有很大差异,凝胶的溶胀对溶剂是有选择性的,只有在亲和力很强的溶剂中才显现,如丙烯酰胺凝胶是典型的亲水凝胶,在有机溶剂中几乎不溶胀。另外,增加温度有可能使有限溶胀转化为无限溶胀。介质的pH值对蛋白质的溶胀作用影响很大,当介质的pH值等于蛋白质等电点时,其溶胀程度最小,pH值一旦偏离等电点,其溶胀程度就会增大。电解质中的阴离子对凝胶的溶胀作用也具有影响,各种阴离子对溶胀作用的影响由大到小的次序是:
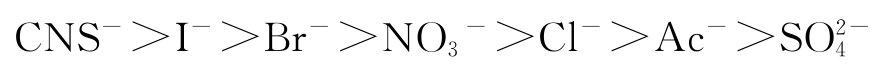
排在Cl - 以前的各种离子能促进溶胀,Cl - 以后的各种离子抑制溶胀。此外,凝胶的溶胀程度还取决于高分子化合物的链与链之间的交联度,交联度越大,溶胀度越低。
(2)脱水收缩性(离浆) 高分子溶液胶凝后,凝胶的结构并没有完全固定,凝胶内分子链段间的相互作用继续进行,链段不断蠕动,自发地相互靠近,挤出液体使网状结构更为紧密,这种液体从凝胶网孔中“自动”流出的现象称为脱水收缩或离浆(图2-15)。析出的液体是稀溶胶或称为高分子稀溶液;另一层仍为凝胶,只是浓度相对增高。一般情况下,弹性凝胶的脱水作用是个可逆过程,即是膨胀作用的逆过程;但是刚性凝胶的脱水收缩作用是不可逆的。
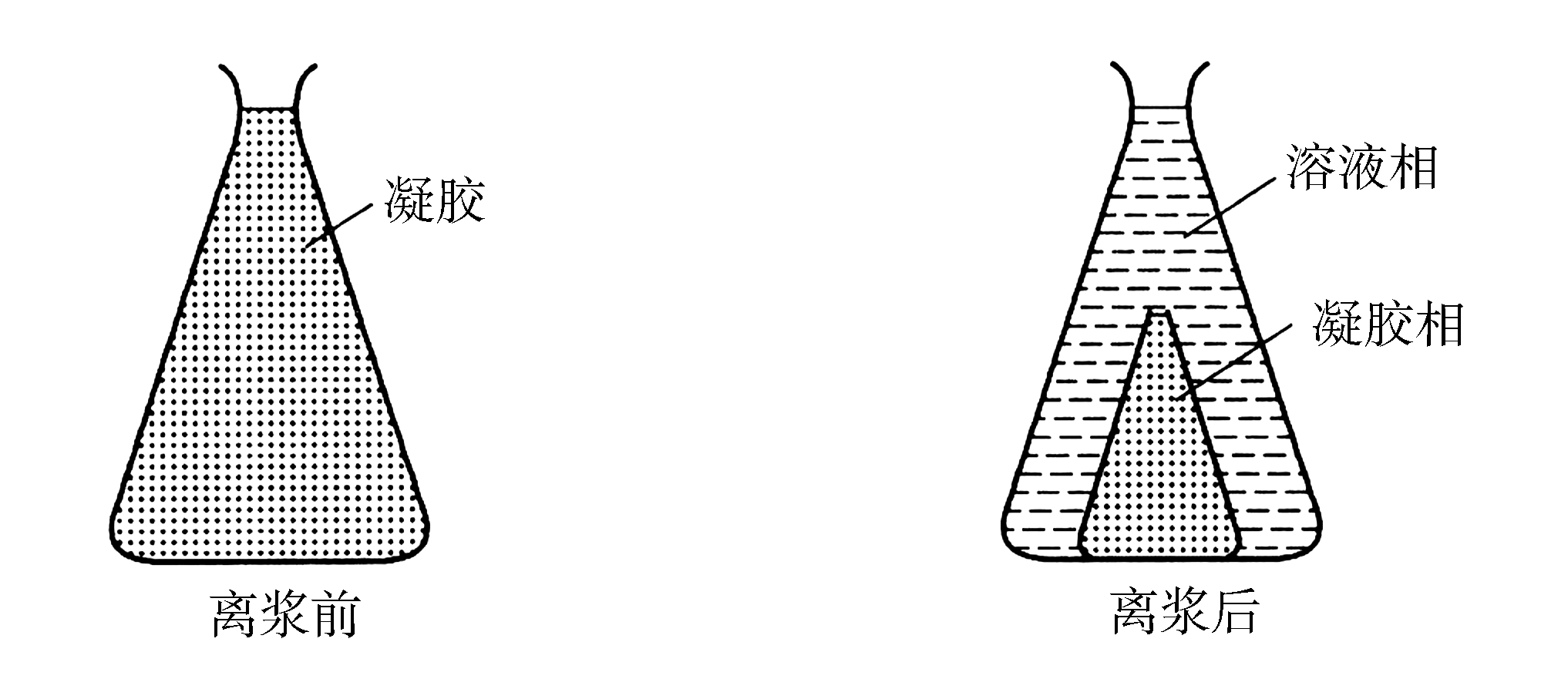
图2-15 离浆现象
(3)触变性 物理凝胶受外力作用变成流体(溶胶),外部作用力停止后,又逐渐恢复成半固体凝胶结构,这种凝胶与溶胶相互转化的过程,称为触变性。具有触变性的原因是在振摇、搅拌或其他机械力的作用下,凝胶的网状结构被破坏,链状结构互相离散,体系出现流动性。静止时链状结构又重新交联形成网状结构。凝胶的触变性被广泛应用于药物制剂,具有触变性的凝胶药物,只要振摇几下,立即就由凝胶变成液体,使用方便。例如某些滴眼液,滴的时候呈溶胶状,易滴出,滴入眼睑后呈凝胶状,延长了药物在眼内的滞留时间,药效因此得到提高。
(4)透过性 凝胶具有与液体相似的性质,可以作为扩散介质。物质(看作粒子)在凝胶中的扩散行为受构成凝胶的网状高分子浓度及网状高分子交联度的影响。当网状高分子浓度较低时,主要由扩散粒子和溶剂的相互作用控制,与在溶液中的扩散行为相似。但是,当网状高分子浓度较高时,则粒子扩散还受网状高分子结构的限制,即凝胶浓度增大和交联度增大时,物质的扩散速率都将变小,因交联度增大使凝胶骨架空隙变小,物质透过凝胶骨架时要通过这些迂回曲折的孔道,孔隙越小,受阻程度越大,扩散系数降低越明显。凝胶中溶剂的性质和含量也会影响凝胶的透过性,溶胀度高的凝胶平均孔径比较大,有利于粒子透过,含水的孔道有利于水溶性物质透过。另外聚电解质(也叫高分子电解质)凝胶对离子的扩散与透过是有选择性的。总之,通过调节以上各种影响因素都可起到控制物质在凝胶中的透过速率。
(5)吸附性 刚性凝胶的干胶大都是具有多孔结构,比表面积很大,所以表现出较强的吸附能力。弹性凝胶,如明胶、纤维素等,在水或水蒸气中都发生吸附,弹性凝胶的吸附能力一般比刚性凝胶弱得多。这是因为弹性凝胶干燥时高分子链收缩成紧密结构,而不是多孔结构。吸附时,收紧的分子链被撑开,极端情况下甚至会断开分子链间的交联,形成溶液或溶胶,所以很难将弹性凝胶的吸附与溶胀截然分开。
6.水凝胶 目前,在缓控释制剂中,利用凝胶的性质来控制药物的释放已取得很大成果。特别是一些亲水凝胶,由于其特殊的透过性能和良好的生物相容性已在医药领域得到广泛应用。
(1)水凝胶的特征及分类 水凝胶(hydrogels)是亲水性高分子通过化学键、氢键、范德华力或物理缠结形成的交联网络,不溶于水但能够吸收大量的水而显著溶胀,多数水凝胶网络中可容纳高分子自身重量数倍至数百倍的水,同时保持固态形状。水凝胶这种强烈的吸水能力是由于其结构中通常含有大量的-OH、-CONH-、-CONH 2 、-COOH和-SO 3 H等亲水基团。水凝胶一般都是柔软而具弹性的,这一特性使它与生物体有着很多的相似性,因此,大多数水凝胶具有生物相容性。水凝胶的另一重要特性是,它会因溶剂的性质、温度、pH值等的细微变化,或者光、电等的刺激而发生体积的突变,常将这一现象称为相变,在相变点,只要外部条件稍微变化,凝胶体积则变化10~1000倍。这一特性使水凝胶在给药系统中得到广泛应用,通常可根据水凝胶的体积膨胀或收缩,控制药物的释放。
水凝胶根据性质可分为电中性水凝胶和离子型水凝胶,离子型水凝胶又分为阴离子型,如褐藻酸、透明质酸、聚丙烯酸、聚丙烯酰基丙磺酸等;阳离子型,如壳聚糖、聚乙烯吡啶等;同时带有正电荷及负电荷的两性型离子在氨基酸中普遍存在,如甘氨酸等。
根据环境变化的类型,环境敏感水凝胶又分为以下几种类型:温敏水凝胶、pH敏水凝胶、盐敏水凝胶、光敏水凝胶、电场响应水凝胶、形状记忆水凝胶等。
(2)水凝胶在药物传送系统中的应用 水凝胶能响应环境刺激改变结构,以此来控制药物的释放。
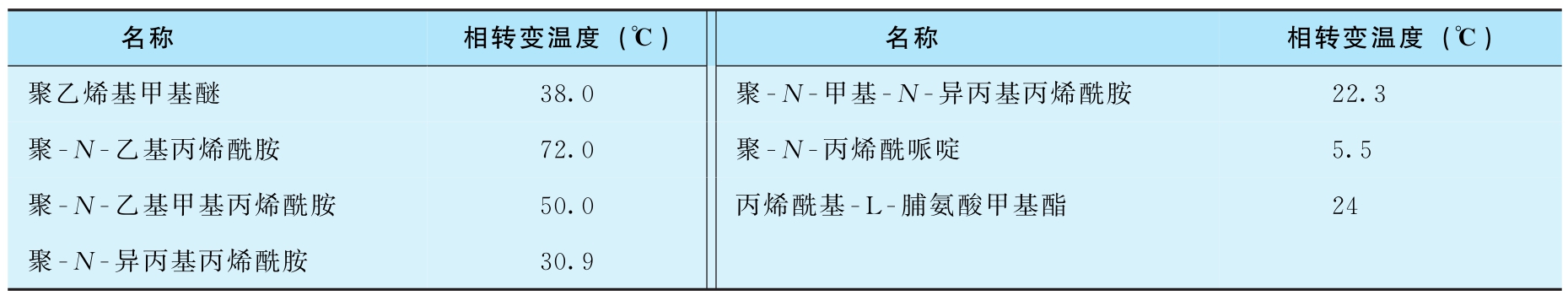
①温度响应型水凝胶:温度响应型水凝胶是其体积随温度变化而改变,分为两类,一类是随温度升高,水凝胶分子链亲水性增加,因水合作用分子链伸展,水凝胶体积增加;另一类是随温度升高,水凝胶分子链亲水性减弱,发生蜷曲,使水凝胶体积收缩。水凝胶体积发生突变的温度叫低临界溶解温度(lower critical solution temperature,LCST)或相变温度。聚- N -烷基系列凝胶具有低温溶胀、高温收缩的性质,这是由于氮原子上的孤对电子与水分子形成氢键,低温下这种氢键较稳定,形成了以交联网为骨架的水凝胶,高温时氢键突然断裂,水分子被排出,致使体积突然收缩。目前在药物控制释放系统中应用较多的聚丙烯酰胺系列就是温度响应型的高分子凝胶。表2-6所示的是在5.5~72℃范围内的温度响应型水凝胶。某些水凝胶的相转变温度随其组成而变化,如N-异丙基丙烯酰胺-甲基丙烯酸丁酯共聚物、丙烯酰基-L-脯氨酸甲基酯-甲基丙烯酸羟乙酯共聚物等。水凝胶在相变温度以下时为溶胀状态,在相变温度以上为收缩状态。凝胶收缩时,凝胶表面形成致密层抑制药物释放,凝胶溶胀时,因致密的表面层溶胀,引起药物释放。
表2-6 温度响应型凝胶及相转变温度
②pH敏感型水凝胶:pH敏感型水凝胶的体积随环境pH值、离子强度变化而变化。聚电解质水凝胶三维网络中具有可解离成离子的基团,其网络结构和电荷密度随介质pH值的变化而变化,并对凝胶的渗透压产生影响;同时由于离子的存在,离子强度的变化也引起体积变化。一般来说,含有酸性或碱性侧基的水凝胶具有pH值响应性。随着介质pH值、离子强度的改变,酸碱基团发生电离,导致网络内高分子链段间氢键的断裂,引起不连续的体积变化。
多肽等药物在胃中pH值低的区域会失活,而消炎药等抗炎症药物对胃的刺激性很大,因而,希望这些药物能在小肠内选择性地释放,并被生物体吸收。为此,可利用碱性敏感水凝胶(分子链侧链上含有在碱性介质中能够解离的基团,如丙烯酸类聚合物)与药物形成复合物,当胃中pH值约1.4时,凝胶状的丙烯酸单元上的羧基不解离,不离子化,凝胶处于收缩状态,抑制药物释放,但在肠中pH值为6.8~7.4,则发生离子化,高分子链上羧酸根阴离子间的排斥作用,使水凝胶溶胀,将所包含的药物释放出来。
水凝胶还能通过响应外界的物理刺激来控制药物释放,如电场、磁场、超声波和各种光等信号。
高分子的性能因其聚集态结构不同而有差异,即使同一聚集态的同一高聚物,因其使用温度及所受外力的不同,其性能也截然不同。例如,在某一温度下,该高聚物是流动的,可以塑制成型,而在较低的温度下则具有弹性,在更低的温度下又变得僵硬。这是因为高分子的分子运动形式不同而产生的结果。高分子由于
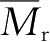 大、结构复杂,所以它的分子运动与低分子有着本质的区别。
大、结构复杂,所以它的分子运动与低分子有着本质的区别。
(1)运动单元的多重性 高分子具有长链结构,分子链长短不一,通常长链上还带有不同的侧基,再加上支化、交联、取向、结晶等因素,所以高分子的分子运动有链的整体运动、链段、链节、侧基、晶区、非晶区运动等多重性。
(2)分子运动的时间依赖性 高分子的热运动是一个松弛过程,该过程缓慢,具有时间依赖性。在一定的外力和温度条件下,聚合物从一种平衡状态通过分子热运动达到相应的新的平衡状态总是需要相对于低分子物质长得多的时间才能完成,完成该过程所需要的时间称为松弛时间。
(3)分子运动的温度依赖性 高分子运动对温度非常敏感。升高温度对分子热运动是有利的,一方面使热运动能量增加;另一方面使高分子体积膨胀,能增加分子链和其他单元活动的空间,有利于加速运动,缩短松弛时间。
2.高分子的热转变 在非晶态高聚物内部,高分子处于不同的运动状态(图2-16),温度较低时,没有足够的能量使聚合物的整个分子链段移动,只有个别原子能在平衡位置周围进行很小的偏移运动,具有虎克弹性行为,形变在瞬间完成,当外力除去后,形变又立即恢复,此时的结构具有硬、脆且抵抗变形的特点,这种力学状态与无机玻璃相似,称为玻璃态。当温度升高,热运动能量增加,达到某一温度后,虽然整个高分子链仍不能移动,但链段已能自由运动,分子的形态可以发生变化,在此温度范围内聚合物受到较小的应力就可产生很大的形变。当外力解除以后,由于存在松弛过程,必须经过一段时间后形变才能最终复原。在此温度范围内聚合物表现为柔软而具有弹性的固体,所以称为高弹态。常温下力学性质处于高弹态的高聚物用作橡胶材料。
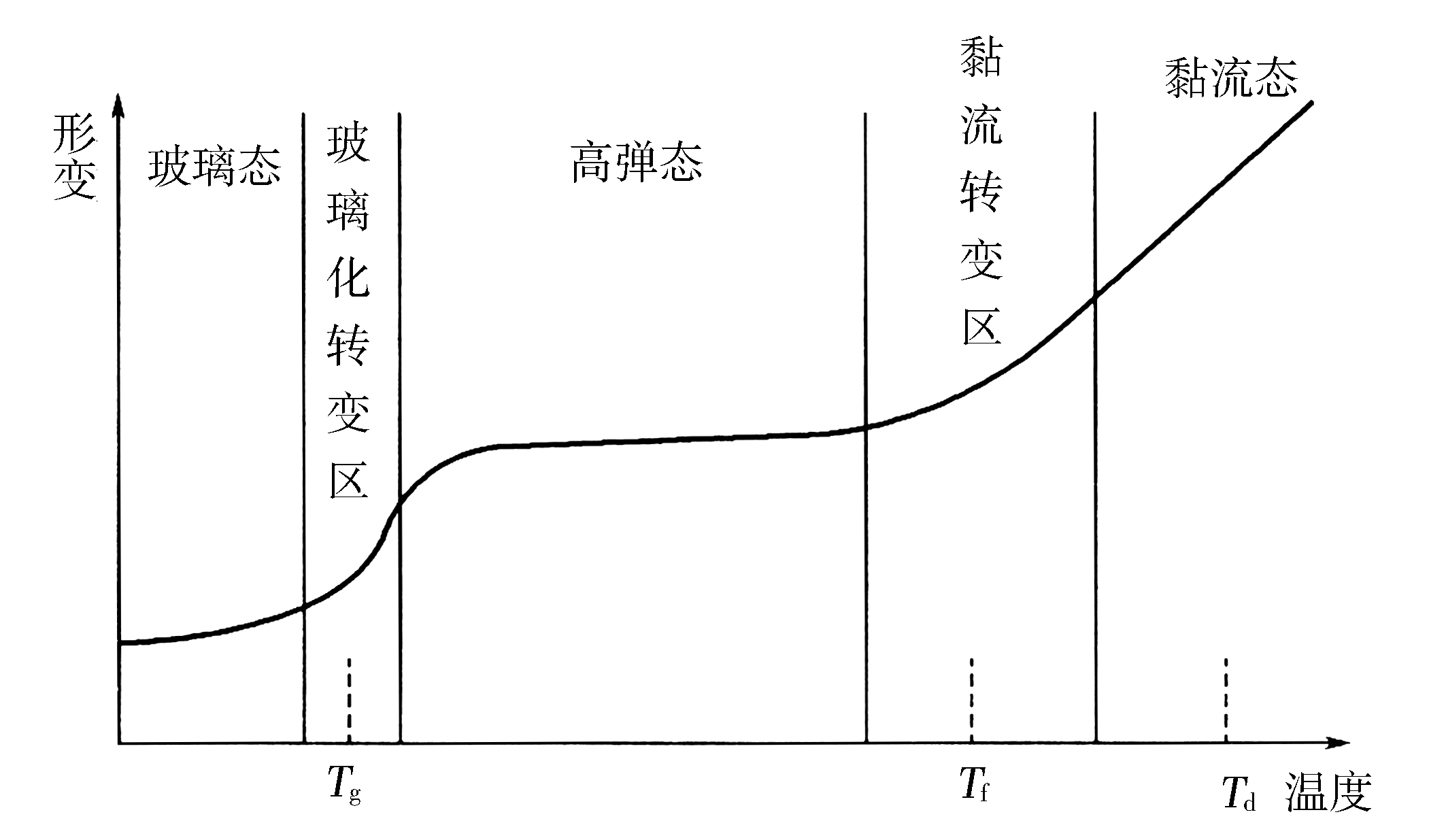
图2-16 非晶态高聚物的温度一形变曲线
当温度继续升高,直至整个分子链发生运动时成为黏流态,此时的聚合物也被称熔体,该状态下的高聚物虽有一定的体积,但无固定的形状,呈黏性液态,力学强度极差,稍受力就可变形,因而有可塑性。常温下处于黏流态的高聚物材料可作为胶黏剂等使用。交联聚合物由于分子链间有化学键连接,不能发生相对位移,不出现黏流态。
(1)玻璃化转变温度 玻璃态向高弹态转变的温度,即链段开始运动或冻结的温度,称为玻璃化转变温度,以
T
g
表示。当高聚物发生玻璃化转变时,它的许多物理性能都会发生急剧变化,对于
 足够大的高聚物,在温度高于
T
g
时是橡胶,具有高弹性,而在低于
T
g
的温度下则成为坚硬的固体——塑料。因此,
T
g
是高聚物的特征温度之一,可作为表征高聚物的指标。所谓橡胶和塑料是按它们的
T
g
在室温以上还是在室温以下而言的。
T
g
在室温以上的高聚物是塑料,
T
g
在室温以下的高聚物是橡胶。
足够大的高聚物,在温度高于
T
g
时是橡胶,具有高弹性,而在低于
T
g
的温度下则成为坚硬的固体——塑料。因此,
T
g
是高聚物的特征温度之一,可作为表征高聚物的指标。所谓橡胶和塑料是按它们的
T
g
在室温以上还是在室温以下而言的。
T
g
在室温以上的高聚物是塑料,
T
g
在室温以下的高聚物是橡胶。
链段运动是通过主链上的 σ 单键旋转来实现的,因此,凡是能影响高分子链柔性的因素,都对 T g 有影响。能减弱高分子链柔性或增加分子间作用力的因素,都可使 T g 升高,如主侧链刚性大、位阻大、规整度大、含极性基团或氢键多、结晶度高等。而能增加高分子链柔性的因素都能使 T g 降低,如加入增塑剂或溶剂、引进柔性基团等。例如,聚氯乙烯的 T g 为87℃,室温条件下是一种硬质塑料。当加入20%~40%的增塑剂邻苯二甲酸二辛酯后,其 T g 降至-30℃,室温条件下呈高弹态,弹性大大增加,可作为橡胶代用品。增塑剂的作用就是增加高分子之间的距离,使高分子内的单键在较低温度下就能“自由”旋转,分子链段就能运动,所以 T g 降低。表2-7列出一些常见聚合物的玻璃化温度。
表2-7 一些常见聚合物的玻璃化温度
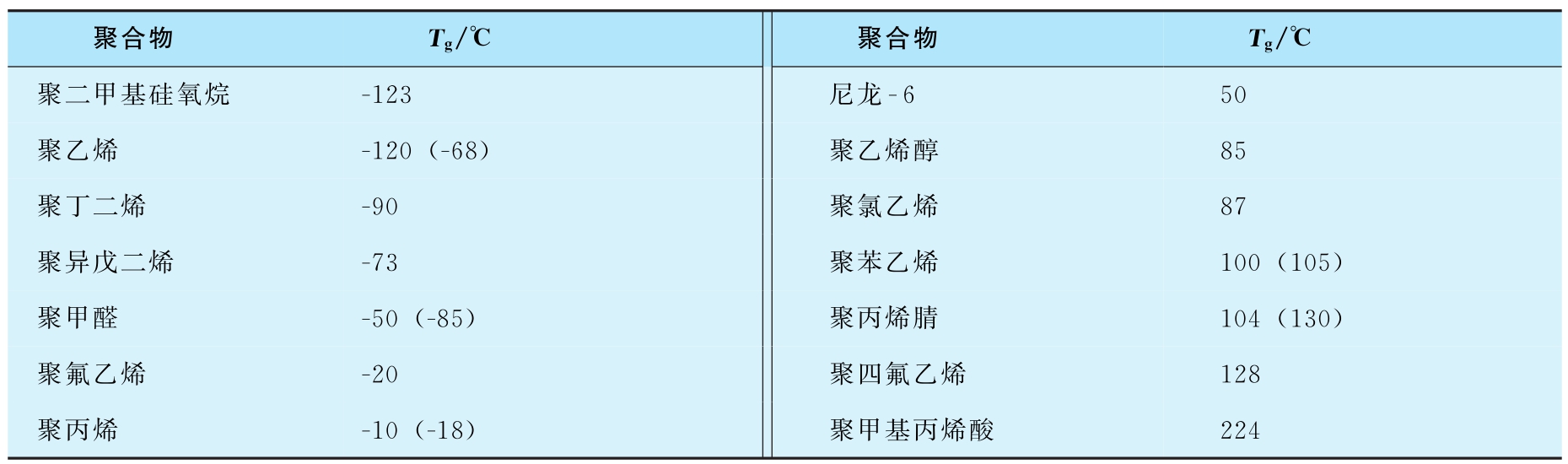
注:括号内的数字由不同检测方法所得。
(2)黏流温度 高分子材料从高弹态开始转变为黏流态的温度称为黏流温度,用
T
f
表示。聚合物
 越大,
T
f
越高,黏度也越大。
越大,
T
f
越高,黏度也越大。
(3)熔点 结晶态聚合物熔融时的温度称为熔点,以 T m 表示。高结晶度聚合物不存在 T g ,也不存在高弹态平台,而只出现 T m 。温度低于 T m 时,晶态聚合物表现普通弹性,高于 T m 时则直接转变为黏流态。聚合物的 T m 随结晶度的降低而逐渐降低,聚合物内非晶态部分的力学特征逐渐显现,当结晶度很低时,其形变-温度曲线与一般非晶态聚合物非常接近。
(4)热分解温度 高聚物材料开始发生交联、降解等化学变化时的温度,用 T d 表示。它提示的是高聚物材料成型加工不能超过的极限温度。
(1)应力与应变 当材料受外力作用而又不产生惯性位移时,物体对于外力所发生的形变称为应变(strain)。材料宏观变形时,其内部产生与外力相等、方向相反的力称为应力(stress),即反作用力,其大小反映了发生形变的物体内部的紧张程度。对于理想的弹性固体,应力与应变成正比,即服从虎克定律,其比例常数称为弹性模量(modulus of elasticity, E ),或杨氏模量(Young's modulus),简称模量。
弹性模量( E )=应力/应变
弹性模量单位为N/m 2 ,模量的倒数为柔量,是材料变形容易程度的一种表征。玻璃、聚乙烯和20%明胶冻的 E 值分别为7×10 11 、2×10 9 和2×10 6 ,即 E 值越小,弹性越大,刚性越小。
(2)硬度和强度 硬度表示材料表面抵抗其他较硬物体压力时的性质,是衡量材料在一定条件下的软硬程度指标,用以反映材料承受应力而不发生形状变化的能力。一般经常测定的是贝氏硬度,方法是把一定直径的钢球,在规定的负荷下压入试样中,并保持一定时间,然后以试样上压痕直径来计算单位面积所承受的力。
在药剂学加工过程中常见的强度有以下几种。
①拉伸强度:是在规定的温度、湿度和加载速度下,在试样上沿轴向施加拉力直到试样被拉断为止。断裂前试样所承受的最大载荷 P 与试样截面积之比称为拉伸强度。
②弯曲强度:是在规定条件下对标准试样施加静弯曲力矩,取试样断裂前的最大载荷 P ,按式2-21计算弯曲强度。

式(2-21)中, l 0 、 b 、 d 分别为试样的长、宽、高。
③抗冲击强度:是衡量材料韧性的一种指标,一般是指试样受冲击载荷而破裂时单位面积所吸收的能量。
在各种实际应用中,强度是材料力学的重要指标。影响聚合物实际强度的因素主要包括聚合物的结构因素和环境因素两个方面。结构因素有分子主链键能和分子间结合力的强弱、结晶度和取向度的高低、
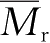 的高低、支化和交联、共聚和共混等。环境因素有温度和外力作用速率、增塑剂和填料的影响等。
的高低、支化和交联、共聚和共混等。环境因素有温度和外力作用速率、增塑剂和填料的影响等。
2.高聚物的高弹性
是由于高聚物极大的
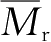 使得高分子链有许多不同的构象,而构象的改变导致高分子链有其特有的柔顺性。链柔性在性能上的表现就是高聚物的高弹性。与一般固体物质相比,橡胶类弹性的特征如下:①弹性形变大,可达1000%,而一般金属材料的弹性不超过1%;②弹性模量小,高弹模量只有10
2
~10
5
N/m
2
,而一般金属材料的弹性模量可达10
10
~10
11
N/m
2
;③弹性模量随温度上升而增大,而一般钢材则相反。
使得高分子链有许多不同的构象,而构象的改变导致高分子链有其特有的柔顺性。链柔性在性能上的表现就是高聚物的高弹性。与一般固体物质相比,橡胶类弹性的特征如下:①弹性形变大,可达1000%,而一般金属材料的弹性不超过1%;②弹性模量小,高弹模量只有10
2
~10
5
N/m
2
,而一般金属材料的弹性模量可达10
10
~10
11
N/m
2
;③弹性模量随温度上升而增大,而一般钢材则相反。
3.高分子的黏弹性 是高分子材料的又一重要的力学特征,指高聚物材料不但具有弹性材料的一般特性,同时还具有黏性流体的一些特性。其实质是聚合物力学的松弛行为,理想的弹性体受到外力作用后,其形变可在瞬间恢复原态,所以可忽略时间因素的影响;理想的黏性体受到外力作用后,形变随时间而线性变化。黏弹体则介于上述二种情况之间,其表现在于它有突出的力学松弛现象。假设有某种高分子材料,在外力作用下拉长一定时间,然后松开、静置,使应力消除,弹性高分子材料有回复趋势,但长度比拉长之前变长了。高分子材料处于拉伸状态的温度越高、时间越长,则高分子材料变长的现象就越明显。高分子材料的黏弹性表现主要有蠕变、应力松弛和内耗。
(1)蠕变 蠕变是指在一定温度、一定应力作用下,材料的形变随时间的延长而增加的现象。所有高分子材料在形变时都有蠕变现象,蠕变和应力松弛一样,都是因为分子间的黏性阻力使形变和应力必须有一段时间才能建立平衡,因此,蠕变是松弛现象的另一表现形式。对于线型高分子,形变可无限发展且不能完全回复,保留一定的永久形变;对交联聚合物,形变可达到一个平衡值。
蠕变是一种复杂的分子运动行为。高分子的结构、环境温度及作用力大小等都影响蠕变过程,其中分子链的柔性影响最大。高分子的蠕变性能反映高分子材料尺寸的稳定性或者形变的大小。例如橡胶制品要经过硫化交联,即通过分子间交联阻止分子链的流动,避免不可逆形变,保证制品良好的弹性。
(2)应力松弛 在温度、应变恒定条件下,材料内的应力随时间延长而逐渐减小的现象称为应力松弛。如日常用的松紧带,用久之后感觉变“松”的现象就是橡胶应力松弛的表现。
(3)内耗 当应力的变化和形变的变化一致时,没有滞后现象,每次形变所做的功等于恢复原状时获得的功,所以没有功的消耗。如果形变的变化落后于应力的变化,发生滞后损耗现象,则每次循环变化中要消耗功,称为内耗。高分子的内耗大小不仅与其本身的结构有关,同时还受温度的影响,温度升高,内耗增加。