




碘是元素周期表中第53号元素,是卤族元素中原子质量最大的元素,也是人体必需微量元素中原子质量最大的元素。碘的发现和历史上很多科学发现一样,是偶然和探索结合的产物。1811年,法国化学家Bernard Courtois,为协助拿破仑制造火药,从海藻灰中提炼硝酸钠,在一次提取过程中发现过量硫酸与海藻灰反应时会产生紫色气体,而这种紫色气体又可以迅速遇冷凝固成为黑色晶体。在化学家Gay-Lussac的帮助下,从这种紫色气体的结晶中鉴定并发现了新的元素——碘 [1] 。他们将它命名为“Iode”,是希腊语中紫色的意思。
已被发现的碘元素同位素有37种,自然界中同位素状态是 127 I ,其余放射性同位素状态除 129 I外,半衰期都很短,在医疗中有广泛应用。 123 I半衰期约13h,常作为影像学检查中碘造影剂 [2-3] ; 125 I半衰期约59d,用于临床检验、核医学成像和肿瘤的近距离放疗 [4] ; 131 I半衰期约8d, 131 I本身是核裂变碘常见产物,在核爆炸后的放射性尘埃中水平很高,能够在甲状腺中蓄积并破坏甲状腺细胞,这一特征被用以甲状腺核素成像和甲状腺功能亢进、甲状腺肿瘤的治疗。
碘元素可以表现出由-1到+7的多种氧化态,既可以形成无机物,又可以形成有机物,广泛存在于自然界中。并在大气圈、水圈、地质圈和生物圈形成“土壤-生物-空气-水体”循环(图6-1)。
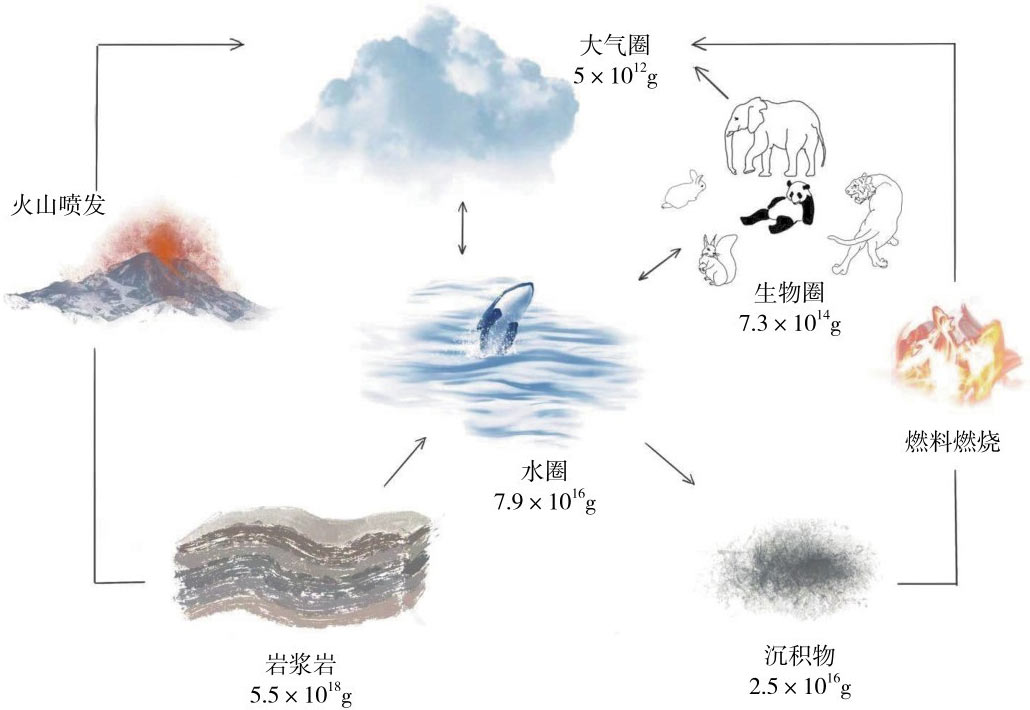
图6-1 碘在大气圈、水圈、地质圈和生物圈的循环过程及质量分布
碘在海水中浓度最大,海水中可溶碘的浓度为0.4~0.5μmol/L,碘的主要存在形式是碘酸根离子(IO 3 - )和碘离子(I - ),也有少量碘以有机碘的形式存在。IO 3 - 是海水碘的主要存在形式,海水中IO 3 - 的分布随海水深度和地理位置的不同而改变。海洋表面IO 3 - 浓度较低,在低纬度地区最低,达到0.22μmol/L。1000m深度以下海水IO 3 - 浓度增加,在500~2400m处达到最大,而在更深的区域,IO 3 - 浓度又下降至0.41~0.42μmol/L。与IO 3 - 相反,I - 在海洋表面浓度较高,可达到0.15μmol/L,200m以下则迅速降低至0.01μmol/L左右。
海水中的碘离子以I 2 、CH 3 I和CH 2 I 2 的形式蒸发进入大气层,通过降雨进入土壤和淡水水体,被植物吸收从而进入食物链。碘也可以在海洋中被海藻吸收而进入食物链。然而这种循环速度很慢,覆盖区域也有限,因此有很多土壤和饮用水中碘缺乏,尤其是山区(如阿尔卑斯山脉、喜马拉雅山脉、安第斯山脉、阿特拉斯山脉、亚平宁山脉等)、泛洪地区(如恒河平原和印度东北部地区)和既往被冰川覆盖的地区很常见 [5] 。碘在乏氧环境中比在富氧环境中更易富集,流动性也更大。因此一般在洪水之后,固态土壤中的碘会进入液态土壤或水体,化学形式也发生改变。在富氧环境和乏氧环境交界区域,碘会大量富集,因此在泛洪区,比如我国黄河流域,在地理范围很小的区域内,可以同时出现高碘地区和缺碘地区,土壤和水体的碘含量差异很大。富氧环境不利于碘的富集,因此大多数植物的根不能很好地吸收碘,而根部耐受乏氧环境的植物,如水稻,吸收碘的能力则比较强。在富碘土壤中生长的作物碘含量水平也较高,相应的,碘缺乏地区农作物碘含量也较低,以此为食的人与动物也易发生碘缺乏。饮用水的水碘浓度主要取决于当地天然水的碘浓度,另外在饮用水处理过程中也会使碘浓度和形式发生变化。在自来水净化过程中总碘含量大约会降低8.5%,饮用水经臭氧化消毒后,可使碘离子转化为碘酸根离子 [6] 。
含碘丰富碘矿石比较稀有,碘酸钙矿石、碘铬钙石等具有一定提炼碘的经济学价值,但不适合大规模生产。碘在海水中浓度最大,约50μg/L,在棕色海藻中浓度尤其高,因此自18世纪以来便作为制碘的原料。随后发现生硝矿石在生产硝酸钠碘过程中,也能够产生相当于其质量0.02%~1%的碘酸钠,生硝矿石便被广泛应用于制碘业,逐渐代替了海藻制碘。智利也因拥有大量生硝矿石,成为生产碘的主要地区。20世纪末期,日本科学家发现卤水也可以作为制碘的原料后,也成为制碘的主要资源之一,拥有大量沼气田的美国和日本也成为制碘的主要地区。生产的碘元素约一半用于合成有机化合物,15%以碘分子(I 2 )的形式存在,15%以碘离子尤其碘化钾形式存在,15%形成其他无机化合物。工业提纯碘可以用于合成工业反应的催化酶、燃料、制造食品添加剂、生产医药用品及医疗成像等。