




虽然静脉麻醉已有 100 多年的历史,但静脉镇静技术在口腔科领域的发展要晚于吸入镇静技术。20 世纪,随着大量麻醉药物的出现,静脉镇静技术在以门诊为主的口腔科领域得到了一定的发展;而另一个不可或缺的因素则是无创监测技术及设备提高了静脉镇静技术(中、深度镇静)的安全性,从而为临床实施提供了安全保障。下面介绍常用的经静脉途径口腔治疗镇静方法。
任何镇静技术的首要适应证都应是与口腔治疗相关的焦虑和恐惧影响了原发疾病的治疗,包括吸入镇静、经鼻途径镇静等。然而对于大多数在门诊进行的口腔科治疗以及目前复杂的医疗环境,经静脉镇静技术不应作为医师的首选,应在其他镇静技术效果不佳时才考虑选择经静脉途径的镇静。
对于口腔科治疗疼痛的控制,经静脉途径给予足量镇痛药物不是首选,良好的局部麻醉仍然是口腔科控制疼痛的最有效的方法。但在一些情况下如治疗过程中局麻效果不佳时,经静脉给予小剂量阿片类药物能有效地辅助控制疼痛,但需要严密监测生命体征。术后疼痛的控制仍首选口服给药。
在开放静脉的同时,给予一些抗胆碱能药物如阿托品、东莨菪碱等能有效地抑制唾液腺的分泌,患者干燥的口腔环境能带给口腔医师治疗中的便利,例如取模型等。
在经静脉途径的镇静技术中,选择具有一定程度遗忘作用的药物(如咪达唑仑、右美托咪定)能给患者带来一些好处,特别是一些需要接受长时间治疗的患者。镇静能使患者放松,但长时间的张口或者治疗时器械发出的吱吱声,对于部分患者仍是一种不快的体验。这部分不快的体验可以在伴随静脉镇静时遗忘,而是否有益是主治医师和患者需要面对和选择的情况。
部分患者由于患有咽炎等原因导致张口过大或口腔科器械放入口内时出现了恶心甚至呕吐的情况,增加了医师治疗的难度和患者不愉快的体验。表面麻醉、笑氧吸入镇静技术都能不同程度地缓解轻、中度的咽反射导致的恶心,而对于一些特别严重的患者,静脉镇静技术能更好地解决此类状况,保证治疗顺利进行。
静脉镇静技术有一些相对的禁忌证,例如:困难气道、肝肾功障碍、重度肥胖患者等,需要做好完善的术前评估和准备,充分考虑药物代谢及镇静下患者的通气情况,在确保安全的前提下,选择合适的镇静深度。
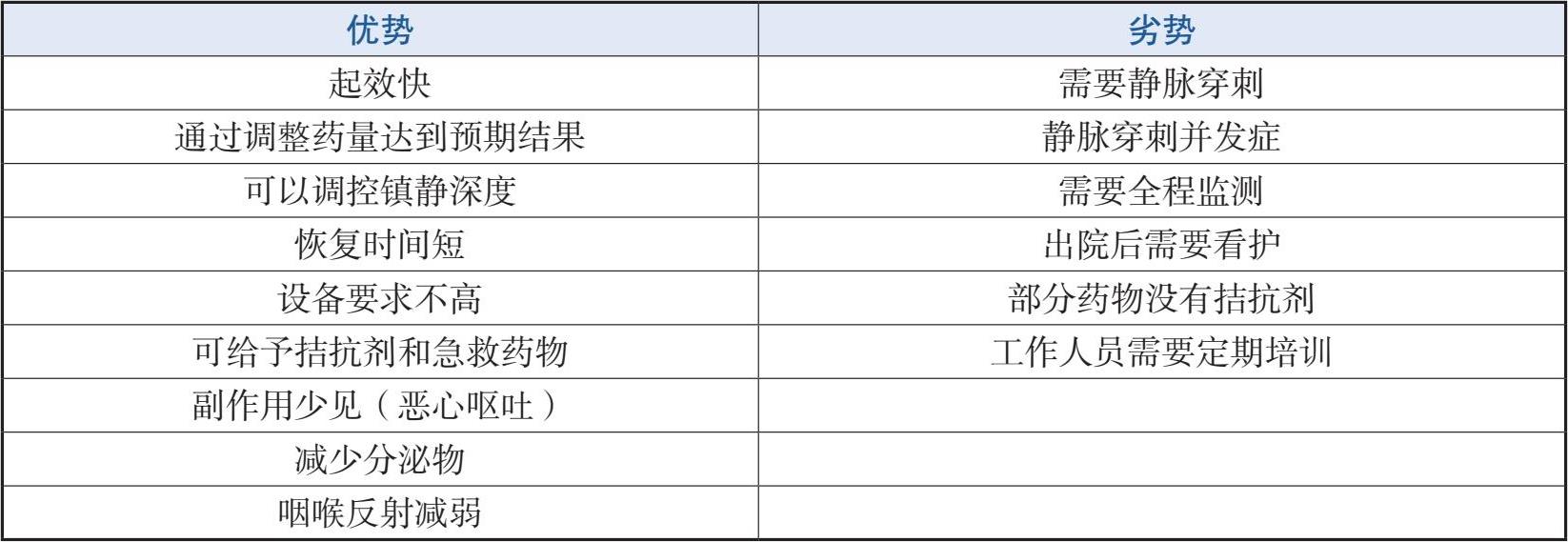
静脉镇静的优势与劣势见表2-4-1。
表2-4-1 静脉镇静的优势与劣势
理想的镇静镇痛是抑制应激反应、术中遗忘、血流动力学稳定、药物起效快、作用时间可控;但目前的药物均不能达到以上效果,并且由于镇静和麻醉之间并没有严格的界限,目前采用多种药物联合应用,同时联合良好的局部麻醉。良好的局部麻醉不但可以减少镇静镇痛药物的使用,持续的术后镇痛减少术后应激反应。
目前常用的静脉镇静镇痛药物为苯二氮䓬类药物、阿片类药物、α2-肾上腺素受体激动药物、丙泊酚等。以上药物可复合笑氧镇静技术,也可以相互联合应用。但联合应用时应高度警惕呼吸抑制,吞咽反射抑制后补牙材料、血液等异物进入呼吸道,给患者带来气道堵塞、误吸等肺部相关并发症,增加手术麻醉风险及患者的留院时间。
1.咪达唑仑(Midazolam)最常用的苯二氮䓬类药物,有镇静催眠、顺应性遗忘、抗焦虑、抗惊厥、抗癫痫、中枢性肌肉松弛作用。注射用咪达唑仑为水溶性制剂。血浆浓度可分为两个时相,分布时相为 10 min,消除时相半衰期为 1.5~2.5 h,充血性心力衰竭患者的消除时相半衰期可延长 2~3 倍。长期用药无蓄积作用,药动学数据及代谢保持不变。咪达唑仑顺应性遗忘作用强,但镇静效果不如地西泮。用法用量:初始剂量 1~2.5 mg,逐步增加达理想镇静深度,平均镇静剂量 2~7 mg。禁忌证:急性肺功能不全者、孕妇、哺乳妇女和过敏患者。其最常见的不良反应是眩晕。
2.地西泮(Diazepam)地西泮为脂溶性制剂,易导致静脉局部刺激、静脉炎甚至血栓形成。属长效药,血浆半衰期为 20~50 h。经肝脏代谢,主要代谢酶为CYP2C19,主要代谢产物为去甲西泮,仍有生物活性,故连续应用可蓄积。容易出现反弹效应或第二峰效应。可透过胎盘屏障进入胎儿体内。主要自肾脏排出,亦可从乳汁排泄。地西泮静脉持续时间约 40~60 min,可能导致呼吸抑制。地西泮有提高阈值和顺应性遗忘作用。用量:5~20 mg缓慢滴注。禁忌证:青光眼和对地西泮过敏者。常见不良反应是嗜睡、头晕、乏力等,大剂量可有共济失调、震颤;个别患者发生兴奋、多语、睡眠障碍,甚至幻觉;停药后上述症状很快消失。
1.芬太尼(Fentanyl)人工合成的强效麻醉性镇痛药(μ受体),药理作用与吗啡类似,镇痛强度为吗啡的 100 倍,起效迅速,维持时间短,不释放组胺,对心血管功能影响小,能抑制气管插管时的应激反应。静脉注射后 1 min起效,4 min达高峰,维持作用 30 min。大剂量快速静注可引起颈、胸、腹壁肌强直,胸顺应性降低影响呼吸。用量:初始剂量 25~50 μg,以 25 μg为单位滴定。平均剂量为 100 μg。禁忌证:慢性阻塞性肺病、支气管哮喘和呼吸系统疾病晚期患者、重症肌无力者和对芬太尼过敏者。禁止与单胺氧化酶抑制剂(如帕吉林等)合用。不良反应可引起呼吸抑制或窒息,呼吸抑制与剂量有关。大剂量引起呼吸抑制可用纳洛酮对抗。心动过缓可用阿托品对抗。在诱导麻醉阶段可引起肌强直,但可在麻醉前服用地西泮或给予肌肉松弛药避免。术后可出现恶心、呕吐,但为时很短。
2.瑞芬太尼(Remifentanil)为高效的阿片类药物,具有起效迅速和极短消除半衰期的特点,1 min可达有效浓度,作用持续时间仅 5~10 min。这些特点使其适合于手术室外麻醉,同样具备其他阿片类药物的特点,即镇痛、呼吸抑制、骨骼肌(如胸壁肌)强直、心动过缓、低血压和恶心呕吐。瑞芬太尼只能通过静脉内途径给药,安全范围高,常用量0.5~2 μg /(kg·min)。瑞芬太尼的镇痛作用及其副作用呈剂量依赖性,与镇静催眠药、吸入性麻醉药合用有协同作用。
3.舒芬太尼(Sufentanil)为芬太尼的类似物,镇痛效果效果强,呼吸抑制相对于其他阿片类药物轻。其亲脂性约为芬太尼的两倍,更易通过血脑屏障,与血浆蛋白结合率较芬太尼高,而分布容积则较芬太尼小,虽然其消除半衰期较芬太尼短,但由于与阿片受体的亲和力较芬太尼强,因而不仅镇痛强度更大(约为芬太尼的 10 倍),而且作用持续时间也更长(约为芬太尼的 2 倍)。舒芬太尼在肝内经受广泛的生物转化,其中去甲舒芬太尼有药理活性,效价约与芬太尼相当,这也是舒芬太尼作用时间长的原因之一。目前除了可以通过静脉给药外,还可以通过经鼻腔、经皮缓释等给药。常用量 0.1~1 μg /(kg·min)。
4.阿芬太尼(Alfentanil)为芬太尼的衍生物,主要作用于μ阿片受体,为短效镇痛药,镇痛强度为芬太尼的 1/4,作用持续时间为其 1/3。起效快,静脉注射 1.5~2min达峰,维持约 10min,消除半衰期为 64~129min。对呼吸频率和经肺泡供氧的抑制作用一般只持续数分钟。对心血管的作用与芬太尼相似,影响小。禁忌证:对阿芬太尼和其他阿片类药物过敏者;明显不能耐受拟吗啡药者。用量:静注 5~20 μg /kg,以后追加 2~5μg /kg或 0.1~0.5 μg /(kg·min)。副作用可引起呼吸抑制或窒息、肌强直、恶心、呕吐等。
5.纳布啡(Nalbuphine)是新型阿片受体激动拮抗剂,完全激动κ受体,部分拮抗μ受体,对内脏痛独具疗效,且不良反应少。纳布啡的阿片拮抗效应为烯丙吗啡的 1/4,为喷他佐辛的 10 倍。纳布啡与同等镇痛剂量的吗啡产生相同程度的呼吸抑制,但其具有天花板效应,即在不影响呼吸的其他中枢活性药物合用时,剂量大于 30 mg时呼吸抑制不随剂量进一步增加。纳布啡静脉用药后 2~3 min起效,血浆半衰期为 5 h,作用时间约 3~6 h。用量:静注 0.1~0.2 mg/kg,以后追加 2~5 mg。临床治疗用纳布啡的最常见不良反应为镇静;不常见的不良反应包括:多汗、恶心/呕吐、眩晕、口干和头痛等。
丙泊酚为烷基酸类的短效静脉麻醉药。丙泊酚属于脂溶性药物,不溶于水。丙泊酚注射液内含大豆油、蛋黄卵磷脂、甘油等,推注时有强烈的静脉刺激作用,使用前可用利多卡因预处理。静脉注射后迅速分布于全身,40 s内可产生睡眠状态,进入麻醉迅速。半衰期约 2~8 min。在肝中主要与葡萄糖醛酸结合而代谢,34~60 min后代谢物由尿排出。如与芬太尼合用,则本品的血药浓度升高。丙泊酚的镇痛效应较弱,可使颅内压降低、脑耗氧量及脑血流量减少。对呼吸系统有抑制作用,可出现暂时性呼吸停止;对循环系统也有抑制作用,可出现血压降低。丙泊酚的麻醉恢复迅速,约 8 min,恢复期可出现恶心、呕吐和头痛。禁忌证:颅内压升高和脑循环障碍的患者等。用量:50~100 μg /(kg·min),直至达到预期镇静效果,维持剂量 25~50 μg /(kg·min)。长时间应用会产生药物蓄积作用延长清醒时间。
羟丁酸钠作用与脑内γ-氨基丁酸(Gamma-aminobutyric Acid,GABA)的中间代谢物一致,主要阻断乙酰胆碱对受体的作用,干扰突触部位冲动的传递,直接抑制中枢神经活动而引起生理样睡眠。有镇静催眠、顺应性遗忘、抗惊厥作用,对呼吸和循环系统一般无明显抑制作用,可使呼吸频率减慢,但呼吸量增大,高龄者应用较大剂量时会出现间歇性呼吸。稍增加收缩压;能兴奋副交感神经,心率明显减慢。其不影响脑血流量,不增加颅内压;咽部反射抑制明显。有时出现恶心、呕吐。可增强子宫收缩的频率和强度,并能透过胎盘屏障。对肝肾无毒性。用量:成人 30~80 mg静推;儿童 50~100 mg静注。静注 10~15 min显效,45 min作用明显,60 min后下降,维持约 2 h。禁忌证:癫痫、原因不明惊厥、低血钾、心动过缓、心脏完全性传导阻滞、慢性酒精中毒、急性间歇性血卟啉病或变色血卟啉病等。
右美托咪定为美托咪定的活性右旋异构体,是相对选择性α美托肾上腺素受体激动剂,对α上腺肾上腺素受体的亲和力比可乐定高 8 倍,具有抗交感、镇静镇痛作用。用量:配成 4 μg /mL浓度以 0.5 μg /kg剂量缓慢静注,输注时间超过 10 min,维持剂量 0.5 μg/(kg·h)。右美托咪定耐受性良好,常见的不良反应包括低血压、恶心、窦性停搏、组织缺氧和心房颤动。禁忌证:Ⅱ度Ⅱ型以上的传导阻滞、怀孕、哺乳期妇女,对右美托咪定过敏者。该药半衰期较长,有苏醒延迟风险;与其他镇静药物合用时,呼吸抑制风险增大。由于该药个体差异大,只能由专业的麻醉医师在具备完好的医疗监护下使用。在没有呼吸保护的措施下尽量减少药物使用的时间与剂量。
1. 氟马西尼(Flumazenil)是苯二氮䓬类拮抗药,化学结构与苯二氮䓬类近似,作用于中枢的苯二氮䓬受体,能阻断受体而无苯二氮䓬类样作用。用于对抗苯并二氮杂革类药物超剂量使用后的镇静作用及定向障碍,并具有抗惊厥活性和抗癫痫作用。起效时间3~5 min,作用时间为 60 min。用量:0.25~0.5 mg静脉注射,每 5 min 0.25 mg,最大剂量1 mg。禁忌证:对本品过敏者、妊娠前 3 个月的孕妇、麻醉后肌松剂作用尚未消失者。
2. 纳洛酮(Naloxone)纳洛酮是阿片类拮抗药,纳洛酮类似吗啡,通过竞争阿片受体(依次为μ,κ,δ)而起作用;同时伴有激动作用,即激动—拮抗的结合作用。能解除类阿片药物过量中毒和术后持续的呼吸抑制。起效时间 2 min,作用时间为 30 min。用量:0.1~0.2 mg静脉注射,每 2~3 min 0.1 mg,最大剂量 1.2 mg。禁忌证:对纳洛酮过敏者,或阿片依赖者。高血压及心功能不良患者慎用。阿片类及其他麻醉性镇痛药成瘾者,注射本品时,会立即出现戒断症状,故要注意掌握剂量。
需要重点注意的是,拮抗药是相关药物的类似物,仍具备药效,同时拮抗药作用时间较镇静镇痛药物作用时间短,容易出现二次镇静风险。因此,使用拮抗药物的患者至少需要在院观察 2 h,医师再次评估后方可离开。
1. 镇静治疗中对人意识产生抑制的药物均可降低上呼吸道肌肉张力,进而降低呼吸驱动力;抑制呼吸道保护性反射。
2. 口腔镇静治疗中口腔有自然关闭的倾向;在重力作用下下颌发生后坠,尤其是舌后坠,和咽部肌肉松弛与会厌一起闭塞声门;软腭亦可阻碍鼻腔气道。所有这些因素都会随麻醉深度加重气道阻塞可能性。下颌骨软组织结构(舌和会厌)是气道阻塞的主要原因。
3. 口腔治疗常用的半卧位以及口腔科治疗中施加于下颌骨向下的压力也是加重上呼吸道梗阻的医源性因素。
总之,由于镇静镇痛药物引起的上呼吸道梗阻或呼吸驱动力下降是口腔专业镇静/麻醉不良事件发生的主要因素,实施中一定注意患者个体差异性,避免多重药物的同时使用。诊室的气道保护工具必不可少。
口腔门诊镇静治疗中常用的呼吸道保护工具分为鼻导管、面罩给氧、简易呼吸器和经鼻湿化高流量通气(THRIVE)装置等。
1. 鼻导管 是最基本的呼吸道保护工具,操作简便,连接气源设备即可使用。可用于种植、牙体牙髓、颌面外科等需镇静患者的气道保护。但鼻导管中气流较干燥、冷,气流量较大或吸入时间过久,患者耐受性较低。
2. 面罩 标准的面罩以塑料或橡胶为材质,完全将鼻和嘴密封。可连接至麻醉呼吸回路或氧气气源,用于麻醉的诱导或者加压给氧。除非手术时间短或者不经口内,否则并不能单独用于镇静。改良的面罩仅罩住鼻子,连接氧气通路可用于门诊口腔镇静治疗,但由于面罩体积相对于鼻导管大,其在需应用多种治疗器械的口腔治疗(如牙种植)时,应用受限。
3. 经鼻湿化高流量通气技术(Transnasal Humidified Rapid-insufflation Ventilatory Exchange,THRIVE)经鼻高流量氧疗(High-flow Nasal Cannula,HFNC)是目前理想的无创氧疗方式,可以将气流温、湿化,吸入氧浓度(FiO 2 )的可调节范围大(21%~100%),在充分温、湿化的前提下,最大氧流量可达到 70 L / min。由此可体现HFNC的重要价值。HFNC潜在的临床疗效主要包括:①鼻腔部死腔冲洗,提高肺泡通气;②提供足够的流量以减少呼吸阻力和呼吸做功;③通过减少冷空气的效应提高气道的传导性和肺顺应性;④通过提供相对湿度为 100%的氧气或空气氧气混合气体减少气体代谢做功;⑤提高黏膜纤毛的清除功能,产生一定的气道正压。目前投入临床使用的HFNC是开放系统设备,可以通过嘴和鼻泄露,此外,鼻孔和导管前端接触处的泄露程度对临床疗效的作用值得重视。
传统HFNC技术适用于急性呼吸衰竭、慢性阻塞性肺部疾病、呼吸睡眠暂停综合征、气管插管前后、急性心力衰竭伴低氧血症。谈及经THRIVE之前,必须理清两个概念:HFNC通过鼻导管给予患者高流量的温、湿化氧气,保障氧合;窒息氧合通过一定技术安全延长窒息(无通气)时间,并保障动脉血氧饱和度(SaO 2 )> 88%~90%。THRIVE是HFNC和窒息氧合交界的一项技术,并逐渐在麻醉学领域引发关注。THRIVE在麻醉学领域的应用相对较晚且较少。保持呼吸道通畅和维持氧合是麻醉与手术安全的前提,预充氧合是提高麻醉诱导期间氧合的重要措施之一,THRIVE相比传统的面罩给氧去氮法,其安全窒息时限可增加 2 倍以上,可提高围插管期安全性,这一点对困难气道的处理意义极为重大。颌面部、咽喉部手术部位与麻醉气道管理重合,保证安全通气的同时又确保手术视野不受阻挡是一个矛盾体,采用THRIVE通气可解决这个问题(图2-4-1)。
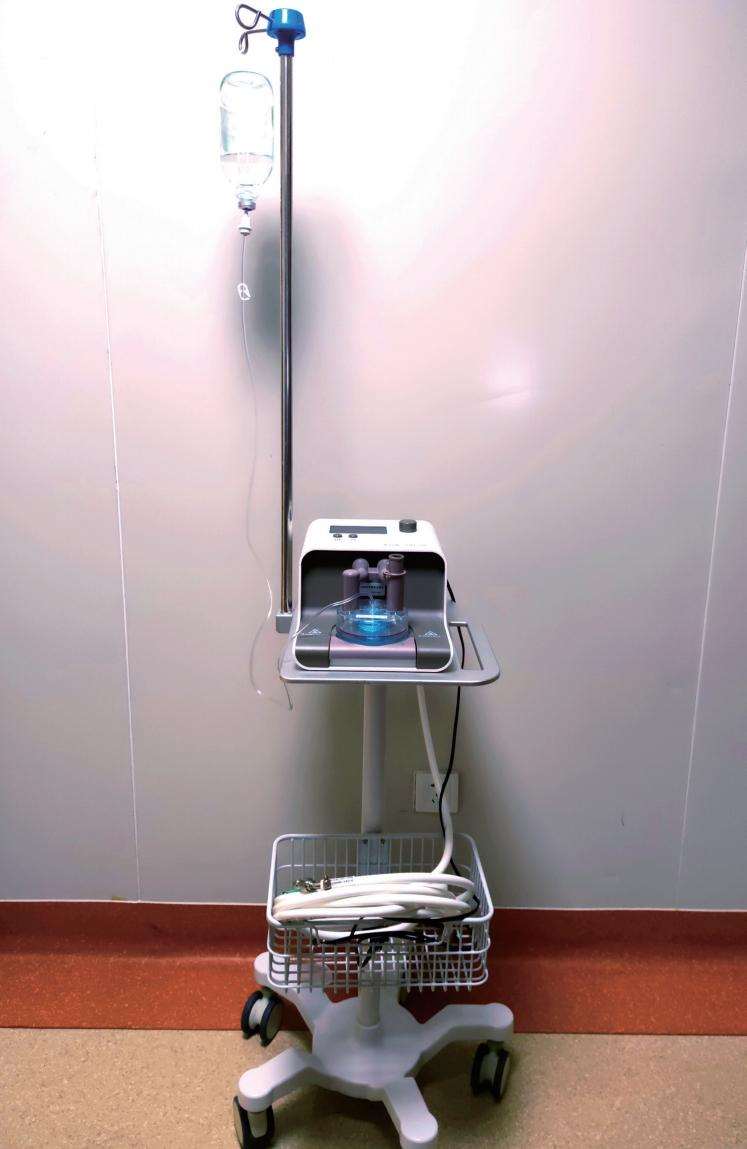
图2-4-1 经鼻湿化高流量通气仪
临床医师在实施THRIVE过程中需要调节三个参数(图2-4-2):第一个参数是气体温度,一般气体温度低于体温 1~2℃,并可根据患者的舒适度调节;第二个参数是FiO 2 ,低氧血症患者一般从 0.6 开始,随后根据脉搏血氧饱和度(SpO 2 )、动脉血氧分压(PaO 2 )、动脉血二氧化碳分压(PaCO 2 )、呼吸频率和心率来调节;第三个参数是流量,根据SpO 2 、PaO 2 、PaCO 2 、呼吸频率和心率来调节。

图2-4-2 THRIVE参数调节界面
在困难气道的麻醉诱导(图2-4-3)中,通过THRIVE维持通气氧合帮助我们从容地进行气管插管操作,并减少患者可能需要承受的伤害,如清醒下气管插管、气管内喷射丁卡因等。此项技术还能用于口腔颌面部术后早期拔管后安全通气。上呼吸道与口腔颌面外科手术部位紧密相关,颌面外科手术后伤口周围肿胀充血,严重挤占上呼吸道,进而影响患者通气;长时间保留气管导管会引起相关肺部感染,并且术后部分患者对气管导管耐受度较差,如若不早期拔出,可能需要给患者进行镇静治疗,增加患者监护室时间,不利于患者术后恢复;还可能会诱发心血管相关疾病恶性发展。采用THRIVE技术进行颌面部手术术后通气,可以使患者更加舒适,同时也保障患者的生命体征平稳。并且,THRIVE用于短时非插管全麻手术不仅能保障患者的通气氧合,也避免了患者气管插管对呼吸道的损伤。同时调整麻醉药物使用,减少患者麻醉药物的用量。
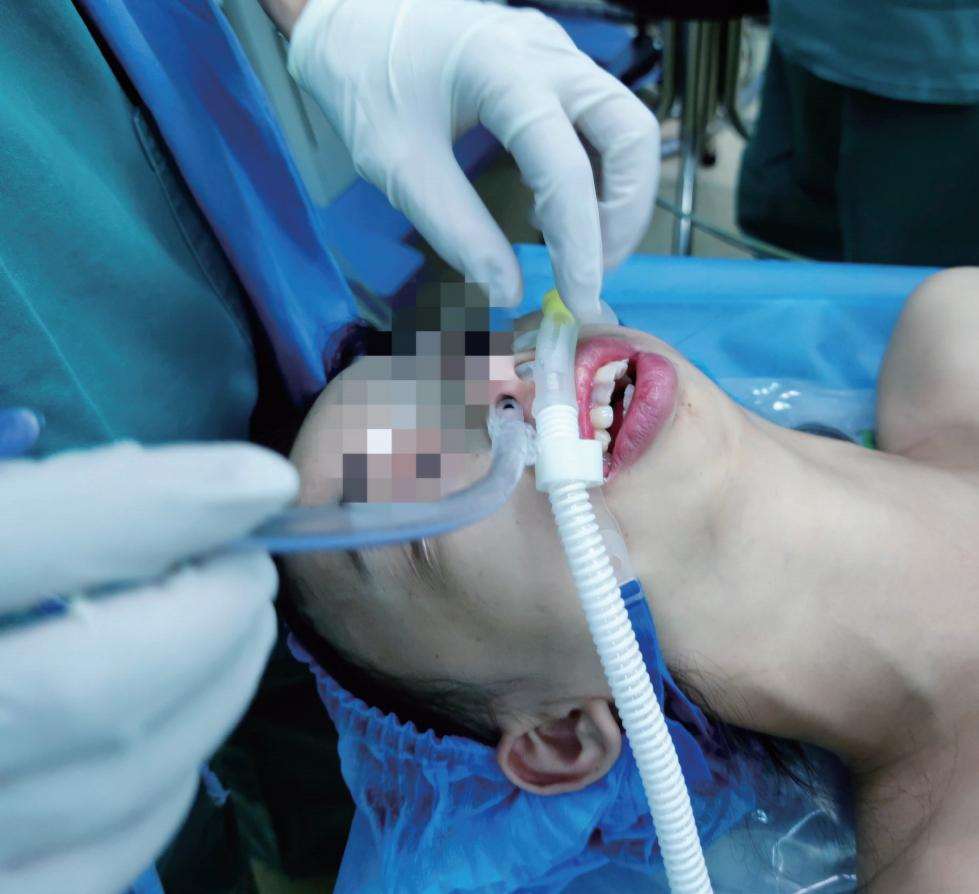
图2-4-3 THRIVE通气下困难气道患者麻醉诱导
镇静深度决定了是否在镇静麻醉中建立可靠的人工气道。对患者是否最有利、治疗持续时间长短、对操作者的能力和并发症发生的担心,如出血、误吸等,也是考虑的相关因素。所以,在口腔门诊治疗中开展深度镇静应用之前,首先明确几个观点:维持上呼吸道通畅是镇静治疗的一个基本要素;镇静治疗中约近 60%的药物涉及使用辅助的气道保护工具;麻醉过深无一例外地将导致气道保护性反射(呛咳、吞咽等)丧失和呼吸暂停,且会发生于牙椅的常用体位(半仰卧位)。缺氧的发生是渐进的,后果非常严重,当缺氧变得明显(血氧饱和度< 85%)约再经历 20~40 s发展到危及生命的缺氧(血氧饱和度< 50%),如果仍没有建立有效的人工气道将非常危险。当合并呼吸道异常解剖(如先天性异常、肿瘤、创伤等)、氧的储备能力降低(如怀孕、肥胖、合并肺部疾病等)、增加氧气消耗(如妊娠等)或循环功能不全时,缺氧的速度和程度会更快速。所以我们建议在施行深度镇静(麻醉)下的口腔治疗时,一定要有可靠的呼吸道隔离(保护)措施,防止由于药物的呼吸抑制作用或呼吸道梗阻(血液、治疗物品等)造成的严重呼吸道事件导致镇静失败乃至严重并发症。
1.笑气/氧气吸入在口腔诊所应用广泛。可以减轻焦虑,甚至开放静脉通道前使用,为静脉镇静减轻术前焦虑。
2.皮质类固醇类药物(地塞米松、甲基强的松龙)减轻术后创伤性水肿,同时减少某些镇静药物释放的组胺。
3.组胺阻滞剂(苯海拉明)减少某些镇静药物引起的组胺增加,同时增加镇静作用。
1.笑气/氧气吸入静脉镇静辅助药物可以减少镇静药物使用剂量且提供氧气。
2.苯二氮䓬类药物(地西泮、咪达唑仑)是最有效的抗焦虑药物,通常和阿片类药物同时使用,可用于轻、中度镇静。
3.右美托咪定同时具有镇静、镇痛作用,易唤醒,可用于中度镇静。
4.阿片类药物(芬太尼、纳布啡等)主要用于镇痛。通常和苯二氮䓬类共同使用达到中度镇静。
5.静脉麻醉药物(氯胺酮、丙泊酚)在特别疼痛或者复杂的手术时增加患者镇静深度(如局麻药注射时),或者当镇静药物复合镇痛药物无法满足手术需要时使用麻醉药物,可用于深度镇静。丙泊酚血浆靶浓度控制输注法镇静深度可调控、灵活度大,能满足绝大多数口腔治疗镇静的要求。
1. 人工给药(手动推注)人工给药是最常见的给药方式,简单、便捷,根据患者自身情况(年龄、体重等数据)计算给药量,但可能因一次性注入大量药物造成一过性的高血药浓度导致呼吸抑制、低血压等不良反应,并且人工给药与医师自身的临床经验有很大关系。同时,若手术时间过长或镇静效果不佳,可能需要反复多次推注药物而致不良反应增加及苏醒延迟。
2. 恒速泵注 能解决人工给药的缺点,减少不良反应的发生,但达到稳定的血浆浓度时间长,且无法估计血药浓度做到个体化镇静,随时间延长药物容易蓄积,镇静效果和麻醉医师的经验有关。
3. 药物靶浓度控制输注 简称靶控输注(Target Controlled Infusion,TCI),是指在输注静脉麻醉药时,以药代动力学和药效动力学原理为基础,经计算机计算控制通过调节目标或靶位(血浆或效应室)的药物浓度来控制或维持适当的麻醉深度,以满足临床麻醉的一种静脉给药方法。靶控目标分血浆靶控输注和效应室靶控输注(图2-4-4)。与上述的输注方式相比,优点在于操作简便,易于控制血浆浓度以到达理想的镇静深度,使镇静过程平稳,不良反应少。通常情况下靶浓度维持在 0.8~1.5 μg /mL时即可获得理想的镇静效果且不良反应少。
口腔治疗时的舒适度是患者和医师关注的重点,丰富的镇静手段给了医师和患者多种选择来实现治疗的舒适化。笑气是口腔科治疗镇静的首选,静脉镇静技术则是一个很好的补充;且对于笑气效果不佳,时间较长的治疗如多颗牙种植、复杂牙体牙髓治疗、特殊患者口腔治疗等,静脉镇静技术则是更优选择。
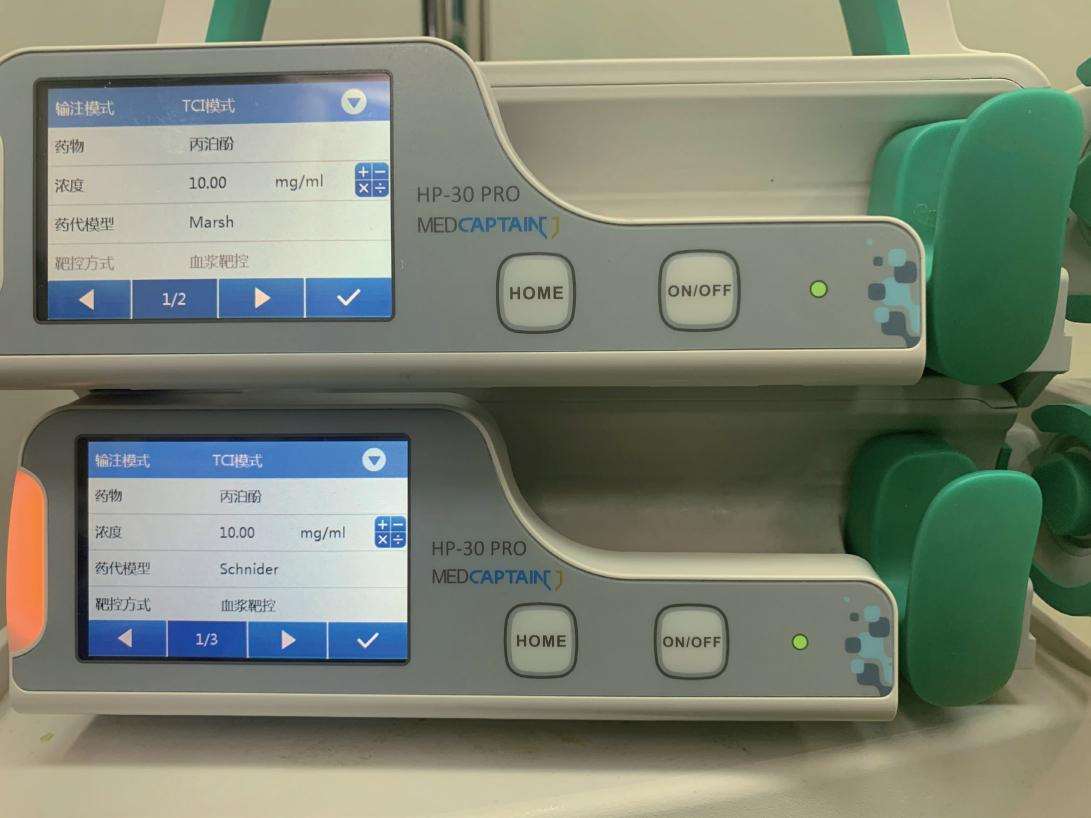
图2-4-4 TCI微量泵
实施深度镇静/麻醉下口腔治疗需要团队合作,良好的术前评估和准备、成熟及标准化的镇静方案都十分重要,不能完全依靠应急预案和补救。原则上实施镇静可以在任何地方执行,如医院、外科中心、口腔门诊等。但在非医院的地方(如私人口腔诊所)深度镇静发生不良事件时抢救失败的几率更高,因为可能缺乏立刻有效的支持。医护人员需熟练掌握各种技能,包括抢救窒息、喉痉挛或气道梗阻,有能力开放气道、吸引分泌物、提供持续正压通气、熟练使用简易呼吸器,有能力插入口咽通气道、鼻咽通气道或喉罩通气道,甚至气管插管。这些技能熟练掌握的最好方法是针对偶发事件经常练习、团队训练。对于安全镇静和成功抢救患者来说,有能力管理气道是预防不良事件发生的根本。
1. 设置深度镇静/麻醉室、观察室,患者离院前意识恢复到镇静前水平并有相应的离院标准。
2. 得到足够的训练和具备经验的医师进行气道管理;配备一名麻醉护士。
3. 准备与年龄、尺寸相符的气道管理设备和静脉通道;合适的药物和拮抗药。
4. 为了保证患者诊疗时的镇静安全,应当在有监护的情况下使用镇静药,整个诊疗镇静期间进行生命体征监测。
5. 完善的抢救应急流程。
1. 对于那些给予镇静药后会增加危险的潜在的药物,镇静前应仔细评估。
2. 扁桃体大或气道结构异常可能增加气道梗阻风险的患者应仔细进行检查。
3. 既往史及家族史(包含既往所有镇静/全麻史)。
4. 服用药物史及过敏史:熟知药物的药代动力学和药效动力学以及药物间的相互作用。
5. 体格检查:着重对心脏、肺脏、肝肾、血液系统等重要脏器的评估。
6. 辅助检查:血常规、尿常规、肝肾功、凝血时间、心功能等。
7. 告知围麻醉期流程;患者/家属了解应该做什么准备,配合什么,医生要做什么。
1.实施ASA禁饮禁食指南,如表2-4-2 所示。
表2-4-2 ASA禁饮食指南

续表
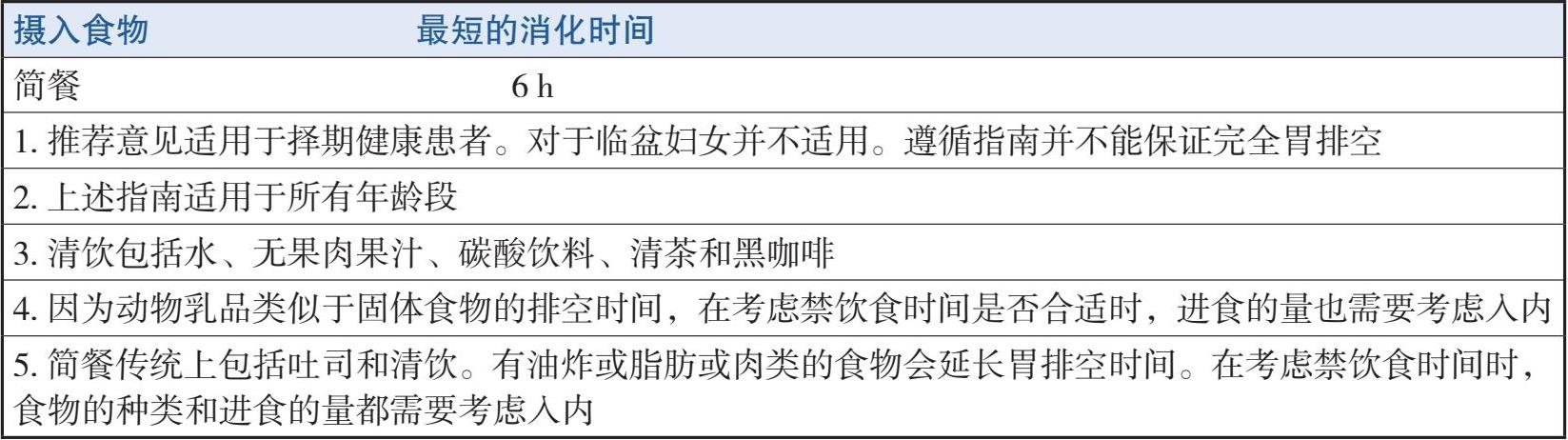
2.实施急诊治疗,是否禁食取决于手术的紧迫性及镇静深度。
对于门诊镇静治疗,术前是否用药取决于目标镇静程度、病情严重程度、手术时间、术前疾病等。术前用药可经口服、舌下、静脉等途径给予,常用麻醉前药物如咪达唑仑(0.02~0.08 mg/kg口服);直肠给药的方式在国内少有应用;其他途径给药相对不易实施。
对于焦虑、治疗时间较短的体重较轻(< 50 kg)患者,通常采用咪达唑仑0.02~0.04 mg/kg静脉注射,密切关注患者的生命体征,待下颌松弛,双频脑电图(Bispect Ral Index,BIS)值维持在 60~80左右为理想的麻醉诱导。治疗时间较长、BMI> 25的患者,待开放静脉通道后,在靶控泵控制板面上输入注射器型号、年龄、体重等基本数据后,选择丙泊酚注输模式,设定丙泊酚靶TCI浓度(1.0~2.0 μg /mL)。
口腔治疗完成后,需仔细检查有无出血,清点口腔内是否有残留物,牙齿治疗是否达到预定效果及补料是否脱落;残留液体清理干净、取出填塞的纱布;继续给予吸氧,同时要密切观察呼吸道是否通畅,皮肤、黏膜色泽是否红润,通气量是否足够,脉搏氧饱和度是否正常,血压、脉搏是否平稳等。为了防止患者在苏醒期间发生意外事件,有必要加强对苏醒期的观察。
患者由家属陪同,在留观室监测生命体征,一般观察 0.5~2 h,若患者达到离院标准,可经麻醉医生同意后离院。离院 6 h及术后第一天,由医护人员电话随访并记录。
(冉龙宽 赵 楠)
1.Lin CS,Wu SY,Yi CA. Association between anxiety and pain in dental treatment: a systematic review and meta-analysis[J]. J Dent Res,2017,96(2):153-162.
2.Talo Yildirim T,Dundar S,Bozoglan A,et al. Is there a relation between dental anxiety,fear and general psychological status?[J]. PeerJ,2017,5: e2978.
3. 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告 2019 概要[J].中国循环杂志,2020,35(9):833-854.
4. No authors listed. Practice guidelines for moderate procedural sedation and analgesia 2018:a report by the American Society of Anesthesiologists Task Force on Moderate Procedural Sedation and Analgesia,the American Association of Oral and Maxillofacial Surgeons,American College of Radiology,American Dental Association,American Society of Dentist Anesthesiologists,and Society of Interventional Radiology[J]. Anesthesiology,2018,128(3):437-479.
5. Moore PA,Hersh EV,Papas AS,et al. Pharmacokinetics of lidocaine with epinephrine following local anesthesia reversal with phentolamine mesylate[J]. Anesth Prog,2008,55(2):40-48.
6. Becker DE,Reed KL. Local anesthetics: review of pharmacological considerations[J]. Anesth Prog,2012,59(2):90-102.
7. American Dental Association and American Heart Association. Management of dental problems in patients with cardiovascular disease: report of a working conference jointly sponsored by the American Dental Association and American Heart Association[J]. J Am Dent Assoc,1964,68: 333-342.
8. Spence JM. Use of epinephrine in connection with procaine in dental procedures[J]. J Am Dent Assoc,1955,50(1):108.
9. Fukayama H,Yoshikawa F,Kohase H,et al. Efficay of anterior and middle superior alveolar(AMSA)anesthesia using a new injection system,the Wand[J]. Quint Int,2003,34(7):573-541.
10. Malamed SF. The periodontal ligament(PDL)injection: an alternative to inferior alveolar nerve block[J]. Oral Surg Oral Med Oral Pathol,1982,53(2):117-121.
11. Malamed SF. Handbook of local anesthesia,ed 4[M]. St Louis: Mosby,1997.
12. Haas DA. An update on local anesthetics in dentistry[J]. J Can Dent Assoc,2002,68(9):546-51.
13. Quinn CL. Iniection techniques to anesthetize the difficult tooth[J]. J Calif Dent Assoc,1998,26(9):665-667.
14. Hass DA,Lennon D. A 21 year retrospective study of reports of paresthesia following locla anesthetic administration[J]. J Can Dent Assoc,1995,61(4):319-320.
15. Hass DA,Lennon D. Local anesthetic use by dentists in Ontario[J]. J Can Dent Assoc,1995,61(4):297-304.
16. Himel VT,Mohamed S,Luebke RG. Case report: relief of limited jaw opening due to muscle spasm[J]. LDA J,1988,47(1):6-7.
17.Feldman HS,Arthur GR,Pitkanen M,et al. Treatment of acute systemic toxicity after the rapid intravenous injection of ropivacaine and bupivacain in the conscious dog[J]. Anaesth Analg,1991,73(4):373-384.
18. 中国加速康复外科专家组.中国加速康复外科围手术期管理专家共识(2016)[J].中华外科杂志,2016,54(6):413-416.
19. American Academy of Pediatric Dentistry.. Guideline on use of nitrous oxide for pediatric dental patients[J]. Pediatr Dent,2013,35(5):E174-E178.
20. European Society of Anaesthesiology task force on use of nitrous oxide in clinical anaesthetic practice. The current place of nitrous oxide in clinical practice. An expert opinion-based task force consensus statement of the European Society of Anaesthesiology[J]. Eur J Anaesthesiol,2015,32(8):517-520.
21. Shin S,Kim S. Dental treatment in patients with severe gag reflex using propofol-remifentanil intravenous sedation[J]. J Dent Anesth Pain Med,2017,17(1):65-69.
22. Togawa E,Hanamoto H,Maegawa H,et al. Dexmedetomidine and Midazolam Sedation Reduces Unexpected Patient Movement During Dental Surgery Compared With Propofol and Midazolam Sedation[J]. J Oral Maxillofac Surg,2019,77(1):29-41.
23. Conway A,Rolley J,Sutherland JR. Midazolam for sedation before procedures[J]. Cochrane Database Syst Rev,2016(5):CD009491. doi: 10.
24. Edgin WA,Ford ML,Mansfield MJ. Alfentanil for general anesthesia in oral and maxillofacial surgery[J]. J Oral Maxillofac Surg. 1989,47(10):1039-1042.
25. Gustafsson IM,Lodenius Å,Tunelli J,et al. Apnoeic oxygenation in adults under general anaesthesia using Transnasal Humidified Rapid-Insufflation Ventilatory Exchange(THRIVE)–a physiological study[J]. British Journal of Anaesthesia,2017,118(4):610-617.
26. Riva T,Pedersen TH,Seiler S,et al. Transnasal humidified rapid insufflation ventilatory exchange for oxygenation of children during apnoea: a prospective randomised controlled trial[J]. Br J Anaesth,2018,120(3):592-599.
27. Patel A,Nouraei SAR. Transnasal Humidified Rapid-Insufflation Ventilatory Exchange(THRIVE):a physiological method of increasing apnoea time in patients with difficult airways[J].Anaesthesia,2015,70(3):323-329.
28. Gustafsson IM,Lodenius Å,Tunelli J,,et al. Apnoeic oxygenation in adults under general anaesthesia using Transnasal Humidified Rapid-Insufflation Ventilatory Exchange(THRIVE)-a physiological study[J]. Br J Anaesth. 2017. 118(4):610-617.
29. Shallik N,Karmakar A. Is it time for high flow nasal oxygen to be included in the difficult airway algorithm?[J]. Br J Anaesth,2018,121(2):511-512.
30. Hermez LA,Spence CJ,Payton MJ,et al. A physiological study to determine the mechanism of carbon dioxide clearance during apnoea when using transnasal humidified rapid insufflation ventilatory exchange(THRIVE)[J]. Anaesthesia,2019,74(4):441-449.
31. Huang L,Dharmawardana N,Badenoch A,et al. A review of the use of transnasal humidified rapid insufflation ventilatory exchange for patients undergoing surgery in the shared airway setting[J]. J Anesth,2020,34(1):134-143.
32. Zhao N,Deng F,Yu C. Anesthesia for pediatric day-case dental surgery: a study comparing the classic laryngeal mask airway with nasal trachea intubation[J]. J Craniofac Surg,2014,25(3):e245-e248.
33. Brimacombe J,Berry A. The laryngeal mask airway for dental surgery—a review[J]. Aust Dent J,1995,40(1):10-14.
34. Molloy ME,Buggy DJ,Scanlon P. Propofol or sevoflurane for laryngeal mask airway insertion[J].Can J Anaesth,1999,46(4):322-326.
35. Schwarz D,Beutner D,Gostian AO,et al. Skull base injury with extensive pneumocephalus after transnasal endotracheal intubation[J]. BMJ Case Rep,2015 : bcr2015211363.
36. Davies PR,Tighe SQ,Greenslade GL,et al. Laryngeal mask airway and tracheal tube insertion by unskilled personnel[J]. Lancet,1990,336(8721):977-979.