




(1)了解有机溶剂纯化的原理和方法。
(2)掌握分液漏斗的使用、干燥剂的使用、蒸馏操作及不饱和烃的检验等方法。
石油醚是常用的有机溶剂,为轻质石油产品,是低相对分子质量烃类(主要是戊烷、己烷和庚烷)的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右,通常将石油醚按沸程分为30~60℃、60~90℃、90~120℃等不同规格。
粗石油醚中含有少量不饱和烃,沸点与烷烃相近,用简单蒸馏的方法难以将其分离。若要将石油醚用作惰性有机溶剂使用时,则必须将其除去,通常是用浓硫酸和高锰酸钾将其除去。不饱和烃能与浓硫酸生成硫酸氢酯而溶于硫酸;也可被高锰酸钾氧化成羧基而溶于水。然后利用石油醚不溶于水和硫酸的性质,通过分液漏斗就可将其分开。
量取沸程为60~90℃的石油醚20mL,小心倒入50mL分液漏斗中,慢慢加入4mL浓硫酸,塞好顶塞,充分振摇分液漏斗后,静置分层,放出下层硫酸。上层石油醚再用4mL浓硫酸洗涤一次。取少量石油醚,逐滴加入1%高锰酸钾溶液。若观察到紫红色褪去,则仍需用浓硫酸洗涤,直至滴加高锰酸钾溶液紫红色不褪去。然后分别用15mL水洗涤石油醚两次。静置,彻底分尽水层,将石油醚倒入干燥的锥形瓶中,加入1.0~1.5g颗粒状的无水氯化钙,塞紧塞子,不时地振摇锥形瓶,干燥30min以上。
将干燥好的石油醚滤入50mL干燥的圆底烧瓶(或梨形烧瓶)中,热水浴加热进行蒸馏,控制加热温度,使馏出速度为1~2 滴/秒,观察并记录蒸馏过程中沸点的变化。量取全部馏出液的体积,计算收率。
(1)根据实验目的预习相关操作。
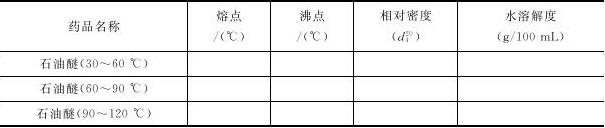
(2)请利用互联网查出下列主要药品的物理常数,并写到预习报告中。
有机化学实验中,液体有机化合物的处理常常要用到分液漏斗,分液漏斗的使用是有机化学实验中一项非常重要的基本操作。
图2-11 分液漏斗
分液漏斗分为球形、梨形和筒形等多种样式,如图2-11所示。但有机实验分液操作最常用的是梨形分液漏斗。分液漏斗的规格以容积大小表示,常用的有60mL、125mL 两种。
分液漏斗上的塞子要用橡皮筋与漏斗连在一起,防止旋塞掉地上摔碎。在使用前要将漏斗颈上的旋塞芯取出,涂上凡士林,插入塞槽内转动使油膜均匀透明,且转动自如(涂凡士林的作用有两个:一个是润滑,另一个是密封)。然后关闭旋塞,往漏斗内注水,检查旋塞处是否漏水,不漏水的分液漏斗方可使用。漏斗内加入的液体量不能超过容积的3/4。为防止有机液体的挥发,应盖上漏斗口上的塞子。放液时,漏斗口磨口塞上的凹槽应与漏斗口颈上的小孔对准,这时漏斗内外的空气相通,压强相等,漏斗里的液体就能顺利流出。分液漏斗不能加热。漏斗用后要洗涤干净。长时间不用的分液漏斗要把旋塞处擦拭干净,塞芯与塞槽之间放一纸条,以防磨砂处黏结。
分液漏斗使用的操作步骤:
(1)准备 选用比被分液体体积大一倍的分液漏斗,涂凡士林,检查分液漏斗的盖子和旋塞是否严密。
(2)加料 将被分液体由分液漏斗的上口倒入,塞好塞子。
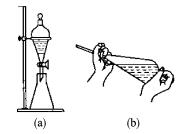
图2-12 分液漏斗的使用
(3)振荡 振荡分液漏斗,使两相液层充分接触。振荡时,用右手掌压紧盖子,左手用拇指、食指和中指握住活塞。把漏斗倒转过来振荡,如图2-12所示。
(4)放气 振荡过程中,要不时旋开活塞,放出易挥发物质的蒸气。这样反复操作几次,当产生的气体很少时,再剧烈振荡几次。
(5)静置将分液漏斗放在铁环中静置。静置的目的是使不稳定的乳浊液分层。一般情况需静置10min左右,较难分层者静置时间需更长些。
在分液过程中,特别是当溶液呈碱性时,常常会产生乳化现象,影响分离。破坏乳化的方法有:①较长时间静置;②轻轻地旋摇漏斗,加速分层;③若因两种溶剂(水与有机溶剂)部分互溶而发生乳化,可以加入少量电解质(如氯化钠),利用盐析作用加以破坏,若因两相密度差小发生乳化,也可以加入电解质,以增大水相的密度;④若因溶液呈碱性而产生乳化,常可加入少量的稀盐酸或采用过滤等方法消除。根据不同情况,还可以加入乙醇、磺化蓖麻油等消除乳化。
(6)分离 液体分成清晰的两层后,就可进行分离。分离液层时,下层液体应经旋塞放出,上层液体应从上口倒出。如果上层液体也从旋塞放出,则漏斗旋塞下面颈部所附着的残液就会把上层液体沾污。
(7)注意 进行分液操作时,一定要搞清楚要的是哪一层,别把有用的一层给扔掉了。
液体有机化合物的洗涤,通常是把洗涤液体加入分液漏斗中被洗涤的液体有机化合物中充分振摇。具体方法通常有下列几种:
(1)清水洗涤 清水洗涤主要是洗涤有机化合物中的水溶性杂质,如水溶性的无机物或有机盐等。
(2)饱和食盐水洗涤 饱和食盐水洗涤主要是利用盐析作用降低被洗涤有机化合物的溶解度,从而降低其在分液过程中的损失。
(3)饱和氯化钙溶液洗涤 饱和氯化钙溶液洗涤主要是洗涤液体有机化合物中包含的醇类、胺类等能与氯化钙生成配合物的杂质。显然饱和氯化钙溶液不能用于醇类、胺类等化合物的洗涤。
(4)浓硫酸洗涤 浓硫酸洗涤主要是洗涤液体有机化合物中包含的烯烃、醇类、醚类杂质。烯烃化合物可以跟浓硫酸生成硫酸氢酯溶于浓硫酸,醇类、醚类化合物可以跟浓硫酸生成盐溶于硫酸。
(5)稀酸洗涤 稀酸(稀盐酸等)洗涤主要是洗涤液体有机化合物中包含的碱性杂质。
(6)稀碱洗涤 稀碱(稀碳酸钠等)洗涤主要是洗涤液体有机化合物中包含的酸性杂质。
有机化学实验中,为除去原料和粗产品中的少量水分,常需要干燥。干燥是指除去固体、液体或气体内少量水分的操作,是有机化学实验室中既普通又重要的一项操作。
干燥方法可分为物理方法和化学方法两种。物理方法有吸附、共沸蒸馏、分馏、冷冻干燥、加热和真空干燥等。化学方法按去水作用的方式又可分为两类:一类与水能可逆地结合生成水合物,如氯化钙、硫酸钠等;一类与水会发生剧烈的化学反应,如金属钠、五氧化二磷等。
为了进行产率计算、结构表征、物理鉴定,固体产物中的水分和有机溶剂必须除尽。
(1)晾干 将待干燥的固体放在表面皿上或培养皿中,尽量平铺成一薄层,再用滤纸或培养皿覆盖上,以免灰尘沾污,然后在室温下放置直到干燥为止。这种方法适用于除去低沸点溶剂。
(2)红外灯干燥 热稳定性好又不易升华的固体中如含有不易挥发的溶剂时,为了加速干燥,可用红外灯加热干燥。
(3)烘箱烘干 烘箱用来干燥无腐蚀、无挥发性、加热不分解的物质。严禁将易燃、易爆物放在烘箱内烘烤,以免发生危险。采用红外灯和烘箱干燥有机化合物,要慎之又慎,必须清楚地了解化合物的性质,特别是热稳定性,否则会造成有机化合物分解、氧化、转化等严重问题。
(4)真空加热干燥 对高温下易分解、聚合和变质以及加热时对氧气敏感的有机化合物,可采用专门的真空加热干燥箱进行干燥。将干燥物料放在真空条件下加热干燥,并利用真空泵进行抽气、抽湿,加快干燥速度。如果没有特别要求,尽量采用循环水真空泵而不用油泵进行抽湿。
(5)真空冷冻干燥 对于受热时不稳定物质,可利用特殊的真空冷冻干燥设备,在水的三相点以下,即在低温低压条件下,使物质中的水分冻结后升华而脱去。但是该方法设备昂贵、运行成本高,普通实验室很少采用。
从水溶液中分离出的液体有机物,常含有许多水分,如不干燥脱水,直接蒸馏将会增加前馏分造成损失,另外产品也可能与水形成共沸混合物而无法提纯,影响产品纯度。有机液体的干燥,一般是直接将干燥剂加入液体中,除去水分。干燥后的有机液体,需蒸馏纯化。
1.液体干燥剂的类型
液体干燥剂按脱水方式,可以分为三类:
(1)硅胶、分子筛等物理吸附干燥剂;
(2)氯化钙、硫酸镁、碳酸钾等通过可逆地与水结合,形成水合物而达到干燥目的。
(3)金属钠、P 2 O 5 、CaO等通过与水发生化学反应,生成新化合物而起到干燥除水的作用。
前两类干燥剂干燥的有机液体,蒸馏前必须滤除干燥剂,否则吸附或结合的水加热又会放出而影响干燥效果;第三类干燥剂在蒸馏时不用滤除。
2.常用干燥剂及选择原则
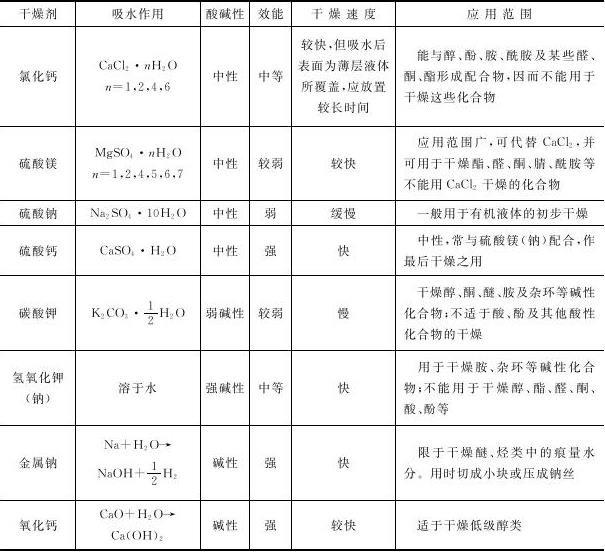
常用干燥剂的性能与应用范围如表2-6所示。
表2-6 常用干燥剂的性能与应用范围
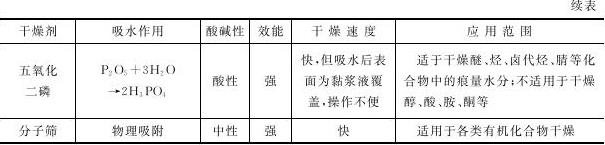
选用干燥剂的原则如下:
(1)干燥剂不能与待干燥的液体发生化学反应。例如,无水氯化钙与醇、胺类易形成配合物,因而不能用来干燥这两类化合物;碱性干燥剂不能干燥酸性有机化合物。
(2)干燥剂不能溶解于所干燥的液体。
(3)充分考虑干燥剂的干燥能力,即吸水容量、干燥效能和干燥速度。吸水容量是指单位质量干燥剂所吸收的水量,而干燥效能是指达到平衡时仍旧留在溶液中的水量。通常可先用吸水容量大的干燥剂除去大部分水分,然后再用干燥效能强的干燥剂。
3.液体干燥操作
加入干燥剂前必须尽可能将待干燥液体中的水分分离干净,不应有任何可见的水层及悬浮的水珠,并置于锥形瓶中。干燥剂研细为大小合适的颗粒(氯化钙通常要用块状的比较好,粉末状的氯化钙通常已被空气中的水饱和了)。干燥剂用量不能太多,否则将吸附液体,引起更大的损失。采取干燥剂分批少量加入,每次加入后必须不断旋摇观察一段时间,如此操作直到液体由混浊变澄清,干燥剂也不再黏附于瓶壁,振摇时可自由移动,说明水分已基本除去,此时再加入过量10%~20%的干燥剂,盖上瓶盖静置即可。静置干燥时间应根据液体量及含水情况而定,一般约需0.5h。
干燥时如出现下列情况,要进行相应处理:
(1)干燥剂互相黏结,附于器壁上,说明干燥剂用量过少,干燥不充分,需补加干燥剂。
(2)容器下面出现白色浑浊层,说明有机液体含水太多,干燥剂已大量溶于水,此时必须将水层分出后再加入新的干燥剂。
(3)黏稠液体的干燥,应先用溶剂稀释后再加干燥剂。
(4)未知物溶液的干燥,常用中性干燥剂干燥,如硫酸钠或硫酸镁。