





化学反应速率及其影响因素
任何一个化学反应都涉及两个方面的问题,一是化学反应进行的快慢问题,二是化学反应进行的程度问题。化学反应速率讨论的就是化学反应进行的快慢问题。各种化学反应的速率差别很大,有些反应进行得很快,如炸药的爆炸、酸碱中和反应等,有些反应进行得很慢,如常温下H 2 和O 2 生成H 2 O的反应,几乎看不出变化。消除汽车尾气的污染,可采用下列反应:

反应的可能性足够大,但反应速率不够快,不能在尾气管中完成,以致CO、NO散到大气中,造成污染。为此,可使用催化剂提高反应速率。
化学反应速率通常以单位时间内反应物浓度的减少或生成物浓度的增加来表示,符号为
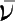 ,单位为mol·L
-1
·s
-1
,mol·L
-1
·min
-1
,mol·L
-1
·h
-1
等。对于反应mA+nB=pC+qD,在等容、等温条件下,化学反应速率
,单位为mol·L
-1
·s
-1
,mol·L
-1
·min
-1
,mol·L
-1
·h
-1
等。对于反应mA+nB=pC+qD,在等容、等温条件下,化学反应速率
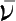 表示为:
表示为:

式中,Δc i 为物质i在时间间隔Δt内的浓度变化。当用反应物浓度变化表示化学反应速率时,要在式子前加一个负号。因为反应物浓度不断减少,Δc i <0,而化学反应速率为正值。如:
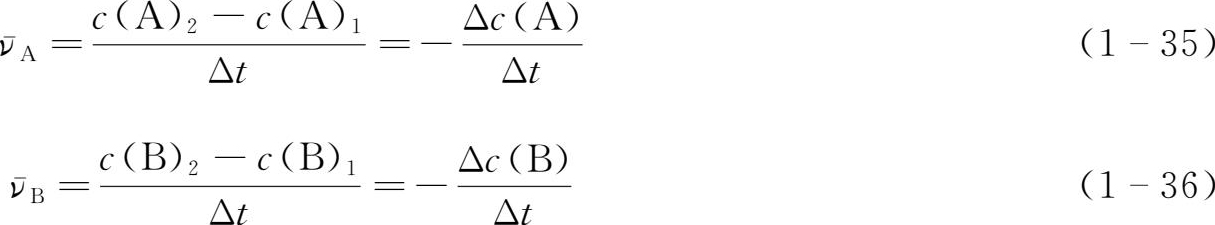
【 例1-14 】 在298 K时,热分解反应2N 2 O 5 →4NO 2 +O 2 中,各物质的浓度与反应时间的对应关系见表15。请用不同物质的浓度变化表示该化学反应在开始后300 s内的反应速率。
表1-5298 K时N 2 O 5 分解反应中各物质的浓度与反应时间的对应关系
【 解 】
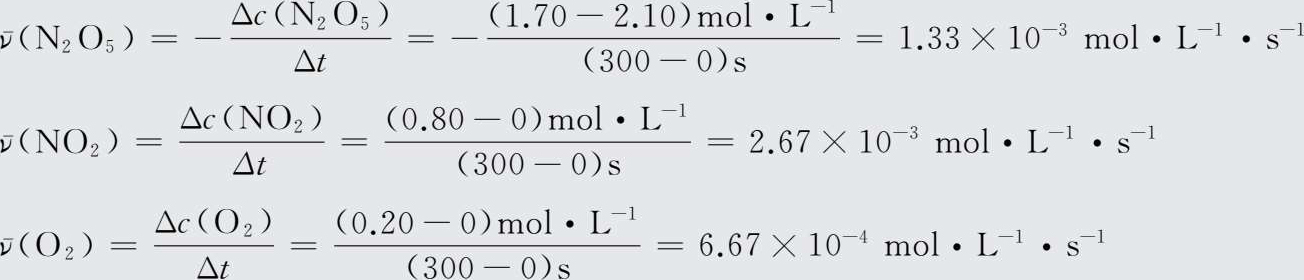
对同一反应来说,可以选用反应系统中任一物质的浓度变化表示该反应的化学反应速率。当以不同物质的浓度变化表示时,数值可能会不同,但其比值恰好等于反应方程式中各物质化学式前的计量系数之比,如例1-14中
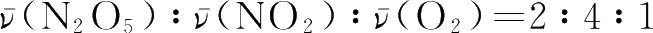 。因此,表示化学反应速率时必须指明具体物质。
。因此,表示化学反应速率时必须指明具体物质。
实际上,大部分化学反应都不是等速进行的。反应过程中,各组分的浓度和反应速率均随时间而变化。前面所表示的反应速率实际上是在一段时间间隔内的平均速率。在这段时间间隔内的每一时刻,反应速率是不同的。要确切地描述某一时刻的反应速率,必须使时间间隔尽量缩小,即当Δt趋于0时,反应速率就趋近于瞬时速率。
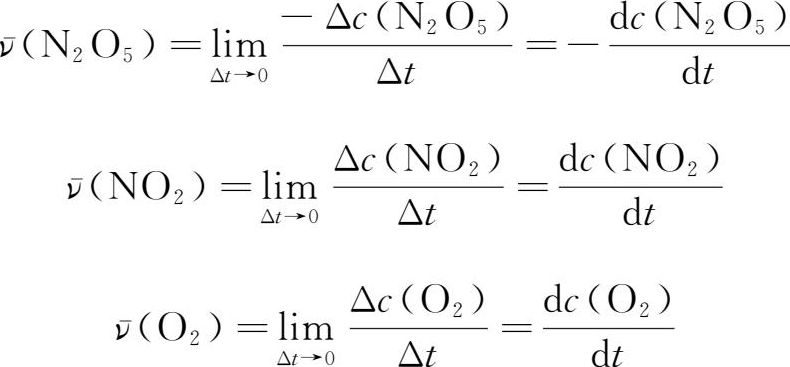
化学反应速率是通过实验测定的。首先测定浓度随时间变化的数据,以浓度为纵坐标,时间为横坐标作曲线,如图1-7所示。在曲线上任一点作切线,其斜率等于该点的瞬时速率,即斜率=dc/dt。
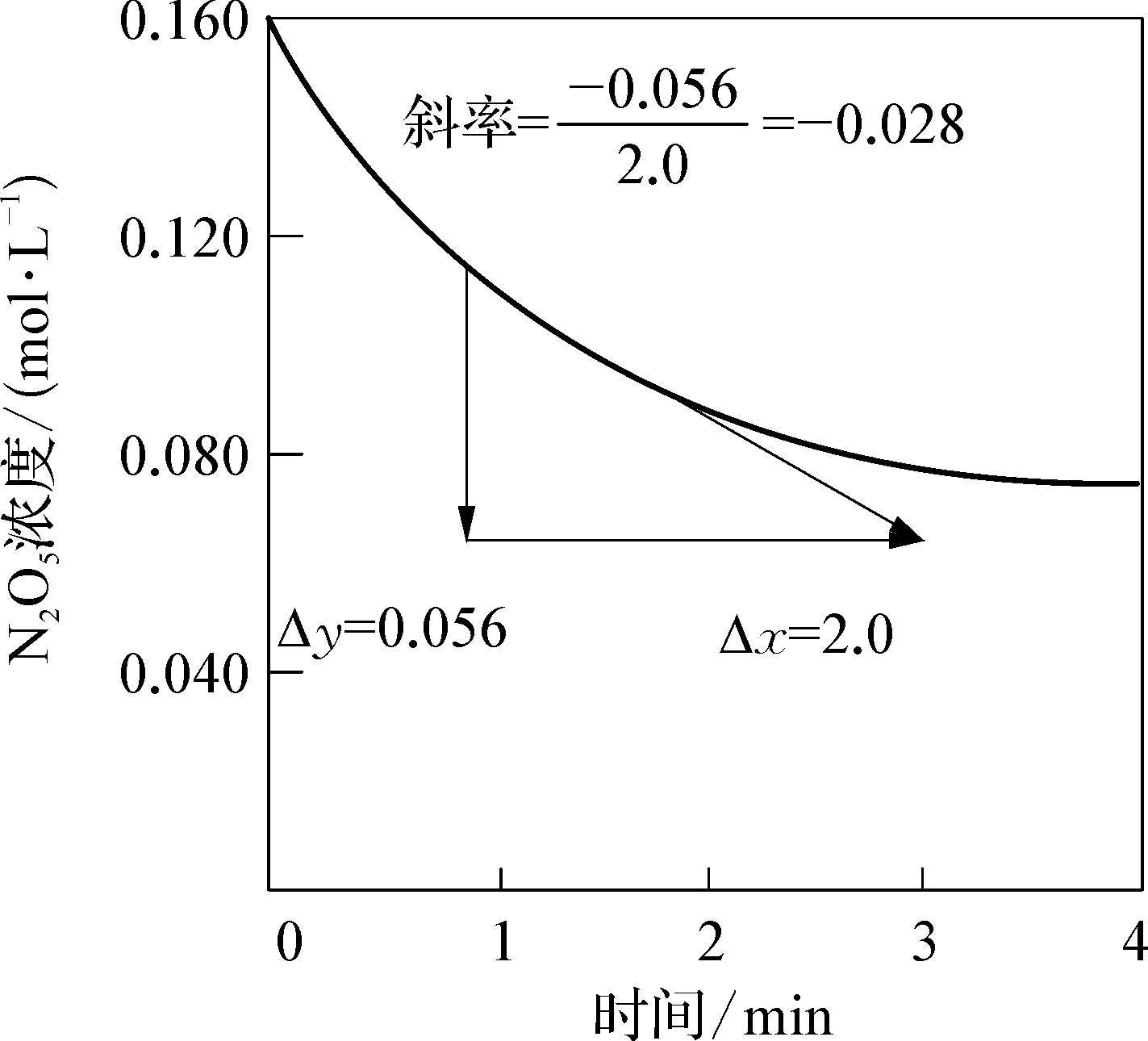
图1-7 N 2 O 5 浓度随时间变化示意图
如2.0 min时,曲线斜率为-0.028,则该时刻的反应速率为
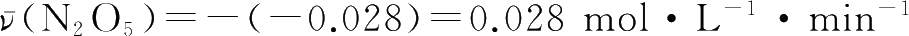 ,体系中各组分的浓度均随时间而变化,反应速率也在不断变化。前面所表示的反应速率实际上是在某一段时间间隔内的平均速率,而不是瞬时速率。瞬时速率是指Δt→0 时的反应速率,代表化学反应在某一时刻的实际速率。
,体系中各组分的浓度均随时间而变化,反应速率也在不断变化。前面所表示的反应速率实际上是在某一段时间间隔内的平均速率,而不是瞬时速率。瞬时速率是指Δt→0 时的反应速率,代表化学反应在某一时刻的实际速率。

化学反应进行的程度
反应进度是描述反应进行程度的物理量,用符号ξ表示。无论对于反应物还是产物,反应进度ξ都具有相同的数值,与反应方程式中物质的选择无关。ξ的量纲与物质的量n的量纲相同,其SI单位为mol。对于给定的任一反应:aA+bB=gG+dD

式中,B代表反应中任一物质的化学式;ν B 为物质的化学计量数,为无量纲的量,对于反应物,其值为负,对于产物,其值为正;n B (x)和n B (0)分别表示反应进度为x和反应进度为零(即反应未开始)时反应中物质B的物质的量。对同一反应,如果书写方法不同,则物质B的化学计量数ν B 不同,其反应进度也就不同,所以,当涉及反应进度量ξ时,反应方程式应予以指明。用反应进度ξ来表示反应速率,则ν可定义为单位体积内反应进度随时间的变化率,即

式中,V为系统的体积。对任一化学反应方程式,有

化学反应之所以不同,一方面与外界因素有关,另一方面还与参加反应的物质本身性质有关。为解释化学反应的相关问题,科学家经过大量的研究探索,提出了化学反应的分子碰撞理论和过渡状态理论。
反应物之间要发生反应,首先它们的分子或离子要克服外层电子之间的排斥力而充分接近、互相碰撞,才能促使外层电子发生重排,即旧化学键削弱、断裂和新化学键重新形成,从而使反应物转化为产物。但反应物分子或离子之间的碰撞并非每一次都能发生反应。据此,1918年路易斯(Lewis)提出了著名的碰撞理论。
碰撞理论认为,反应物分子(或原子、离子)间的相互碰撞是反应进行的先决条件。但是反应物分子之间的每一次碰撞并不都能够发生反应。对大多数反应来说,只有少数或极少数分子的碰撞才能发生反应,能发生反应的碰撞称为有效碰撞。发生有效碰撞,必须具备以下两个条件。
(1)反应物分子必须具有足够的能量,即当反应物分子具有的能量超过某一定值时,反应物分子间的相互碰撞才有可能使化学反应发生,即旧的化学键断裂并形成新的键。碰撞理论把这些具有足够能量的分子称为活化分子。
(2)分子间相互碰撞时,必须具有合适的方向性。也就是说,并非所有的活化分子间的碰撞都可以发生反应。只有当活化分子以适当的方向相互碰撞后,反应才能发生。如水与一氧化碳的反应:

只有当高能量的CO(g)分子中的C原子与H 2 O(g)中的O原子迎头相碰才有可能发生反应,见图1-8。
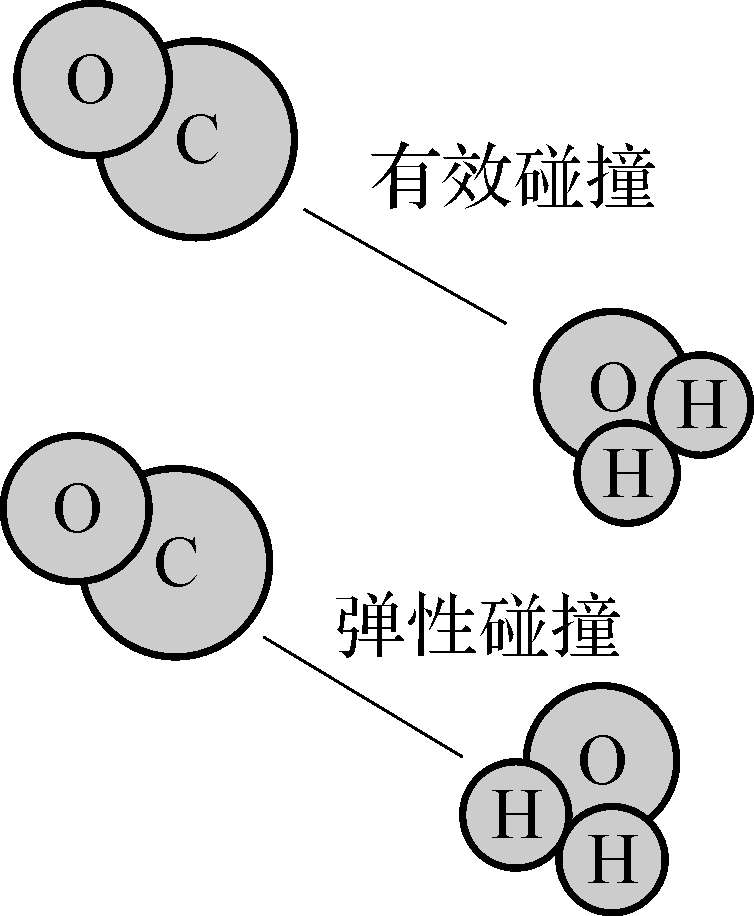
图1-8 有效碰撞、弹性碰撞示意图
分子碰撞理论比较直观形象地解释了简单分子间的反应,但是它不能说明反应过程及反应过程中能量的变化。
过渡状态理论认为,化学反应不只是通过反应物分子之间简单碰撞就能完成的,当两个具有足够能量的分子相互接近并发生碰撞后,要经过一个高能量的中间过渡状态,即形成一种活化配合物,然后再分解为产物。例如,在化学反应NO 2 +CO→NO+CO 2 中,当NO 2 和CO的活化分子碰撞之后,就形成了一种活化配合物[ONOCO],如图1-9 所示。
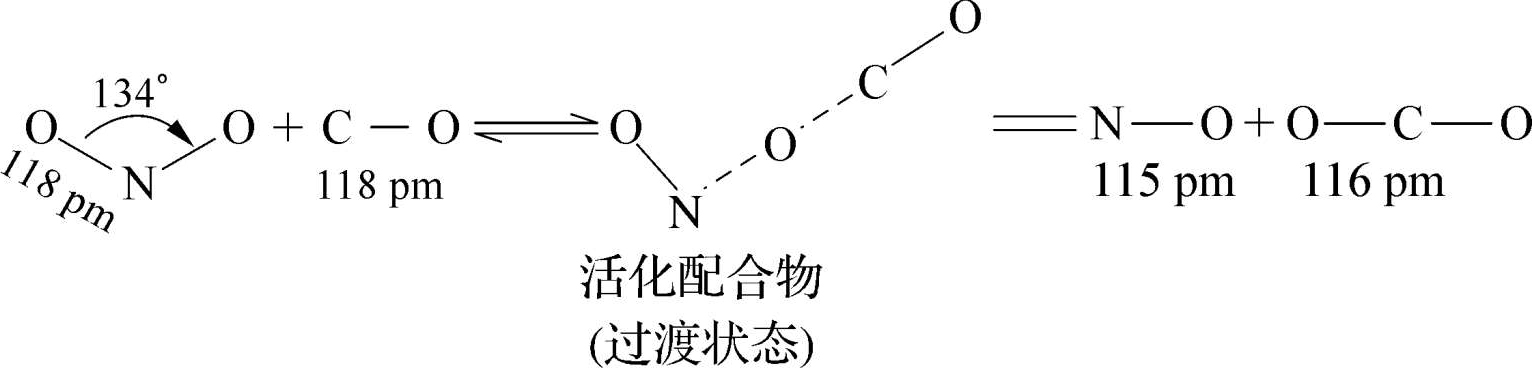
图1-9 NO 2 和CO的反应过程
在活化配合物中,原有化学键部分断裂,新的化学键部分形成,反应物NO 2 和CO的动能暂时转变为活化配合物[ONOCO]的势能,所以活化配合物[ONOCO]很不稳定。它既可以分解成反应物NO 2 和CO,又可以分解成生成物NO和CO 2 。当该活化配合物中靠近C原子的那个N—O键完全断裂,新形成的C—O键进一步强化时,即形成了产物NO和CO 2 ,此时整个体系势能下降,反应完成。过程中的势能变化如图1-10 所示。
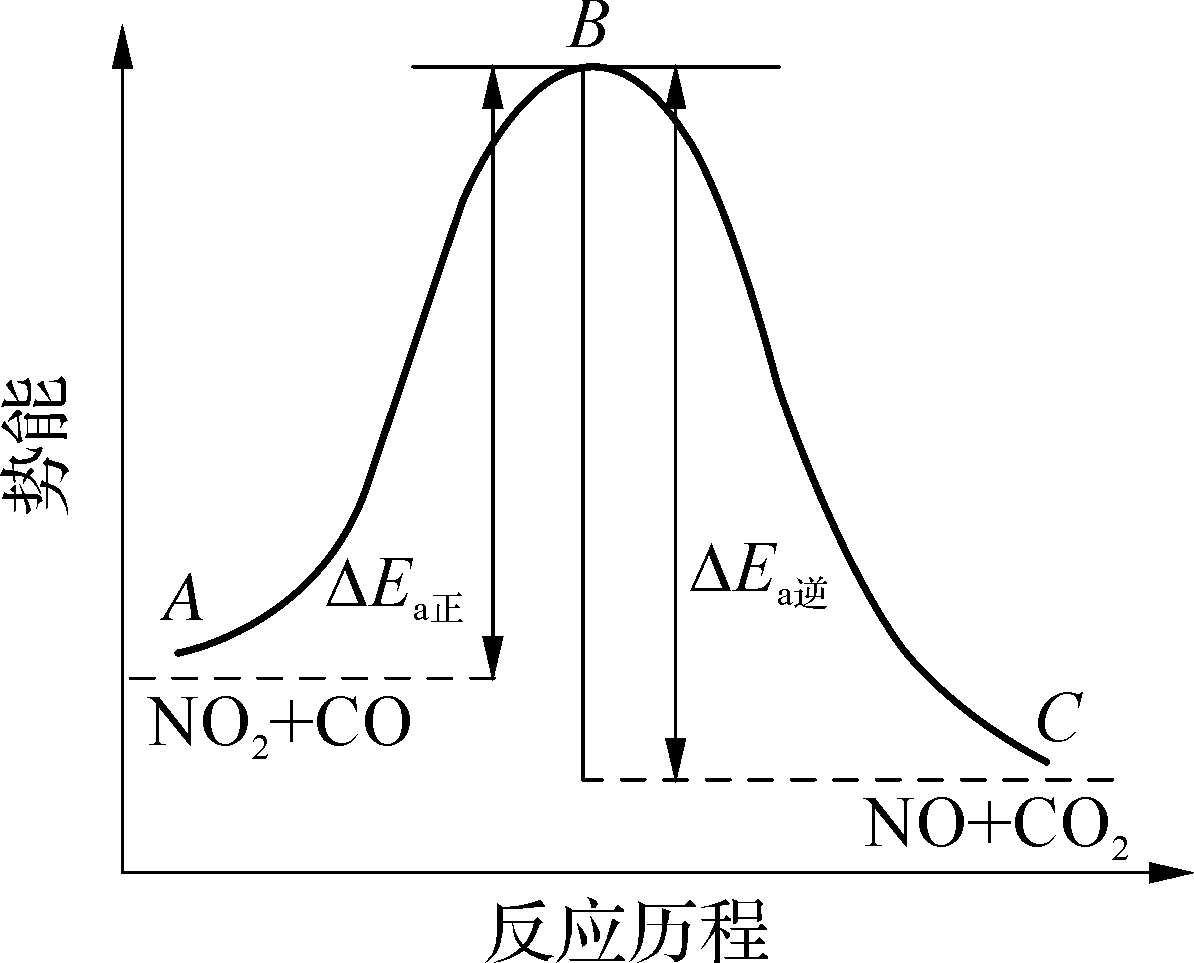
图1-10 反应过程中势能变化图
过渡状态理论中,活化能也是指使反应进行所必须克服的势能,活化配合物能量与反应物分子平均能量之差即为正反应的活化能。对于可逆反应,逆反应同样具有活化能,正、逆反应活化能的差值即为该反应的热效应。如果E a 正 >E a 逆 ,则正反应为吸热反应,逆反应为放热反应;E a 正 <E a 逆 ,则正反应为放热反应,逆反应为吸热反应。

反应速率常数与活化能的测定
具有较大的动能并能够发生有效碰撞的分子称为活化分子。活化分子具有的最低能量与反应物分子的平均能量之差,称为活化能,用符号E a 表示,单位为kJ·mol -1 。活化能与活化分子的概念,还可以从气体分子的能量分布规律加以说明。在一定温度下,分子具有一定的平均动能,但并非每一分子的动能都一样,由于碰撞等原因,分子间不断进行着能量的重新分配,每个分子的能量并不固定。但从统计的观点看,具有一定能量的分子数目是不随时间改变的。以分子的动能E为横坐标,以具有一定动能间隔(ΔE)的分子分数(ΔN/N)与能量间隔之比ΔN/(N·ΔE)为纵坐标作图,得到一定温度下气体分子能量分布曲线,见图1-11。
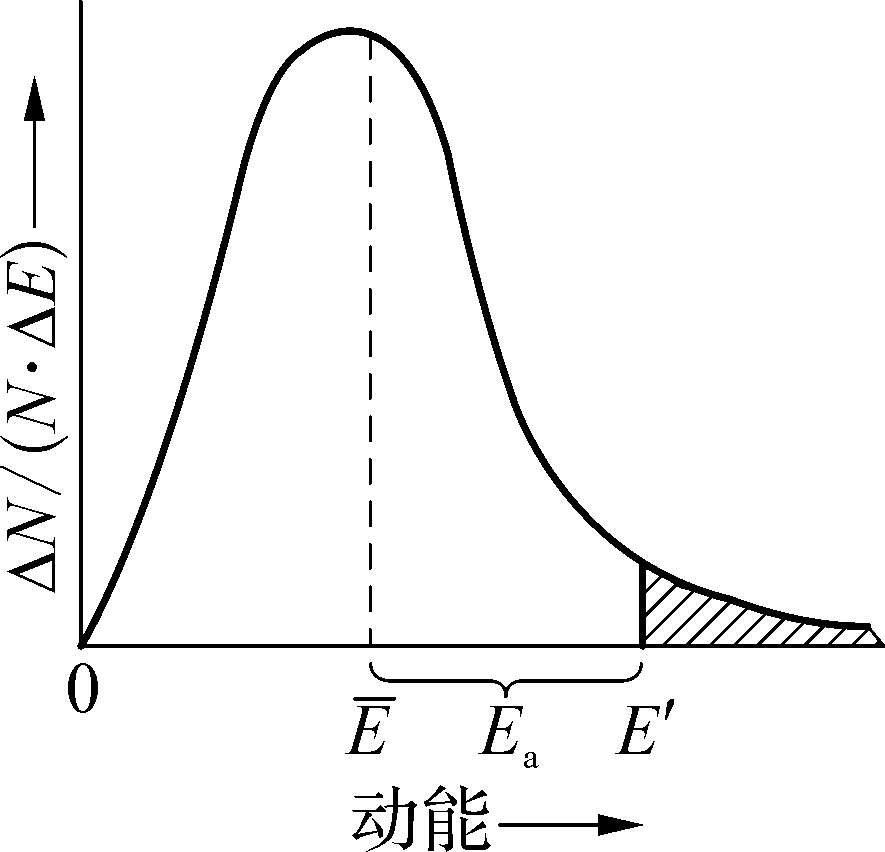
图1-11 气体分子的能量分布曲线
图中,
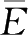 是分子的平均能量,
是分子的平均能量,
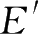 为活化分子所具有的最低能量,活化能
为活化分子所具有的最低能量,活化能
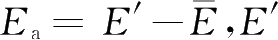 右边阴影部分的面积为活化分子在分子总数中所占的比值,即活化分子分数。一定温度下,活化能愈小,活化分子分数愈大,单位时间内有效碰撞的次数愈多,反应速率愈快;反之,活化能愈大,反应速率愈慢。因为不同的反应具有不同的活化能,所以不同的化学反应有不同的反应速率,活化能不同是化学反应速率不同的根本原因。
右边阴影部分的面积为活化分子在分子总数中所占的比值,即活化分子分数。一定温度下,活化能愈小,活化分子分数愈大,单位时间内有效碰撞的次数愈多,反应速率愈快;反之,活化能愈大,反应速率愈慢。因为不同的反应具有不同的活化能,所以不同的化学反应有不同的反应速率,活化能不同是化学反应速率不同的根本原因。
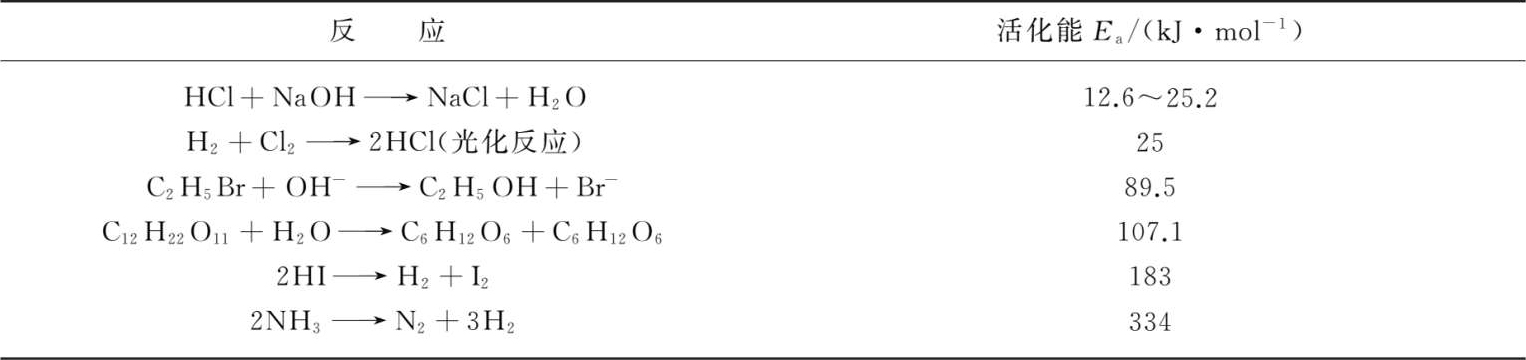
活化能一般为正值,许多化学反应的活化能与破坏一般化学键所需的能量相近,为40~400 kJ·mol -1 ,多数在60~250 kJ·mol -1 ,活化能小于40 kJ·mol -1 的化学反应,其反应速率极快,用一般方法难以测定;活化能大于400 kJ·mol -1 的反应,其反应速率极慢,难以察觉。表1-6 列出了一些反应的活化能。
表1-6 一些反应的活化能

影响反应速率的因素
化学反应速率的大小首先取决于反应物的本性,例如,氟和氢在低温、暗处即可发生爆炸反应,而氯和氢则需要光照或加热才能化合。对于给定的化学反应,其化学反应速率还与反应物的浓度(压力)、温度及催化剂等因素有关。
大量实验证明,在一定的温度下,化学反应速率与浓度有关,且反应物的浓度增大,反应速率加快。这是由于对于任意一个化学反应,温度一定时,反应物分子中活化分子的百分数是一定的,而活化分子的浓度正比于反应物分子的浓度,当反应物的浓度增加时,活化分子的浓度也相应增加,单位时间内反应物分子之间的有效碰撞次数也增加,所以反应速率加快。固体与纯液体的浓度是一个常数,所以增加这些物质的量不会影响反应速率,但固体物质的反应速率与其表面积大小有关。
化学反应中,一步就能完成的反应,称为基元反应。由两个或两个以上基元反应构成的化学反应,称为非基元反应或复杂反应。等温下,对于基元反应mA+nB=pC+qD,其反应速率和反应物浓度之间的关系表示为:

即在一定温度下,化学反应速率与各反应物浓度幂的乘积成正比(幂指数在数值上等于基元反应中反应物的计量系数),这个规律称为质量作用定律。式(1-40)是质量作用定律的数学表达式,也称为反应速率方程。式中,ν为该基元反应的瞬时速率,c(A)和c(B)为反应物A和B的瞬时浓度,k为速率常数。速率常数的大小与反应温度有关,不随反应物浓度而变化。
速率方程中,m和n称为反应级数。m、n分别为反应物A和B的级数,m+n为该反应的总级数。假如反应中m=1,n=2,则该反应的级数为3级。反应级数由实验测定。反应级数越大,反应速率越快。基元反应的级数可为零或正整数。
非基元反应是通过若干个连续的基元反应实现的。其反应速率取决于最慢的一个基元反应的速率,因此,最慢基元反应的速率方程代表了总反应的速率方程。显然,对于一个非基元反应,不能根据反应方程式直接书写速率方程,必须通过实验确定其反应级数后,才能写出速率方程。
【 例1-15 】 某气体反应为基元反应,A和B为反应物,测得其实验数据如表1-7:
表1-7 反应过程中A和B的浓度

求该反应的反应级数n,并写出反应的速率方程。
【 解 】 设该反应速率方程为ν=kc m (A)c n (B),由实验1和实验2可得:
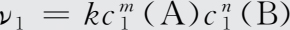
两式相除得
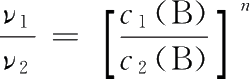
即
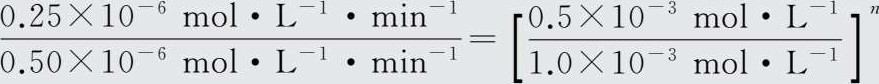
解得n=1。再由实验3和实验4得:
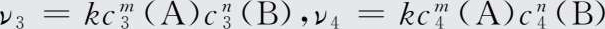
两式相除得
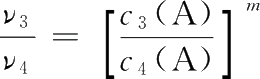
即
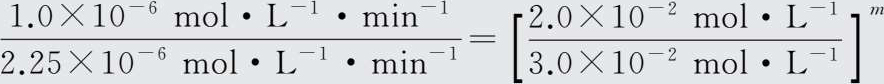
解得m=2。故该反应的速率方程为:
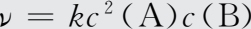
反应级数m +n =2+1=3
通过计算或测量知某一反应级数,找出对该反应速率影响大的反应物,通过改变此反应物浓度可以更有效地改变反应速率。质量作用定律有一定的使用条件和范围,使用时应注意以下几点。
(1)质量作用定律只适用于基元反应和构成非基元反应的各基元反应,不适用于非基元反应的总反应。
(2)稀溶液中的反应,若有溶剂参与,其浓度不写入反应速率方程。例如,蔗糖在稀溶液中的水解反应
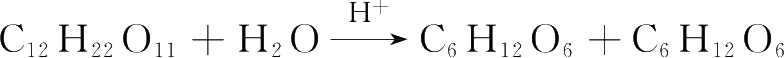 ,反应速率方程为
,反应速率方程为
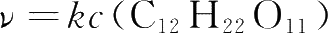 。
。
(3)有固体或纯液体参加的多相反应,若它们不溶于介质,则其浓度不写入反应速率方程,如煤燃烧反应C(s)+ O 2 (g)→CO 2 (g)的速率方程为ν=kc(O 2 )。
(4)气体的浓度可用分压代替,如煤燃烧反应的速率方程可写为ν=kp(O 2 )。

温度对化学反应速率的影响
温度对反应速率的影响要远大于反应物浓度对反应速率的影响。例如,H 2 与O 2 生成H 2 O的反应,常温下反应速率极小,几乎不发生,但当温度升高到873 K时,反应速率急剧增大,甚至发生爆炸。对于大多数化学反应来说,反应速率随反应温度的升高而加快。一般地,在反应物浓度恒定时,温度每升高10 K,化学反应速率增加2~4倍。温度升高反应速率加快的根本原因是温度升高,分子能量升高,活化分子百分数增加,有效碰撞机会增大,从而使反应速率加快。
温度升高反应速率加快在速率方程式上反映为反应速率常数增大。可从阿仑尼乌斯经验公式大致看出温度对反应速率常数的影响:

其对数式表示为

或

式中,k为速率常数;E a 为反应活化能,单位为kJ·mol -1 ;T为绝对温度,单位K;R为气体常数;A为指前因子,也称频率因子或碰撞因子。
速率常数k与温度有关。对于同一化学反应,温度越高,k值越大,反应速率越快。当化学反应的温度变化不大时,E a 和A可看作是常数。若反应在温度T 1 时的速率常数为k 1 ,在温度T 2 时的速率常数为k 2 ,则
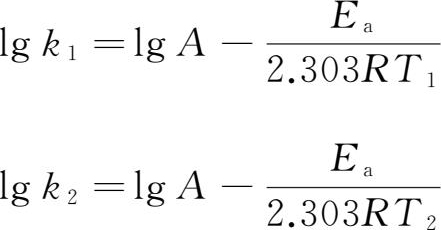
两式相减,得
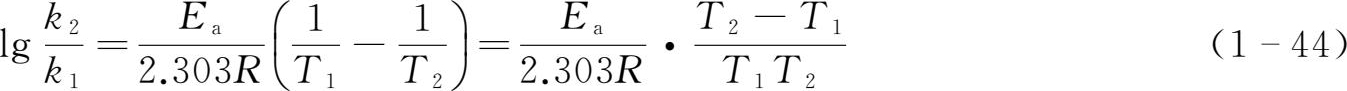
对于某反应,若已知其在温度T 1 时的速率常数k 1 ,在温度T 2 时的速率常数k 2 ,可由式(1-44),求得此反应在任一温度下的速率常数k。
【
例1-16
】 反应
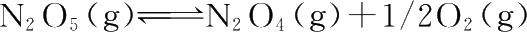 ,在298 K时速率常数k
1
=3.4×10
-5
s
-1
,在328 K时速率常数k
2
=1.5×10
-3
s
-1
,求反应的活化能和碰撞因子A。
,在298 K时速率常数k
1
=3.4×10
-5
s
-1
,在328 K时速率常数k
2
=1.5×10
-3
s
-1
,求反应的活化能和碰撞因子A。
【
解
】
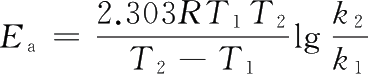 ,代入数据得:
,代入数据得:
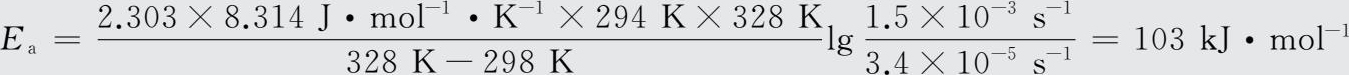
由公式lg k =lg A -E a /2.303RT,可得lg A =lg k+E a /2.303RT。
将T =298 K,k =3.4×10- 5 s -1 ,E a =103 kJ/mol代入式中
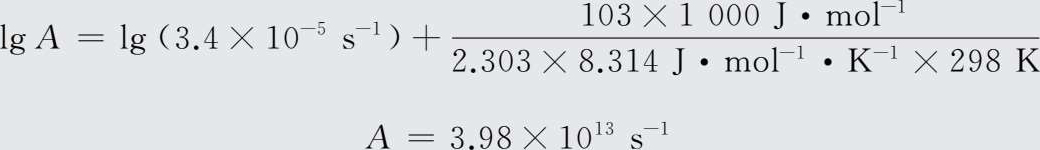

催化剂对化学反应速率的影响
常温下,混合在一起的氢气和氧气很难发生化学反应,但如果在该混合气体中加入少量细的铂粉,则会立即发生爆炸性反应并化合成水,铂粉是该反应的催化剂。在现代化工生产中,催化剂担负着重要角色。据统计,化工生产中80%以上的反应都采用了催化剂。例如,接触法生产硫酸的关键步骤是将SO 2 转化为SO 3 ,自从采用了V 2 O 5 作催化剂后,反应速率增加一亿六千万倍;甲苯为重要的化工原料,可从大量存在于石油中的甲基环己烷脱氢制得,但因该反应极慢,以致长时间不能用于工业生产,直到发现能显著加速反应的Cu、Ni催化剂后,它才有了工业化价值。
凡能加快反应速率的催化剂称为正催化剂,凡能减慢反应速率的催化剂称为负催化剂。一般提到催化剂,若不明确指出是负催化剂时,则是指正催化剂。催化剂对化学反应速率的影响称为催化作用。有催化剂存在的反应称为催化反应。
催化剂通过改变反应历程,降低了反应的活化能,使活化分子组的百分数增加,有效碰撞次数增多,从而大大提高反应速率。例如合成氨反应,无催化剂时反应的活化能为326.4 kJ·mol -1 ,加Fe作催化剂时,活化能降低至175.5 kJ·mol -1 。计算结果表明,在773 K时加入催化剂,正反应的速率增加到原来的1.57×10 10 倍。
在催化反应里,人们往往加入催化剂以外的另一物质,该物质自身不起催化作用,却能够增强催化剂的催化作用,这种物质称为助催化剂。助催化剂在化学工业上极为重要。例如,在合成氨的铁催化剂里加入少量的铝和钾的氧化物,可以大大提高催化剂的催化作用。
在化学反应中使用的催化剂有如下特点:
(1)催化剂是通过改变反应途径来改变反应速率的,它不能改变反应的焓变、方向。
(2)在可逆反应中,催化剂只能改变到达平衡的时间,但不能改变化学平衡常数,也不会使平衡发生移动。
(3)催化剂具有一定的选择性,主要表现在两个方面:一是不同的反应需要用不同的催化剂来催化,如氯酸钾分解制备氧气时加少量MnO 2 ,合成氨生产中用Fe作催化剂等;二是许多化学反应往往生成多种产物,筛选合适的催化剂可以使反应定向进行,以获得所要产物。
(4)某些物质会影响催化剂的催化效果。有时反应中的少量杂质会严重降低催化剂的活性,这种现象称为催化剂的中毒。如在接触法制备硫酸中,少量的AsH 3 就能使铂催化剂中毒。
(5)催化剂有活性温度,催化剂在一定温度范围内催化活性较高,超出这个温度范围会降低其活性,有时甚至会使催化剂报废。
催化剂不但在化学工业中有着十分重要的意义,在生命过程中,催化剂也起着重要作用,生物体中进行的各种化学反应,如食物的消化、细胞的合成等几乎都是在酶的催化作用下进行的。
以上讨论的主要是均相反应,对于多相反应来说,影响反应速率的因素还有接触面积大小、扩散速率和接触机会等。在化工生产中,常将大块固体加工成小块或磨成粉末,以增大接触面积;对于气液反应,液态物质可采用喷淋方式扩大与气态物质的接触面积;还可以将反应物进行搅拌、振荡、鼓风等以强化扩散作用。另外,超声波、紫外光、激光和高能射线等也会对某些化学反应的速率产生较大的影响。