




图4.16是上皮细胞的示意图。为了更合理地模拟药物在细胞质内的生物过程,细胞质内的药物有效浓度应该定义为游离型药物浓度 f u1 C 1 ① 。f u1 C 1 可能与顶端侧的药物浓度有很大的差异。图4.16显示对过程进行全数值积分,已广泛用于研究肠道细胞中的药代动力学。然而,通过应用稳态近似,净渗透率和f u1 C 1 可以简单地计算,无需数值积分。
① 本节中应用的参数的具体定义请见图4.16。
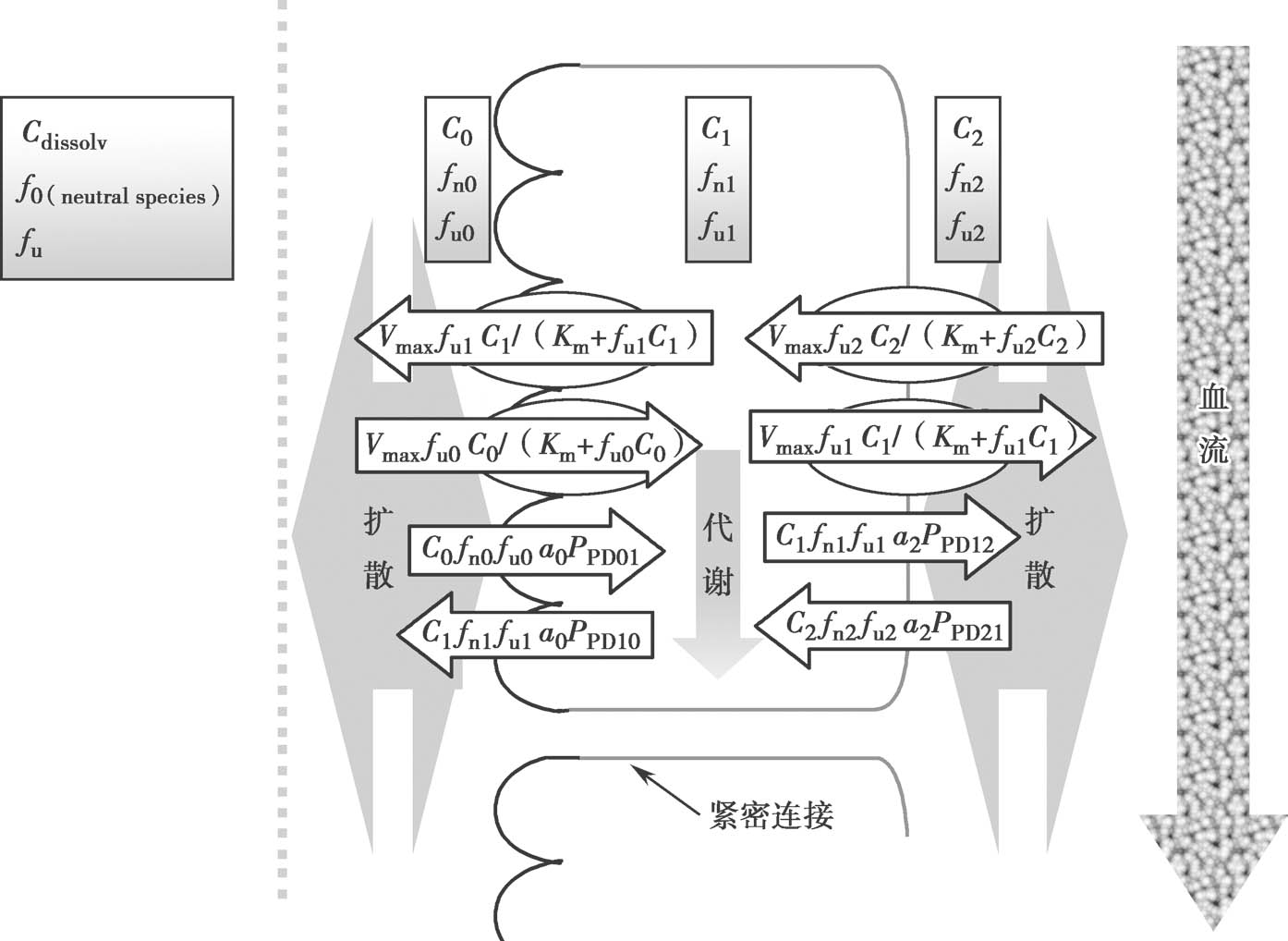
图4.16 肠上皮细胞架构图
在体外细胞膜渗透测定中,在短暂诱导后,接收池中的浓度随时间呈现线性增加,这意味着细胞质中的浓度在诱导后达到了稳定状态。在这个线性范围内,表观渗透率P app 可以用以下方程计算:

其中C donor 是给药池孔中溶解的药物浓度,A well 是孔的表面积,X acceptor 是接收池孔中的药物量。
在大多数情况下,采用稳态近似法是合适的,主要因为细胞质中的液体体积比肠液少得多 ① 。在下一节中,基于稳态近似方法,将讨论细胞模型的理论细节。
① 与给药池浓度变化的时间刻度相比,当细胞溶质中的稳态快速建立时,就可以用稳态近似来解析方程。即使当C dissolv 随时间变化,稳态近似也适用于每个时间点。在稳定状态下,给药池和细胞质中的浓度之比可近似为恒定。
通常,通过载体介导的渗透过程是会达到饱和的,而且底物是有特异性的,该过程也可以被抑制。载体介导的固有渗透率可以表示为:

其中,J max 是最大流量,K m 是米氏常数,C cm 是转运部位的有效浓度。K m 和C CM 定义一致。当C CM <<K m :

J max 与每个酶的表达水平成正比,为了校正体外和体内表达水平的差异,可用下面的方程表示:
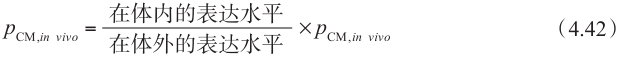
这种最简单的情况下,稳态下细胞质房室的质量平衡方程表达为:
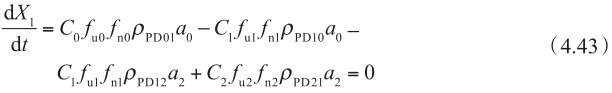
其中,fn=非离解型(不带电荷)药物的百分数;
fu=游离药物的百分数;
p=理想渗透率;
C=每个房室中溶解的药物的总浓度;
a=绝对的表面积;
X=每个房室中的药物量;
PD=被动扩散
0,1和2=图4.16中的房室。
这个方程基于两个假设:
1.只有游离的药物可以渗透过细胞膜(游离组分理论)。
2.只有非解离型的药物可以被动扩散进入膜(pH分配理论)
在稳定状态下,在每个时间点细胞质内的净质量平衡可以近似为零。基底侧C 2 药物浓度远小于顶端侧的药物浓度,可以忽略不计(C 2 =0)。通过重新整理方程4.43,C 1 f u1 可以表示为:
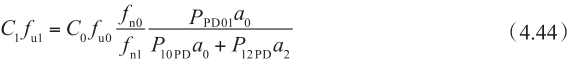
这个方程可以解释为细胞质中游离药物的浓度C 1 f u1 由以下四个因素决定:非解离型药物百分数在顶端侧和细胞室之比值f n0 /f n1 ,固有的被动渗透率,顶端侧游离药物分数f n0 ,表面积 P PD01 a 0 /( P PD10 a 0 + P PD12 a 2 )。f n0 /f n1 可以根据药物的p K a 和顶端侧及细胞质中pH计算得到。因此,稳态下,计算细胞质中游离药物的浓度并不需要知道细胞质游离药物的百分数 ① 。换句话说,游离的非解离型药物的浓度梯度仅仅决定了被动扩散过程。图4.17是依靠浓度梯度扩散穿过肠壁的示意图;图4.18显示了非离解型和解离型药物的浓度曲线。
① 这种情况与PK-PD理论相似,因此靶器官中细胞质内的药物浓度可以通过血浆中药物浓度和血浆游离药物百分数来计算(当不涉及载体介导的转运时)。
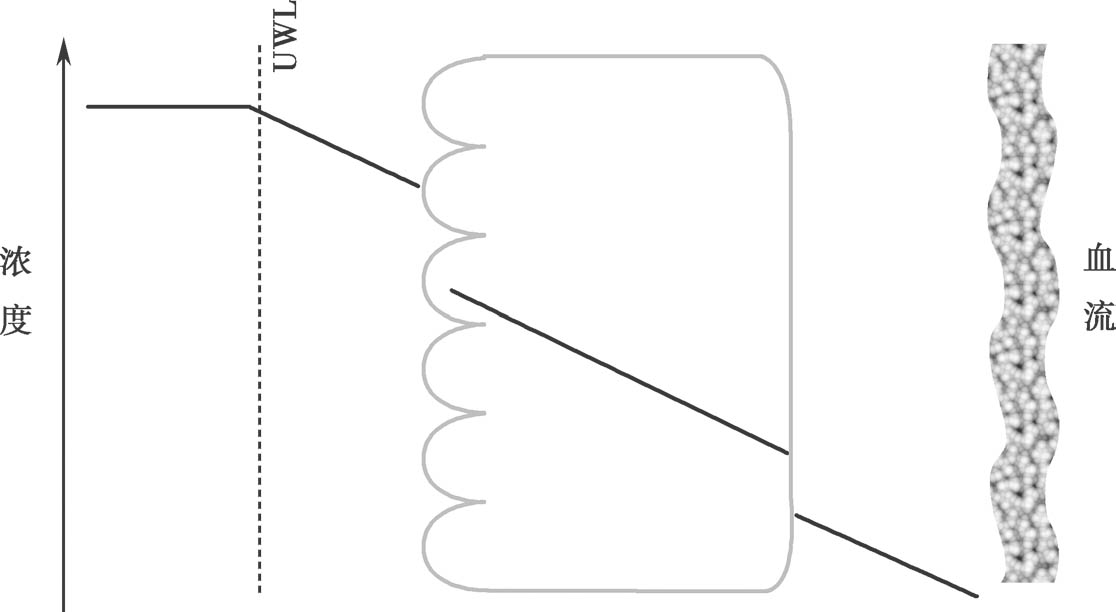
图4.17 跨越上皮细胞膜的浓度梯度示意图(粗线表示穿过肠壁的浓度梯度)
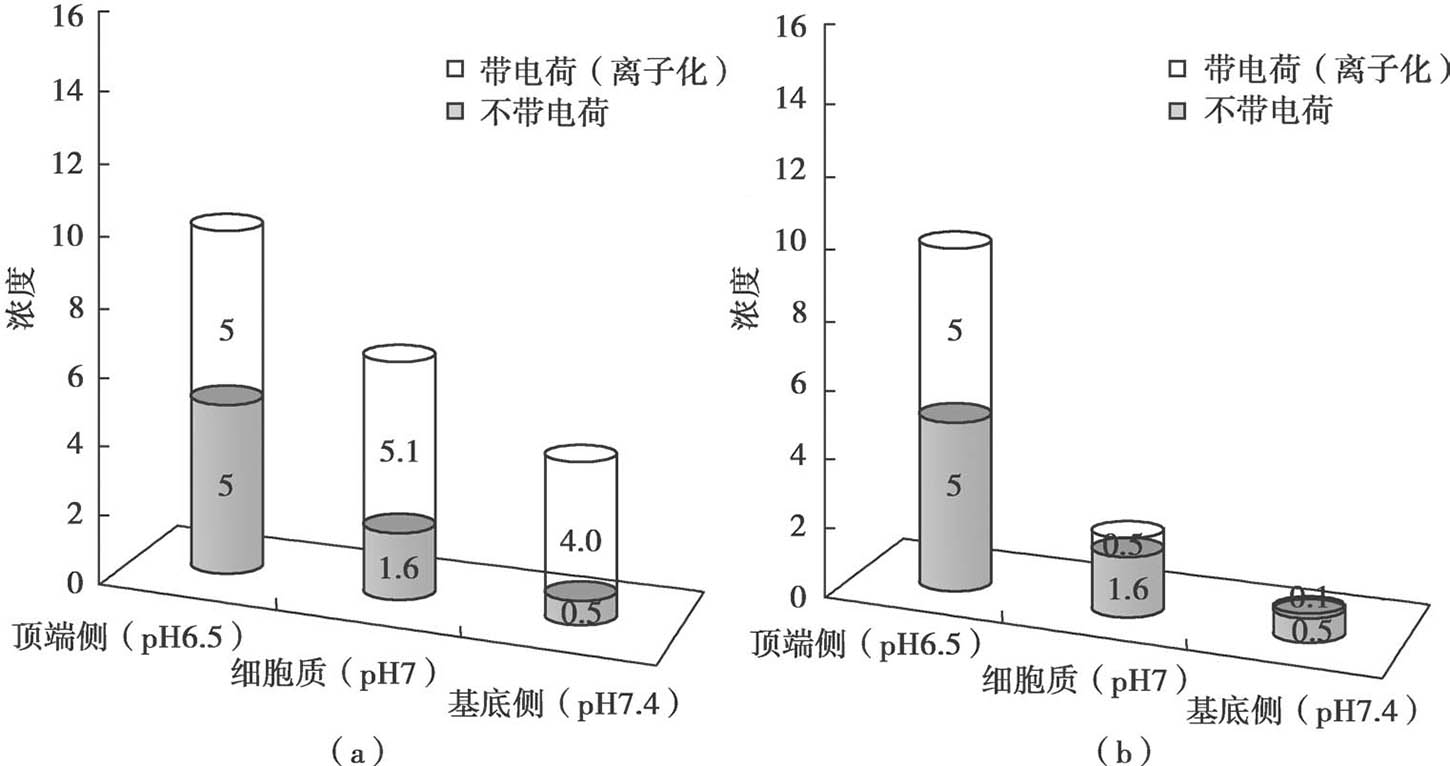
图4.18 上皮细胞中非离解型和带电物质的浓度,游离的非解离型药物的浓度梯度(灰色柱)仅决定被动渗透过程
(a)酸性药物的示意图(b)碱性药物的示意图(两者的p K a 均为6.5)。游离的非解离型药物分子浓度梯度决定被动渗透性
当被动渗透在流入和流出的方向是对称的,且顶端侧和基底侧上的流入和流出是相等的(即 P PD01 = P PD10 = P PD12 = P PD21 = P PD ) ① ,同时上皮细胞的表面积比为1∶3时,则方程4.44变成:
① 这一假设得到以下事实的支持:在不同pH时,顶端侧A到基底侧B和对应B到A的被动渗透率相同。
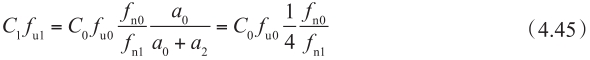
因此,当顶端侧pH与细胞质房室中pH相同(例如pH 7.4),或者药物是不可解离时,细胞质中的游离药物浓度C 1 f u1 是其在顶端侧的药物浓度C 0 f u0 的1/4。当pH不同时(例如在顶端侧微环境为酸性pH 6.0~6.5,细胞质中pH为7.0~7.4),且药物是可解离的时,应考虑非解离型百分数的差异,这对预测肠上皮细胞中药物相互作用DDI特别重要,见14.2章节。
举例
西咪替丁在细胞质/顶端侧中的游离药物浓度比值可以计算如下(p K a =6.9;顶端侧pH=6.5,细胞质pH=7.0,且顶端侧没有胆汁胶束-药物结合):
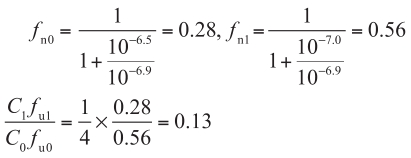
用细胞溶质中的药物浓度计算净渗透率,如下所示。在稳态下,透过顶端膜的流量等于从顶端侧到基底侧的净流量。
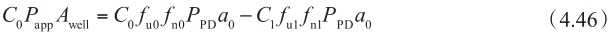
方程的左边是从顶端侧到基底侧的宏观净流量(即表观渗透性P app ),表观渗透率P app 的定义是根据细胞培养孔板的表面积A well 和顶端膜表面的溶解药物浓度C 0 计算。方程的右边是在顶端膜微观净流量。将方程4.44代入方程4.46,得到:
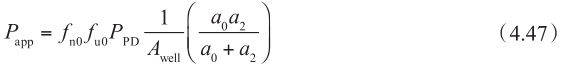
这个方程可以理解为表观渗透性P app 受顶端侧中不带电荷药物百分数f n0 和游离型药物百分数f u0 的影响,但不受细胞质中不带电荷药物百分数f nl 和游离型药物百分数f ul 的影响(该方程中没有f nl 和f ul ) ① 。如图4.18所示,被动渗透的流量仅由非解离型的游离药物的浓度梯度决定 ②③ 。
① 通常认为,pH分配理论应该是不正确的,因为无论顶端侧的pH如何变化,细胞质中pH保持恒定(在pH 7.4)。并且对于酸性药物来说,其基底侧的渗透是限速步骤,即主要渗透屏障(除非顶端侧的被动固有清除率a 0 p 01 远小于基底侧的被动固有清除率a 1 p 12 )。根据方程4.47,细胞质中的pH和游离药物百分数不会影响表观渗透性Papp,因此,无论a 0 p 01 和a 1 p 12 的值如何,pH分配理论都是有效的。文献中的大量实验已证实可解离的化合物都遵循pH分配理论。
② 不应混淆药物浓度和药物百分数。
③ 在原位测定和离体试验中,由于微环境pH的存在,通常pH依赖的药物的渗透不能得到准确的测量,微环境pH可以维持不变,并且几乎不受流体pH的影响
当C 1 f u1 <<K m 时,外排转运体介导的转运可以看作一级动力学过程。从顶端侧A到基底侧B方向,稳态下,细胞质内的质量平衡如下:
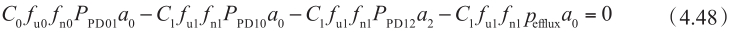
重整该方程,得到:
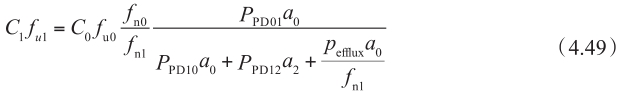
另一方面,根据稳态下表观渗透性的定义和穿过基底膜的流量,得到:
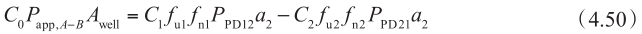
该方程中,稳态下穿过基底膜的流量(方程右边)等于给药侧浓度和表观渗透率的总流量(方程左边)。通常,P app 在C ≈0的时间点和第二项可忽略不计时计算。在方程4.49中代入方程4.50,得到:
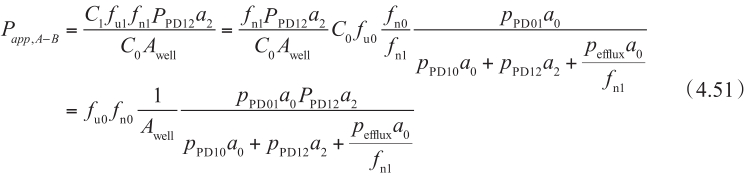
同理,从B侧到A侧方向的方程为:
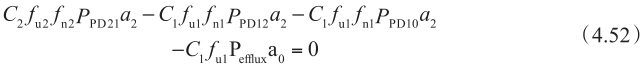
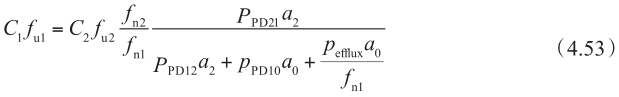
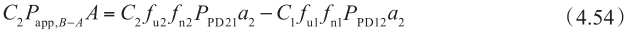
因此,
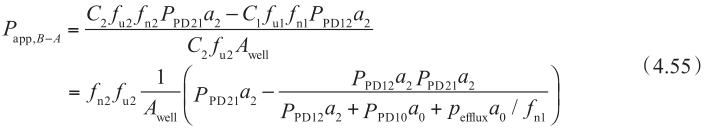
当f n0 =f n2 (不同pH条件下),f u0 =f u2 和P PD01 =P PD10 =P PD12 =P PD21 =P PD ,则外排转运率ER为:

这个方程特别重要,因为它清晰地阐明了外排转运率ER、被动扩散、主动外排转运之间的关系。将方程4.56代入方程4.49中,得到:
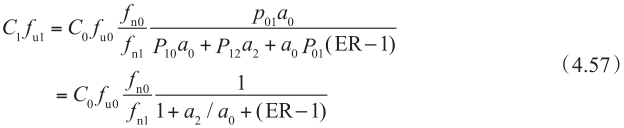
当ER=1,上皮细胞中表面积的比值是1∶3时,该方程代入方程4.44中,得到
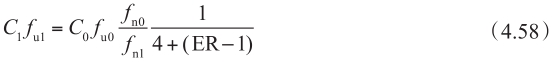
因此,一旦有外排转运率ER数据,就可以估计外排转运体作用下细胞质中的游离药物浓度。
通常,通过抑制实验来估算口服吸收中的外排转运体对其底物的影响。在这种情况下,

这个方程表明,顶端侧外排转运体的抑制引起的AUC的变化比外排转运率ER的变化小得多。例如,当ER=2时,通过抑制顶端侧外排转运体导致的AUC增加是1.25 ① 。方程4.59的另一个优点是可以通过 P app,PD / P app,A-B 估算外排转运率ER。对于很多高脂溶性的P-gp的底物, P app,B-A 超过了体外非搅拌水层 UWL 限制,见章节 7.9.8,而 P app,PD 和 P app,A-B 却没有超过体外UWL限制。这种情况下,方程4.59可以用于计算不受UWL影响的ER。此外,如果没有 P app,PD 数据,可以用 P app,A-B 和 ER 估算 P app,PD (当 P app,B-A << 体外 P UWL 时)。
① 因此,对于有/无外排转运体介导的口服吸收,考虑生物等效性范围(0.8~1.25AUC和 C max ),假设外排转运率ER=2是个很好的标准。
根据方程4.59,

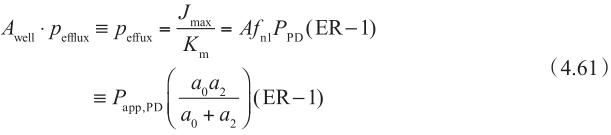
使用方程4.59和方程4.61,可以估算体外和体内的K m /J max 。可以合理假设体内和体外的K m 是相似的。因此,可以通过比较体外和体内J max 值来估算表达水平的区别。这使机制性体外-体内转化IVIVE成为可能。
图4.19中,针对结构不同的药物绘制了体外P efflux 对细胞质中的游离药物百分数f n1 ×被动扩散渗透率P PD 的关系图。P app 数据来自文献。用以下方法估算P efflux :①当P app,PD 、P app,A-B 和P app,B-A 数据已知,且在UWL限制内时,这些数据可用于计算P efflux 和f n1 ×P PD ;②当P app,B-A 超过 UWL限制,而 P app,PD 和P app,A-B 不超过 UWL限制时,用方程4.59计算ER;③当 P app,PD 未知,但P app,A-B ,和P app,B-A 都在UWL限制内时,用方程4.59方程由P app,A-B 和ER计算得到P app,PD 。系统中观测到的最高渗透性的一半被用作UWL限制标准。所有实验在顶端侧和基底侧都为pH 7.4的条件下进行(因此,f n0 =f n1 =f n2 ),且不加入任何增溶剂(f u0 =f u2 =1)。
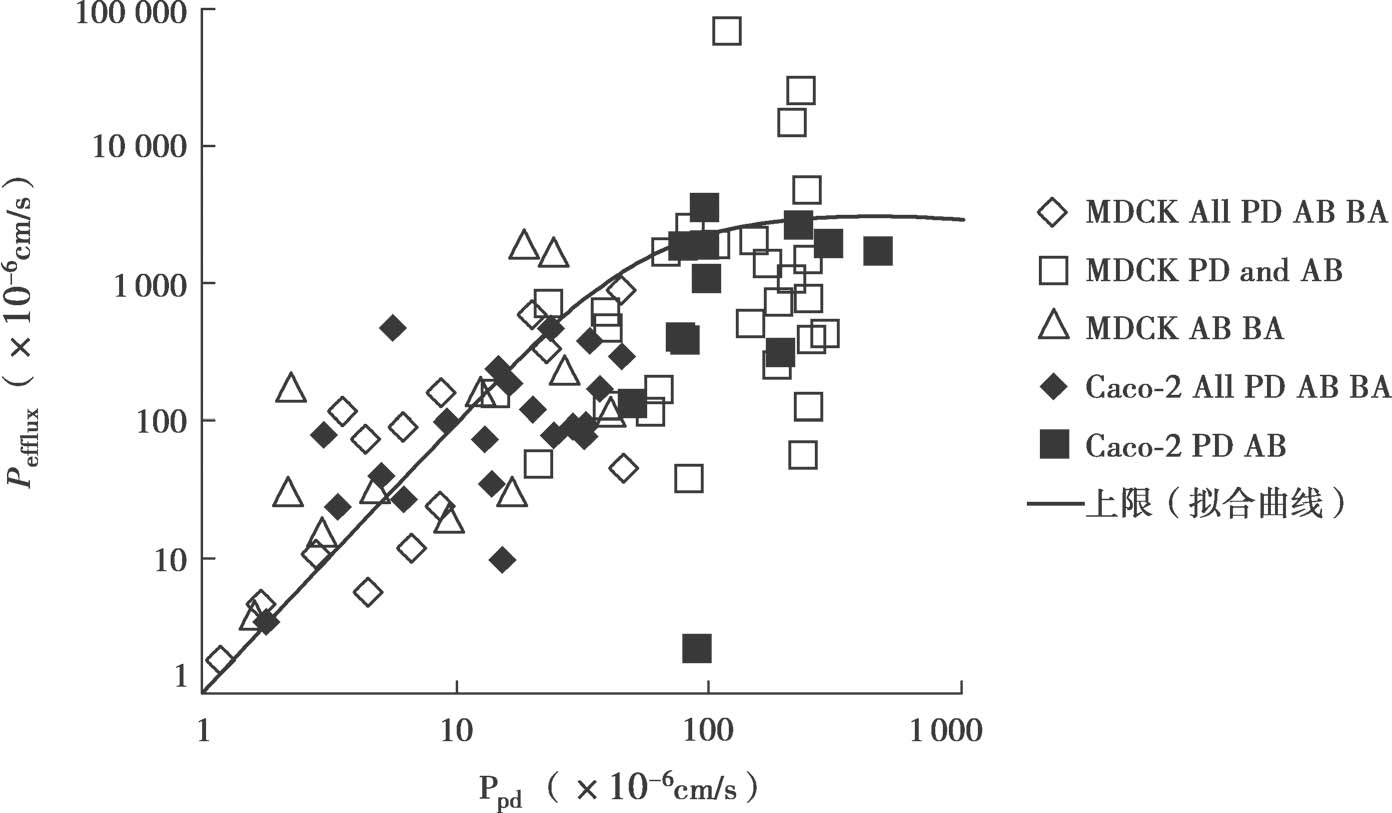
图4.19 p efflux -p PD 关系图
如图4.19所示,在p efflux 和f n1 ×p PD 之间存在相关性。这与P-gp机制非常吻合,即外排转运首先是被动膜扩散步骤,然后是主动跨膜转运步骤,见图4.20。图4.19中的趋势线是:
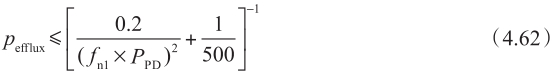
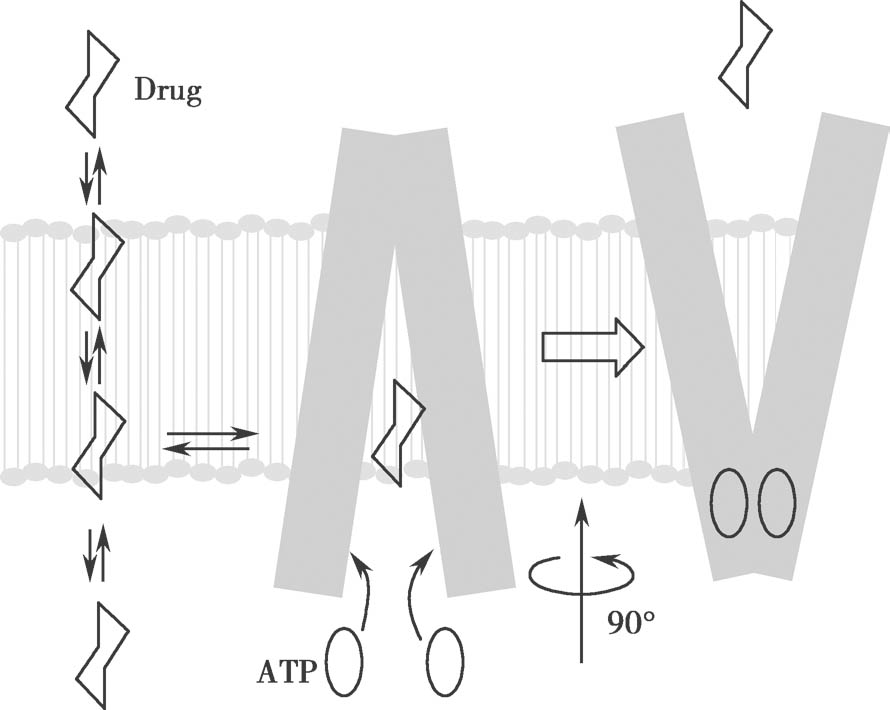
图4.20 P-gp介导的底物转运模型
底物嵌入膜脂双层并通过开放的入口进入内部药物结合口袋,ATP与口袋结合诱导了构象发生大的变化,使药物结合位点产生外排。
其中,P efflux 和f n1 ×P PD 的单位都是10 -6 cm/s。应用这个趋势线,可以计算P-gp对上皮细胞渗透性P ep 、P eff 和Fa%的最大影响。图4.21b显示了抑制P-gp后,不可解离型药物的P ep 、P eff 和Fa%的最大增加值。方程4.35和方程4.62分别用于计算P trans,0 和最大P efflux 。对于中等脂溶性不可解离型药物,抑制/无抑制的P ep 最大比值大约是7,但当被动P ep 高于3×10 -3 cm/s(logD oct 约=2.5)时,P-gp对净P ep 的影响最小。此外,当被动P ep >2×10 -4 cm/s(logD oct 约=1.25)时,净P ep 的最小值大约为50×10 -6 cm/s,且UWL将成为限速步骤,因此即使药物是P-gp的底物,这时P-gp抑制对于总P eff 影响很小,并且可预期口服完全吸收。这些理论推测与实验观测结果非常吻合,当被动P ep 很高时,P-gp对体外ER和体内总吸收几乎没有影响,见章节14.4.2。
此外,对于碱性药物,P-gp对其影响要比不可解离型药物和酸性药物大得多,见图4.22。这是因为顶端侧和细胞质pH值存在差异。当顶端侧pH从7.4变成6.5,且P-gp外排保持不变(细胞质pH一直维持7.4)时,碱性药物的被动流入大约会减小10倍。对于具有中度渗透性的碱性药物,能够观测到P-gp对Fa%的最大抑制作用大约是7倍。
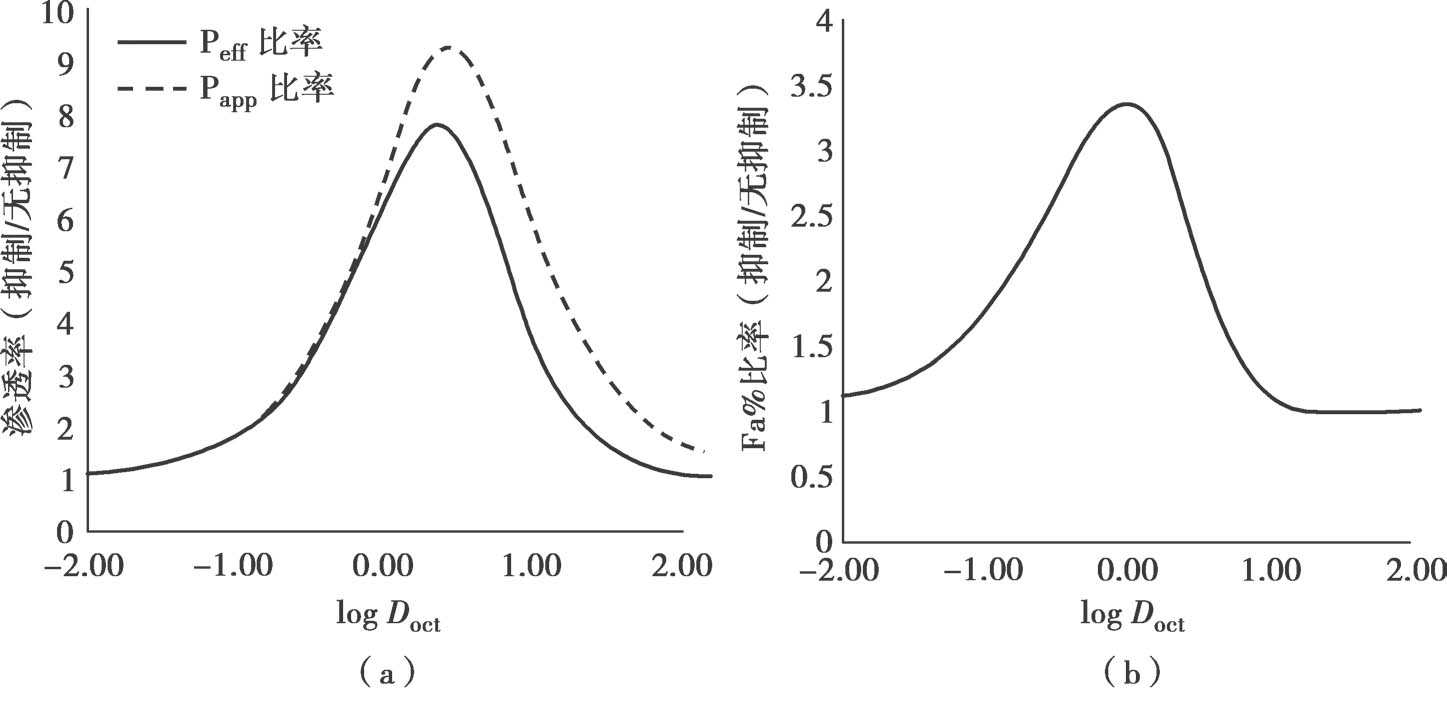
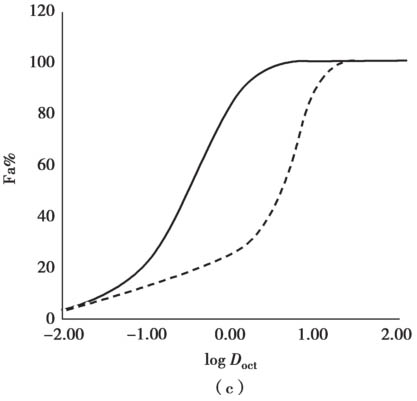
图4.21 P-gp抑制对P eff 和Fa%的最大影响(无溶解度低和溶解速率的限制、无经细胞旁路渗透和胆汁胶束-药物结合,f u =1)
(a)P eff 比率,(b)Fa% 比率,(c)Fa%。PE=3,VE=10,h UWL =0.03cm,D mono =7×10 -6 cm/s,H villi =0.06cm,W channel =0.02cm,W villli =0.05cm,P WC =0.23×10 -5 cm/s
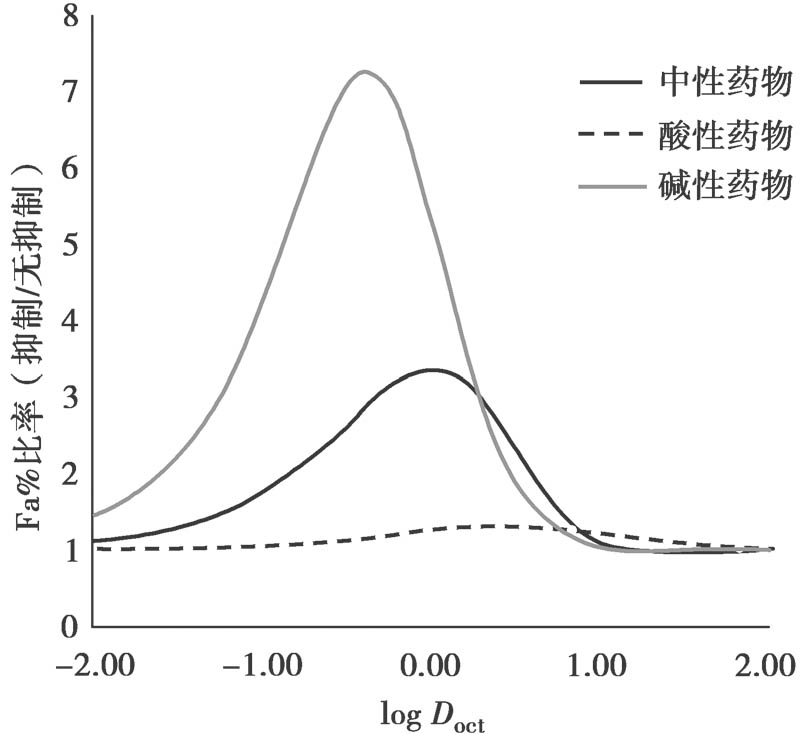
图4.22 P-gp抑制对不可解离药物、酸性药物、碱性药物的Fa%的最大影响
设置酸p K a =4,碱p K a =9。其他条件与图4.21相同。
为了计算外排转运体导致的非线性效应,米氏方程可整合至明确的细胞模型。在这种情况下,细胞房室的质量平衡可写为:
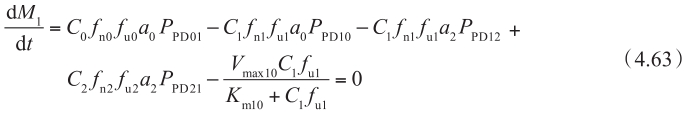
其中K m10 是顶端侧上外排转运体的固有米氏常数,重新整理方程4.63得到如下方程:
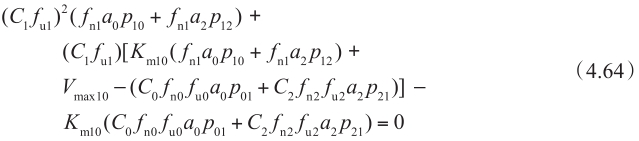
这是C 1 f u1 的二次方程,通过求解方程4.64,可以得到C 1 f u1 :



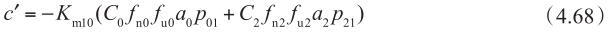
另一方面,根据P app,A-B 定义(方程4.69的左边)和基底侧(方程4.69的右边)的质量转移平衡,可得到:
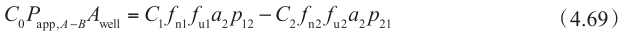
同理,
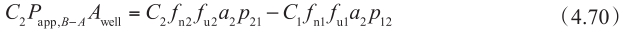
对于从顶端侧到基底侧的渗透,假设在基底侧存在漏槽条件(C 2 =0),可得到:
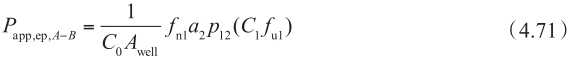
同理,对于 P app,B-A :
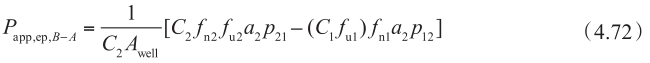
这些方程中,C 0 和 C 2 分别是 P app,A-B 和 P app,B-A 的给药侧浓度。将方程 4.65(C 1 f u1 )代入方程 4.71 和方程 4.72 中,可计算 P app,A-B 和 P app,B-A 。
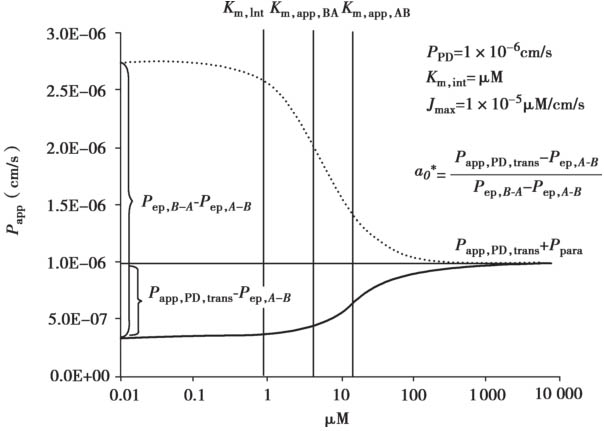
图4.23 在顶端侧膜有外排转运体介导时,浓度-P app 曲线的示意说明
用方程4.62~4.72计算得到浓度-P app 曲线的示意说明见图4.23。很多情况下,对于外排转运体底物,从顶端侧A到基底侧B的渗透和对应B到A的渗透的浓度-P app 曲线是不对称的。这种不对称是由顶端膜和底端膜的被动清除率的差异引起的。图4.24显示了罗丹明123和非索非那定的拟合曲线。此外,表达水平的差异可以改变表观K m 值,因为细胞质浓度是根据P-gp表达水平而变化的。图4.25显示了具有单一的固有K m 值的长春碱的拟合曲线。
图4.24 罗丹明123和非索非那定实验观测值和模拟的浓度-P app 曲线
(a)罗丹明 123;(b)非索非那定。
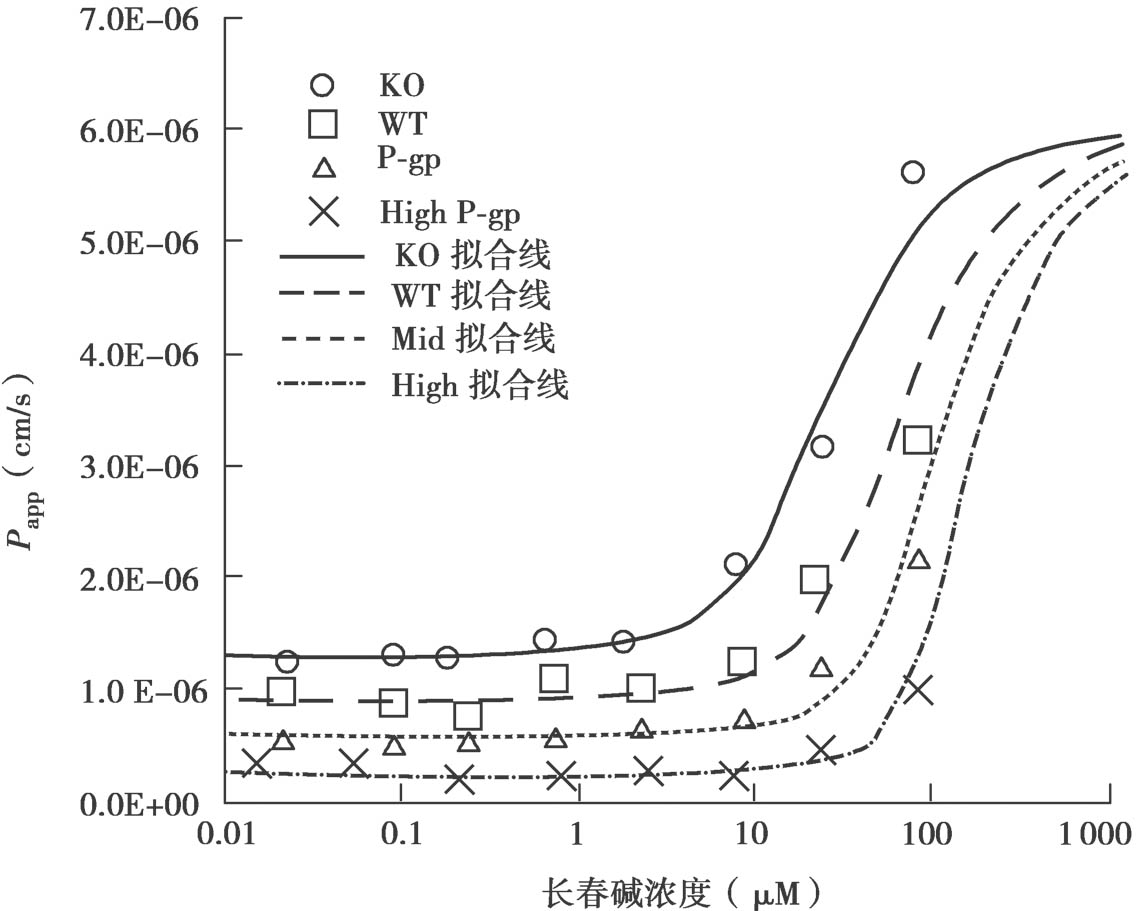
图4.25 长春碱通透性与P-gp表达水平的依赖性
当顶端侧膜涉及摄取转运体参与的膜渗透时,P app,A-B 可以表达为:

当顶端侧膜存在摄取转运体与外排转运体且同时参与转运时,考虑顶端侧上摄取转运体的影响可以通过将等式4.68代替为:
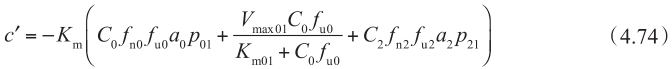
在上述明确的细胞模型的讨论中,非搅拌水层UWL被忽略不计。当考虑UWL的影响时,额外引入以下条件:

其中C 0 是与顶端膜相邻的顶端池的浓度。这个方程意味着在稳态下,透过UWL的流量与透过上皮细胞膜的流量是相同的。
无转运体参与时,重新整理方程4.75,C 0 /C dissolv 可以通过如下方程计算:

当P UWL <P ep 时,由于UWL上存在浓度梯度,上皮细胞膜表面的药物浓度C 0 远比C dissolv 小。此外,对于中性和碱性的药物,f u1 C 1 比f u0 C 0 低约3~10倍(对于酸性药物,f u0 C 0 /f u1 C 1 =2)。因此,为了饱和或抑制细胞质内的代谢酶,给药侧的浓度应该远高于固有K m 和K i 值。当预测药物相互作用DDI时,应把UWL和上皮细胞膜的浓度梯度考虑在内,见章节14.2.2。
当顶端侧有摄取转运体参与时,方程4.73和方程4.75可以解为四元方程(对非线性情况,P ep 是C 0 的函数)。
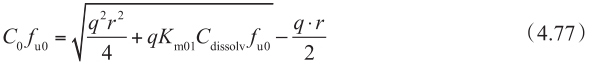

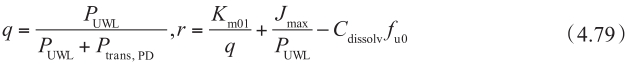
图4.26 显示了顶端侧有摄取转运体参与时,浓度-P app,A-B 的关系。如计算固有K m 时忽略UWL效应,则固有K m 值将被高估(表观K m >固有K m )。
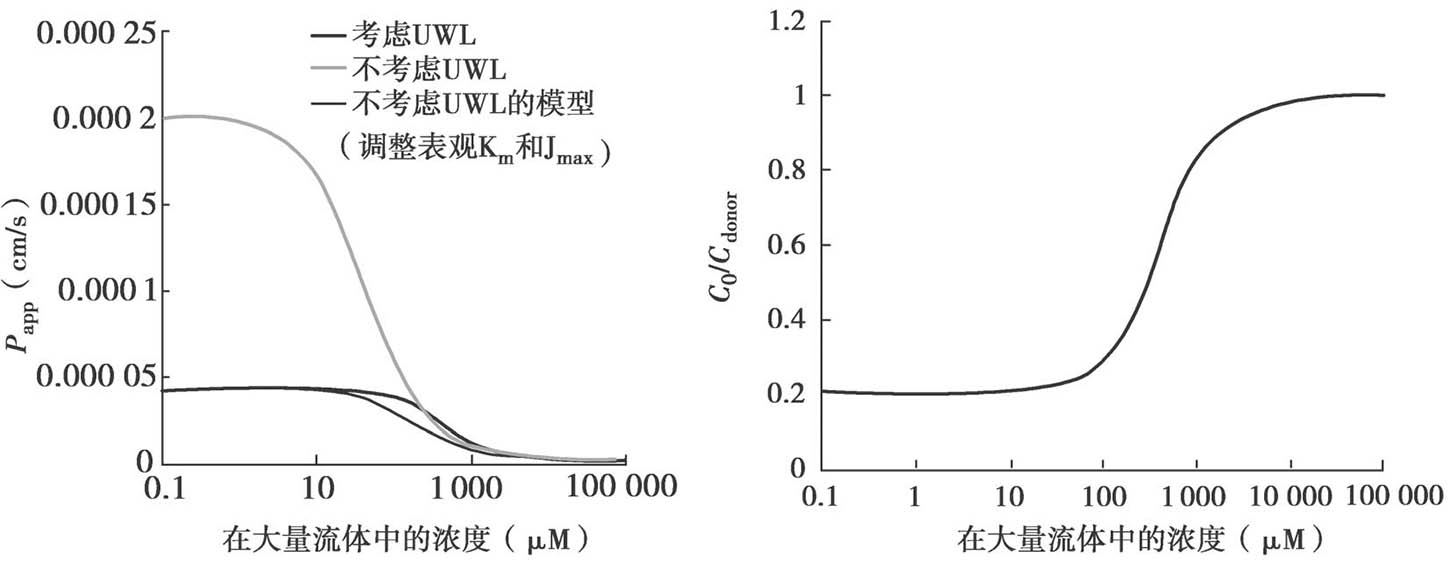
图4.26 在顶端侧有摄取转运体参与时,UWL对底物总渗透性的影响
P active =200×10 −6 cm/s,K m =50μm,P UWL =50×10 −6 cm/s。无被动扩散。
在这种情况下,同时考虑UWL效应和可饱和外排转运体的影响的理论处理是非常复杂的,还没有一个简单开放的解决方案。但以下过程可用于计算稳态下的P app :


在该条件下,可寻找符合方程4.80的C 0 值,例如采用Newton方法或简单方法 ① 。一旦获得C 0 ,P app 可计算为:
① 体内P eff 可以用相同的方法获得,但计算体内Peff时应考虑表面积(皱襞和绒毛)和胆汁胶束-未结合药物百分比。

图4.27显示了非搅拌水层UWL的渗透率 P UWL 是如何影响表观渗透性 P app 的。
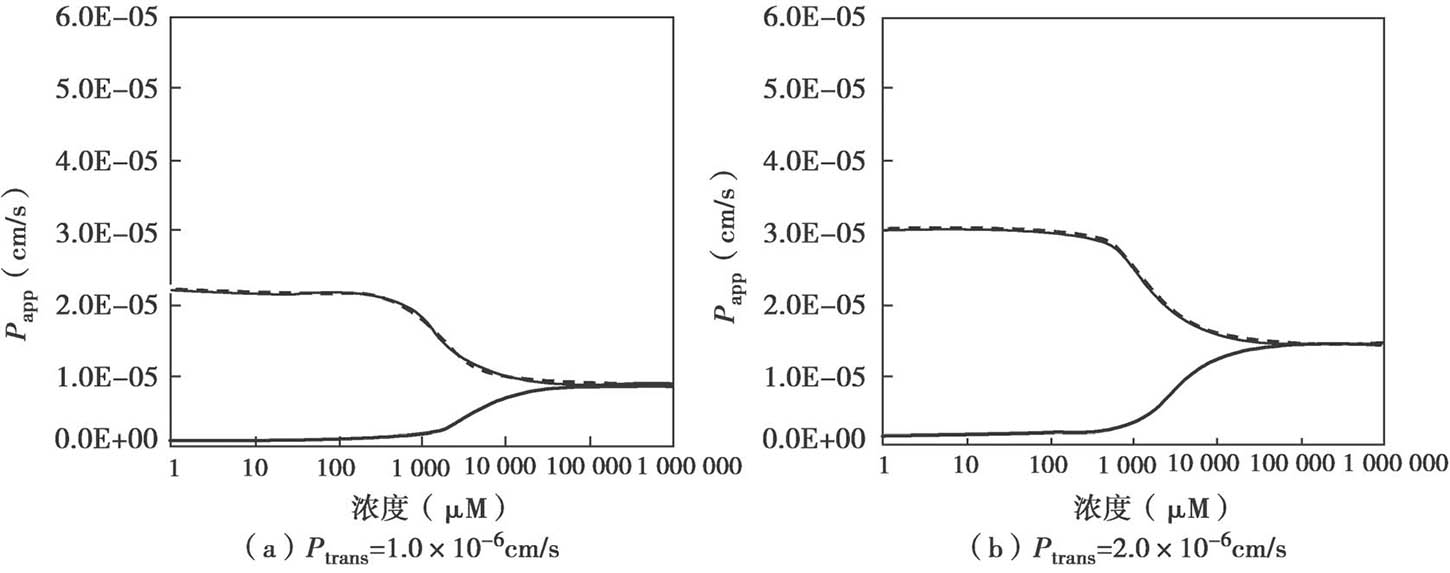
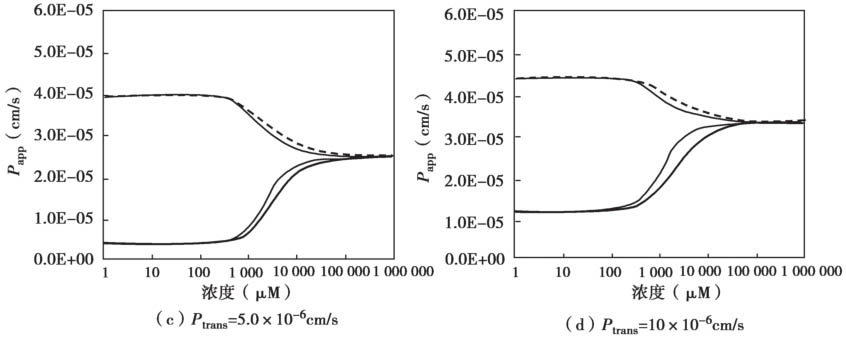
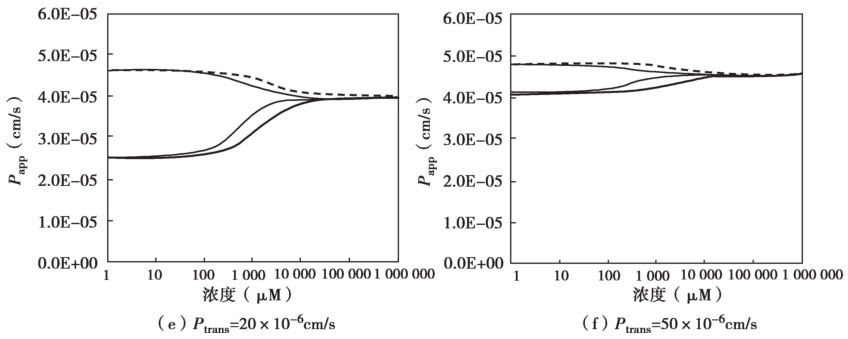
图4.27 非搅拌水层UWL对外排转运的底物总渗透性的影响
主要参数如下:K m =50μM,P UWL =50×10 -6 cm/s;被动扩散P trans 是从 1变化到50×10 -6 cm/s;P efflux 由方程4.62计算得到