




3D打印技术因其制造三维复杂结构的强大能力,目前在工程、医疗、教育等领域得到了广泛应用。相比传统制造方法,3D打印最重要的优势是采用逐层打印累加的方式,可经济、快速地实现三维结构的个性化订制。随着3D打印技术的不断发展以及在组织工程领域的延伸,近些年科研工作者开始打印生物活性材料,制备生物活性组织。基于生物活性材料的3D打印在生物医学领域有着重大需求,可在体外打印人体组织和器官的三维结构,用于人体组织修复或器官移植。生物活性材料3D打印的另一应用是在体外构建正常或疾病微组织,进行基础的生理学或病理学研究。最近的研究让人们深刻认识到在二维与三维培养系统下细胞行为的巨大差异,三维培养系统可以给细胞提供与相关生理环境更接近的刺激因素,影响细胞行为并促进其功能的实现。3D打印技术能够在体外构建三维微组织,并在为细胞提供三维复杂微环境方面发挥独特的优势。
3D打印制备微组织或器官通常有两种途径。第一种方式是将生物活性材料打印成特定的三维形貌,该结构也称为生物支架。随后在支架上贴附种植细胞使其最终形成支架的形状。第二种方式是将细胞和生物活性材料预先混合一起,随后将其打印成特定的三维结构。因此,3D打印生物活性材料的选取和对现有材料的加工改性则显得尤为重要。许多适宜人体植入和细胞生长的3D打印材料越来越受到人们的重视。
基于生物活性材料的3D打印与传统的3D打印原理相似,将液态的生物材料(可预混细胞)通过打印头喷出至接收平台,采用计算机控制打印喷头或者接收平台的运动路径实现图案的调控。打印一层或几层后,将液态材料进行物理或化学交联以保持其形貌,通过逐层累加的方式成型三维结构。依据结构单元的不同,生物3D打印可分为基于液滴的3D打印和基于连续体的3D打印(图2-13)。
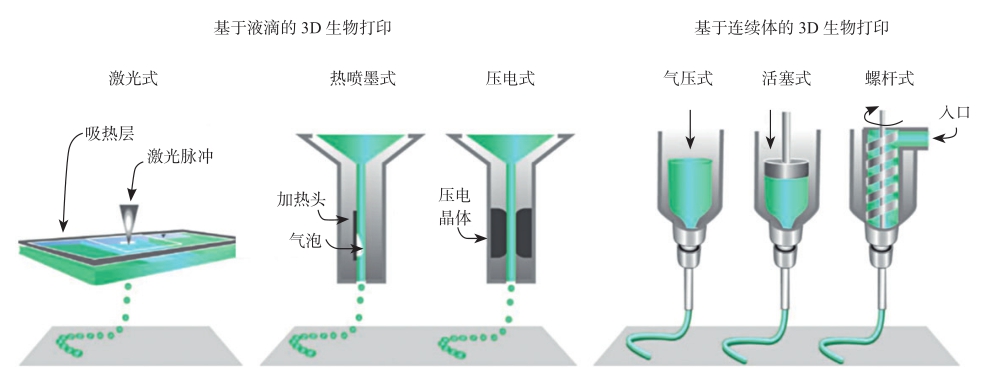
图2-13 3D生物打印的主要类型及原理
液滴式生物3D打印的结构单元是离散的液滴,通过液滴的连续打印形成二维图案,进而构成三维结构。根据液滴形成的方式不同,又可具体分为激光式、热喷墨式以及压电式三种。激光生物3D打印技术利用激光的热效应对吸热层进行加热,在生物材料内部产生微气泡,随着气泡的膨胀,包裹细胞的生物材料滴落到接收平台。激光生物打印的精度受多个参数影响,如激光能量密度,基板的润湿特性,生物材料的表面张力、黏度以及层厚等。通过调控脉冲激光的位置,该技术可实现单细胞精度的打印及位置调控。激光3D打印不需要打印喷头,避免了喷头的堵塞问题。该技术方法的缺点是产生局部高温,一定程度上降低了细胞存活率。
热喷墨打印是应用最早的一类生物打印机,通过对传统的二维打印机进行改造,在墨盒中填充生物活性材料及细胞。其打印原理是通过加热头的加热使生物材料气化形成气泡,随后气泡将生物材料及细胞挤出打印喷头,形成液滴。热喷墨打印机的优势是造价较低,易于推广应用。打印过程中的高温(200~300℃)对活细胞可能存在隐患。但目前的研究表明,热喷墨打印出的活细胞仍然具有较高的存活率,原因是高温持续的时间较短,并未影响细胞的活性。
压电式打印是通过晶体的压电效应将生物材料挤出打印喷头。相比于热喷墨式打印,其优势是避免了高温对细胞的潜在损伤及生物活性材料的改性。另外,该方法的可控性较好,对液滴的体积、速度等具有较好的调控能力。通常,热喷墨式和压电式打印统称为喷墨式3D打印。
连续体3D生物打印,又称挤出式3D打印,其结构单元是连续的线。相比离散液滴式3D打印,基于连续体的生物打印目前应用更加广泛。根据挤出力的不同,可分为气压式、活塞式以及螺杆式几类。气压式3D打印采用压缩气体将生物材料从打印头挤出,通过控制压缩气体的通断或打印头开关来启动和终止打印过程。气压式打印所需的结构简单,其缺点是压缩气体的驱动作用有一定延时。活塞式和螺杆式是采用机械力的方式将材料挤出,相比气压式,对材料的可控性更好。螺杆式的打印精度更高,可用于高黏度生物材料的打印。基于连续体的3D打印机的成型精度为5~200μm,打印速度为10~50μm/s。
相比于液滴式3D打印,基于连续体的3D打印其细胞存活率通常低一些(约为40%~86%)。原因是在挤出的过程中,细胞通过打印头时承受了较大的剪切力。前期研究表明,采用较小的挤出压力和较大的打印头直径,细胞的存活率有显著提高。相比打印头的直径,挤出压力对细胞存活率的影响更大。
3D打印过程中,生物材料的性质对成型的三维组织至关重要。其主要作用包括两方面:一是打印过程中为细胞提供保护作用,使其免受机械力损伤;二是打印后保持固定的三维形貌,为细胞的生长、分化等提供支撑。理想的3D生物打印材料,不仅要满足打印过程中的力学要求,更要承担作为细胞生长、繁殖、分化和功能实现等多种功能的微环境载体。目前,3D生物打印最常用的材料(生物墨水)是高分子水凝胶。该材料作为一种高水合的三维聚合网络物质,可模拟体内的细胞外基质,取代在体的复杂组织微环境情况。并且,水凝胶网络可以促进细胞外基质的重建、细胞迁移以及细胞之间黏附,有利于功能性组织的正常发育。通过改变水凝胶材料的物理、化学性质可调控细胞的行为,影响细胞的命运。面向3D打印的生物活性材料种类众多,应根据需求具体选择。目前表征生物活性材料的指标包括生物相容性及可降解性、可打印性及可交联性、力学特性、孔隙率及微观结构等。
生物相容性这一概念通常用于再生医学领域,通常生物相容性指材料本身不会引起异物反应(包括炎症反应或免疫原性反应)且对细胞无毒性。生物活性材料应用于3D打印时,最重要的性质即是生物相容性。首先,细胞与生物活性材料之间具有相容性,否则细胞在打印后会失去活性,丧失其功能。其次,3D打印的组织或器官如果用于移植,则要求患者身体与植入材料之间是兼容的。不同的水凝胶材料其生物相容性也不同,有些水凝胶材料(如卡拉胶)本身会引起异物反应,这些材料可被用于动物模型中,激发早期异物反应来测试抗炎试剂的功效。此外,植入物内的细胞和其他物质也可能引起异物反应。
对于生物活性材料,细胞的黏附能力也会影响其生物相容性。细胞通常需要在材料上铺展并贴附生长,而缺乏细胞黏附能力的材料会引起凋亡现象,这一现象因细胞与细胞外基质之间相互作用不足而引起。细胞与材料的黏附通过特定的连接关系实现,如细胞和细胞外基质中的蛋白连接。有些水凝胶材料不含特定的细胞黏附结构,但人们可以在材料上修饰特定的蛋白来提高材料的黏附能力。目前,最常用的提高细胞黏附能力的方法是束缚整合素,将整合素结构域绑定在水凝胶骨架上。研究表明,将整合素多肽序列绑定在一种无细胞黏附能力的多糖(结冷胶)上,可以显著提高细胞的黏附效果。
生物可降解性是生物活性材料的另一重要指标,特别是用于植入体内的生物活性材料。对于植入物材料,要能够被细胞降解或整合入细胞外基质中,而不产生有害分解物。理想的生物可降解性是细胞或组织对材料的自然降解速率与体内自发生成的细胞外基质的速率能够相匹配。水凝胶等高分子聚合物通常有两种降解方式,即蛋白酶解和水解。当聚合物含有可用于酶解的多肽序列存在时,植入物内及其周围的细胞所分泌的酶类即可将暴露出的多肽序列进行切割降解,例如胶原即是蛋白聚合物,可被金属蛋白酶所降解。可被蛋白酶解的聚合物的主要优势在于其降解速率与内部细胞的生长速率相匹配,这是由于细胞控制蛋白酶的分泌,从而按需重塑其所需的微环境。一些水凝胶聚合物也可以在没有蛋白酶的条件下被水解,不过该降解过程通常比较缓慢。对于生物降解过程,降解后的产物可能引起一些副作用,如酯基聚合物的降解产物为酸性,可导致自动催化降解等问题。聚酯类α-羟基羧酸是唯一一类可自然降解的人工合成聚合物材料,降解产生的单体随后会进入三羧酸循环。聚乳酸(PLA)和聚乙醇酸(PGA)是两种常见的α-羟基羧酸聚合物,目前被广泛用于生物医学工程领域,如可降解支架、缝合线以及伤口敷料等。除此之外,大多数应用于组织工程的人工合成聚合物材料一般都是不可降解的,这些材料可用于制备不需要降解的植入物,或者通过较低分子量使材料可通过肾脏系统排出。另一策略是,在不可降解的水凝胶材料中设计增加可降解区域,从而调控材料的可降解性。如聚乙二醇即是一种应用广泛、自发降解性差的人工合成聚合物,通过在其分子结构中增加酶解结构域,可改善其降解性能。
对于3D生物打印材料而言,除了需要具备良好的生物相容性和可控的降解性能以外,可打印性以及成型特点对3D生物打印过程的快速成型制造同样十分重要。对于连续体3D生物打印,采用的材料通常为热交联,并且具有剪切变稀的特性。剪切变稀是一种非牛顿流体特性,经典的牛顿流体模型认为流体的黏度为一常数,但3D打印通常采用水凝胶等聚合物材料,其黏度与材料所受的剪切力有关,剪切力越大黏度越小(图2-14)。材料在高压气体或机械力的推动下,通过打印喷头时承受较大的剪切力,此时黏度较小,利于材料流动通过,黏度过高会发生堵塞。如果生物材料的黏度过低,则会出现难以抵消喷嘴内壁处的高剪切力,进而导致细胞受到较大机械损伤的情况。因此,材料自身的黏度很大程度上影响其可打印性能。通过打印喷头后,由于剪切力的骤减会导致生物材料黏度的增加,该特性有利于结构的成型及形状保持。
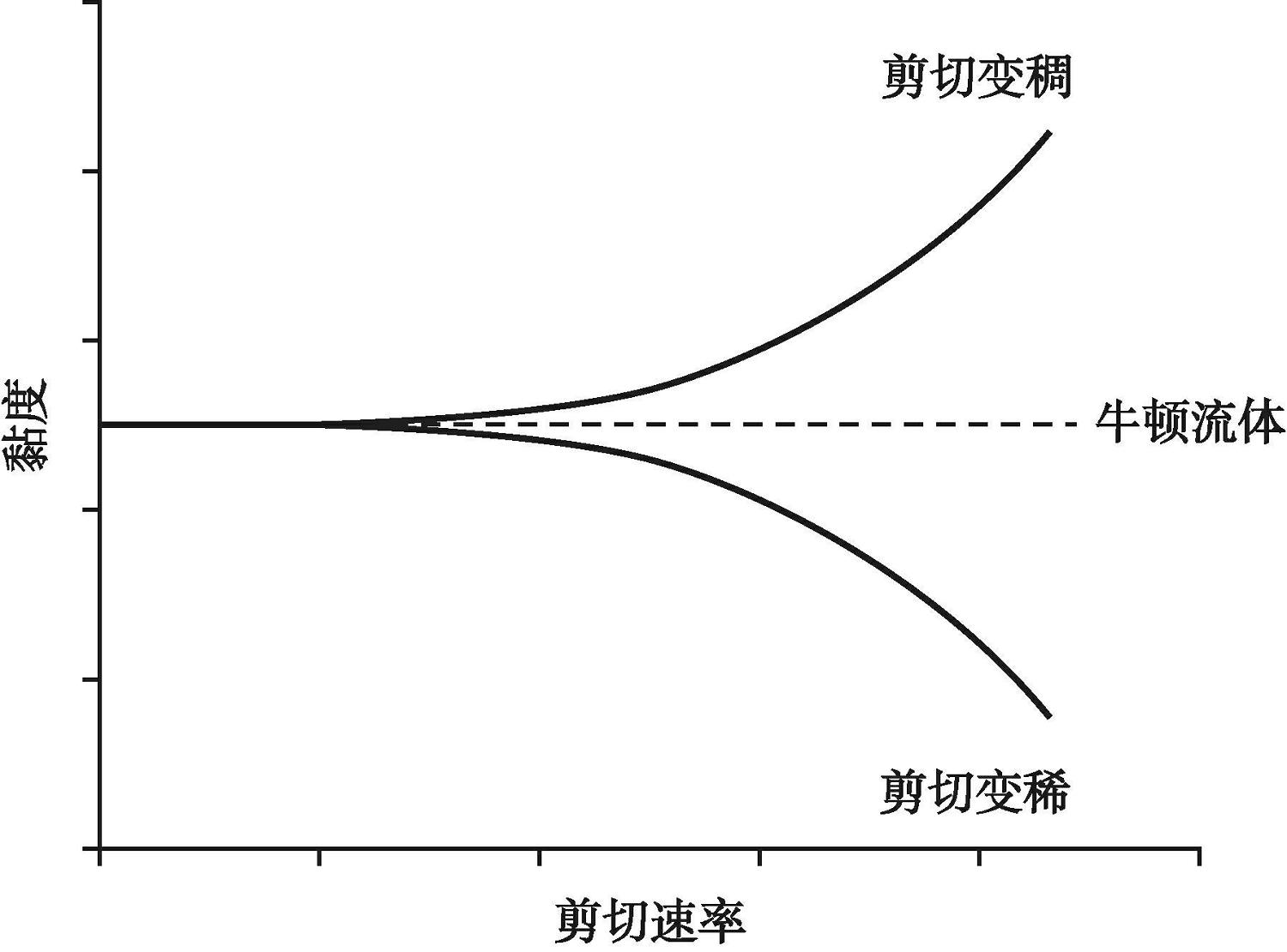
图2-14 牛顿流体和非牛顿流体的黏度与剪切速率的关系
材料的可打印性主要是指材料能否实现打印高精度的图案化结构,通常是由生物材料在接收基底上的润湿性决定。而润湿性取决于材料的表面张力,可通过两种介质之间的接触角所测定。为制造三维支架结构,打印出的液态生物材料在基底上不应过于扁平,这就要求材料在垂直方向上保持张力,从而保证与基底之间存在较大的接触角。具体实验中,一般采用玻片和培养皿作为接收基底,这就要求生物材料能够在玻璃和塑料基底上实现垂直结构的打印。但多数材料在玻片基底上的接触角都比较小,为此可在基底表面涂覆一层薄膜材料来增强疏水性,如3-丙基甲基丙烯酸酯等。
另一方面,可打印性也受材料交联难易程度的影响。目前的3D生物打印多采用液态生物材料来制备成型,待材料从打印喷头中挤出后将材料交联形成固体。目前水凝胶生物材料的交联方式包括物理光交联、温度交联、离子交联、pH交联以及酶交联等(图2-15)。光敏感水凝胶材料通常需要添加光引发剂,可见光或紫外光的照射会激发出自由基团,使液态水凝胶发生交联固化。通过控制光的强度和光照时间,该方法可实现水凝胶材料不同程度的交联。若采用紫外光交联包裹细胞的水凝胶材料,需要对曝光时间进行严格控制。哈佛大学医学院Melero-Martin小组采用胶原材料(一种紫外光交联水凝胶)培养人内皮细胞,实验结果表明紫外光照射时间小于120s,细胞活性不受影响,而照射时间超过120s则细胞存活率显著降低。温度交联型水凝胶通过温度变化进行交联,例如聚丙二醇与环氧乙烷的加聚物在低温下呈液态,在高温下则交联成固体。离子交联型水凝胶的典型代表是海藻酸钠,该材料通常呈液态,但遇到钙离子(如加入氯化钙溶液)后发生交联反应变成固体。此外,有些水凝胶材料是通过改变pH或者加入特定的酶实现交联。
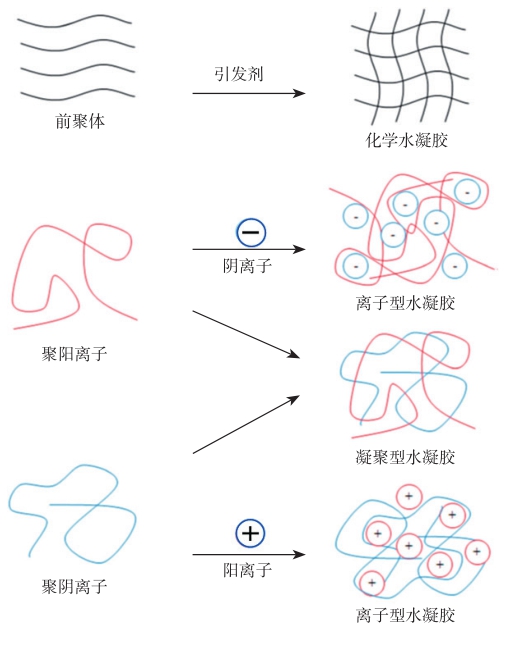
图2-15 水凝胶的常见交联形式
不同水凝胶材料交联(固化)所需的条件有所差异,并且水凝胶材料在交联前后的性能变化也比较大,发生交联的时长及交联程度最终会决定成型质量。采用3D打印制备生物微组织和器官,通常是打印一层或数层后进行一层交联处理。如果交联的速度太慢(1分钟以上),材料在交联过程中会在重力和界面力的作用下流动,发生下垂、坍塌、结构变宽或缝隙填充等现象,导致最终成型的三维结构的精度和保真度与初始设计有较大差距。相反,如果凝胶形成的速度太快(小于5s),层与层之间的生物材料则很难彼此黏合牢固,有损打印结构的力学特性和结构完整性。
水凝胶等生物材料的力学指标主要包括刚度、屈服强度和质量溶胀比等。水凝胶在交联后应具有较强力学特性,以维持3D打印的组织工程移植物的三维结构。此外,材料对细胞的黏附、增殖和分化等行为提供稳定的环境。水凝胶材料的刚度对细胞的贴附、分化和迁移等行为有着重要影响。理想生物材料的力学性能应该与体内组织相近,如用于骨组织的材料应具有较高的刚度,而用于皮肤等软组织的生物材料则应具有较低的刚度。研究表明,平滑肌细胞在硬材料上具有较好的铺展,在骨、软骨和皮肤重建中,干细胞的分化方向及组织的功能也依赖于材料的力学特性。单种生物材料有时无法同时满足3D打印所需的可打印性、生物相容性以及力学特性等多方面需求。为此,科研工作者设计了多种材料或混合材料同时打印的策略,如可将水凝胶材料和聚己内酯同步交错打印,两种材料分别为彼此提供力学支撑,可用于生物活性材料体外组织的3D打印构建。
3D生物打印有别于传统3D打印的重要一点是选择的生物材料具有较高的孔隙率(不低于90%)、适宜的孔隙尺寸以及内部连通的孔隙结构。生物材料的孔隙结构对高密度细胞的包埋和生长增殖、细胞外基质的分泌重构、代谢废物的排泄、氧气和营养物质的传递运输以及内部的血管网络和神经网络的内生长都有十分重要的意义。材料的孔隙率取决于材料种类(图2-16),同一材料的浓度也会影响交联后的孔隙率,进而影响细胞的存活率及功能。例如,浓度配比为2%的海藻酸盐材料可实现90%的细胞存活率,而浓度配比6%的海藻酸盐则导致细胞存活率急剧下降至35%。将浓度为5%的明胶与1%的海藻酸盐混合物进行打印,6小时后可以保证100%的细胞存活率,但将其中的明胶浓度升高至10%时,细胞的存活率降至70%。虽然目前生物材料的最适孔径尚无定论,但多数研究者认为数十到数百微米的孔径尺寸,有利于细胞的黏附、铺展和在材料内的迁移等行为。若支架孔径过小,不利于细胞的迁移,培养的细胞经过长时间培养仍然停留在初始位置,不能充分利用内部空间。相反,如果材料的孔径过大,则不利于细胞的黏附和铺展,同样会妨碍细胞的生长。

图2-16 水凝胶的多孔结构
材料为甲基丙烯酸酯明胶和聚乙二醇混合物,两者配比分别为1∶4、2∶3、3∶2和4∶1,不同配比的材料其微观结构也不同。标尺为50μm。
有些科研人员将纳米尺度纤维与微米尺度纤维进行混合,作为生物材料进行3D打印。纳米纤维为细胞的黏附和生长提供合适的依附形态,有助于细胞在材料内部的黏附与生长;微米纤维提供整体的支撑环境,利于细胞的渗透、迁移。根据所需的孔隙率不同选择微米纤维和纳米纤维的配比,因此微纳米复合支架材料在3D生物打印技术中具有很大的应用前景。
3D生物打印用的软材料主要是水凝胶,是由高聚物的三维交联网络结构和介质共同组成的多元体系,作为新型的生物医用材料在生物医学工程领域有着广泛应用。水凝胶具有良好的生物相容性,且其组成与细胞外基质类似,表面黏附蛋白质和细胞的能力弱,基本不影响细胞的正常代谢过程。水凝胶的存在可以进行细胞的保护、细胞间的黏合扩展及器官的构型。因此,水凝胶成为3D生物打印的首选。
水凝胶材料分为天然存在的水凝胶与人工合成的两种。天然水凝胶由于来源于生物体,其有效成分和官能团与人体细胞外基质成分十分相似,因而目前在生物3D打印中得到广泛应用。
胶原(collagen)是生物医学工程中大量应用的一种天然水凝胶材料,该材料在生物体组织的细胞外基质中普遍存在。目前针对该材料(特别是Ⅰ型胶原)的分离和提纯技术已比较成熟,采用胶原材料进行3D打印,可用于体外构建皮肤及其他组织。胶原中最重要的结构构成是精氨酰-甘氨酰-天冬氨酸肽(RGD),细胞上的整联蛋白与胶原上RGD结合形成整联蛋白-RGD键,因此细胞可在胶原上贴附铺展。通常,天然胶原是富含多种成分的混合物,包括弹性纤维、氨基葡聚糖、纤维蛋白原以及层粘连蛋白等成分。这些复杂的成分对细胞的生长繁殖也有重要作用,研究表明采用纯胶原进行细胞培养反倒效果不好。胶原材料在在体生理的pH、温度以及离子浓度等条件下可实现交联,当pH在7~7.4,温度37℃时,胶原会在30~60分钟内实现交联。胶原材料的缺点是力学性能较差,结构含有疏水肽,作为移植物进入体内后会因疏水导致材料收缩,降低了营养和气体的扩散,易引起细胞死亡。但是,胶原材料仍然是目前应用最广泛的水凝胶材料。
明胶(gelatin)是胶原材料经过部分水解后的产物,该材料含有丰富的蛋白质,能够促进细胞黏附。与胶原不同,明胶可溶于水,当温度降低时明胶溶液会发生脱水交联,其转变温度为30~35℃。明胶也可以通过甲基丙烯酰胺修饰之后与紫外线进行交联,因此也可用于基于光学的生物打印平台。明胶常与其他水凝胶材料混合使用,使材料在打印过程中具有一定的力学强度,打印体能够更好地成型。明胶材料可作为细胞载体,辅助伤口治愈。研究表明,采用明胶和聚乙二醇的混合物包裹骨髓间充质干细胞可降低免疫反应,促进伤口闭合以及上皮细胞和神经血管系统的再生,从而治疗小鼠的伤口。
海藻酸钠(alginate)是从褐藻或海藻当中提取、分离出来的一种天然多糖,属于β- D -甘露糖醛酸和α- L -古罗糖醛酸的天然共聚物。海藻酸钠的优点包括价格低廉、生物相容性好、可打印性好、适用于多种3D打印方式、成型的三维结构强度好。海藻酸钠通过与二价阳离子(如钙离子)的化学交联,能够短时间内从液态变为固态,多种钙离子溶液如氯化钙、碳酸钙或硫酸钙均可使海藻酸钠快速交联。这一特性使得海藻酸钠材料在三维组织构建、微组织和器官打印中得到广泛应用。目前,研究者开发出了海藻酸钠的多种3D打印方式,包括在钙离子液池中打印、集成多喷头系统进行打印交联一体化、同轴喷嘴打印系统、预交联海藻酸钠并进行二次交联,以及喷雾式交联等。基于连续体的挤出式3D打印是打印海藻酸钠最常用的方式。有些科研工作者将纳米纤丝和海藻酸钠结合作为生物材料打印人软骨细胞,打印出的活性软组织经过7天的三维培养后,表现出剪切稀化行为和86%的细胞存活率,其性质类似于软骨组织,可打印成耳朵和半月板等形状。
透明质酸(hyaluronic acid)是从牛眼玻璃体中分离出的一种酸性黏多糖。透明质酸在临床上应用已有几十年历史,最初是用来减轻关节炎或关节损伤患者的疼痛。采用透明质酸材料包裹软骨细胞具有较高的细胞存活率。透明质酸的缺点是其力学性能较差并且降解速度较快,经过化学改性后应用范围更加广泛。例如,经过丙烯酸酯或甲基丙烯酸酯改性的透明质酸可通过光交联形成凝胶。光交联透明质酸可用于治疗角膜损伤,也可用于血管结构的3D打印成型。
除了从生物体直接提取水凝胶材料外,科研工作者也在实验室对天然水凝胶进行合成改性,在其结构上链接肽或蛋白质等,从而合成了多种人工水凝胶材料。人工合成水凝胶的主要优点是可对材料的分子量、分子结构、交联强度以及机械性能(如弹性模量)等参数进行精确调控。常见的人工水凝胶有聚乙二醇类和聚丙烯酰胺类等材料。
聚乙二醇(PEG)是一种具有亲水性、生物相容性以及获FDA批准的聚合物。聚乙二醇因具有水溶性,因此常被用于制作拥有复杂三维结构体的牺牲材料。聚乙二醇材料的力学性能较差,为此可通过在分子链上链接二丙烯酸酯增强其力学性能。改性后的聚乙二醇二丙烯酸酯(PEG-DA),可添加光引发剂变为紫外光交联。Hockaday采用PEG-DA 3D打印出具有空间异质性的三维动脉瓣结构,并接种了猪主动脉瓣间质细胞,细胞存活时间可达21天以上。聚乙二醇材料的主要缺点是细胞的增殖能力较差。
明胶-甲基丙烯酸酐(GelMA)是明胶和甲基丙烯酸甲酯的复合成分,该材料具有可控的力学性能并且溶胀率低,在生物医学工程领域应用非常广泛。GelMA在室温下黏度较低,易于挤出,适于3D打印成型。该材料可用紫外光交联,交联速度可通过紫外光强进行调控。材料的生物相容性与浓度相关,GelMA浓度为5%时,细胞可自由迁移,并与相邻细胞形成连接网络,当浓度升高到10%~15%时,细胞的迁移能力降低。采用GelMA材料可用于软骨细胞、肝细胞以及骨髓间充质干细胞的3D打印。
上文介绍的水凝胶等生物软材料通常和细胞混合后进行3D打印,用于制备软组织和器官等。而对于骨等硬组织,通常采用3D打印硬材料制备生物支架,随后在支架上进行细胞培养成型微组织。常见的生物硬材料包括聚己内酯、聚乳酸、聚乳酸-羟基乙酸共聚物等,目前上述材料均已用于3D生物打印技术。
聚己内酯(PCL)具有较低的熔融温度(59~64℃),可应用于挤出式3D打印技术中。聚己内酯在室温下呈橡胶状且具有一定的流变性,打印性较好。同时聚己内酯无毒,并具有良好的生物相容性,在三维结构中的主要作用是提供一个支持框架以确保结构的力学强度。聚己内酯也可以和其他生物材料混合,用于增强材料的力学性能。韩国浦项科技大学Dong-Woo Cho小组采用多喷头沉积系统层层叠加聚己酸内酯和海藻酸盐混合物,成功制备出了软骨组织。
聚乳酸(PLA)是一种饱和脂肪族聚酯类,该材料可通过脱酯化进行水解降解,降解后各聚合物的单体成分通过自然途径被代谢。人体的三羧酸循环等调节机制可去除聚乳酸。因此,聚乳酸在3D打印行业中被广泛使用,如可降解的缝合线已通过FDA认证。乳酸和羟基乙酸两种单体混合后,可聚合形成聚乳酸-羟基乙酸,该材料是一种可降解的功能高分子聚合物,具有良好的热塑性、生物相容性,被广泛应用于制药、医用工程材料等领域。聚乳酸-羟基乙酸常作为细胞堆叠的“生物纸”被用于3D生物打印。
聚醚醚酮(PEEK)是目前国际上先进的高分子植入材料,是一种无生物毒性的半结晶高分子,具有质量轻、弹性模量接近原骨、耐热、耐辐射、耐化学腐蚀、抗疲劳性能和抗冲击性能优异等特点,同时具有良好的生物相容性。PEEK材料是非常理想的非金属人工骨植入物替代材料。新加坡南洋理工大学科研人员采用3D打印技术,将聚醚醚酮和羟基磷灰石混合制备出半径为6mm、厚度为5mm的圆柱形支架。近几年,临床医生开始将纯PEEK作为打印材料制造出骨假体,植入患者体内并开展了临床试验。西安交通大学课题组也开展了3D打印PEEK肋骨的相关研究。
不同生物材料各有其优缺点,应根据实际需求具体选择。图2-17展示了常见生物活性材料的3D打印结果。本文将常见3D生物打印材料的性质和特点进行了总结(表2-1),以方便读者查阅和选择。
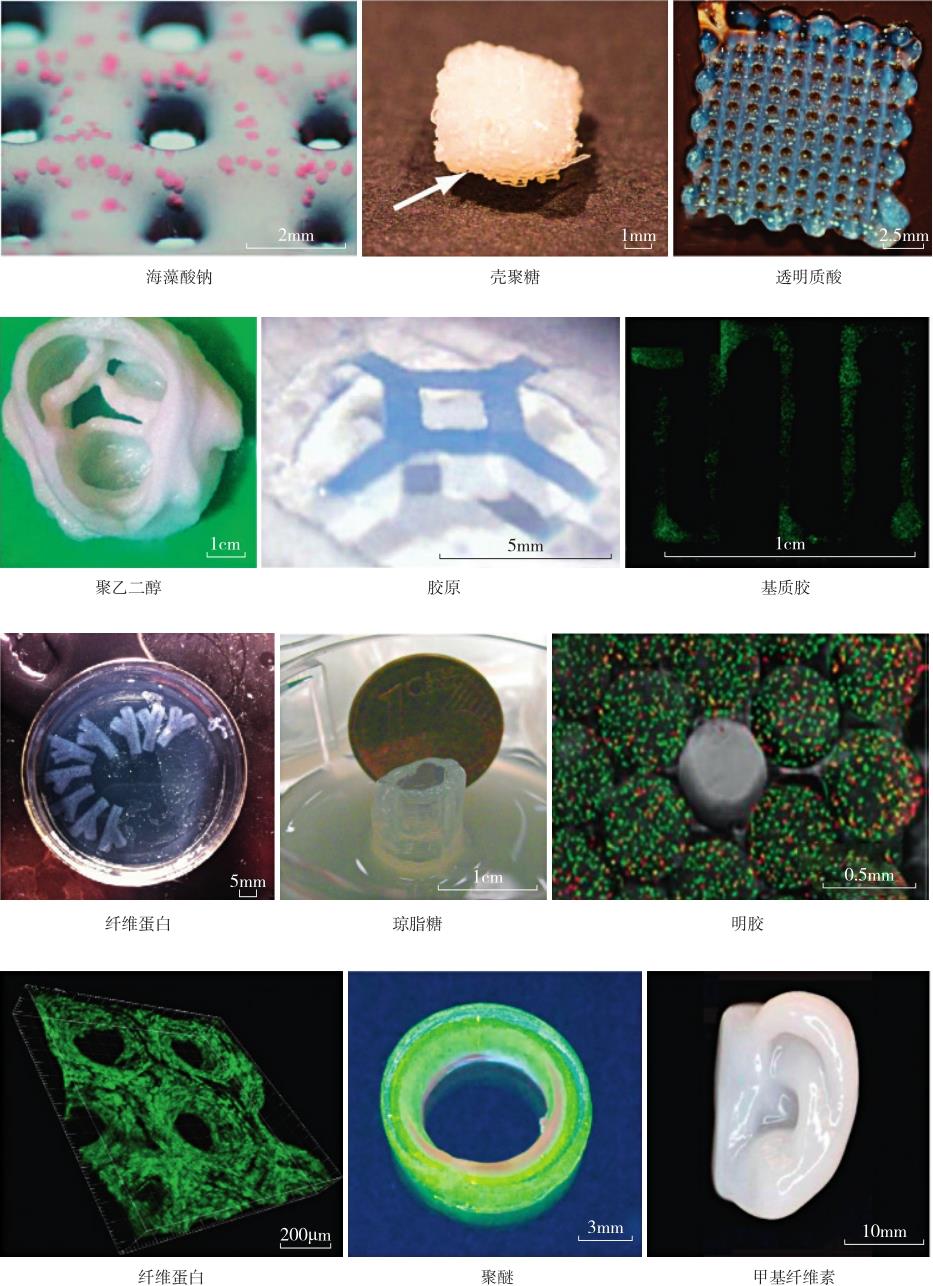
图2-17 3D打印生物活性材料的典型结构
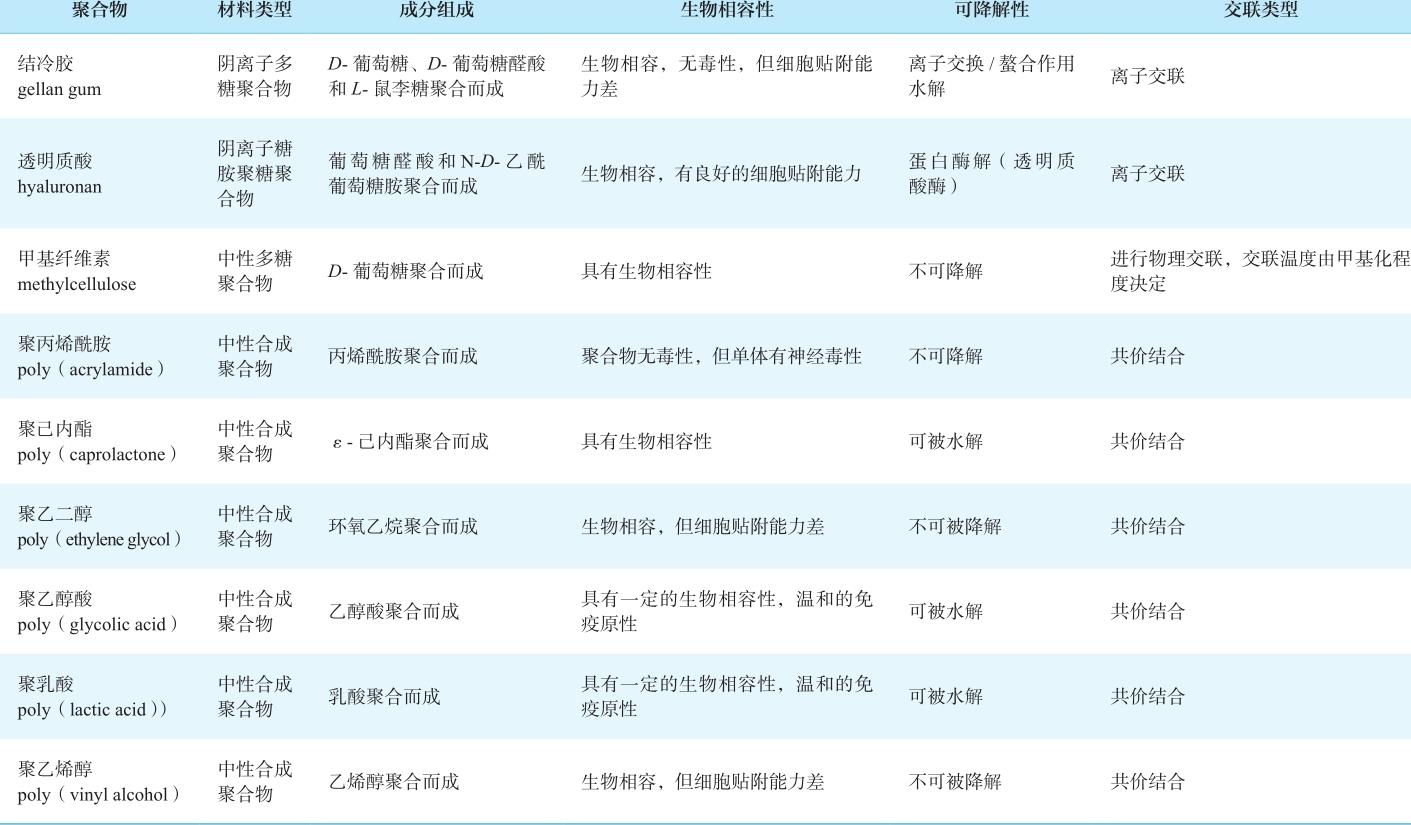
表2-1 常用的3D打印生物活性材料及特性
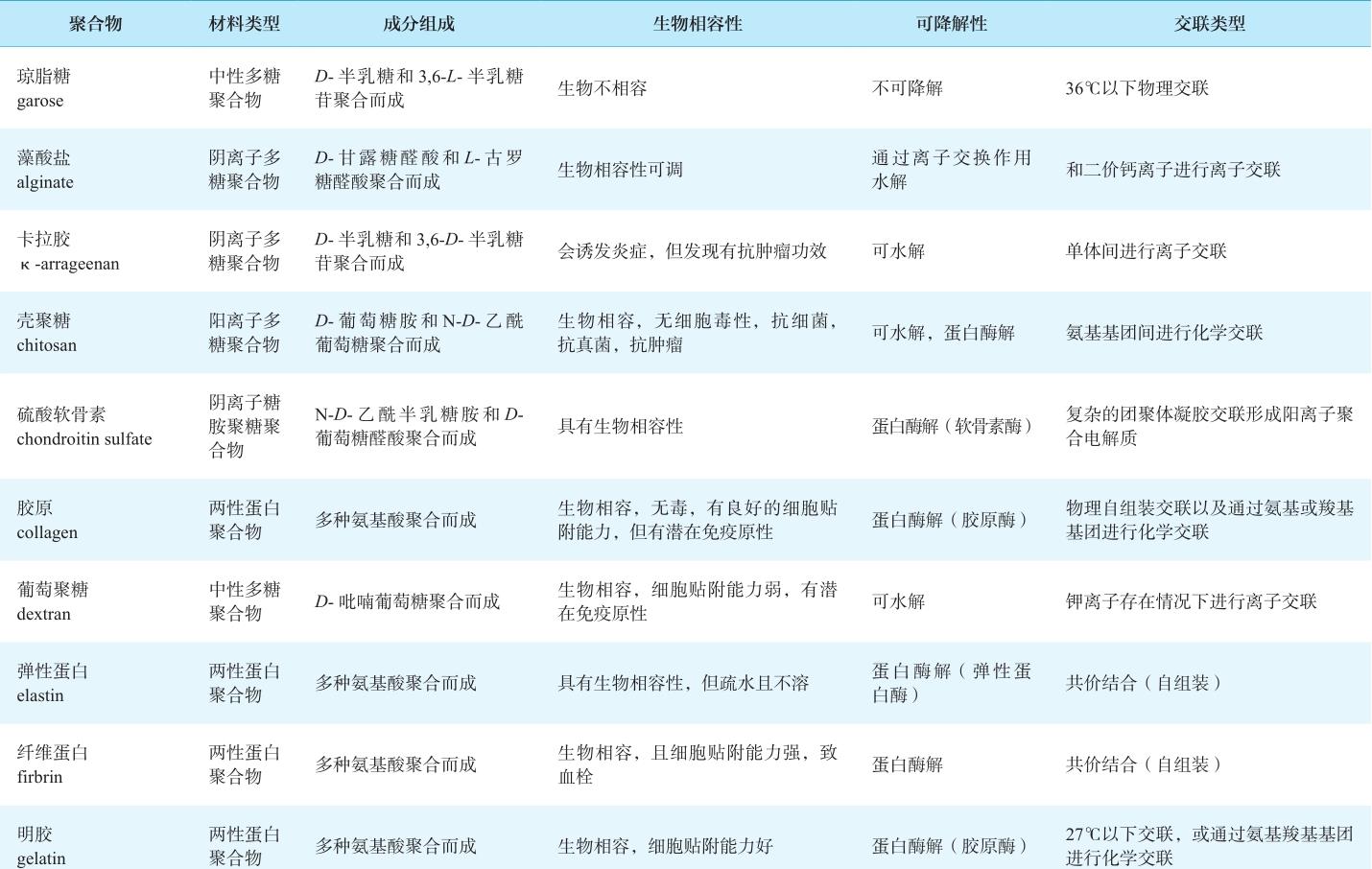
续表
近年来,3D生物打印受到越来越多科研工作者的关注。该技术有望解决组织工程目前面临的众多难题,包括组织结构的血管化、三维复杂结构的构建以及定向诱导干细胞的分化等。对于3D生物打印,选择合适的生物材料至关重要。理想的生物活性材料要求具有可打印性、结构保真性、力学强度、生物相容性以及生物可降解性等,其中决定可打印性的关键指标是剪切变稀以及快速交联。通常,某种材料并不能满足3D生物打印的全部要求。例如,对于特定的某种材料,通过增加聚合物浓度和交联强度可提高材料的力学强度,但同时会降低材料的生物相容性。因此,采用多种材料的混合体系可能是较好的解决方案。通过优化设计,多材料体系可在具备各材料优点的同时又规避各自的缺点,有望满足3D生物打印的需求。
总的来说,生物材料的发展推动着3D生物打印的进步,也使得3D打印的生物组织从实验室真正走向临床。展望未来,3D生物打印有望在将来解决人类众多疾病,从关节炎和烧烫伤的治疗到最终器官的移植替换。
(徐 峰)
[1] CHIMENE D, LENNOX K K, KAUNAS R R, et al. Advanced bioinks for 3D printing: A materials science perspective. Ann Biomed Eng, 2016, 44(6): 2090-2102.
[2] LIPSON H, KURMAN M. Fabricated: The new world of 3D printing. Wiley Publishing(New Jersey), 2013.
[3] MALDA J, GROLL J. A step towards clinical translation of biofabrication. Trends Biotechnol, 2016, 34(5): 356-357.
[4] FISHER O Z, KHADEMHOSSEINI A, LANGER R, et al. Bioinspired materials for controlling stem cell fate. Acc Chem Res, 2010, 43(3): 419.
[5] JUNGST T, SMOLAN W, SCHACHT K, et al. Strategies and molecular design criteria for 3d printable hydrogels.Chem Rev, 2016, 116(3): 1496-1539.
[6] HILBORN J, BJURSTEN L M. A new and evolving paradigm for biocompatibility. J Tissue Eng Regen Med, 2007,1(2): 110-119.
[7] THOMSON A W, FOWLER E F. Carrageenan: a review of its effects on the immune system. Agents & Actions,1981, 11(3): 265-273.
[8] BETTINGER C J. Biodegradable elastomers for tissue engineering and cell-biomaterial interactions. Macromol Biosci, 2011, 11(4): 467.
[9] JOUNG Y K, BAE J W, PARK K D. Controlled release of heparin-binding growth factors using heparin-containing particulate systems for tissue regeneration. Expert Opin on Drug Deliv, 2008, 5(11): 1173.
[10] MA P X. Biomimetic materials for tissue engineering. Adv Drug Deliv Rev, 2008, 60(2): 184-198.
[11] MANDRYCKY C, WANG Z, KIM K, et al. 3D bioprinting for engineering complex tissues. Biotechnol Adv, 2016,34(4): 422-434.
[12] SONG S J, CHOI J, PARK Y D, et al. Sodium alginate hydrogel-based bioprinting using a novel multinozzle bioprinting system. Artif Organs, 2011, 35(11): 1132-1136.
[13] PARK J Y, CHOI J C, SHIM J H, et al. A comparative study on collagen type I and hyaluronic acid dependent cell behavior for osteochondral tissue bioprinting. Biofabrication, 2014, 6(3): 035004.
[14] XU K, CANTU D A, FU Y, et al. Thiol-ene Michael-type formation of gelatin/poly(ethylene glycol) biomatrices for three-dimensional mesenchymal stromal/stem cell administration to cutaneous wounds. Acta Biomaterialia, 2013,9(11): 8802-8814.
[15] LEE K Y, MOONEY D J. Alginate: properties and biomedical applications. Prog Polym Sci, 2012, 37(1): 106-126.
[16] MARKSTEDT K, MANTAS A, TOURNIER I, et al. 3D bioprinting human chondrocytes with nanocellulose–alginate bioink for cartilage tissue engineering applications. Biomacromolecules, 2015, 16(5): 1489-1496.
[17] KUNDU J, SHIM J H, JANG J, et al. An additive manufacturing-based PCL–alginate–chondrocyte bioprinted scaffold for cartilage tissue engineering. J Tissue Eng Regen Med, 2015, 9(11): 1286.
[18] TAN K H, CHUA C K, LEONG K F, et al. Scaffold development using selective laser sintering of polyetheretherketone–hydroxyapatite biocomposite blends. Biomaterials, 2003, 24(18): 3115-3123.