




流式细胞术(FCM)应用荧光标记的抗体组合对造血细胞的胞膜和胞内抗原进行标记,从而识别细胞的系列来源、分化程度。FCM在血液疾病中的应用,包括急性白血病免疫表型分析、非霍奇金淋巴瘤的诊断、微小残留病检测、CD34 + 造血干细胞计数检测、阵发性睡眠性血红蛋白尿症的检测、免疫功能检测等。
FCM对诊断急性白血病的最大优势在于对肿瘤细胞进行系列鉴定(髓系、淋系、单核系、红系、巨核系)及细胞分化程度的判断。FCM的免疫表型分析是对形态学的重要补充,在疾病诊断、预后判断、治疗策略和发病机制的研究上起着举足轻重的作用。
通过免疫表型分析区分急性髓细胞性白血病(AML)和急性淋巴细胞白血病(ALL,B/T-ALL),并帮助鉴别急性白血病的亚型。急性白血病的亚型分类在一定程度上反映了白血病细胞的分化程度,可依据正常细胞的分化规律,通过不同的抗体搭配进行鉴别和分类。
髓系细胞包括粒系、单核系、红系及巨核系细胞,各系细胞在分化发育的早期阶段发生恶性克隆性改变则会出现相应的急性白血病改变。AML中分析急性粒细胞白血病常用到的免疫标记包括:CD34、HLA-DR、CD117、CD13、CD33、CD15、CD11b、CD16、CD45 等,单核细胞相关的标记包括:CD36、CD64、CD14、CD4等,红系细胞相关的标记包括CD71、CD235a等,巨核细胞相关的标记包括CD41、CD61、CD42等。CD34及HLA-DR是造血干/祖细胞相关的抗原标记,表达于原始细胞,而幼稚阶段的粒细胞包括早幼粒细胞及成熟阶段分化的粒细胞不表达,这两个抗原可用来区分白血病细胞的分化程度。CD117是C-Kit原癌基因细胞表面分化抗原,表达于髓系干/祖细胞、早幼粒细胞阶段及原始/早幼红细胞。髓细胞性白血病细胞区别于正常的髓系细胞主要有以下几点:①原始细胞上的正常抗原表达不同步,如CD34与晚期抗原CD15、CD11b等共表达,抗原的不同步表达是AML最常见的一种表型异常形式;②抗原的跨系列表达,如原始髓系细胞表达淋系抗原CD7、CD2、CD19、CD56等;③正常髓系抗原的表达强度改变,表现为低表达、过表达或不表达。
ALL的流式最低诊断分型可以参考1995年欧洲白血病免疫学分型协作组(EGIL)标准(表5-1)。
表5-1 急性淋巴细胞白血病(ALL)的免疫学分型(EGIL,1995)
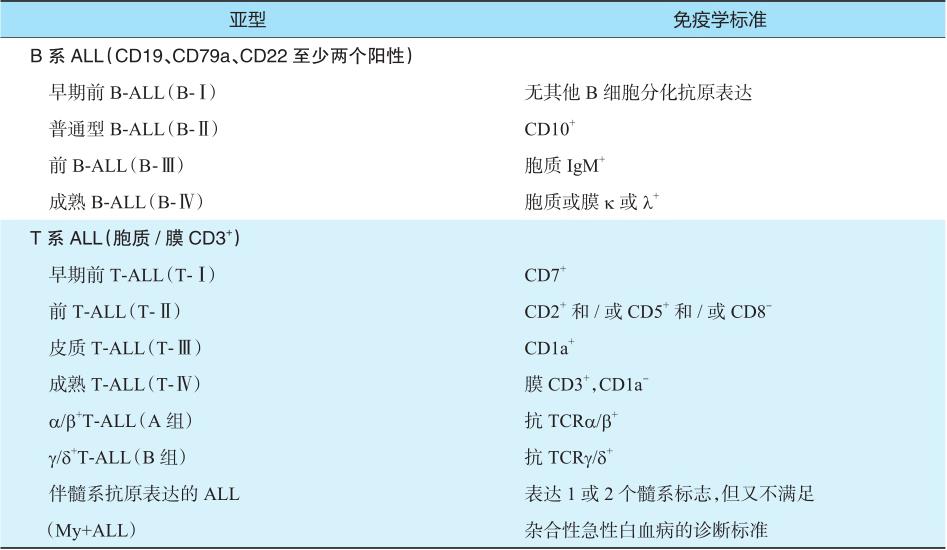
注:α/β + T-ALL、γ/δ + T-ALL:是T-ALL中根据膜表面T细胞受体(TCR)的表达情况进行的分组。
急性系列不明型白血病(acute leukaemias of ambiguous lineage,ALAL)是指没有明确证据表明肿瘤细胞沿单一谱系分化的急性白血病,包括急性未分化型白血病(AUL)和混合表型急性白血病(MPAL)。AUL不表达谱系特异性抗原,MPAL的原始细胞表达一个系列以上标志,以至于不能肯定地将其归为任何单一系列的白血病。MPAL包括双表型急性白血病和双系列急性白血病。
在将白血病归类为AUL之前,必须用一组全面的抗体组合进行免疫表型分析,以排除少见系列白血病,如浆细胞样树突状细胞前体细胞、NK前体细胞、嗜碱性粒细胞甚至非造血细胞肿瘤。
MPAL中的双表型急性白血病是一群白血病细胞同时表达两个或两个系列以上的标志。MPAL中的双系列急性白血病,即同时存在一个系列以上的不同原始细胞群,其中一群原始细胞将独立地满足AML的免疫表型标准,另一群原始细胞则符合T和/或B系ALL的标准。虽然原始细胞必须占所有有核细胞总数的20%,但双系列急性白血病并不要求每一群原始细胞比例达到这个标准。混合表型急性白血病的系列确定建议参照WHO 2008年《WHO造血与淋巴组织肿瘤分类》的标准(表5-2),可以同时参考1998年EGIL标准(表5-3)。
表5-2 WHO诊断混合表型急性白血病的标准

表5-3 EGIL计分法(1995)
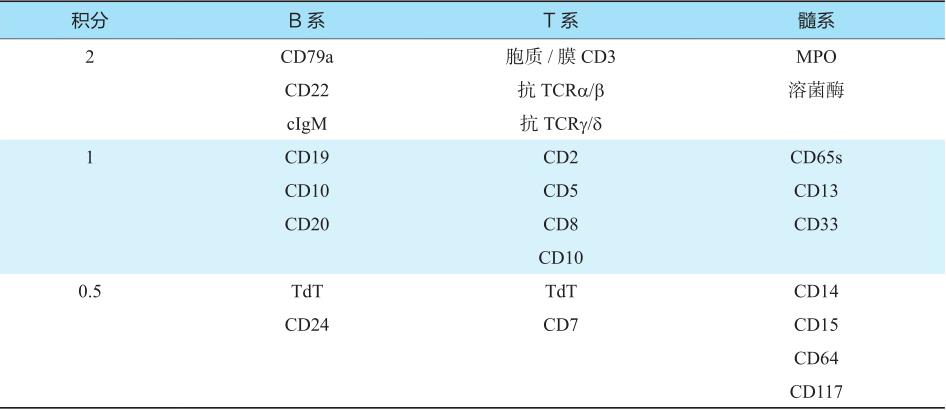
注:EGIL,欧洲白血病免疫学分型协作组;每一系列>2分才可以诊断。
判断与某些核型异常或特异性分子学改变相关的亚型,如AML伴t(8;21)(q22;q22)/RUNX1-RUNX1常见的基因型免疫表型为CD19 + CD56 + CD33 dim+ CD34 + CD117 + 。当FCM检测到基因型相关的免疫表型时,常常提示存在相关的遗传学异常,但不能作为确诊的依据,仍需结合细胞遗传学和分子生物学检测以明确诊断。
如应用FCM检测慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)细胞的CD38、ZAP-70、CD49d高表达,是影响CLL预后的不良因素。
非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)是一组异质性很大的淋巴细胞增殖性疾病,起源于T、B、NK细胞。FCM应用相关系列抗体,不仅可检测淋巴瘤细胞表型,还可以对细胞克隆性进行鉴别,并对部分NHL亚型进行区分。检测的样本包括细胞学样本(血液、骨髓液等)、组织学样本(淋巴结、结外器官或组织)和体液样本(胸腔积液、腹水、脑脊液等)。《流式细胞学在非霍奇金淋巴瘤诊断中的应用专家共识》总结了成熟B细胞淋巴瘤的典型免疫表型鉴别诊断流程(图5-3)以及常见T、NK细胞淋巴瘤的典型免疫表型鉴别诊断流程(图5-4)。
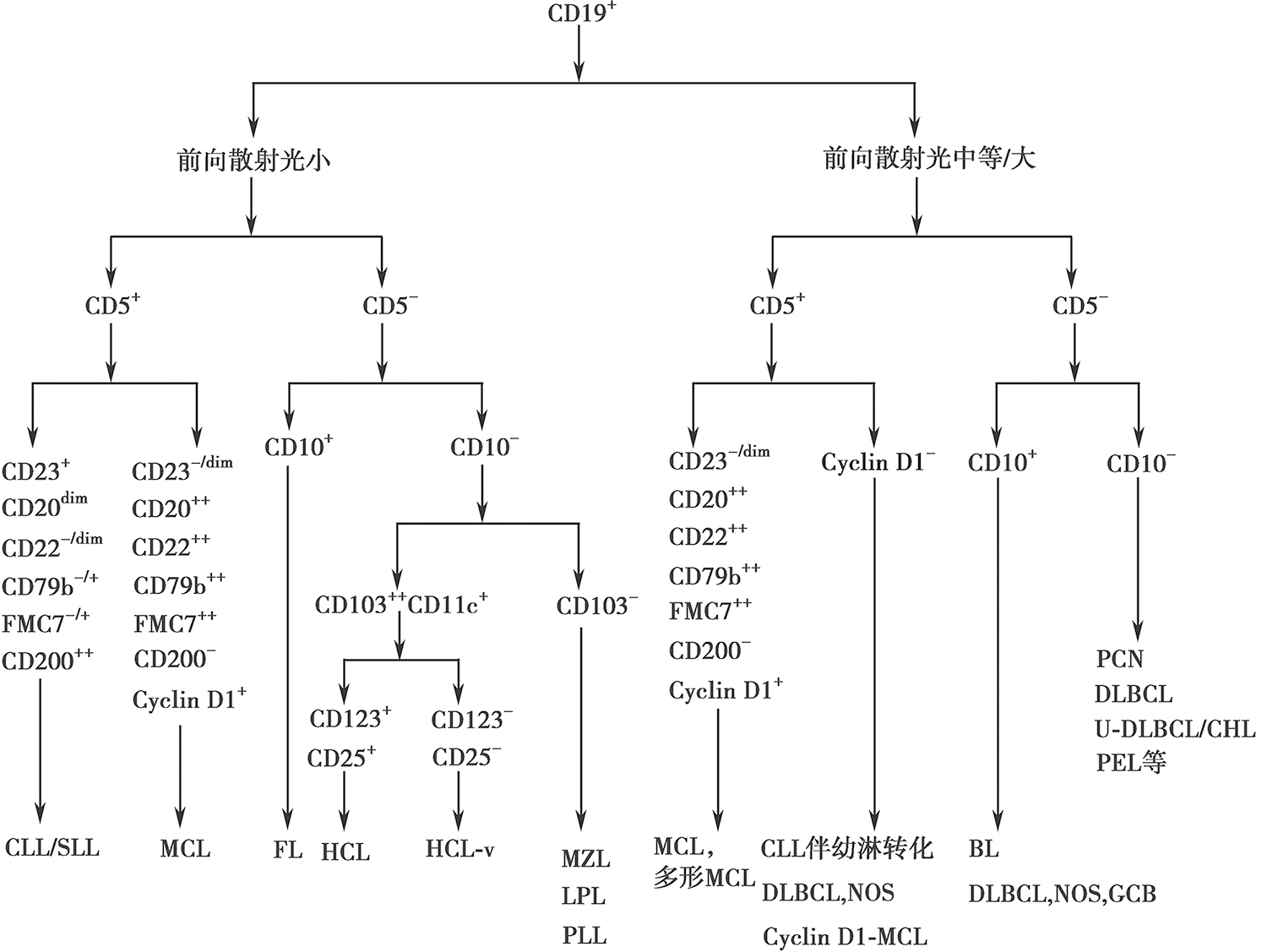
图5-3 成熟B细胞淋巴瘤的典型免疫表型鉴别诊断流程
CLL/SLL:慢性淋巴细胞白血病/小淋巴细胞淋巴瘤;MCL:套细胞淋巴瘤;FL:滤泡淋巴瘤;HCL:毛细胞白血病;HCL-v:毛细胞白血病-变异型;MZL:边缘区淋巴瘤;LPL:淋巴浆细胞淋巴瘤;PLL:幼淋巴细胞白血病;DLBCL,NOS:非特指型弥漫大B细胞淋巴瘤;BL:伯基特淋巴瘤;PCN:浆细胞肿瘤;GCB:生发中心B细胞;U-DLBCL/CHL:介于DLBCL和经典霍奇金淋巴瘤之间的B细胞淋巴瘤;PEL:原发渗出性淋巴瘤。
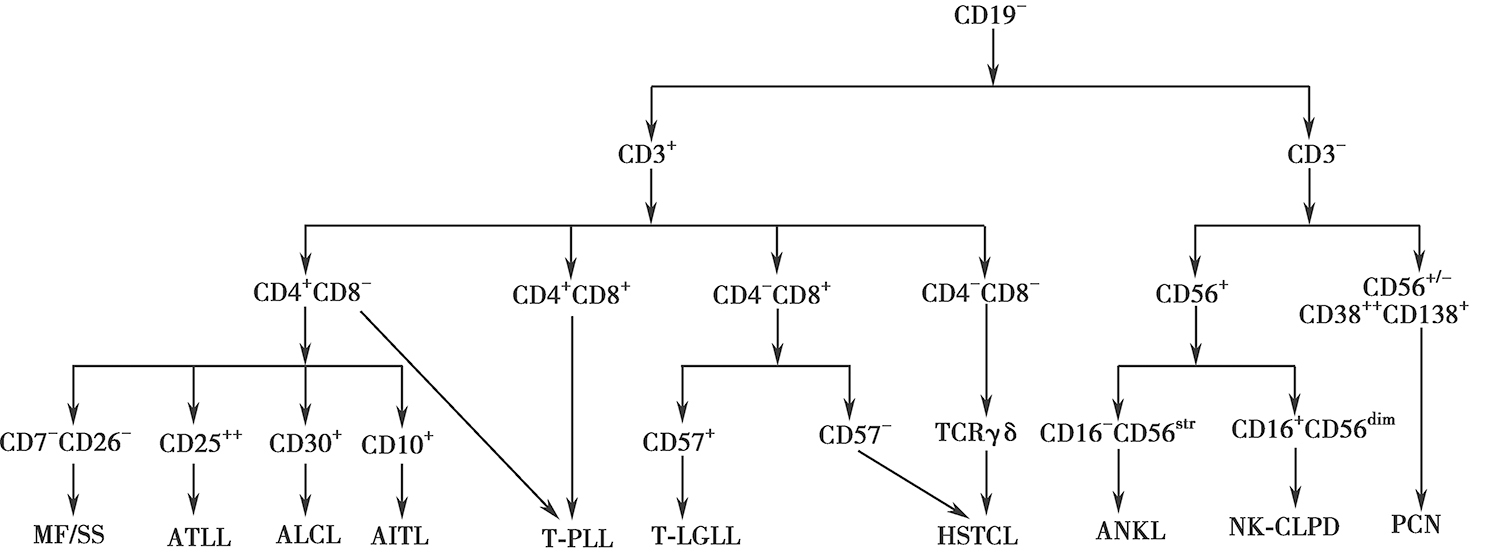
图5-4 常见T/NK细胞淋巴瘤的典型免疫表型鉴别诊断流程
MF/SS:蕈样肉芽肿/Sezary综合征;ATLL:成人T细胞白血病/淋巴瘤;ALCL:间变大细胞淋巴瘤;AITL:血管免疫母细胞T细胞淋巴瘤;T-PLL:T细胞幼淋巴细胞白血病;T-LGLL:T大颗粒淋巴细胞白血病;HSTCL:肝脾T细胞淋巴瘤;ANKL:侵袭性NK细胞白血病:NK-CLPD:NK细胞-慢性淋巴增殖性疾病;PCN:浆细胞肿瘤。
用于大多数成熟B细胞淋巴瘤分析的标记有CD19、CD20、CD22、CD79b、FMC7、CD23、CD103、CD25、CD200等,结合前向散射光(FSC)和 CD5、CD10 的抗原表达特征,对成熟B细胞淋巴瘤进一步区分亚类。
绝大多数成熟B细胞肿瘤限制性表达膜表面分泌型免疫球蛋白(sIg)轻链κ或λ(κ/λ>3:1或<1:3)。如果B细胞不表达sIg,建议进一步行胞质轻链检测,通常可检测出限制性表达。
T细胞淋巴瘤的诊断与分型主要依靠病理活检、免疫组织化学染色、TCR基因重排检测,但FCM检测到以下免疫表型时需考虑T细胞淋巴瘤的可能性。
CD4:CD8比例失衡,大于10:1或小于1:10;CD4 + CD8 + 或CD4 - CD8 - T细胞比例增高;泛T抗原表达异常,主要表现为CD7、CD5、CD2、CD3抗原表达强度减弱或增强;淋巴细胞群中某些抗原,如CD16、CD25、CD56、CD57等表达增多;伴异常抗原表达,如CD30、CD10、CD20、CD103、CD13、CD33等。当样本中肿瘤细胞比例较低时需通过多参数分析设门进行判断。
应用FCM检测αβT细胞TCRvβ的24种表位鉴定其克隆性,出现其中1种TCRvβ抗原的显著增高或者24种表位总和的显著减低,提示T细胞克隆性增殖。需要注意的是,该方法只能覆盖所有TCRvβ家族的70%,并且某些免疫反应,如病毒感染、自身免疫性疾病也会出现T细胞的克隆性增生,所以即使FCM检测到克隆性T细胞,仍需要充分结合临床、遗传性检测等确定其是否为肿瘤性。
临床上用FCM对NK细胞淋巴瘤辅助诊断的疾病主要有NK细胞-慢性淋巴增殖性疾病(NKCLPD)、侵袭性NK细胞白血病(ANKL)、结外鼻型NK/T细胞淋巴瘤等。
通常sCD3 - 、CD5 - ,伴有NK细胞标志物CD16、CD56或CD57的表达,部分可出现CD2和CD7表达减弱或缺失,少数病例可伴有CD5的表达。不同类型的NK细胞淋巴瘤NK细胞表型有各自的特点。
通常选择CD158a/h、CD158b、CD158e、CD158k、CD158i等杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)系列抗原鉴别NK细胞克隆性,目前这些抗原的检测仅能覆盖部分CD158抗原簇。检测到NK细胞克隆性并不意味着恶性,仍需要结合临床表现等进行综合分析。
对于发病时骨髓或外周血浸润明显的CLL、MCL、HCL等淋巴瘤,应用多参数(8色以上)FCM检测MRD敏感度达10 -4 ,而CLL依据合理的抗体组合,获取白细胞总数2×10 6 时,敏感度可达10 -5 。相对于B细胞淋巴瘤,T/NK细胞淋巴瘤由于缺乏明确的克隆性依据,其应用尚不成熟,检测结果需要与其他检测结果相结合综合评估。
微小残留病(minimal residual disease,MRD)是指恶性血液病经化疗或骨髓移植达到血液学完全缓解后体内残存的形态学上不能检测到的微量白血病细胞状态。2018年欧洲白血病网(ELN)提出MRD术语的含义应为measureable residual disease,即可检测的残留病。
遗传学特征是初诊白血病在治疗前最重要的预后判读指标,FCM-MRD作为白血病治疗后的检测指标,与遗传学结合可更好地判读预后并指导个体化治疗,对高复发风险的患者可及时调整化疗方案和强度,对低复发风险的患者可避免过度治疗引起的毒副作用。
多参数流式细胞术(multiparameter flow cytometry,MFC)用于血液肿瘤MRD检测,可高敏感、高特异性地识别导致复发的白血病细胞。MFC-MRD由两种不同的方法来评估。
其特点是在初诊时定义LAIP,在随后的检测样本中根据初诊时所定义的LAIP设计特异性抗体组合,并跟踪这些LAIP。
LAIP包括几种形式:抗原跨系表达、抗原跨阶段(非同步)表达、抗原表达量的异常、散射光信号异常以及表达少数白血病特异性抗原(如NG2)。
原理是始终以同系列相同分化阶段的正常细胞作为对照,在每次检测时,观察是否存在与正常细胞免疫表型不同的细胞群体,从而判断是否存在MRD。它是基于在随访时识别出肿瘤细胞的异常分化/成熟曲线。
没有初诊免疫表型作参考时,可以应用DFN方法,并且还可以检测到新的异常。实质上,LAIP在绝大多数情况下是DFN异常。建议将这两种方法的优点有机结合起来,以确定MRD负荷,并且注意在随访时检测新出现的异常。
白血病不同亚型、不同治疗阶段、不同危险度分层下的MRD检测与疾病的复发、无事件生存(EFS)、总生存(OS)等均有关系。
检测样本通常用EDTA或肝素抗凝,两者无显著差异性。选择骨髓还是外周血,由于不同类型血液病的细胞起源、遗传背景、生物学特性、药物敏感性以及化疗后肿瘤细胞在外周血和骨髓中的凋亡、倍增时间的不同,MRD的敏感性存在一定的差异。
AML形态学达完全缓解后,骨髓标本的检测敏感性明显优于外周血标本,可相差一个对数级。对于B-ALL的MRD检测,外周血敏感性较骨髓低1~3个对数级,所以建议首选骨髓。为了最大限度地提高检测敏感度,必须避免骨髓样本的血液稀释。所以,建议选取第一管骨髓样本用作MRD分析。同时,样本量的细胞数要保证流式检测时能获取足够多的细胞用于分析。
从诱导治疗开始,不同时间点的MRD检测对预后的指导意义不同。诱导治疗后的MRD检测,可指导早期危险度分层和巩固治疗策略的选择。巩固治疗后的MRD检测,可指导维持治疗的强度和出现MRD水平复发时的挽救治疗策略。化疗后骨髓造血细胞恢复的不同时期,其MRD检测的敏感性也有不同程度的差异。
MRD的检测频率没有统一的标准。肿瘤细胞的增殖动力因细胞的遗传学特征不同而不同,所以从分子水平复发到血液学复发的时间也不一致,需根据疾病类型、遗传学特征和患者的年龄、治疗方案而选择检测频率。对复发危险度较高的患者,检测频率要相对较高。
MRD的阳性阈值即阴性、阳性界限(cut off值)的界定。主要取决于以下几个方面:白血病细胞的LAIP特异性和敏感性、治疗后不同时间点标本中正常细胞的背景干扰程度、不同治疗方案对白血病克隆选择性清除和表型漂移的影响等。
目前血液肿瘤微小残留病的检测有几种常用的方法,包括多参数流式细胞术(MFC)、实时定量聚合酶链反应(PCR)、二代测序(NGS)、数字PCR等,各种方法的MRD检测敏感度不同。形态学能检测到10 -2 水平的白血病细胞,MFC可达10 -4 检测水平,PCR检测灵敏度达到10 -4 水平,NGS可达到10 -6 水平。PCR和NGS具有更高的敏感性和特异性,但仅适用于部分白血病患者,MFC则适用于更多的患者,但对检验人员的技术和经验有较高要求,结果判读包含一些主观因素。
欧洲流式细胞学会建议应用两管8色抗体组合的二代流式细胞术(next generation flow cytometry,NGF)用于多发性骨髓瘤MRD检测,其突出特点是采用Infinicyt软件把两管检测数据融合在一起,分析高达1×10 7 个细胞,其敏感性可达10 -6 。
MRD各检测方法应相互结合,以提高检测阳性率。评估时需结合临床特征和其他指标综合判断,不能将MRD值作为临床评价缓解的单一指标。
1.造血干细胞移植(hematopoietic stem cell transplantation,HSCT)时,采集物中CD34 + 细胞的数量和质量是决定能否快速移植成功的关键因素,应用FCM精确检测CD34 + 细胞的绝对值计数,对确定造血干细胞的采集时机、判断移植后植活和免疫重建状态非常重要。
2.用于再生障碍性贫血(aplastic anemia,AA)的诊断。2017年的《再生障碍性贫血诊断与治疗中国专家共识》提出FCM检测CD34 + 细胞数量为诊断的必检项目。
CD34 + 细胞绝对计数由流式细胞仪测得的CD34 + 细胞百分比和全血细胞分析仪测定的白细胞计数计算得到。白细胞密度与抗体用量同单平台方法相比,不需要采用已知数量的荧光微球管或加入荧光微球悬液。
单平台CD34 + 细胞计数法是在计数管中加入已知数量的荧光微球,采用FCM获取CD34 + 细胞百分比的同时,根据获取的已知密度的荧光微球数来计算出CD34 + 细胞绝对数。单平台计数法裂解红细胞后不需洗涤,不需要采用血细胞计数仪计数白细胞,因此系统误差小,被认为是首选的CD34 + 细胞计数方法。
CD34 + 细胞在骨髓(BM)、动员外周血(MPB)和脐带血(CB)中的含量非常低,推荐采用全血溶血法进行CD34 + 造血细胞计数,建议单平台法进行绝对数检测。标本的采集和制备、抗体选择、检测方法、流式细胞仪的质量控制、数据获取和分析、结果报告和审核、数据储存等诸多环节应严格按照规章流程进行。
阵发性睡眠性血红蛋白尿症(PNH)的传统检测方法有以补体溶血为基础的血清酸化溶血试验(Ham试验)、糖水试验(蔗糖溶血试验),以及尿含铁血黄素染色试验(Rous试验),其敏感性和特异性较差,不利于PNH的早期诊断。FCM检测并计数PNH克隆细胞,是目前诊断PNH最直接、最敏感、最特异的方法,包括以下两种检测方法。
用荧光素标记的CD55、CD59单克隆抗体与血细胞膜上的糖化磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚蛋白抗原分子进行结合,经FCM检测,正常人造血细胞CD55和CD59均为阳性表达,PNH患者由于细胞表面锚蛋白部分或完全缺失,而呈现CD55和/或CD59部分或完全阴性表达。
分析未输血的PNH患者红细胞,可将红细胞分为三种类型:Ⅰ型细胞(正常表达)、Ⅱ型细胞(部分缺失)、Ⅲ型细胞(完全缺失)。临床溶血程度主要取决于Ⅲ型细胞的多少。分析粒细胞时,建议使用系列标记(非GPI锚蛋白,如CD15、CD33、CD45)/SSC设门圈出粒细胞,然后再分别检测目标粒细胞GPI相关抗原(CD55、CD59)的表达。PNH粒细胞的百分含量准确地反映了PNH克隆大小。所以,患者外周血标本PNH粒细胞的动态监测是疾病活动性最准确的指标。
单纯CD55缺乏并不能导致溶血,这在先天性CD55缺乏症患者中已经得到证实,所以不能单纯检测CD55。CD59的敏感度要高于CD55,检测粒细胞的CD59有早期诊断价值,并且受输血影响小。PNH红细胞寿命短,特别是在严重溶血或输血后,GPI的红细胞比例减少,此时如果仅检测红细胞的CD55、CD59,会造成假阴性,所以在建立PNH诊断时至少需要有一系及以上细胞的2种GPI锚蛋白缺失。PNH粒细胞的百分含量准确地反映了PNH的克隆大小,所以患者外周PNH粒细胞监测是疾病活动性的准确指标。
嗜水气单胞菌溶素变异体(aeromonas hydrophila lysin variant,FLAER)是Alexa-488标记的无活性嗜水气单胞菌溶素前体的变异体,可特异性地与血细胞膜上的GPI锚蛋白结合,在一定条件下被激发出荧光,经FCM检测后,区分出GPI + 和GPI - 细胞。正常人造血细胞为系列抗原和FLAER双阳性表达,PNH患者由于细胞表面锚蛋白部分或完全缺失,表现为FLAER阴性或部分阴性表达。
FLAER作用于所有GPI锚蛋白,不会因不同细胞表达GPI锚蛋白种类和多少的不同形成误差,是诊断PNH更敏感、更特异的方法。由于红细胞表面没有气单胞菌溶素前体产生所需要的蛋白水解酶类,所以,FLAER主要用于有核细胞的检测,不能评价红细胞的PNH克隆。
与CD55、CD59检测相比,FLAER具有更敏感、更特异的特点,特别是对检测微小PNH克隆更敏感,而且不受输血和溶血的影响。FLAER检测可精确区分Ⅱ、Ⅲ型细胞,为判断病情轻重提供依据,有助于PNH患者的疾病进展和疗效判断。对于长期应用免疫抑制剂治疗的血细胞减少的患者,特别是再生障碍性贫血、骨髓增生异常综合征等疾病,可检测是否发生了PNH克隆改变,及早发现病情变化。FLAER直接检测GPI锚蛋白,可明确真正的GPI细胞,而非自身抗体覆盖细胞膜锚蛋白的假性PNH克隆。
免疫系统具有免疫防御、免疫监视、免疫自稳三大功能,由免疫器官、免疫细胞、免疫分子组成。免疫细胞间相互作用导致多种细胞因子的释放,因此,免疫功能的检测不仅涉及免疫细胞数量和功能的检测,还包括细胞因子的测定,但目前对免疫细胞功能的检测程序复杂,还没有标准化。应用FCM对免疫细胞表型进行分析不仅对免疫细胞的分化、功能以及鉴别新的亚群有重要意义,关键是在对疾病的诊断、疗效评估、病情监测等方面发挥着越来越重要的作用。
在血液病的诊疗过程中,《再生障碍性贫血诊断与治疗中国专家共识(2017年版)》明确提出再生障碍性贫血诊断时必检项目须包括免疫相关指标:T细胞亚群(如CD4 + 、CD8 + 、Th1、Th2、Treg等)及细胞因子(如IFN-γ、IL-4、IL-10等)。这是针对发病机制的检测,因为目前认为再生障碍性贫血是T细胞异常活化、功能亢进造成的骨髓衰竭性损伤。再生障碍性贫血免疫功能检测是诊断所必需的,也是应用针对免疫发病机制选择、治疗免疫抑制药物的基础。联合免疫抑制治疗后在获得血液学缓解时监测免疫状态,依据免疫指标恢复的时间顺序进行疗效评估,指导药物减停,防止复发。免疫指标在再生障碍性贫血的应用经验,将会为免疫功能检测在自身免疫性疾病、免疫缺陷病、感染性疾病、肿瘤、器官移植后排斥反应、免疫重建等方面的应用提供重要参考价值。免疫细胞包括淋巴细胞、粒细胞、单核巨噬细胞、树突状细胞等。
包括淋巴细胞亚群的相对计数(百分比)和绝对计数检测。FCM可直接测定淋巴细胞亚群的百分比,而绝对计数的检测包括2种方法。
采用定量微球,直接获得淋巴细胞亚群绝对计数。
采用FCM测定的淋巴细胞百分比,结合血常规中总淋巴细胞数量,计算得到各亚群淋巴细胞的绝对计数。建议采用单平台方法进行绝对计数以减少室间变异,并避免多台仪器间的系统误差。绝对计数的判断应注意仪器、年龄段、种族等因素的影响,同时个体间的变化也较大,各个实验室所采用的标准也不同。
在应用时需百分比和绝对计数相互结合,如果仅检测百分比,对评估疾病的免疫状态有较大局限性。通常百分比可反映机体整体的免疫状态,但某些疾病(如噬血细胞综合征)会引起T、B、NK细胞同时减少,此时若仅检测相对计数就无法发现异常,所以应结合绝对计数综合评估。
淋巴细胞来源于骨髓的造血干细胞,分化成熟后分布于血液、淋巴液及淋巴组织中,当受到不同抗原刺激后,活化、增殖、分化为不同阶段、不同功能的效应细胞,执行不同的免疫功能。
包括 T细胞(CD3 + )、B细胞(CD3 - CD19 + )、NK 细胞(CD3 - CD16 + CD56 + ),其中T细胞包括两个亚群:辅助性T细胞(Th,CD3 + CD4 + )和杀伤性T细胞(Ts,CD3 + CD8 + )。
淋巴细胞亚群具有高度异质性,仅仅检测T、B、NK三大细胞亚群,不能完全解释疾病发生、发展过程中的免疫状态,如同样都是T细胞增高,但增高的T细胞是抑制状态还是活化状态,那么产生的免疫应答不同,临床结局也大不相同,对疾病的预后判断也不一样。所以,有必要详细了解淋巴细胞的精细亚群,以评估淋巴细胞不同分化阶段、不同活化状态对疾病的影响。
T细胞检测:根据T细胞TCR的不同分为αβ T细胞和γδ T细胞;依据分泌的细胞因子谱不同将辅助性 T 细胞分为 Th1(CD4 + IFN-γ + )、Th2(CD4 + IL-4 + )、Th9(CD4 + IL-9 + )、Th17(CD4 + IL-17 + )、调节性T细胞(Treg,CD4 + CD25 + 127 - )。B细胞检测:依据细胞来源、功能及免疫表型可分为多个亚群。从细胞来源上,B细胞分为非骨髓来源的B1细胞和骨髓来源的B2细胞。B1细胞又依据CD5的表达情况分为CD5 + 的B1a和CD5 - 的B1b细胞。依据膜表面标记CD19、CD27、CD38、CD24、IgD又可将外周血B细胞分为过渡型B细胞(CD19 + CD27 - CD38 high CD24 + )、初始B细胞(CD19 + CD27-IgD + )、记忆B细胞(CD19 + CD27 + CD38 dim IgD - )和浆母细胞(CD19 + CD27 high CD38 high IgD - )等。
T细胞活化状态可用CD25、CD69、CD38、HLA-DR将T细胞分为早期、中期、晚期活化T细胞;其分化状态可应用CD45RA、CD45RO、CD62L、CCR7等将T细胞分为初始T细胞(CD3 + CD4 + CD45RA + CCR7 + )、效应 T 细胞(CD3 + CD4 + CD45RA + CCR7 - )、记忆 T 细胞,记忆 T 细胞又可分为效应记忆T细胞(CD3 + CD4 + CD45RA - CCR7 - )和中心记忆 T细胞(CD3 + CD4 + CD45RA - CCR7 + )。
免疫表型往往可以反映细胞的功能,但并不能完全替代淋巴细胞功能的检测。目前淋巴细胞功能的检测和应用尚无统一的标准,仍需更多的临床研究以探明淋巴细胞免疫表型与细胞功能以及与疾病间的关系。
细胞因子是免疫细胞和非免疫细胞合成、分泌以及发挥功能的具有多种生物活性的多肽或蛋白质。通过检测细胞因子对进一步研究免疫细胞的功能有重要意义。用于临床的主要有三种方法:ELISA法、细胞内染色法和流式细胞微球芯片捕获技术(cytometric bead array,CBA),后两种方法通过FCM检测。
原理是用Brefeldin(BFA)、Monensin阻断细胞内高尔基体介导的转运,使得细胞因子聚集、蓄积、增强的细胞因子信号可被FCM检测。方法是用抗细胞因子抗体与细胞表面或胞内特定亚群标志结合,即可检测单个细胞内多个细胞因子,并可区分表达特定细胞因子的细胞亚群,如分泌 IL-2、IFN-γ的Th1细胞,分泌IL-4、IL-5、IL-6、IL-10等的 Th2细胞,分泌 IL-17的 Th17细胞。
是直接检测分泌到细胞外的处于游离状态的细胞因子。它是在具有特定荧光强度的人工合成微球上包被特定的细胞因子抗体,当微球与待测样品混合后,微球上的特异性抗体就会与样品中相应的细胞因子结合,然后加入荧光标记的检测抗体,形成“三明治”夹心复合物结构,最后通过FCM对目的因子进行检测。
CBA法检测所需样本体积为传统ELISA的1/6,50μl体积即可对多种细胞因子进行快速定量检测,对于稀有样本CBA法是目前最好的选择。同时CBA稳定性好,可重复性高,检测速度快,灵敏度高,能避免酶联免疫放大技术使信号失真导致的假阳性。此方法已广泛应用于免疫学领域、干细胞领域、肿瘤研究、CAR-T治疗后的细胞因子检测等。
与血小板相关的血液疾病,如先天性血小板功能异常所致的巨血小板综合征、血小板无力症,免疫介导的血小板减少相关的免疫性血小板减少性紫癜等疾病,应用FCM对血小板进行分析,其应用越来越广泛。主要体现在以下几个方面:
1.血小板糖蛋白表达的分析,如GPⅠb/Ⅸ/Ⅴ复合物(CD42b/CD42a/CD42d)、GPⅡb/Ⅲa(CD41/CD61)、GP Ⅰa(CD49b)等的定性和定量分析。
2.网织血小板计数用RNA染料使血小板染色,测定血小板内RNA的含量,计数含RNA的血小板(网织血小板)数量。
3.血小板自身抗体测定包括特异性血小板抗体、血小板相关免疫球蛋白(PAIg)、血小板同种抗体、药物相关血小板抗体等。
4.血小板计数 以CD41或CD61设定血小板门,计数单位体积血液中血小板的绝对数量,尤其是血小板减少症患者血小板的计数。
血小板膜表面糖蛋白主要存在于静止的血小板膜表面,其中GPⅠb/Ⅸ/Ⅴ复合物(CD42b/CD42a/CD42d)、GPⅡb/Ⅲa(CD41/CD61)分别与巨血小板综合征和血小板无力症的发病有关。FCM分析健康人的GPⅠb、GPⅨ、GPⅤ、GPⅡb、GPⅢa阳性血小板>98%。
患者血小板膜糖蛋白GPⅠb/Ⅸ/Ⅴ复合物缺乏,不能使血小板黏附到损伤的血管内皮下启动止血。FCM直接检测血小板膜GPⅠb/Ⅸ/Ⅴ复合物数量的减少或缺如,是诊断巨血小板综合征的重要方法。
患者的血小板膜糖蛋白GPⅡb(CD41)和/或GPⅢa(CD61)质或量的异常,导致血小板对各种生理性诱导剂的聚集大大减少或缺如。FCM检测GPⅡb/Ⅲa的数量是诊断血小板无力症的重要方法。
巨血小板综合征和血小板无力症均属于先天性血小板功能异常,对于获得性血小板功能异常可由多种原因引起,如原发病、肿瘤、药物、手术等,FCM通过分析血小板膜糖蛋白的改变,协助诊断获得性血小板功能异常。
网织血小板(reticulated platelet,RP)是循环血中最年轻的血小板,可作为分析血小板生成状态的指标,相对于成熟血小板,RP中残留有mRNA,噻唑橙(TO)可透过血小板膜特异性地结合RNA,FCM可对带有核酸特异性荧光标记的RP进行检测。
网织血小板计数可应用于免疫性血小板减少性紫癜的协助诊断。造血干细胞移植后检测RP可预测骨髓的恢复情况。在白血病化疗后骨髓恢复过程中检测RP,可预测骨髓生成血小板的能力。检测RP的临床意义,还有待更多的临床研究进行评估。
血小板自身抗体包括血小板相关免疫球蛋白(PAIg:PAIgG、PAIgA、PAIgM),血小板特异性膜糖蛋白自身抗体、抗同种血小板抗体等。血小板自身抗体的检测主要用于免疫性血小板减少性紫癜的协助诊断。
FCM通过检测富含血小板血浆或全血样本,测定血小板膜上的PAIg,但PAIg的来源可能是机体免疫系统产生的针对血小板的自身抗体,结合在血小板膜上,也可能是血清中的抗原-抗体复合物覆盖或黏附在血小板表面,所以在协助诊断免疫性血小板减少症时,PAIg的测定敏感性较高,但特异性不高。
应用单克隆抗体特异性捕获血小板抗原试验(MAIPA法)和流式微球检测抗原特异性自身抗体,特异性较高,可以鉴别免疫性与非免疫性血小板减少,有助于免疫性血小板减少症的诊断,但不能鉴别免疫性血小板减少性紫癜与继发性免疫性血小板减少症。
循环中血小板计数减少是临床引起不同程度出血的主要原因。目前,血小板计数主要应用自动血细胞分析仪进行分析,但往往受到小红细胞、细胞碎片等的影响,使血小板计数偏高,而大的血小板不能被计数,导致计数减低,影响对真正血小板计数的判断。
FCM检测分析,应用红细胞和血小板比值法或荧光微粒绝对计数法进行免疫血小板计数可准确地计数血小板,对放疗、化疗、骨髓移植后造血功能的检测,骨髓造血功能衰竭引起的血小板严重减少具有重要意义。
(袁小庚)