




支气管肺隔离症(bronchopulmonary sequestration)是肺先天发育异常,被隔离的肺组织与正常肺组织之间有胸膜将其分离,并接受体循环动脉的血液供应,包括叶内型和叶外型两种。叶外型即位于脏层胸膜外,表现为有胸膜包裹性的肿块,多见于婴幼儿,可伴有支气管食管憩室、膈疝和骨骼异常等其他类型的先天性畸形。叶内型指肺内的肺隔离症,可发生于儿童,更多见于20岁以上的成人。诊断叶内型支气管肺隔离症的主要依据是被隔离的肺组织与正常肺组织内的支气管不相通,且有独立的动脉血供,内见多数囊性扩张的支气管、伴有慢性炎症和纤维化的肺组织,被隔离的肺组织内无炭末沉着。
支气管源性囊肿(bronchogenic cyst)被认为是在胚胎发育期间,呼吸道上皮与气管支气管树分离并移行到其他部位所致,分为肺内型、纵隔型和异位型,囊肿通常位于气管隆嵴下方或中纵隔,发生在肺实质内者相对较少。异位型罕见,可发生于颈部、脑部、硬脊膜、腹腔等。组织学上囊肿衬以呼吸道上皮,由杯状细胞和假复层纤毛柱状上皮构成,囊壁可含平滑肌,罕见软骨,无炭末沉着。
先天性支气管扩张(congenital bronchiectasis)表现为先天性的小气道发育不全或缺乏软骨及软骨环,呈囊性扩张的状态。镜下可见囊壁内衬纤毛柱状上皮,囊壁内围绕平滑肌和纤维,常见慢性炎细胞浸润。
先天性囊性腺瘤样畸形(congenital cystic adenomatoid malformation,CCAM)是一种较少见的肺发育异常性疾病,多见于婴幼儿,成人也可发生。按囊的大小和内衬上皮,分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ型。
(1)0型为外围性囊肿,常伴有严重的肺发育不良,是致死性近端气管支气管畸形。
(2)Ⅰ型最常见,囊腔较大,直径可达3~10cm,囊腔内衬假复层纤毛柱状上皮,厚壁内存有平滑肌和弹力组织,局部可见小灶软骨,周围同时伴有小囊腔(图5-1)。
(3)Ⅱ型的囊较小,类似终末细支气管结构,一般直径小于2cm,囊壁内衬立方或柱状上皮,在间隔和邻近囊壁内可见横纹肌。
(4)Ⅲ型囊最小,直径常在0.5cm以下,类似细支气管肺泡导管结构,病变范围较大,有时占据整个肺叶,肉眼见病变呈蜂窝状,镜下见病变由弯曲的管状或微囊构成,囊壁衬以立方或柱状上皮,无黏液细胞,囊壁内无软骨和复层平滑肌纤维。
(5)Ⅳ型为邻近中心气管支气管树型,类似肺泡囊结构,囊壁衬覆Ⅰ型及Ⅱ型肺泡上皮细胞。
图5-1 先天性囊性腺瘤样畸形Ⅰ型
囊壁内衬假复层纤毛柱状上皮,囊壁内见平滑肌束,与正常肺组织分界清楚。
子宫内膜异位症(endometriosis)可发生在支气管、胸膜及纵隔等部位,引起月经性气胸、血胸等相应症状,影像学见囊性或实性结节。在支气管管壁周围可见子宫内膜样间质和腺体(图5-2)。
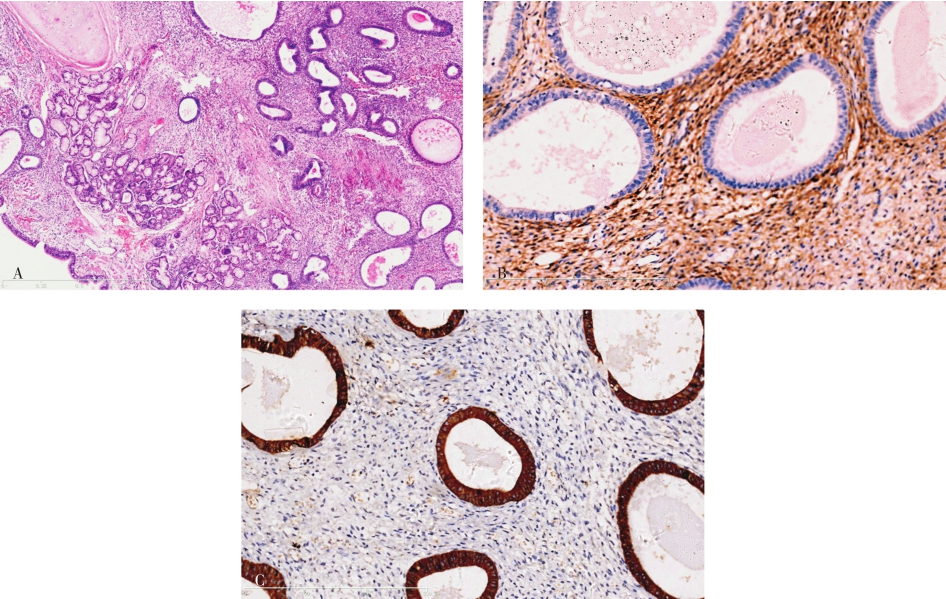
图5-2 支气管子宫内膜异位症
A.支气管软骨和腺体下可见子宫内膜样间质和腺体;B.间质细胞CD10阳性;C.腺上皮细胞CK阳性。
肺的炎性假瘤(inflammatory pseudotumor,IPT)是一种位于肺实质内、界限清楚的炎性增生性病变,主要由各种慢性炎性细胞(淋巴细胞、浆细胞、嗜酸性粒细胞)、泡沫细胞及成纤维细胞和胶原纤维等构成,可见Ⅱ型肺泡上皮细胞呈腺样增生和淋巴滤泡的形成(图5-3)。本病有时需要与肿瘤相鉴别。
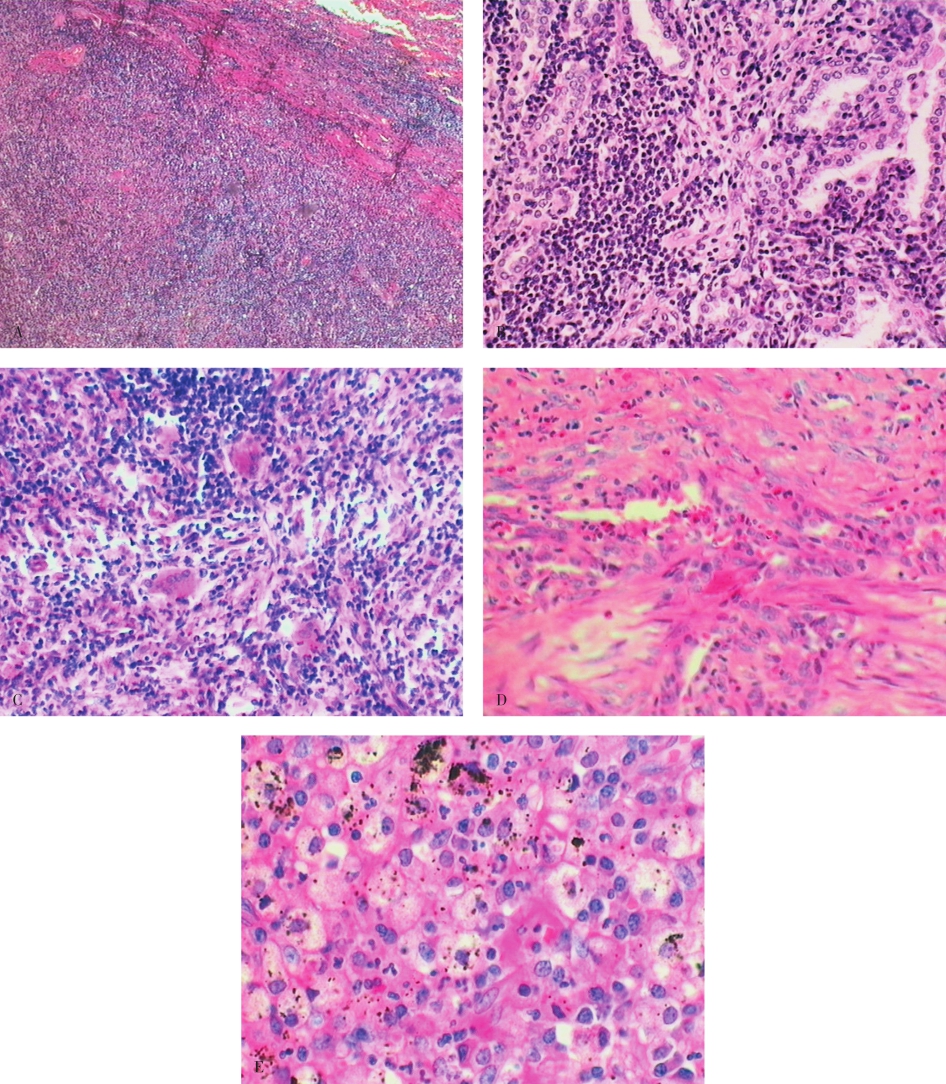
图5-3 肺炎性假瘤
病变界限清楚但无包膜(A),可见以淋巴细胞为主的各类炎性细胞(B)、多核巨细胞(C)、嗜酸细胞(D)、泡沫细胞(E),成纤维细胞和胶原纤维(D),增生的Ⅱ型上皮可呈腺样结构(B)。
韦格纳肉芽肿病(Wegener granulomatosis)为自身免疫性疾病,典型的病变为坏死性肉芽肿性血管炎、累及上呼吸道和肺的非化脓性坏死,以及灶性肾小球肾炎三联征。本病也可以累及皮肤、关节、眼和神经系统。患者常伴有发热、体重减轻、咳嗽、胸痛、咯血等。X线可见肺内多个结节致密影,常伴空洞,也可见局限性实变区。血清学特征为抗中性粒细胞胞质抗体(ANCA)阳性。
双肺多发结节状肿物,边界不清。切面呈淡棕色、实性,中央可有灰红、灰黄坏死区,可有空洞形成。特征性病理改变是坏死性血管炎和肉芽肿形成。在液化性和/或凝固性坏死中可见中性粒细胞、少量淋巴细胞、浆细胞和多核巨细胞。
骨化性气管支气管病(tracheobroncheopathia osteochondroplastica,TO)是指气管、支气管黏膜下有多发性骨质或软骨组织结节状增生并突向管腔的良性病变,病因不明,大多数小结节直径为2~4mm,主要位于气管中下段的前壁和外侧壁。气管、主支气管内多发的黏膜下小结节钙化影并突向管腔是TO较具特征性的CT表现。
镜下见气管软骨环与黏膜间有多发散在的成熟骨和软骨小结节,50%患者可合并支气管黏膜上皮鳞状化生,其周围可见慢性炎性细胞的浸润(图5-4),需与气管、支气管结石鉴别。
肺泡微石症(pulmonary alveolar microlithiasis,PAM)是一种以双肺肺泡内弥漫分布的含钙、磷酸盐为主的微小结石的罕见疾病。该病为 SLC34A2 基因突变导致的常染色体隐性遗传病,多发生于近亲结婚者。患者无肺部基础疾病,血清钙、磷指标均正常,影像学上呈两肺弥漫分布的小结节影,直径<1mm,密度高,边缘清楚,但形状不规则。
肺脏切面呈“细砂纸样”,有砂粒感。早期病变的镜下突出改变是在肺泡腔内弥漫存在的直径0.02~3mm,呈同心圆板层结构或洋葱皮样的微结石(图5-5),结石之间有纤维索条状组织间隔,一般无炎症反应。晚期则可见不同程度的白细胞浸润和不同程度的肺间质纤维化。故肺泡微石症的晚期需要与粟粒型肺结核、硅沉着病及特发性肺含铁血黄素沉着症等疾病鉴别。
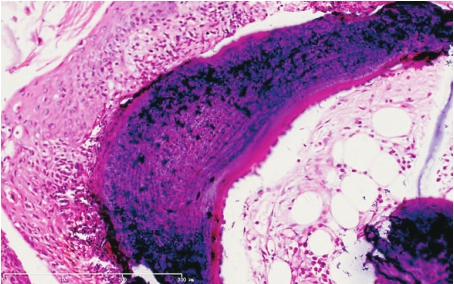
图5-4 骨化性气管支气管病
气管黏膜上皮鳞状化生,黏膜下见少量炎性细胞、成熟骨、骨周边的骨母细胞和骨髓样结构。
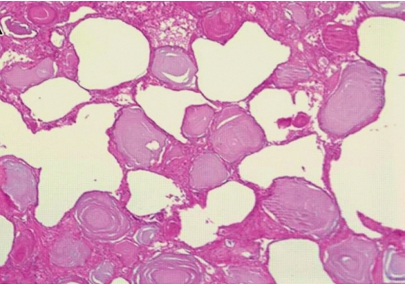
图5-5 肺泡微石症
肺泡腔内同心圆状微结石沉着,肺泡间隔轻度纤维化,炎性反应不明显。
支气管结石(broncholithiasis)是由于各种感染(结核、真菌病等)、硅沉着病或慢性阻塞性肺病时的黏液滞留所导致的钙化。支气管结石直径常小于1cm,可引起咳嗽、支气管扩张及感染等。其与骨化性气管支气管病不同的是没有成熟骨形成。
肺含铁血黄素沉着症(idiopathic pulmonary hemosiderosis,IPH)为少见疾病,既往又称Ceelen病、特发性肺褐色硬化综合征,为肺泡毛细血管反复出血,渗出的血液溶血后,含铁血黄素沉着于肺组织内所引起的反应。患者可出现反复发作性的咳嗽、气促、咯血和缺铁性贫血。
肺脏外观呈褐色实变状,表面及切面可见散在出血斑和弥漫性棕色色素沉着,肺门、纵隔淋巴结可见肿大,呈棕色。镜下见肺泡上皮细胞肿胀、变性、脱落和增生,肺泡腔内充满吞噬红细胞或含铁血黄素的巨噬细胞(图5-6),肺泡壁弹性纤维变性,毛细血管增生,基底膜增厚,含铁血黄素沉着,间质纤维化。
肺泡蛋白沉积症(pulmonary alveolar proteinosis,PAP)是以肺泡和细支气管腔内充满嗜伊红色细颗粒状蛋白物质为特征的疾病。该病好发于中青年,男性是女性的3倍,病因未明,推测与大量粉尘吸入(铝、二氧化硅等)、机体免疫功能下降(尤其婴幼儿)、遗传因素、酗酒和微生物感染等有关。该病可能为脂质代谢障碍所致,即在机体内、外因素作用下引起肺泡表面活性物质的代谢异常所致。X线表现为弥漫性小结节影、斑片状影或大片实变影。
肺泡腔内充满PAS及D-PAS阳性的粗颗粒状物质(图5-7),晚期可致肺的纤维化。
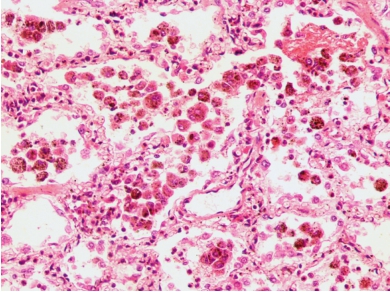
图5-6 肺含铁血黄素沉着症
肺泡上皮细胞变性脱落,肺泡腔内充满吞噬红细胞或含铁血黄素的巨噬细胞。
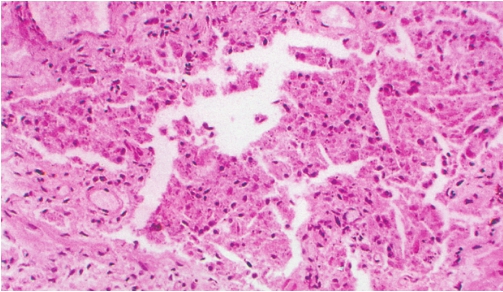
图5-7 肺泡蛋白沉积症
肺泡腔内充满PAS阳性的粗颗粒状物质。
间质性肺疾病(interstitial lung disease,ILD)是指一大组主要累及肺间质的肺疾病的统称,表现为不同类型的间质性肺炎和纤维化。已知病因或疾病而导致的ILD称为病因明确的ILD,习惯上将其归属于各原疾病(如支气管扩张症、肺结核、硅沉着病等引起的肺纤维化)。原因不明的ILD称为特发性肺间质病(如肺结节病、特发性间质性肺炎等)。
特发性间质性肺炎(idiopathic interstitial pneumonitis,IIP)是一种原因不明的,以弥漫性肺泡炎和肺泡结构紊乱最终导致肺纤维化为特征的进行性下呼吸道疾病。因IIP广泛的肺纤维化所导致的肺动脉高压、肺源性心脏病和右心衰竭,半数以上患者因呼吸衰竭而死亡。其病因和发病机制尚不十分清楚,临床上也无特效治疗方法。IIP的病理诊断和分类着重强调必须要与临床和影像学密切结合。
是IIP中最为常见的一个亚型,约占IIP的65%。多发于50岁以上的成人,男性多于女性。UIP病因不清,多数学者认为是一种自身免疫性疾病,也可能有遗传因素的参与。患者以隐袭性进行性呼吸困难为突出症状,临床多呈慢性经过,持续进展,预后不良,对糖皮质激素反应差,常因呼吸衰竭和心力衰竭而死亡,5年生存率不足50%。部分患者血清抗核抗体(ANA)和抗类风湿因子(RF)阳性。X线片和CT主要表现为两肺基底部和周边部的网状阴影,可有少量毛玻璃影,支气管和细支气管扩张和/或胸膜下的蜂窝样改变。
病变双肺体积缩小,重量增加,质地较硬,脏层胸膜有局灶性瘢痕形成,可形成肺气肿甚至肺大疱。切面双肺呈弥漫性实变区,轻重不一,严重受累处形成多房囊性结构,即蜂窝肺。
镜下见病变主要累及双肺胸膜下及周边肺间质,呈斑片状分布,间质炎症、纤维化和蜂窝状改变。病变特点为轻重不一,新旧病变交杂分布,病变间可见正常肺组织。较新的病变见肺泡间隔增宽、充血,淋巴细胞、浆细胞、组织细胞和散在的中性粒细胞浸润,伴有Ⅱ型肺泡上皮细胞和细支气管上皮细胞的增生,部分肺泡内可见巨噬细胞。而纤维化区内的炎症细胞相对较少,肺泡间隔毛细血管床减少或消失,其间可见Ⅱ型肺泡上皮增生形成的假腺样结构。蜂窝改变区域是由大小不等的囊性纤维气腔组成,被覆有细支气管上皮细胞(图5-8)。在纤维化区和蜂窝状区可见呼吸性细支气管、肺泡管及重建的囊壁内有大量增生的平滑肌束,形成所谓“肌硬化”。
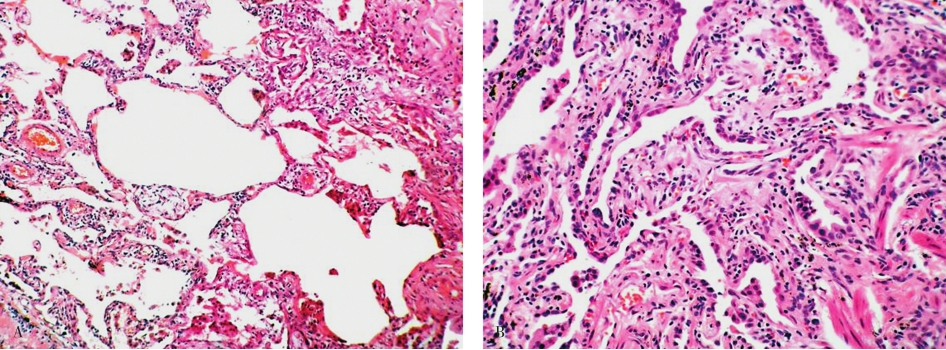
图5-8 普通型间质性肺炎
A.纤维组织小灶状增生和小囊状改变;B.弥漫性纤维组织增生,肺泡减少、变形。
UIP另一特征性的改变是在黏液基质的背景下,由成纤维细胞相对集中所构成的成纤维细胞灶(fibroblast foci)位于肺间质内,常突向被覆呼吸上皮的腔面。总之,成纤维细胞灶、伴胶原沉积的瘢痕化、不同时相病变的共存和蜂窝病变是诊断UIP的重要病理依据,也是UIP与其他IIP类型相区别的要点。
发病以中老年为主,也可见于儿童,起病隐匿或呈亚急性经过。病因不清,部分患者可能与伴有某些潜在的结缔组织疾病、有机粉尘的吸入、某些药物反应及急性肺损伤的缓解期等有关。临床主要表现为渐进性呼吸困难和咳嗽。高分辨CT显示双肺对称性毛玻璃影或双肺肺泡腔的实变影。与UIP相比,大部分NSIP患者对皮质激素有较好的反应和相对较好的预后,5年内病死率为15%~20%。
NSIP主要的病理学特征为肺间质不同程度的炎症和纤维化。根据其间质炎细胞的数量和纤维化程度,可进一步分为:①富于细胞型,主要表现为间质的炎细胞尤其是浆细胞的浸润突出(图5-9A);②纤维化型,约占10%,与富于细胞型明显不同的是在其肺间质内以致密的胶原纤维沉积为主,伴有轻微的炎症反应或缺乏炎症(图5-9B),很少出现成纤维细胞灶(缺乏活动性纤维化表现),且病变一致,这是不同于UIP的重要鉴别点;③混合型,约占40%,间质有大量的慢性炎细胞浸润和明显的胶原纤维沉积(图5-9C)。此型与UIP不易鉴别,区别的要点是本病肺内的病变相对一致,无蜂窝肺,部分可见成纤维细胞灶,但数量很少。
多见于有吸烟史者,男性发病几乎是女性的2倍。大多数患者为亚急性或隐匿性起病,临床表现与UIP类似,咳嗽和呼吸困难是最常见的症状,半数患者有杵状指。肺功能表现为限制性通气障碍,伴有弥散功能降低和低氧血症。一般实验室检查无特殊发现。20%的患者胸片接近正常。约1/4的患者胸片和高分辨CT扫描显示在中下肺野弥漫的磨玻璃样改变,后期也可出现线状、网状、结节状间质影像。DIP治疗和预后都较UIP为好,10年生存率约为70%。
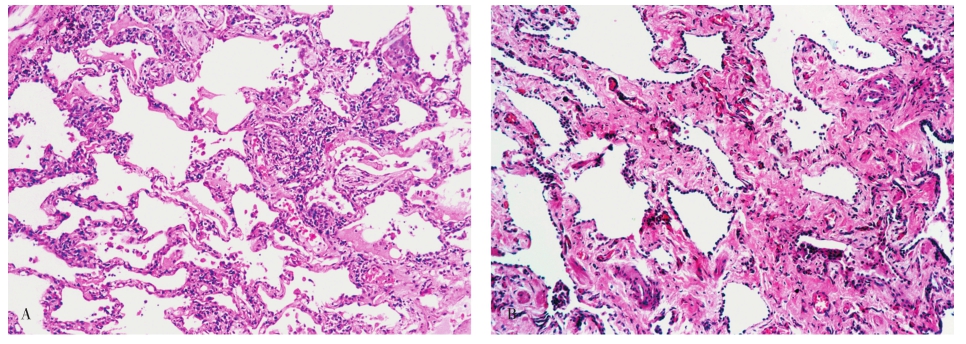
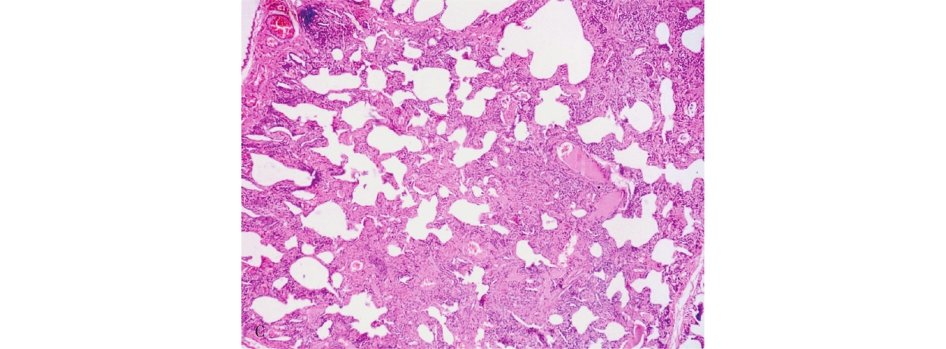
图5-9 非特异性间质性肺炎
A.富于细胞型;B.纤维化型;C.混合型。
弥漫性的肺泡内巨噬细胞聚集,均匀分布(图5-10),在呼吸性细支气管周围尤为明显,并弥散到远端气腔甚至整个肺实质。除了肺泡壁轻至中度增厚外,无纤维化瘢痕、蜂窝肺,成纤维细胞灶缺如或不明显,增生的纤维组织显示在同一阶段。间质的炎症在范围和程度都很轻,主要为淋巴细胞及少量的浆细胞浸润。
平均发病年龄36岁,男性稍多于女性,迄今报道的病例均有吸烟史。临床表现类似DIP,杵状指/趾少见,双肺有爆裂音。约2/3的患者在高分辨CT扫描显示出网状结节影,缺乏毛玻璃样改变。在发病人群、治疗反应、病程和预后上都与DIP不易区分。与UIP相比,糖皮质激素治疗有明显的效果,预后较好。
在呼吸性细支气管及其周围的气腔内有大量含色素的巨噬细胞聚积,与DIP极为相似(图5-11),远端气腔不受累,并且有明显的呼吸性细支气管炎,肺泡间隔增厚和上皮化生等亦类似于DIP的表现。
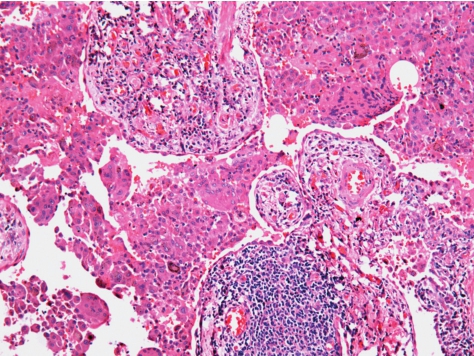
图5-10 脱屑性间质性肺炎
肺泡腔内巨噬细胞聚集,分布均匀,无纤维化瘢痕和成纤维细胞灶。
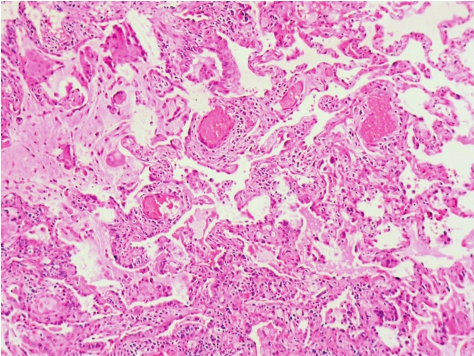
图5-11 呼吸性细支气管炎-间质性肺病
呼吸性细支气管及其周围见大量的含色素的巨噬细胞聚集。
是一种罕见的暴发性肺损伤,平均发病年龄为49岁,无明显性别差异。临床表现为起病急剧(数日至数周内)、发热、咳嗽和气急,继之出现呼吸衰竭,常规实验室检查无特异性。X线胸片显示弥漫、双侧性肺阴影,CT扫描表现为双侧对称的斑片状毛玻璃影。这种改变与急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)类似。AIP死亡率极高(>60%),多数在1~2个月内死亡,AIP的诊断必要标准之一为临床表现为原因不明的特发性ARDS。
组织病理学表现为弥漫性肺泡损伤(diffuse alveolar damage,DAD)的机化期改变。病理特点是病变时相一致,肺泡间隔显著增宽,在增宽的肺泡间隔内有卵圆形及梭形的成纤维细胞和散在的淋巴细胞、浆细胞浸润,Ⅱ型肺泡上皮增生,细支气管上皮可有鳞状上皮化生,在肺泡间隔显著增宽区可见大小不等的肺泡腔隙。少数肺泡腔内有少量透明膜(图5-12)。这是与其他IIP鉴别的关键点。极少数患者经及时、正确的治疗可存活,肺脏可以恢复到正常,也可向终末期蜂窝纤维化发展。
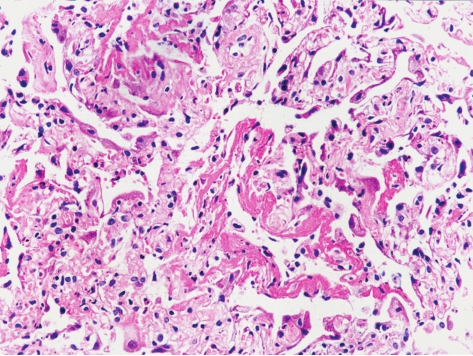
图5-12 急性间质性肺炎
肺泡间隔一致性地显著增宽,内见成纤维细胞和散在的淋巴细胞、浆细胞浸润,在肺泡间隔显著增宽区可见大小不等的肺泡腔隙,并见肺泡腔内有少量透明膜。
发病年龄以50~60岁为主,无性别差异,与吸烟无关。患者发病时有类似流感的症状,如咳嗽、发热、周身不适、乏力和体重减轻等。常有吸气末的爆裂音。常规实验室检查无特异性。肺功能主要表现为限制性通气障碍,静息和运动后的低氧血症是一个常见的特点。胸片表现为双侧弥漫性肺泡影,肺容积正常,复发性和游走性阴影常见,单侧肺泡阴影罕见。高分辨CT显示肺部斑片状肺泡腔内实变、毛玻璃影、小结节阴影和支气管管壁的增厚和扩张,主要分布在肺周围,尤其是肺下野。2/3的患者对皮质激素有较好的反应。
COP的主要病理变化是呼吸性细支气管及以下的小气道和肺泡腔内有机化性肺炎改变,病变表现单一,时相一致,呈斑片状和支气管周围分布,病变位于气腔内,肺结构未被破坏,增生的成纤维细胞/肌纤维母细胞灶通过肺泡间孔从一个肺泡到邻近的肺泡形成蝴蝶样的结构(图5-13),蜂窝肺不常见。
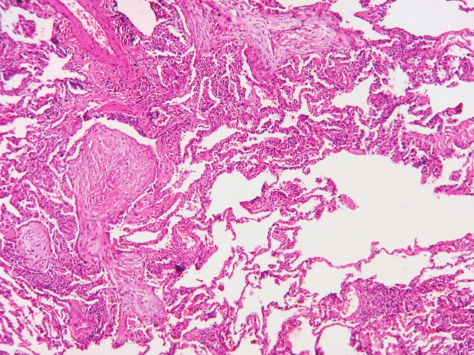
图5-13 隐源性机化性肺炎
肺结构不被破坏,增生的成纤维细胞通过肺泡间孔从一个肺泡到邻近的肺泡形成蝴蝶样的结构。
在HIV感染的人群及其他免疫缺陷或自身免疫性疾病患者中相对常见。X线胸片表现为实变和血管周围浸润影。
LIP主要表现为淋巴细胞、浆细胞和组织细胞在肺间质、特别是肺泡间隔内弥漫浸润,伴有Ⅱ型肺泡上皮细胞的增生和肺泡腔内巨噬细胞的增加(图5-14),沿淋巴管常见具有生发中心的淋巴滤泡形成。有时可见肺泡结构改建和非坏死性的肉芽肿形成。
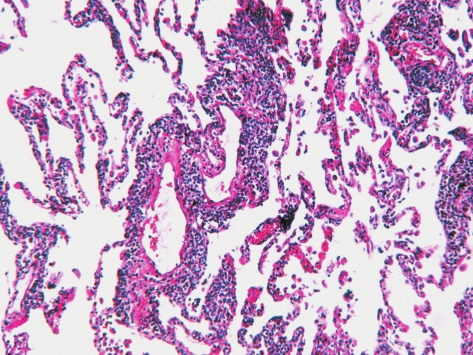
图5-14 淋巴性间质性肺炎
淋巴细胞、浆细胞和组织细胞在肺间质、特别是肺泡间隔内弥漫浸润。
总之,IIP的诊断和分类对病理医师是一个新的问题,病理医师必须仔细阅片,密切联系临床和影像学资料,才能作出正确的诊断。尽管各型IIP都表现为不同程度的间质炎症和纤维化,但每型都有各自的病变特点。在病变时相上,除UIP显示病变进展不一致外,其他各型都显示病变在同一个阶段。胸膜下的蜂窝肺主要见于UIP,其他各型不易出现或出现较晚。DIP主要表现为弥漫性的肺泡内巨噬细胞聚集,RBILD的病理变化与DIP类似,不同点在于病变相对局限在呼吸性细支气管及其周围的气腔,有明显的呼吸性细支气管炎。成纤维细胞灶主要见于UIP。AIP有透明膜形成,其他各型则无此变化。COP主要显示呼吸性细支气管及以下的小气道和肺泡腔内有机化性肺炎改变,其他各型的闭塞性支气管炎间质性肺炎样改变较局限或缺乏。
肺尘埃沉着病(pneumoconiosis)简称尘肺,是因长期吸入有害粉尘并沉着于肺内所引起的以肺广泛纤维化为主要病变的肺疾病。本病伴有肺功能损害,常为职业性肺疾病。根据沉着粉尘的化学性质,可将肺尘埃沉着病分为无机尘埃沉着病和有机尘埃沉着病。国内常见的是无机尘埃沉着病,主要有硅沉着病、石棉沉着病和煤沉着病等。有机尘埃沉着病多由真菌代谢产物或动物性蛋白质、细菌产物引起,如农民肺、棉尘肺、麦芽肺等。
简称硅肺或硅沉着症,是因长期吸入含大量游离二氧化硅(SiO 2 )粉尘微粒而引起的以硅结节形成和肺广泛纤维化为病变特征的尘肺。硅肺也是尘肺中最常见、进展最快、危害最严重的一种。硅肺的发病与石英的类型、粉尘中游离二氧化硅的含量、粉尘颗粒大小、接触时间、防护措施及呼吸道防御功能削弱等因素有关。硅尘颗粒越小,在空气中的沉降速度越慢,被吸入的机会也越多。直径<5μm的硅尘颗粒则可被吸入肺内并沉着于肺间质而致病,尤其是直径1~2μm的硅尘颗粒致病力最强。
硅沉着病的基本病变是肺及肺门淋巴结内硅结节(silicotic nodule)形成和肺间质弥漫性纤维化。硅结节为境界清晰的圆形、椭圆形结节,直径2~5mm,灰白色,质坚实,触之有砂粒感。随着病变的不断进展,硅结节逐渐增大或相互融合成团块状,中心常因缺血缺氧而发生坏死液化,形成硅肺性空洞(silicotic cavity)。
硅结节的形成和发展过程大致可分为:①细胞性结节,为早期硅结节,由吞噬硅尘的巨噬细胞聚集在局部形成;②纤维性结节,由成纤维细胞、纤维细胞和胶原纤维组成,纤维组织呈同心圆状排列;③玻璃样结节,纤维性结节从中心开始发生玻璃样变,最终形成典型的硅结节,硅结节由呈同心圆状或漩涡状排列的玻璃样变的胶原纤维构成(图5-15),结节中央往往可见内膜增厚的血管。病变肺组织除硅结节形成外,尚有不同程度的间质弥漫性纤维化。在血管、支气管周围及肺泡间隔纤维组织增生,多为玻璃样变的胶原纤维。此外,胸膜也因纤维组织弥漫增生而增厚,可达1~2cm。
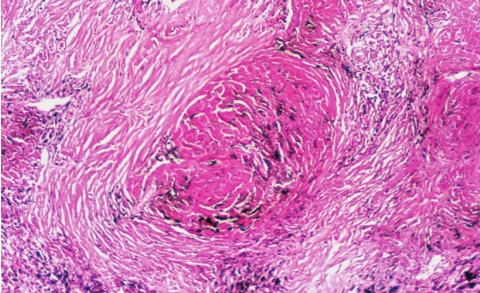
图5-15 肺硅沉着病
由同心圆状或漩涡状排列的玻璃样变的胶原纤维构成。
Ⅰ期硅肺的硅结节主要局限于肺门淋巴结内,近肺门的肺组织中可见少量直径1~3mm的硅结节,数量少。X线检查见肺门阴影增大,肺野内硅结节阴影主要分布在两肺中、下叶近肺门处,胸膜增厚不明显。
Ⅱ期硅肺的硅结节体积增大,多数直径>1cm,数量增加,散布于全肺,但总的病变范围未超过全肺的1/3,胸膜明显增厚。肺的重量、体积、硬度均有所增加。
Ⅲ期硅肺的硅结节密集且融合成肿瘤样团块,直径可达2cm,X线检查可见团块状硅结节阴影,团块状结节中央可有硅肺空洞形成。胸膜明显增厚,肺的重量、体积、硬度明显增加,浮沉试验全肺入水下沉。由于硅肺患者抵抗力较低,易继发细菌、病毒感染和诱发呼吸衰竭。60%~70%的Ⅲ期硅肺患者可并发肺结核病,称硅肺结核病(silicotuberculosis)。
晚期硅肺患者常发生不同程度的阻塞性肺气肿、胸膜下形成肺大疱,剧烈咳嗽时可引起自发性气胸。60%~75%的晚期硅肺患者并发肺源性心脏病。
是因长期吸入石棉粉尘而引起的以肺间质纤维化为主要病变的职业性尘肺。本病发病隐匿,患者逐渐出现咳嗽、咳痰、气急、胸闷等症状,晚期因并发肺源性心脏病而出现右心室肥大。石棉具有致癌性,石棉肺易并发恶性胸膜间皮瘤和肺癌,亦有并发胃癌、喉癌的报道。约10%的肺石棉沉着病患者合并肺结核。
肺石棉沉着病的病变特点是肺间质弥漫性纤维化,石棉小体形成及脏层胸膜肥厚,壁层胸膜形成胸膜斑(pleural plaque)。胸膜斑是指发生于壁层胸膜上的境界清楚,突出于胸膜,质地坚硬,呈灰白色、半透明样局限性的纤维瘢痕斑块。石棉小体常位于增生的纤维组织中,大小不等,呈黄褐色、分节状,两端膨大呈哑铃形(图5-16),旁边有时可见异物巨细胞。石棉小体呈铁反应阳性,检出石棉小体是病理诊断石棉肺的重要依据。
结节病(sarcoidosis)为一种可侵犯全身多系统的慢性疾病,其基本病变为形成非干酪样坏死性肉芽肿。该病多见于中、青年,女性发病率稍高于男性,肺及肺门淋巴结最常受累(超过90%),也可累及浅表淋巴结、皮肤、眼、扁桃体、肝、脾、骨髓等处。多数患者肺部症状较轻,一般仅为干咳,少数可有呼吸困难、胸痛等。X线的典型表现为弥漫性网状或结节状,偶可见大结节。绝大多数患者不经治疗可自行缓解。结节病的病因及发病机制目前尚不清楚,但多数学者认为细胞免疫反应在该病的发病中起到了重要作用。
肺结节病可单独或同时累及肺和肺门淋巴结,病变特点是主要由类上皮细胞构成的非干酪样坏死性肉芽肿,形态学上与结核性肉芽肿相似,但具有以下特点:肉芽肿大小较一致,境界清楚,少有融合;结节中心无干酪样坏死,多核巨细胞可为朗汉斯(Langhans)型,也可为异物型,结节周围浸润的淋巴细胞较少(图5-17);随着病变的进展,细胞性肉芽肿可逐渐发展成洋葱皮样纤维化。巨细胞胞质中可见到星状体(asteroid body)(胞质内透明区中含有的强嗜酸性放射状小体)和Schaumann小体(球形同心层状结构,其成分为含铁和钙的蛋白质)。
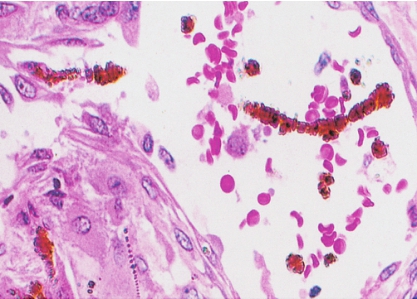
图5-16 肺石棉沉着病
在增生的纤维组织及肺泡腔内见石棉小体。
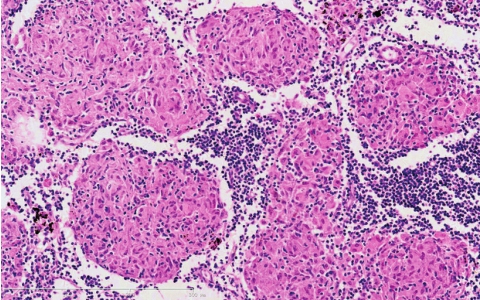
图5-17 肺结节病
类上皮细胞呈结节状增生,内可见多核巨细胞,无干酪样坏死,周围有淋巴细胞围绕。
结核病(tuberculosis)是由结核分枝杆菌引起的一种慢性肉芽肿性炎,以肺结核最常见,但也可见于全身各器官。
典型的结核结节的中心为粉染无结构的干酪样坏死,周围围绕类上皮细胞、淋巴细胞、浆细胞、巨噬细胞及多核的朗汉斯巨细胞(Langhans giant cell)(图5-18A),在坏死组织及巨噬细胞内可有结核杆菌存在(图5-18B)。
典型的结核病的病理诊断非常容易,具有挑战性的是不典型的病变,抗酸染色与结核分枝杆菌DNA实时荧光定量PCR(real time PCR)检测在辅助结核病诊断时具有指导意义。结核病需要与肺结节病、其他肺部感染,甚至需要与肺癌相鉴别,诊断时应结合临床症状、结核菌素试验、影像学改变及病原体检查结果等综合考虑。
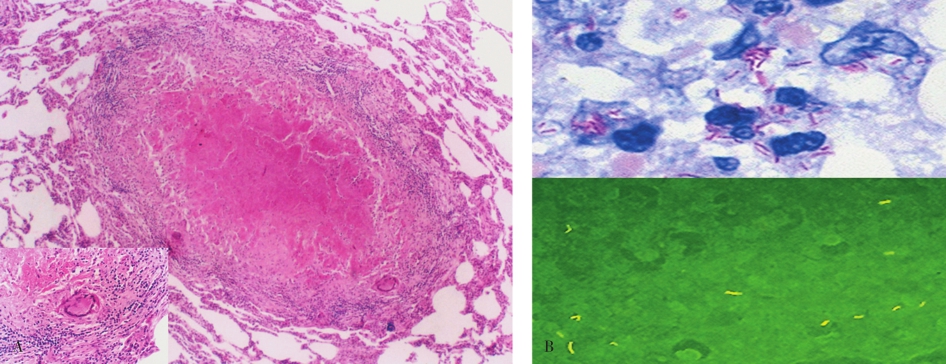
图5-18结核结节及结核分枝杆菌
A.典型的结核结节;B.结核分枝杆菌,抗酸染色为红色,阿拉明(间羟胺)荧光染色为黄色荧光。
引起人类肺部感染的真菌病虽然没有细菌和病毒那么多,但由于肺部真菌病(fungal diseases of the lung)通常发病隐匿而易忽视,或由于症状不典型等因素,往往造成诊断、鉴别诊断乃至治疗上的相对困难。由于广谱抗生素、肾上腺皮质激素和免疫抑制剂的不正确应用等,使真菌感染性疾病有明显增长趋势。肺部真菌病也是AIDS的重要机会感染主要受累器官之一。
真菌病常见的病理变化:
①轻度非特异性炎;②化脓性炎;③坏死性炎;④肉芽肿性炎。其中化脓性肉芽肿性炎是真菌病最具特征、最常见的肉芽肿性反应,但找到病原真菌才是确诊的唯一依据。同时也不要排除真菌感染只是主要病变的一种继发性改变的可能。
曲菌病(aspergillosis)由曲菌引起。曲菌可引起身体许多部位的病变,但以引起肺部病变最常见。曲菌可引起小脓肿形成,有时不化脓而发生组织坏死及出血,周围有较多量嗜中性粒细胞和单核细胞浸润。在小脓肿和坏死灶内有大量菌丝。曲菌常侵入血管引起血栓形成,可使组织缺血、坏死。慢性病灶有肉芽肿样结构形成。曲菌菌丝粗细均匀,有隔,为分支状,常形成45°的锐角分支(图5-19A)。PAS或银染色显示更为清晰(图5-19B)。
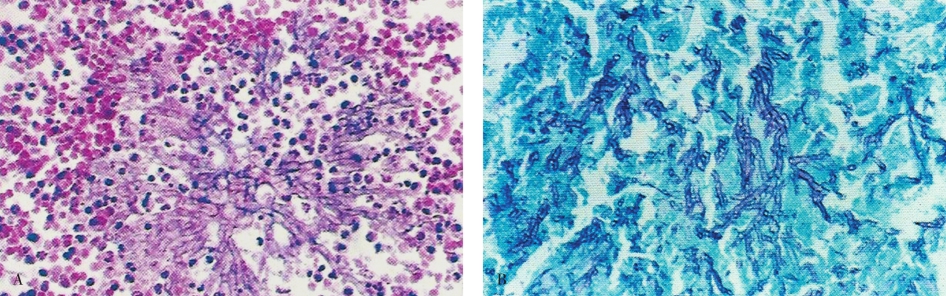
图5-19 肺曲菌病
A.HE染色可见菌丝呈放射状排列;B.银染色可见菌丝有隔,呈锐角分支状。
毛霉菌病(mucormycosis)多表现为急性化脓性炎症,发展迅速,常引起广泛播散,并常侵袭血管引起血栓形成和梗死,慢性期则出现肉芽肿样改变。毛霉菌菌丝粗大,不分隔,分支较少而不规则,常呈钝角或直角分支(图5-20)。
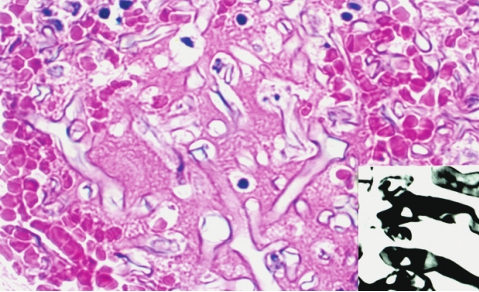
图5-20 毛霉菌病
毛霉菌菌丝呈嗜碱性,分支较少,常呈钝角或直角分支;银染色菌丝染成黑色(右下)。
隐球菌病(cryptococcus)几乎总见于免疫抑制的个体,如艾滋病、白血病、恶性淋巴瘤等,发生于健康个体者罕见。肺隐球菌病可形成肉芽肿样的结节状病灶,多数在胸膜下形成单个小结节,有时需与结核球或肺癌鉴别。镜下在肺泡腔内或在肉芽肿内的巨噬细胞胞质中可见有多数隐球菌存在(图5-21)。PAS和六胺银染色阳性,黏液卡红染色菌体呈红色,墨汁负染发现宽厚的荚膜有诊断意义。
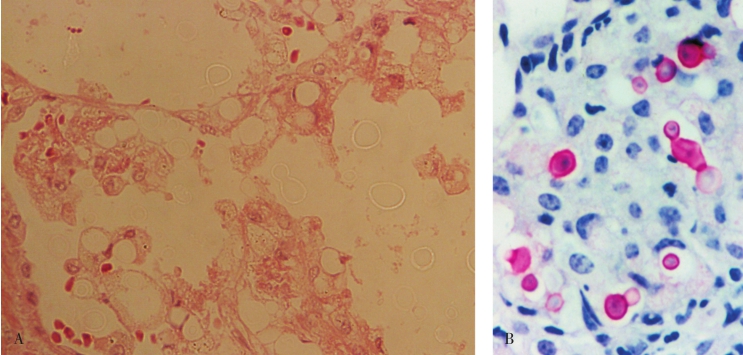
图5-21 隐球菌病
A.HE染色可见肺泡腔及巨噬细胞内呈空泡或亮环状的隐球菌;B.黏液卡红染色菌体呈红色。
卡氏肺孢子菌性肺炎(pneumocystis pneumonia)是由卡氏肺孢子菌感染所引起的肺炎,也是艾滋病和恶性肿瘤患者化疗后最常见的机会性感染。本病的典型病理改变为肺间质内大量浆细胞和淋巴细胞浸润、弥漫性肺泡损伤及Ⅱ型肺泡上皮细胞增生。肺泡腔内充满大量特征性的泡沫状、嗜酸性渗出物,后者由大量免疫球蛋白及菌体构成,菌体呈小泡状。肺泡间隔及肺泡腔内可见大量浆细胞、巨噬细胞和淋巴细胞浸润,部分区域可见肉芽肿性病变。六胺银染色在泡沫样渗出物或巨噬细胞胞质中可见肺孢子菌,为圆形或新月形,直径5μm,局部染色较深的部分为厚的菌壁(图5-22)。约50%患者可以通过肺灌洗液的病原体检查得到确诊。
主要是以色列放线菌(ctinomyces israeli)引起的一种慢性化脓性炎。放线菌并不属于真菌而属于一种厌氧细菌。由于其引起的病变与真菌病相似,所以将其与真菌病一起叙述。
慢性化脓性炎症,在脓肿壁和周围肉芽组织中可见大量吞噬脂质的巨噬细胞,因此肉眼见组织常呈黄色。放线菌形成的菌丝,其中的细小黄色颗粒,直径1~2mm,称为“硫黄颗粒”。直接压片或组织切片中可见颗粒由分支的菌丝交织而成,颗粒中央部分HE染色呈蓝色,周围部分菌丝排列呈放线状,菌丝末端常有胶样物质组成的鞘包围而膨大呈棒状,HE染色呈红色,所以称为放线菌(图5-23)。
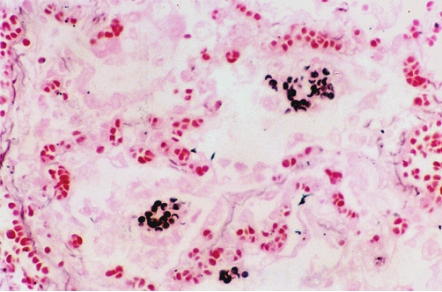
图5-22 卡氏肺孢子菌性肺炎
六胺银染色见泡沫样渗出物中肺孢子菌的菌壁。
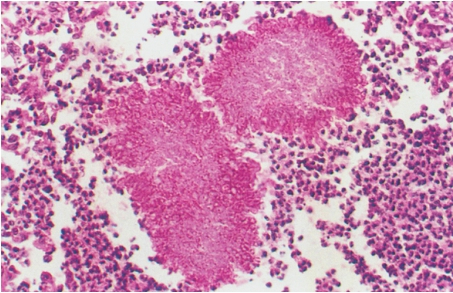
图5-23 放线菌病
菌落中央的细颗粒染成淡蓝色区为“硫黄颗粒”,周边为放线状菌丝,菌丝末端膨大呈棒状。
(邱雪杉)