肠内营养(EN)是经胃肠道提供代谢需要的营养物质及其他各种营养素的营养支持方式。随着对胃肠道结构和功能研究的深入,逐渐认识到胃肠道不仅是消化吸收器官,也是重要的免疫器官。因此,较之肠外营养(PN)支持,EN的优越性除体现在营养素直接经肠吸收利用、更符合生理特点、费用低廉、给药方便外,更有助于维持肠黏膜结构和屏障功能的完整性,防止肠道萎缩和细菌移位。所以选择营养支持方式时,首选EN已成为众多临床医师的共识。由于大多数患者在接受肠内营养喂养的同时需要进行药物治疗,而肠内营养配方与药物都具有特殊的理化性质,因此在联合使用时存在生物利用度改变、兼容性、并发症和相互作用的问题,导致饲管堵塞或改变药物的代谢和排泄,最终影响治疗的安全性与有效性。通常这些问题的产生被认为与肠内营养的不耐受相关,事实上与联用药物的类型或配方等因素相关。
由各种原因导致的不能经口进食或消化吸收功能受损的患者需要通过管饲来提供营养支持。在体外,营养素与药物相互作用主要发生在两者的直接物理接触过程中,例如在营养液配制过程中、输液袋中以及液体输注系统中。这种不相容导致形成颗粒、凝胶或出现分层,以致阻塞管道,影响营养素的吸收和利用。将酸性药剂糖浆加到肠内营养配方中,原有的乳剂状态就会被破坏,这种情况一般发生在全蛋白配方中。此外,蛋白质的种类及液体剂型的药物载体也会影响药物与肠内营养配方的相容性。药物与肠内营养配方的不相容性具体见表4-3。
表4-3 药物与肠内营养配方的不相容性

很多原因都会引起肠内营养与药物的相互作用,包括患者的生理状态、肠内营养配方的特点、肠内营养的方式及药物的特点等。
患者的年龄、疾病状态、胃肠道生理功能、营养状态都会影响药物与营养素相互作用的发生。婴儿、儿童和老年人由于缺乏药物代谢酶或肾功能不全,是相互作用的高风险人群。肥胖和营养不良会影响药物的代谢,营养不良会降低小肠的吸收能力,使血浆蛋白下降、药物代谢酶的活性降低。此外,肝肾功能不全或患有某些慢性疾病如高血压、糖尿病,以及哺乳期妇女、孕妇都是药物与营养素相互作用的高发人群,应特别关注。
肠内营养管饲的途径多种多样,主要分为经鼻、经口和经皮置管。管尖端的位置可置于胃、十二指肠或空肠内。肠内营养路径的选择受很多因素的影响,包括患者的疾病状态、生理状态以及预期的营养支持的疗程。
肠内营养配方组成比较复杂,与药物发生相互作用会影响药物和营养素的治疗效果。肠内营养配方的脂肪含量、渗透压、黏性、维生素K含量、蛋白含量都是重要的影响因素。
药物的剂型、治疗窗、效价、辅料、渗透压、黏度、溶解性等都会影响相互作用的发生。治疗窗较窄的药物如茶碱、苯妥英钠、地高辛,某些具有强大药理作用的药物如抗凝血药在与EN合用时应注意监测。表4-4列举出一些常见的药物与肠内营养配方的相互作用。
表4-4 药物与肠内营养配方的相互作用

续表

肠内营养配方与药物的相互作用还会改变药物的生物利用度、分布、代谢和排泄。肠内营养制剂或其某一成分可能会影响药物的吸收、分布、代谢或排泄,从而影响药物的生物利用度。如酸性环境有利于铁的吸收,加入增强酸性的化合物可增强吸收。竞争转运蛋白的结合能干扰药物或营养素的分布,脂肪含量较高的营养液能增加血浆游离脂肪酸的含量,增加药物的药理作用。蛋白质摄入不足会降低血浆蛋白浓度,影响药物的分布。营养配方组成可能对肝功能有明显的作用,尤其是脂质对于保持肝脏药物代谢的正常水平非常重要,蛋白质和脂肪的改变可以影响肝脏和小肠的药物代谢。服用高渗性药物易导致肠内营养的不耐受,高渗溶液进入小肠导致大量电解质和水进入肠腔,当超过小肠的吸收能力时就会引起腹泻。若药物中含有大量的山梨醇也会引起腹泻。为防止腹泻,药物需先用水稀释,饲管在使用前后均应进行冲洗。肠内营养与药物的不相容性改变药物的代谢和排泄,最终会可能导致药物治疗的失败。营养素能抑制或改变细胞转运系统而改变药效。如使用华法林进行抗凝治疗时,摄入维生素K会降低华法林的抗凝作用,为了不影响治疗效果,应注意对肠内营养配方中维生素K含量的限制,建议维生素K摄入量不超过75~80mg/1 000kcal。
为了有效避免肠内营养配方与药物的不相容性导致的腹泻、恶心、呕吐、脱水、血糖升高等一系列并发症,对管饲途径的选择要严格遵循适应证。此外,对药物剂型的选择、滴速、饲管的冲洗以及肠内营养液与特殊药物的使用时间间隔等环节都应严密控制。在管饲喂养前有效预防、在管饲喂养中密切监测,使肠内营养支持与药物治疗的安全性和有效性达到最大化。
在管饲喂养前给接受肠内营养支持疗法的患者的建议如下:
1.尽可能使用口服给药,当患者不能吞咽时改用其他剂型,如直肠给药、舌下给药、经皮给药或使用口腔给药(口颊片)。
2.必须使用管饲给药时,口服溶液通常是首选,特别是酏剂和混悬剂,然而这些剂型通常渗透压较高或含有大量的山梨醇,容易增加发生不良反应的风险。当药物与肠内营养配方存在高风险的物理性不相容或胃肠道不耐受时,可选用其他剂型。存在问题的口服溶液,如pH≤4的糖浆剂、油性基质的药物、山梨醇含量高的药品(累积摄入不超过5g/d)应避免使用。有些药物不应使用管饲,否则会增加饲管堵塞的风险,例如克拉霉素悬浮液是微晶粒状剂型、红霉素悬浮液是微囊制剂。
3.口服溶液在管饲之前需做好准备。黏性药物在使用前用30~50ml水稀释(对于儿童,体积比胃为50∶50),如苯妥英钠和卡马西平悬浮液;在使用高渗性药物或刺激性较大的药物前至少用30ml水稀释,其中高渗性药物要用至少100ml水稀释才能使渗透压达到300mOsm/kg。
4.管饲喂养药选择合适的固体剂型,如即释片或胶囊剂,或包衣片、胶囊剂。
5.不应使用管饲喂养的固体剂型有舌下含片、口颊片、肠溶片(胶囊)、缓释制剂、混悬液。
6.固体剂型在管饲之前要做好准备,确定胶囊剂能否打开使用、片剂能否粉碎后使用。片剂应研成粉末并和30~50ml温水混合;胶囊剂应打开硬胶囊,将其中的粉末用30~50ml温水稀释并使用大口径管进行喂养;软胶囊内的填充物用30~50ml温水稀释并使用大口径管进行喂养。
7.只用水混合和冲洗。免疫功能低下的患者应使用不含微生物或其他微粒的水(如无菌水);不将药物直接与肠内营养配方直接混合(不包括氯化钠用作电解质注射液)。
8.不同的药物应分开进行管饲,中间至少用5ml水冲洗,在使用之前不将药物混合以免增加发生相互作用的风险,冲洗的量应根据饲管的长度和内径来决定,遵循生产商的建议。
9.使用前后对饲管进行充分的冲洗。鼻饲管需要至少15ml水冲洗,建议量为30ml;小肠饲管需要20ml水冲洗,建议量为30~50ml。尽量使用建议量,尤其是清洗使用过其他药物的饲管。
10.某些药物给药应与肠内营养配方有一定的时间间隔。卡马西平与肠内营养喂养间隔2小时;环丙沙星给药前1小时或给药后2小时给予管饲喂养;青霉素V钾给药前1小时或给药后2小时给予管饲喂养;苯妥英给药前后1~2小时给予管饲喂养;华法林给药前后1小时给予管饲喂养。
11.用临床参数和治疗药物监测对药物进行评价。
12.对肠内营养治疗进行评价。
肠外营养(PN)支持是经静脉途径为患者提供所需要的热能及各种营养素,包括常量营养素(碳水化合物、脂肪、必需和非必需氨基酸)和微营养素(维生素、电解质及微量元素)。用于治疗营养不良或预防不能进食期间营养不良状况的发生。由于肠外营养可导致静脉给药通路相关机械性与感染性并发症,还可引起水、电解质、酸碱平衡、糖代谢、脂肪代谢等代谢性并发症,使用肠外营养前需要评价患者的风险与获益。而且肠外营养液的理化性质十分复杂,极易与静脉用药之间在相容性方面有复杂的相互作用。相互作用包括体外不相容性及对体内代谢与分布的影响。体外不相容性与不稳定性可表现为沉淀、变色、混浊或脂粒凝聚等,给静脉用药安全带来隐患。药物在体内代谢与分布的改变可影响药物的治疗效果甚至引发药物不良反应。本节将重点介绍肠外营养与药物之间的相容性与稳定性、肠外营养对药物代谢与分布的影响,以及肠外营养对药物治疗的影响。
静脉输注途径和技术是肠外营养的必要保证。肠外营养支持主要通过静脉系统供给患者营养,具体输注途径包括经外周静脉肠外营养与经中心静脉肠外营养。经外周静脉肠外营养适合低渗透压营养液、短期静脉营养支持,操作简便。但因肠外营养液的浓度较高和渗透压大,需每次更换静脉穿刺部位,易引起静脉炎或血栓形成。经中心静脉肠外营养是利用大血管输注营养素,适用于胃肠道功能丧失或需要长期(超过5~7天)静脉营养支持的疾病或状态。由于腔静脉管径粗、血流量大和流速快,输注的液体很快被血液稀释,对血管的刺激性较小,因此经中心静脉肠外营养对输液的浓度和速度的限制不大。但置管条件和技术要求较高,且可发生严重的并发症,如中心静脉血栓、感染和机械性损伤等。
不论是采取经外周静脉肠外营养还是经中心静脉肠外营养途径同时输注药物,肠外营养液的复杂化学成分决定了其与其他静脉用药制剂之间的高风险理化性质不相容性。这种不相容性的结果可改变输液成分的理化性质,发生沉淀现象。需要强调的是有时通过肉眼往往很难观察到这种变化。沉淀的产生轻则堵塞静脉导管,如果进入人体则可以发生肺栓塞等严重不良反应事件。
对某一肠外营养制剂而言,影响稳定性与相容性的综合因素有肠外营养的组分、药物种类、溶液的pH与浓度、输注环境(温度、光照等)及在体外混合接触的时间等。例如新生儿肠外全营养液与新生儿病房13种常用药物的相容性实验结果报道,在体外模拟的“Y”通道输液试验中,采用比浊法观察,咖啡因、克林霉素、依那普利拉、肾上腺素、氟康唑、磷苯妥英钠、氢化可的松、甲氧氯普胺、咪达唑仑9种药物与新生儿肠外营养液混合输注3小时未有沉淀发生;而戊巴比妥、苯巴比妥、利福平、胺碘酮与新生儿肠外营养液不相容,不能同时混合输注。
此外,由于头孢曲松具有很强的钙亲和力,可与含钙的肠外营养制剂产生头孢曲松钙沉淀。在新生儿接受联合使用抗感染药物与静脉含钙制剂的病例中就曾发生过严重的不良反应事件。因此,在新生儿治疗中,联合使用头孢曲松和静脉含钙制剂是绝对禁止的。对于其他年龄组的患者也不推荐同时双通道输注头孢曲松和静脉含钙制剂,并且要求连续使用前进行冲管处理。值得注意的是,儿童的滴注速度较成人慢,因此药物与肠外营养的接触时间较长等因素均应考虑在内。
药物与肠外营养液之间的不相容性因素具有较高的用药风险,因此应该制定和执行相关安全规范指南。责任药师应确认联合输注肠外营养液与静脉用药的安全性,确保其是临床适合的、稳定的及非不相容的。下列原则可以作为参考:
1.确保药物在与肠外营养混合配备后至完全输注患者体内的期间(通常为24~36小时)是相容与稳定的。
2.确保肠外营养中成分的稳定性与相容性。
3.确保药物的治疗效果与核定药物的使用剂量。
4.确保适合的稳定滴注速度。
5.肠外营养液与药物同时使用时,在停药或停止肠外营养的情况下需仔细核查药品标签,防止重复治疗或治疗药物间断等情况的发生。
6.如果没有相容性数据支持,应避免联合输注使用。
7.参考相容性数据应注意药物的溶解度与肠外营养的类型。
肠外营养除与静脉用药在体外存在相容性和稳定性相互作用因素外,在体内也可以影响药物的分布与代谢,影响药物治疗或引起用药风险。药物在体内通过代谢和排泄途径消除,代谢与排泄途径涉及的酶与转运体会受到营养状态的影响。肠外营养可以通过纠正营养不良、改善代谢功能,使接受肠外营养治疗的营养不良患者的细胞色素P450活性得到增强。肠外营养也可引起肝脏疾病并发症,如长期超量输入脂肪乳和葡萄糖可引起肝脂肪变性,在这种情况下可影响肝代谢功能,从而影响药物的代谢。
此外,肠外营养属于高渗溶液,通过静脉输注可影响体液容量和细胞外液量,对主要分布到细胞外液中的药物(如氨基糖苷类抗生素与β-内酰胺类抗生素)影响尤为明显。此外,肠外营养液可以影响药物与血浆蛋白结合,改变血中的游离药物浓度。例如抗癫痫药,有研究表示全肠外营养液中的脂肪乳中的游离脂肪酸可以竞争血浆蛋白结合位点,将苯妥英等药物置换出来,导致游离丙戊酸的浓度升高。全肠外营养液与含氨基酸的部分肠外营养液中的L-色氨酸也可通过竞争血浆蛋白结合位点,显著改变苯妥英等药物的游离分子浓度。因此苯妥英、苯巴比妥、丙戊酸在与含以上成分的肠外营养液同时使用时,其游离药物浓度有可能升高,需要进行治疗药物监测。尤其对于低蛋白血症(如烧伤、老年人、孕妇、艾滋病患者)、尿毒症、慢性肝病等特殊疾病患者,应进行药物药动学参数评估和药物剂量调整。
肠外营养还可以影响药物的治疗效果,例如含维生素K 1 的肠外营养制剂(如肠外复合维生素产品与静脉用脂肪乳)。由于不是所有的肠外复合维生素产品中都含有维生素K 1 ,而且不同的静脉用脂肪乳制剂中的维生素K 1 含量不同,因此当患者更换不同的肠外复合维生素产品或静脉用脂肪乳制剂时,可通过改变患者体内的维生素K 1 基线水平影响抗凝血药治疗方案、改变口服抗凝血药的治疗效果,甚至引起不良反应。
肠外营养可通过改变患者的糖代谢,对血糖控制药物产生影响。研究发现,葡萄糖的滴注速度超过4~5mg/(kg·min)可导致高血糖症状。患者自身调节血糖的能力也取决于葡萄糖的总摄入量,尤其是危重症患者,从而影响患者使用降血糖药的指征、路径及类型。胰岛素依赖型糖尿病患者的胰岛素类型与剂量需重新核定。
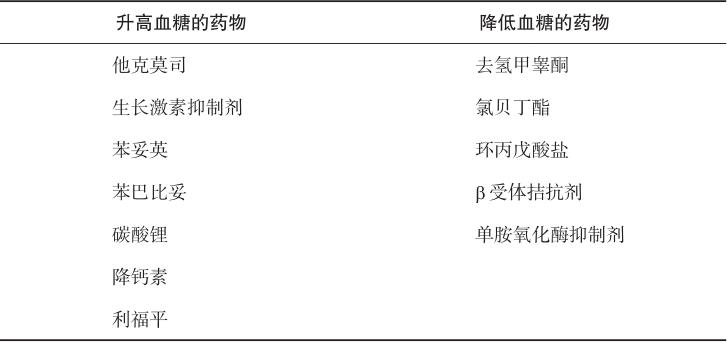
此外,有些药物可以影响血糖水平(表4-5),给予肠外营养的患者在使用上述药物时应当加强监测。患者经其他给药途径也可能引入葡萄糖,如静脉血液透析、腹膜透析、抗生素滴注等,也应当根据葡萄糖的实际使用量调整静脉营养的成分。另外还需按照比例增加胰岛素用量,增加血糖监测次数(每4~6小时1次),必要时停药至血糖恢复正常水平。
表4-5 可影响血糖水平的常用药物

续表