




超声(ultrasound,US)医学是声学、医学、光学及电子学相结合的学科。凡研究高于可听声频率(高于20000Hz)的声学技术在医学领域中的应用即超声医学,包括超声诊断学、超声治疗学和生物医学超声工程,具有医、理、工三结合的特点,为临床交叉学科,涉及内容广泛,在预防、诊断、治疗疾病中有很高的临床应用价值。超声诊断仪器向人体组织中发射超声波,遇到各种不同的物理界面时,产生不同的反射、散射、折射和吸收衰减的信号差异,利用超声波在人体组织中的这些传播特性,将不同的信号差异加以接收放大和信息处理,显示各种可供分析的图像,提取所需要的医学信息,从而进行医学诊断。
超声医学是医学影像学的一个重要分支,尽管其成像原理与方法不同,但均系人体内部结构和器官形成影像,以达到诊断和治疗的目的。
诊断用超声仪器由主机、显示器和探头三部分组成,其中主机包含发射电路、接受电路、扫描电路、主控电路和标距电路等部分。
采用灰度调制显示(brightness modulation display)声束扫查人体解剖切面产生的图像,简称B超。其原理是超声仪器发射脉冲超声进入人体,然后接收各层组织界面的回声和脏器内部散射回声,并将回声脉冲电信号放大后送到显示器,构成二维断面图像,通过对超声图像断面的分析做出诊断。不同的组织有不同的声衰减和声阻抗,因此产生不同的回波强度,从而在显示器上显示不同灰阶强度的图像,利用这些回波来传达人体组织和脏器解剖形态和结构方面的信息。二维灰阶成像是超声在临床诊断中最基本和最常规的诊断模式,彩色多普勒血流成像(color Doppler flow imaging,CDFI)、彩色多普勒能量图(color Doppler energy,CDE)或其他血流图、三维超声成像(3-dimensional ultrasound,3-D US)、超声造影(contrast enhanced ultrasound,CEUS)、介入性超声治疗(interventional ultrasound,IUS)以及高强度聚焦超声(high-intensity focused ultrasound,HIFU)等超声诊断和治疗技术都必须建立在二维灰阶成像的基础上。因此,二维灰阶图像质量的好坏直接影响其他图像的质量。对肝脏检查而言,常规检查使用实时B超仪,凸阵或线阵探头,频率2.5~5.0MHz,根据不同的体形和病情进行相应的调节。
多普勒效应是由奥地利数学、物理学家Christian Andreas Doppler于1842年首先提出,用以阐述振动源与接收器之间存在运动时,所接收的振动频率因运动而发生改变的物理现象。①振动源与接收器相对运动时,接收器收到的振动频率增高;②相互背离运动时,接收器收到的振动频率减低;③振动源不动,接收器向振动源运动,收到的振动频率增高;④振动源不动,接收器背离振动源运动,收到的振动频率减低;⑤接收器不动,振动源运动,所接收到的振动频率变化规律与第③④相同,取决于运动的方向。多普勒技术包括彩色多普勒和频谱多普勒技术,前者包括CDFI和CDE,后者包括脉冲多普勒(pulse wave Doppler,PWD)、连续多普勒(continuous wave Doppler,CWD)等技术。
(1)多普勒效应公式为f d =f r -f 0 =2Vcosθ·f 0 /c,式中f 0 为发射超声频率,f r 为接收超声频率,f d 为多普勒频移,c为声速,θ为入射声速与运动方向之间的夹角,V为运动速度。利用多普勒频移的解调效应可以检测血流速度。
(2)彩色多普勒血流成像:又称彩色多普勒超声,以红、蓝、绿三基色及三基色混合产生的二次色显示人体组织器官及病灶内的血流信息。通常人为设定红色表示血流朝向探头,蓝色表示血流背离探头。色彩的灰度显示速度的大小,越亮表示血流速度越快,色彩越暗表示血流速度越慢。应用彩色多普勒技术可以检出人体组织器官及病灶内的血流信息,鉴别脏器内管道的性质,判断动脉或静脉,显示血管的起源、走向、时相和管腔内血流的性质,观察血管有无狭窄、梗阻、扭曲或动静脉畸形和心腔内异常通道形成,引导频谱多普勒取样位置的放置。根据肿瘤内部血管的分布、血管数目的多少可用以鉴别肿瘤的良恶性。通常瘤体血供越丰富,其恶性程度越高。
(3)彩色多普勒能量图:CDE技术主要是依据血管内运动的红细胞多普勒能量的总积分,即多普勒信号强度或能量为成像参数,故可弥补彩色多普勒超声的不足,彩色血流的分布显示不受血流方向等因素的限制,因此能显示出比彩色多普勒超声所见更为细小的血管,对肿瘤血管的显示比彩色多普勒超声更优越,有助于肿瘤良恶性的鉴别。
(4)频谱多普勒血流的检测方式:
1)脉冲多普勒:以频谱图的方式显示血流。调整取样容积的大小及位置,可检测感兴趣区或靶区血管某一点的血流动力学指标,如最大血流速度(V max ),平均血流速度(V mean )、最低血流速度(V min )、血流阻力指数(resistive index,RI)、血流搏动指数(pulsative index,PI)及血流量等。同时可判断血流方向:频谱位于基线上方为朝向探头的血流,反之则为背离探头方向的血流。对门静脉血流动力学指标的监测,可早期诊断门静脉高压症,并随访治疗效果。对肝动脉及肝脏肿瘤血流动力学指标的检测有助于判断病灶的良恶性。
2)连续多普勒:探头内有两个超声换能器,一个连续发射超声信号,另一个连续接收超声信号,无选择检测深度的功能,但可测高速血流,不会产生混迭现象。
超声显像为现代医学影像技术的重要组成部分,在肝脏疾病的诊断治疗中发挥重要作用,然而常规灰阶仅提供组织结构的回声,无法准确判断疾病的特征性表现。彩色多普勒超声虽可用于评估组织器官和病灶的血流灌注,提供血流动力学信息,但对病灶内微小血管的低速血流的评估能力是有限的,特别是肝内小病灶以及体内深在病灶内的微小血管由于红细胞散射的不足,难以探测到微小的多普勒信号,超声对病灶性质的判断仍存在不足。实时超声造影技术主要是利用了造影剂微气泡非线性特性的谐波成像能力,由于造影剂微气泡的非线性效应强于组织几十倍乃至上百倍,故其产生的二次谐波信号要明显强于组织的二次谐波信号。因此在造影条件下,主要接收造影剂产生的二次谐波信号,不受组织在基波水平上产生的杂波干扰,可以获得鲜明的造影效果。近二三十年来,随着高效、稳定的新型造影剂的不断研发、应用,以及造影剂成像相关技术的飞速发展,超声造影技术取得了突破性的进展,可以实时观察造影剂微泡在组织器官的灌注情况,从而揭示器官组织以及病灶的血流灌注特征,增加了信噪比,弥补了彩色多普勒超声对病灶内微小血管低速血流信号低敏感性的问题,较好地显示病灶内的血管分布,反映和观察正常组织和病变组织的血流灌注情况,提高了诊断的敏感性、准确性及特异性,已成为超声诊断重要的诊断手段。此外,以造影剂微泡为载体实现基因、药物的靶向转移和释放的治疗目的,将大大拓展了超声造影在临床的应用。
由于肝脏组织有着特殊的血供模式,由肝动脉(25%~30%)和门静脉(70%~75%)提供双重血供,使用造影增强超声可以观察到三个血管时相,即早期-动脉期、中期-门脉期、晚期-延迟期或称肝实质期(表5-21-1)。目前我国使用的造影剂多为注射用六氟化硫微泡(SonoVue),采用团注法注入外周静脉,根据肝脏病灶内造影剂增强(wash in)与消退(wash out)的模式和时间差异,可以对病灶作出特异性诊断。
表5-21-1 肝脏超声造影的血管相(注射后时间)
介入性超声技术为现代超声医学的重要分支,指在实时超声的监视或引导下,完成各种穿刺活检、X线造影以及抽吸、插管、肿瘤消融、注药治疗等操作,可以避免某些外科手术,并达到与外科手术相当的效果。
广义的介入性超声包括腔内超声(经气管超声、经食管超声、胃镜超声、经直肠超声、经尿道超声、经阴道超声)、细径导管超声(血管内超声、胃肠镜超声)、术中超声(腔镜超声、开放性手术术中超声引导)等均纳入其范畴。
超声诊断技术是各种肝病的首选检查方法。二维实时超声显像主要用于肝脏形态及质地的变化,彩色多普勒血流显像则用于肝脏血管病变与血流动力学检查。超声检查显示肝脏的病变图像,属于声学物理的性质变化。同一病变,病程发展的不同阶段,超声图像表现不同;而不同病变,如其声学物理性质相似,超声图像的表现可能相同。因此,超声不能提示病理解剖学的诊断。新型造影剂和超声造影技术的发展,使肝脏的超声影像正在发生巨大的变化。当静脉注射不同类型的超声造影剂时,微泡通过肺循环,在特定的影像程序下,不仅可以增强多普勒信号、改善灰阶超声图像的质量,而且可以实时观察微血管及组织的血流灌注,在肝脏疾病的诊断和治疗中可提供至关重要的信息。肝占位性病变必要时可在超声定位下行肝脏穿刺活检或其他影像检查。临床医生对超声检查提示的结果,应密切结合临床表现及其他检查所见,全面分析后做出诊断。
为保证检查图像清晰显示,患者于检查当天应禁早餐。如当天同时进行胃肠钡餐或胃镜检查,则应先行超声检查。若腹内积便或积气较多,宜于检查前夜服用泻药以促使排除粪便和消化道积气,以保证图像质量。
仪器调节
肝脏超声检查以二维灰阶超声为基础,选用凸阵探头,探头频率2.5~4MHz,检查过程实时灰阶显示(帧频≥8f/s),高分辨率,高灰阶(灰阶级≥128)。对于小儿、体瘦者或病灶位于肝脏浅部可选用更高频率或高频线阵探头,频率5~7MHz。
在良好的二维灰阶图像基础上使用彩色多普勒观察断面的血管走向、病变区血流和周围血流的关系,利用频谱多普勒测量血流速度,计算血流量。取样框适当大小以保证帧频,适当调节彩色增益、壁滤波、量程等调节键,使得血流清晰显示,充盈良好又无明显噪声;选择合适的量程,频谱多普勒测量尽量减小声束与血流方向的夹角,使之<60°。
1.肝的大小、形态、位置,解剖变异。
2.肝脏弥漫性病变 脂肪肝、肝硬化、肝纤维化、血吸虫肝病、淤血肝等。
3.肝脏囊性占位性病变 肝囊肿、多囊肝、肝脓肿、肝周脓肿、肝包虫病等。
4.肝实质性占位性病变 肝脏原发性良、恶性肿瘤、肝脏转移性肿瘤、肝脏局灶性病变。
5.肝脏外伤、破裂、血肿等。
6.肝血管性疾病 门静脉血栓与癌栓、Budd-Chiari综合征、先天性肝血管畸形、肝动脉瘤等。
7.肝脏门静脉、肝动脉、肝静脉血流动力学监测。
8.肝移植术前评估及术中、术后监测。
9.肝脏介入性超声诊断与治疗 超声引导下穿刺肝组织学和细胞学检查;肝脏脓肿穿刺引流及治疗;肝囊肿穿刺引流及硬化剂注射治疗。超声引导下肝脏肿瘤药物、酒精注射治疗;经皮肝内胆管穿刺引流、造影术;经皮肝门静脉穿刺造影术;肝脏肿瘤消融术等。
10.肝脏术中超声。
11.超声造影在肝脏疾病诊断和治疗中的应用。
正常肝脏形态横切面上呈楔形,肝右叶和后缘较厚而圆钝,左叶、左缘和前下缘锐薄。肝脏轮廓光滑、整齐、清晰,被膜呈纤细线状强回声带包绕整个肝脏,膈面呈弧形,左叶和右叶交界处,可出现弯曲和切迹变化。肝脏的形态可因体型不同而变化,也可以有变异。
肝脏实质回声为细小点状回声,分布均匀,呈中低强度回声,回声强度介于肾实质与胰腺实质回声强度之间,即比肾实质回声强而低于胰腺实质回声强度。
门静脉系统、胆道系统及肝静脉系统的三级分支均能在声像图上显示,并作为肝脏分叶的定位标志。肝固有动脉及左右分支在肝门处可显示,依搏动的血管结构及多普勒频谱来确定。
(1)肝右叶最大斜径:
右肋缘下扫查显示第二肝门,以肝右静脉和肝中静脉汇入下腔静脉的肝脏斜切面为标准测量切面,测量右肝前后缘最大垂直距离,正常值10~14cm。
(2)肝右叶前后径:
第5或第6肋间肝脏最大切面为标准切面,显示门静脉主干和下腔静脉之间肝脏回声,测量右肝前后缘最大垂直距离,正常值8~10cm。
(3)肝左叶前后径和上下径:
标准测量切面为通过腹主动脉长轴显示左肝矢状面,在此切面测量肝左叶最大前后径和上下径,前后径不超过6cm,上下径不超过9cm,肝脏有变异时,需综合考虑。
肝内管道结构的超声测量如图5-21-1~图5-21-3所示:
图5-21-1 肝右叶前后径测量切面
图5-21-2 肝右叶最大斜径测量切面
图5-21-3 肝左叶前后径和上下径测量切面
(1)门静脉主干内径:
正常值1.0~1.3cm,小于1.4cm。正常平均血流速度15~25cm/s。
(2)肝动脉内径:
正常值0.4~0.5cm,收缩期峰值血流速度正常为40~60cm/s,阻力指数0.50~0.70。
(3)肝静脉内径:
肝右静脉或肝中静脉内径正常为0.7~1.0cm,不超过1.1cm,不小于0.7cm。左肝静脉因比较细小,常汇入肝中静脉后再汇入下腔静脉。
(4)胆管系统:
正常肝内胆管直径0.2~0.3cm;肝总管长3~4cm,直径0.4~0.6cm;胆总管长4~8cm,直径0.6~0.8cm。
【声像图表现】
(1)灰阶超声:
①肝形态正常,轻、中度脂肪肝大小正常或增大,重度脂肪肝肝体积可增大;轻、中度脂肪肝肝实质内回声弥漫性致密增强,即所谓“明亮肝”。②前半部回声细密,由浅至深回声逐渐减弱。轻度:后半部回声稍衰减,深面肝包膜回声可见;中度:肝深面1/3回声明显减低,可呈低回声,深面肝包膜回声不显示,提高增益可显示;重度:肝深面2/3回声明显减低,深面肝包膜回声不显示。③肝内管道结构回声减弱,分支不易显示,中度和重度者血管结构显示不清。
(2)彩色多普勒超声:
重度脂肪肝患者肝内血管血流不易显示。
需要注意的是,超声图像判断脂肪肝的程度无量化标准,检查者及使用仪器不同会得出不同结论,随着仪器设备的进步,脂肪肝深面实质可无明显衰减,因此脂肪肝轻重与否需要结合患者的血脂和肝功能状况综合进行判断。
【声像图表现】
局限性脂肪肝超声像图表现如图5-21-4所示:
图5-21-4 局限性脂肪肝二维灰阶图像
(1)灰阶超声:
也称为叶段型脂肪肝,肝实质脂肪变分布在某一肝叶或肝段,或呈斑片状或结节状,回声明显增强,境界清晰,无占位效应,肝内管道结构正常。
(2)彩色多普勒超声:
脂肪变的肝叶或段内血管无受压及推移,血流可正常显示。
(3)超声造影表现:
局灶性脂肪变性结节样异常区在动脉相、门脉相及延迟相与正常肝组织增强表现一致,未见异常灌注区,结节样回声消失。
【声像图表现】
(1)灰阶超声:
回声致密增强的肝实质内出现圆形或不规则形片状低回声区,边界清,多位于右肝前叶和左肝内叶的胆囊床附近,为典型或非典型的假性结节样回声。
(2)彩色多普勒超声:
肝实质内低回声区无占位效应,其内及周边肝内血管走行正常,无受压及推移。
(3)超声造影表现:
同局限性脂肪肝。
急性肝炎指病程6个月以内者,常见为甲型和乙型病毒性肝炎。
【声像图表现】
(1)轻度急性肝炎肝脏超声显像无明显变化。
(2)中重度急性肝炎肝脏不同程度增大,肝缘角变钝,肝脏实质回声减低,切面回声均匀呈密集细点状,后方回声可增强;肝内管道回声清晰,门静脉、脾静脉无增宽伴管壁回声增强;脾正常大小或轻度增大;部分患者可见胆囊缩小、胆壁黏膜水肿而成弱至中等的点状回声;肝门处可见数目不等的、大小为1~2cm的椭圆形淋巴结。
由急性肝炎迁延而来,病程超过6个月,常见于乙型肝炎和丙型肝炎。
【声像图表现】
(1)轻度慢性肝炎肝脏超声显像无明显变化。
(2)中度慢性肝炎肝脾可稍增大,实质回声增粗,增大或清晰,包膜平整,肝内回声增粗、增多,分布尚均匀,肝内管道回声清晰,门静脉、脾静脉无增宽。
(3)重度慢性肝炎肝大小一般正常,包膜欠光整,肝脏实质回声增粗、增多,肝内管道回声欠清晰;门静脉、脾静脉可增宽,脾轻度增大;胆囊壁黏膜水肿增厚呈“双层征”,部分患者肝门处可见数目不等的、大小为1~2cm的椭圆形淋巴结。
肝硬化(cirrhosis of liver,CL)是肝纤维化的终末阶段,由一种或多种病因长期或反复作用形成的弥漫性肝损害。在我国大多数为肝炎后肝硬化,少部分为酒精性肝硬化和血吸虫性肝硬化。早期无明显症状,后期可出现不同程度的肝功能不全和门静脉高压。超声检查有一定的图像特征能提示明确诊断,但不能区分门脉性、坏死后性肝硬化和胆汁性肝硬化,需结合肝胆系统病史提示。
1.早期肝硬化
超声声像图无特异性表现,肝大小变化不明显或轻度增大,肝包膜尚光滑,内部回声密集、增多,分布较均匀,肝内结节形成不明显,血管纹理与多普勒超声检测基本正常。
2.典型肝硬化
(1)形态轮廓:
肝脏缩小,肝右叶上下径变短,肝边缘角变钝或不规则。部分病例随病程进展显示肝右叶明显萎缩,左叶轻微萎缩或有肿大倾向,肝尾叶可代偿性增大。肝包膜增厚,回声增强,厚薄不均。肝表面不平整,呈锯齿状或波浪状,肝前有腹水时显示更清晰。
(2)肝脏实质回声:
多表现为普遍增高、增粗、增多,分布不均匀,肝小叶被纤维组织所分隔,形成众多假小叶,再生结节明显时,肝内布满圆形或类圆形稍高或稍低回声结节,大小为0.1~0.5cm,少数超过1.0cm。
(3)肝血管:
肝内血管网变少。①门静脉高压:门静脉系统血管粗细与门静脉压力呈正相关。门静脉主干内径≥1.4cm,彩色多普勒显示门静脉色彩暗淡,严重者门静脉内显示双向血流或离肝血流,频谱多普勒超声检测正常的轻度波动消失,血流频谱低平或双向、反向血流,峰值流速一般低于20cm/s,同时脾静脉(内径≥0.8cm)及肠系膜上静脉增宽(内径≥0.7cm),有时可见呈瘤样扩张或脾肾静脉分流,部分患者可见门脉血栓形成及海绵样变性。②肝静脉可受挤压变细或粗细不均,血流频谱。部分肝静脉变细,纹理紊乱,仅见粗细不均、迂曲的蓝色血流。多普勒频谱曲线S<D峰,或S、D峰相连呈驼峰。③肝内动脉:肝硬化后,由于门静脉循环障碍,可使肝动脉代偿性扩张和增生,并与门静脉吻合支沟通。结果使肝动脉血流量增加,二维灰阶显示肝动脉内径增宽,彩色多普勒超声显示肝门部与门静脉并行的搏动性血流信号,脉冲多普勒超声可测得较高的峰值血流速度。④侧支循环开放:脐静脉重新开放使圆韧带内已闭塞的脐静脉分离而出现管状无回声区,自门静脉左支囊部延向腹壁。彩色多普勒检查门静脉左支彩色条状管道沿圆韧带方向一直通向肝表面,并穿过肝包膜及肌层至腹壁。重新开放的脐静脉血流多少与门静脉高压的严重性呈正相关。⑤胃左静脉扩张:内径≥0.5cm,血流速度增快,血流方向向肝、离肝或双向。门静脉高压患者伴有胃左静脉扩张提示存在食管胃底静脉曲张。⑥脾大:多为中度或重度肿大。脾静脉在脾门部和脾实质内有扩张的征象,脾实质回声无明显变化或轻度增强。腹水:肝前、脾周围、肝肾间隙、腹侧、盆腔出现液性无回声区,形态不定,且随体位改变而有相应变化,最大径可超过10cm。肝硬化肝血管超声声像图表现如图5-21-5~图5-21-7所示。
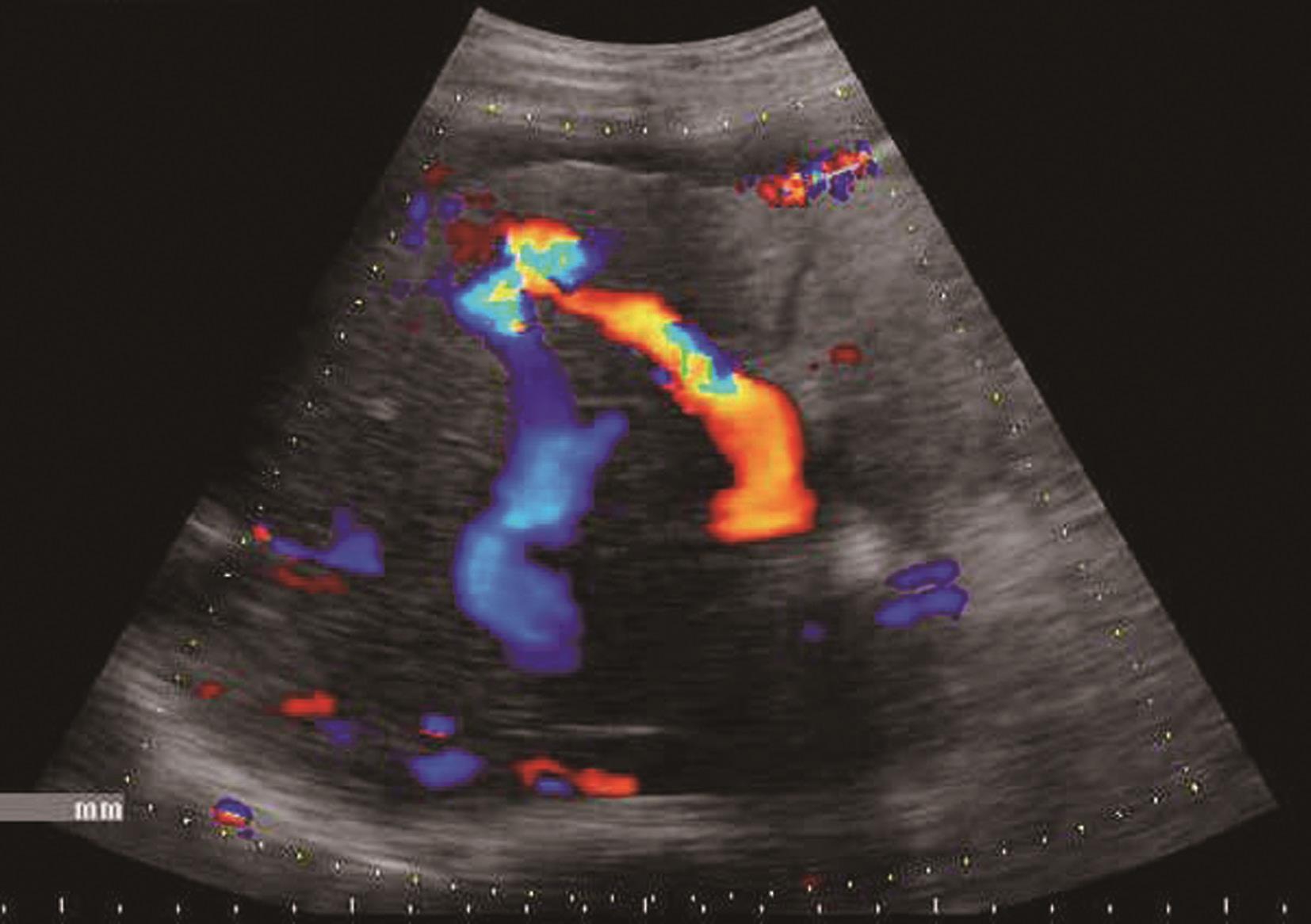
图5-21-5 肝硬化门静脉扩张、腹水、门静脉-肝静脉瘘彩色多普勒图像
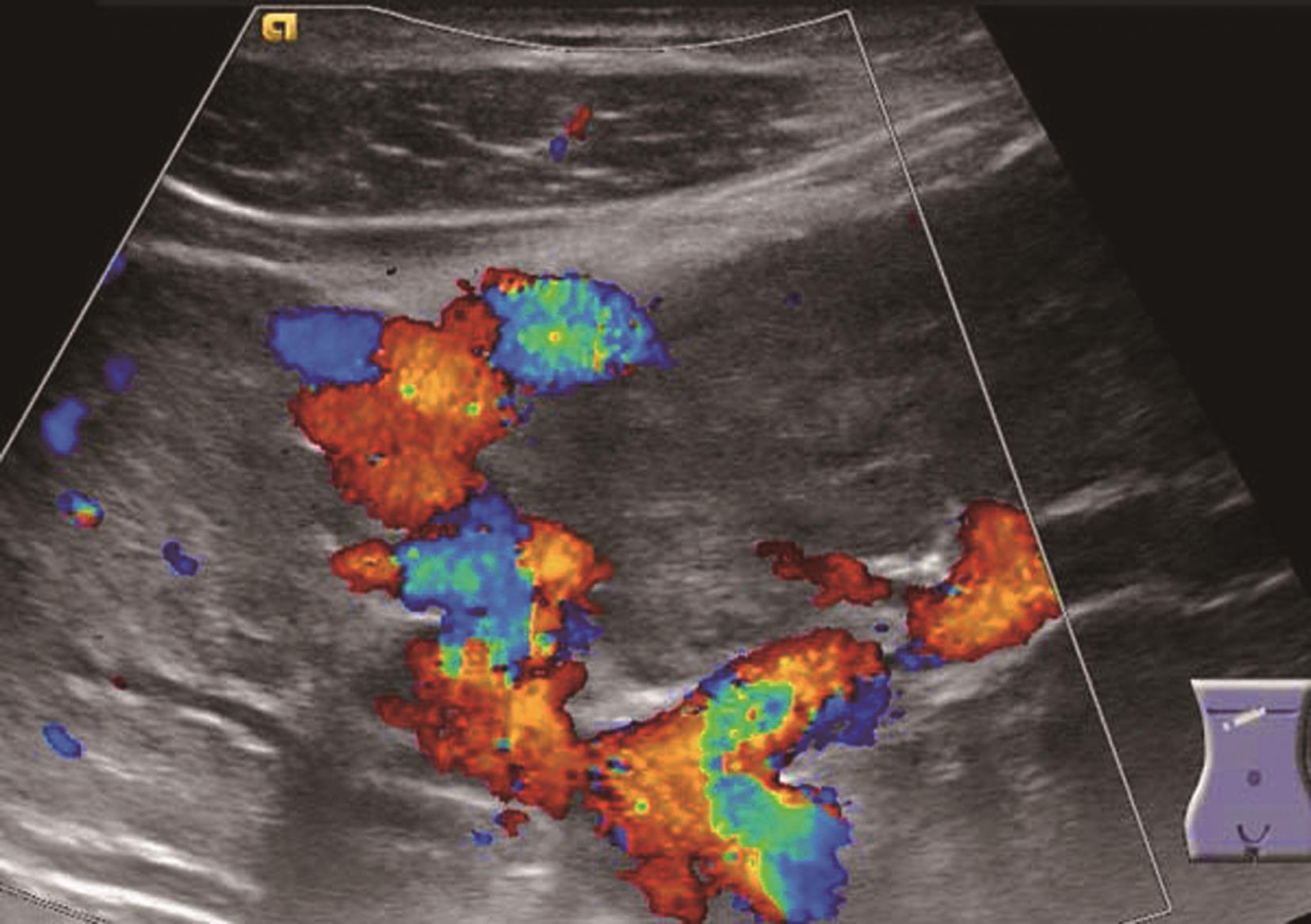
图5-21-6 肝硬化脐静脉扩张彩色多普勒图像
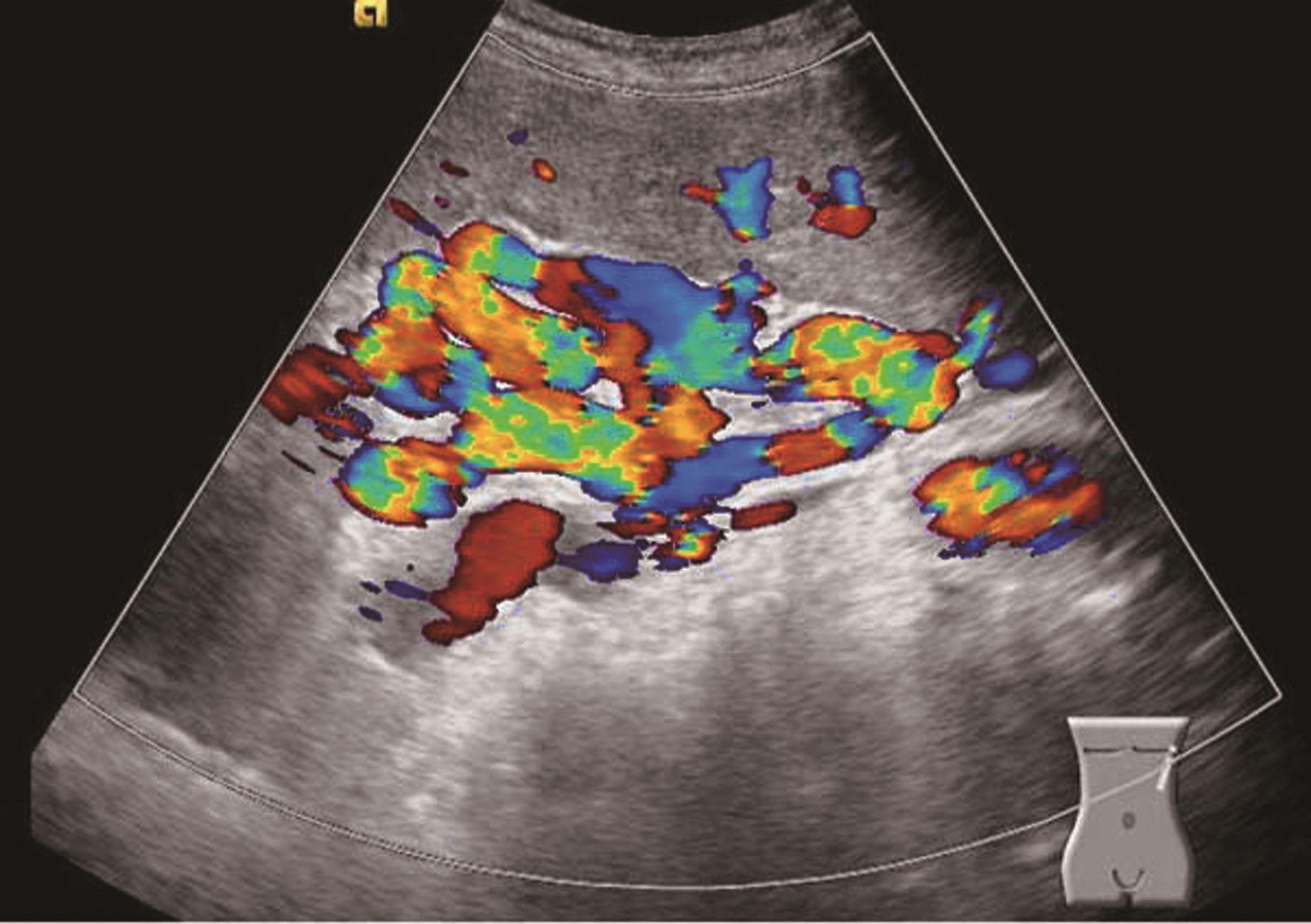
图5-21-7 肝硬化脾肿大伴脾静脉曲张彩色多普勒图像
(4)胆道系统:
因低蛋白血症、腹水和门静脉压力增高、淋巴液回流受阻等因素导致胆囊壁增厚、水肿,出现均匀性水肿样增厚,呈双层改变,一般无肝内胆管扩张。
(5)其他类型肝硬化超声表现:
①胆汁性肝硬化者可见一些有关征象,如肝内胆汁淤积引起者,肝外胆道及胆囊常难显示。肝外胆道阻塞引起者可探及胆系扩张及相关原因的征象。②血吸虫病肝硬化者肝实质回声常有特征性图像,即“龟背纹”或“网格状”图像特征。③淤血性肝硬化者可见下腔静脉和肝静脉明显增宽。
(6)超声造影评估肝硬化:
在肝硬化中,由于肝组织结构的变化,纤维结缔组织的增生,窦周间隙的胶原化,累及肝窦的毛细血管样通道,导致血管空间的减少,通常伴有血流动力学紊乱,肝内多发动静脉分流,其肝静脉显影时间早于正常人群及非肝硬化人群。Albrecht等提出了一种利用声学造影诊断肝硬化的方法,即测量静脉内注射造影剂到肝静脉内出现造影剂信号的时间。肝硬化患者组的超声造影时间-强度曲线显示造影剂度越时间(transit time,TT)明显异于正常组和非硬化性弥漫性肝病组,肝硬化组平均通过TT为18s,继而出现一个早而陡的多普勒强度上升,正常组和非硬化组TT分别为52s、39s,而后出现一个较迟而缓慢的多普勒信号上升,推测造成肝硬化通过时间缩短的原因可能是肝内动静脉短路。在有明显的肝动脉和门静脉短路时,动脉相和门静脉相几乎同时出现。Abbattiasta等研究表明肝静脉显影时间17s为诊断肝硬化的阈值,且显影时间与肝弹性检查密切相关,弹性值越大,肝静脉显影时间越早。
(7)超声弹性成像评估肝硬化的临床应用:
超声弹性成像是一种新型超声诊断技术,基本原理是对组织施加一个内部或外部的动态或静态与准静态的激励,在弹性力学、生物力学等物理规律的作用下,利用压迫前后接受的超声波信号变化,结合数字信号、数字图像处理技术,反映组织内部弹性模量的差异。目前临床广泛应用的主要有瞬时弹性成像(transient elastography,TE)、声辐射力脉冲弹性成像(acoustic radiation force impulse,ARFI)、实时超声弹性成像(real-time tissue elastography,RTE)及剪切波成像(shear wave elastrography,SWE)技术等。国内外研究表明,弹性模量值与肝纤维化病理分级、门静脉高压程度呈正相关,为当前肝硬化超声医学研究的热点。
血吸虫性肝病(schistosomiasis japonca)是日本血吸虫寄生在门静脉系统所引起的疾病。基本病变为肝与结肠由虫卵引起的肉芽肿性反应。根据临床表现分为急性期、慢性期和晚期。
病变以炎性渗出和虫卵沉着所致的嗜酸性结节为主。
【声像图表现】
(1)灰阶超声:
肝脏常有轻度肿大,左叶明显,肝边缘角圆钝,实质回声稍增高、增密,分布不均匀,有时可见散在分布的不均质片状低回声。脾大小正常或轻度肿大。
(2)彩色多普勒超声:
肝内血流可无异常。
少量多次感染尾蚴,不引起机体明显病变或急性期自然退热,急性期治疗不彻底,都可转为慢性血吸虫病。
【声像图表现】
(1)灰阶超声:
肝脏形态正常或失常。右叶常缩小,左叶增大,左肝边缘角圆钝,表面呈波浪状或凹凸不平。肝实质回声根据增生的程度不同,可有以下声像图改变:①鳞片状回声分布:肝内弥漫分布稍强纤细带状回声将肝实质分隔呈小鳞片状,境界不清,同时有较粗大斑片状强回声在其内分布。②网格状回声:肝内由较细而均匀的纤维带状回声将肝实质分隔成大小不一的网格状回声,网格境界不清,内部呈低回声或等回声。③粗网格状回声:网格回声增强、增粗、不均匀,所分隔肝实质境界清楚,近似圆形,回声较低,易误诊为肝癌。肝内门静脉壁回声增强,管壁增厚、毛糙、回声增强,肝内门静脉管腔扭曲变细,肝外门静脉主干及其属支均有不同程度的扩张。晚期伴有脾肿大、腹水。
(2)彩色多普勒超声:
肝内血流可无异常。并发门静脉高压时,门静脉血流速度减慢,并可显示侧支循环血流。并发血栓形成时,可见彩色充盈缺损。
指血液经过下腔静脉从肝脏回流到心脏,因某些原因使这种回流受阻,导致血液在肝静脉内淤滞的状态,常见病因为右心衰竭、缩窄性心包炎或肝静脉血栓。
1.灰阶超声
表现为:①下腔静脉及肝静脉及其属支内径明显增宽,下腔静脉内径大于2.0cm,肝静脉内径测值大于1.0cm,管腔内可出现“云雾”状回声。②下腔静脉及肝静脉壁及其属支管腔内径随心动周期和呼吸变化不明显或消失。③肝脏肿大,肝脏实质因充血回声减低。④脾肿大、腹腔积液及右心功能不全相应的超声表现。
2.彩色多普勒超声
下腔静脉及肝静脉超声血流回流严重受阻时,可血流反向,呈向肝血流。下腔静脉、肝静脉血流频谱三相波消失,可呈向肝或离肝等单向血流频谱。
肝脏常见良性疾病,囊壁由胆管上皮组成,囊壁菲薄,囊内分泌透明浆液,可单发或多发,随年龄增长发病率上升。
肝囊肿超声声像图表现如图5-21-8所示。
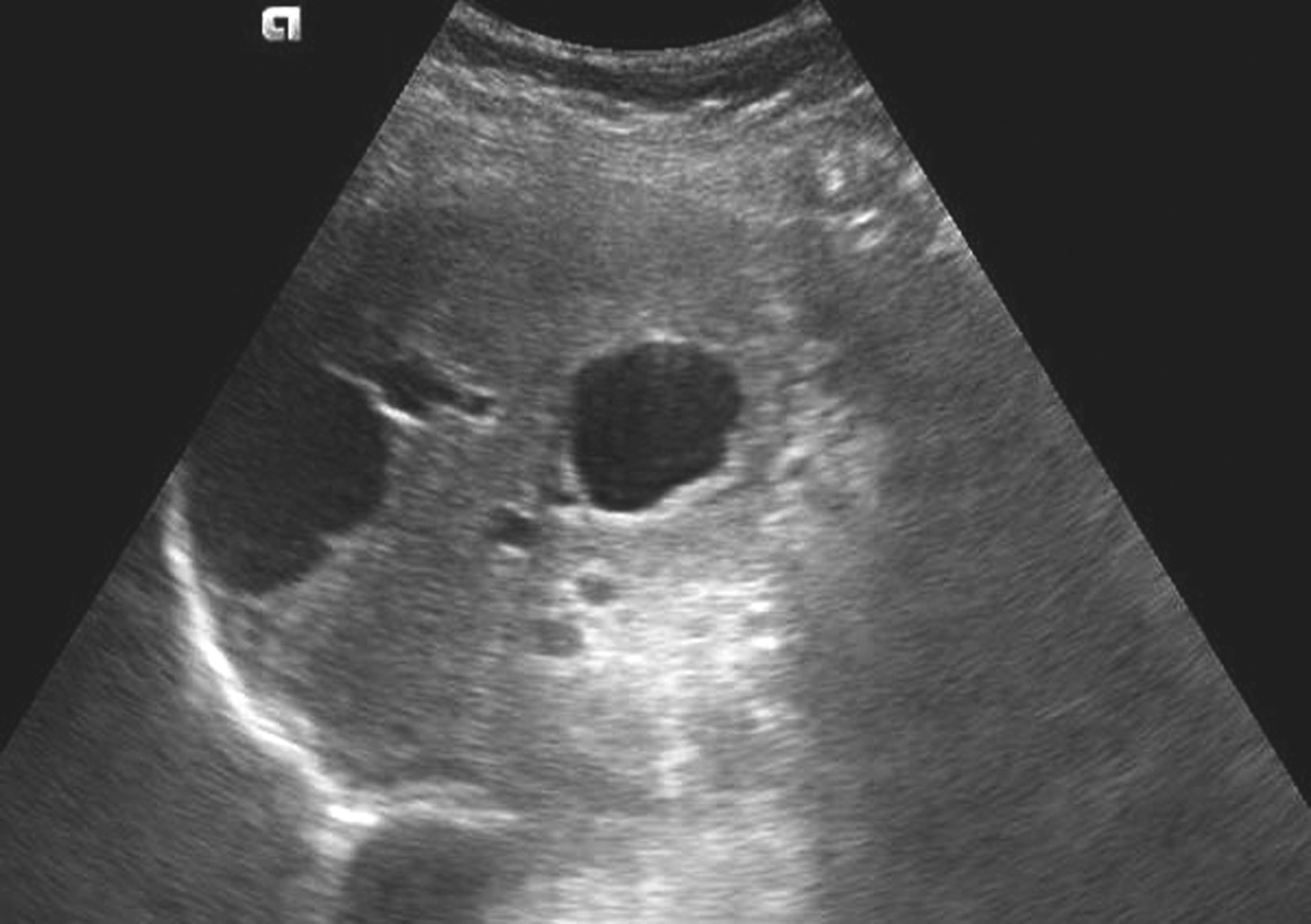
图5-21-8 肝囊肿二维灰阶图像
1.灰阶超声
肝脏形态、大小多正常,肝内可见一个或数个圆形或椭圆形无回声区,部分因囊肿体积增大而导致肝脏增大。囊肿单发或多发,边界清,壁薄光滑,内部为无回声区,透声好,部分内可见分隔,后壁和后方回声增强,侧壁回声失落。位于肝脏表浅位置或体积较大者,用探头加压时可见压缩征。囊肿合并出血或有继发感染时,囊内可见弥漫性细小点状回声,囊壁可增厚,模糊不清。
2.彩色多普勒超声
囊肿内无彩色血流信号,囊壁偶见短条状彩色血流信号。
3.超声造影表现
囊内造影全程无造影剂微泡灌注,呈边界清晰的三期无增强团块,囊壁呈等增强。
为常染色体显性遗传性疾病,由于肝内多余胆管未发生退化和吸收导致胆管囊状和分节状扩张,可分布于全肝或一侧肝叶,部分患者尚伴有多囊肾、多囊脾、多囊胰等其他内脏的多囊性病变,亦可并发原发性肝癌。
1.灰阶超声
肝脏普遍性肿大,切面形态失常,表面不规则。轻型者,肝脏形态、大小及切面形态大致正常。肝内可见大小不等,形状不一的无回声区弥漫分布于整个肝脏,无回声区之间的肝组织回声增强,分布不均匀,有较多“小等号”状回声。严重者肝实质及肝内管道结构显示不清。如囊内有出血或感染时可见部分囊肿透声性减低,内有絮状物漂浮。
2.彩色多普勒超声
肝内管道结构受压变细,难以显示正常管道结构。囊肿内部无彩色血流信号,囊壁偶见短条状彩色血流信号。
3.超声造影表现
同单纯性囊肿。
分为细菌性、阿米巴性及真菌性肝脓肿三类,其中真菌性肝脓肿罕见。细菌性肝脓肿多继发于胆道感染、其他化脓性疾病或血糖控制不良的糖尿病患者,病情急骤,全身脓毒症症状明显,有寒战、高热,脓液涂片和培养可发现细菌。阿米巴性肝脓肿常继发于阿米巴痢疾后,起病较缓慢,病程较长,可有高热,或不规则发热、盗汗,白细胞计数可增加,血清学阿米巴抗体检测阳性,脓液和粪便镜检有时可找到阿米巴滋养体,若无继发性细菌感染,血液细菌培养阴性。
超声声像图表现视脓肿的不同阶段而异。
1.灰阶超声
(1)脓肿早期:
由于脓腔尚未形成,肝内显示局限偏低回声区,边界不清,囊壁不明显,或其周边出现炎症反应带(内缘清晰,外缘模糊不清),回声不均匀,内部可呈中低回声,并有较粗大点状强回声。细菌性肝脓肿内可见散在的气体增强回声,后伴彗星尾征。
(2)脓肿形成期:
此时脓肿部分开始液化,其外形逐渐变圆,脓肿壁形成。脓肿表现为无回声区,边界清,边缘不光滑,其内有较多粗大点状强回声,分布不均匀,后方回声轻度增强。脓肿壁显示为厚壁高回声,内缘不平整,呈“虫蚀”样改变,脓腔内有分隔者可见分隔带或蜂窝样回声改变。脓肿较大者可致肝脏轮廓改变和肝内血管及邻近器官受压移位。细菌性肝脓肿有时可见肝内多发性散在小液性无回声区或低回声区,已融合者可稍大,形态不规则。脓肿内部因液化程度不同及脓液性状可有不同的超声表现:①脓液稀薄:液性无回声区内透声好。②脓液稠厚:液性无回声区内可见密集细小低回声,有坏死肝组织碎片时,可见斑片状强回声。典型脓肿常有伴随征象,如右侧膈肌活动受限和反应性右侧胸腔积液。
(3)脓肿恢复期:
脓肿内无回声区逐渐缩小,边界清晰,回声逐渐增高,最后消散吸收与正常肝组织回声相同。
2.彩色多普勒超声
肝脓肿早中期病变区处于充血阶段,血流量增多,脓肿周边和/或内部可探及点状或短线状彩色血流信号;脓肿形成期,周边及囊壁可见较多彩色血流信号,细菌性肝脓肿较阿米巴脓肿血供更丰富,后者血流信号较稀少或不能探及。脓肿液化部分无彩色血流信号显示。
3.超声造影表现
炎症充血期,动脉期病灶整体快速蜂窝状增强,呈等增强或轻度高增强,无增强区呈细小点状无回声;脓肿形成期病灶内液性部分增大,动脉期呈簇状、蜂窝状或片状无增强区,脓腔后期成熟后可形成较大脓腔,超声造影可见不规则分隔带或“花瓣”征,实质部分门脉期及延迟期呈等增强,少数病例可轻度消退;脓肿恢复期,超声造影显示脓腔缩小,表现与脓肿早期类似,直至恢复正常。肝脓肿超声造影动脉期、静脉期及延迟期超声像图表现如图5-21-9~图5-21-11所示。
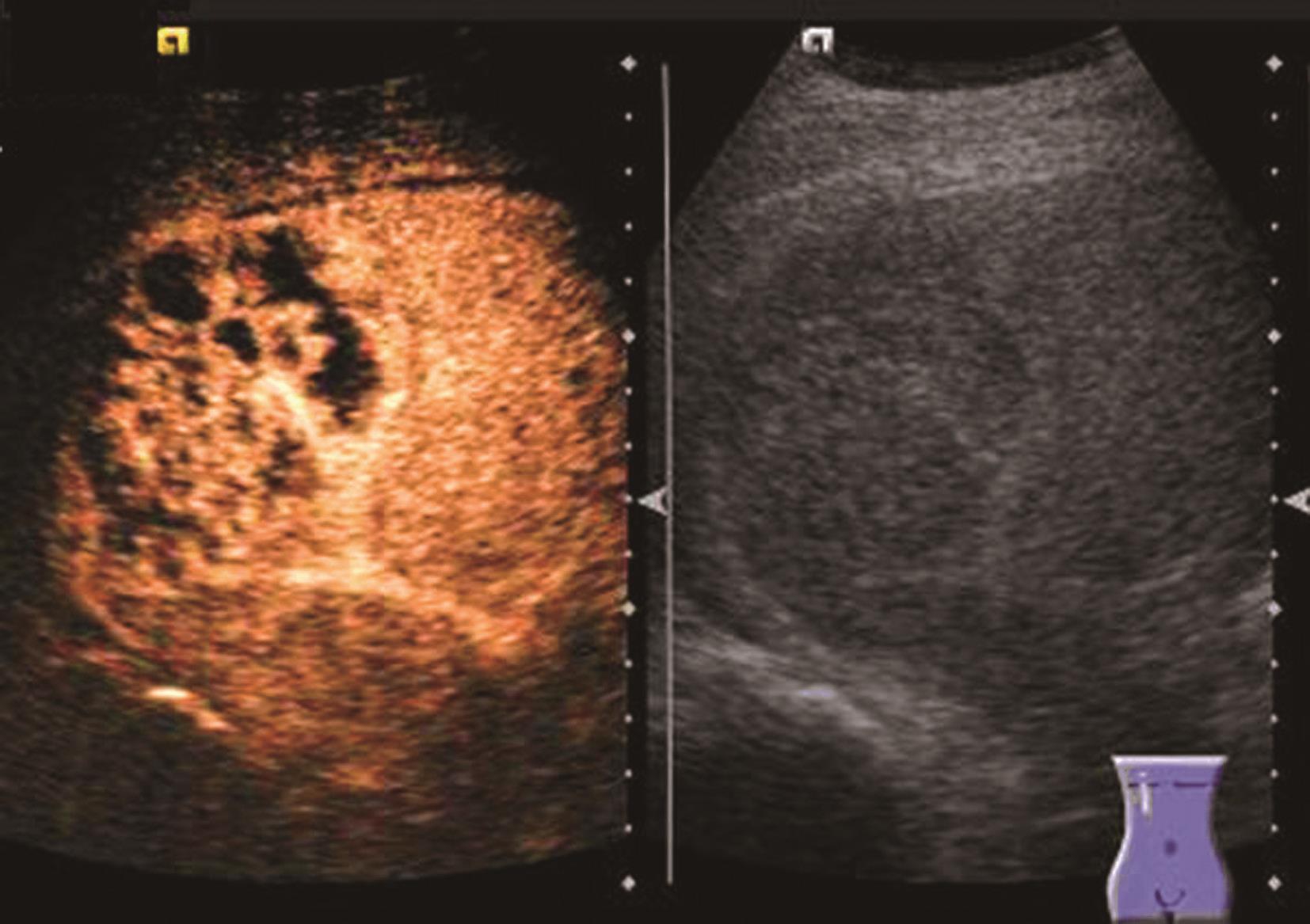
图5-21-9 肝脓肿超声造影动脉期
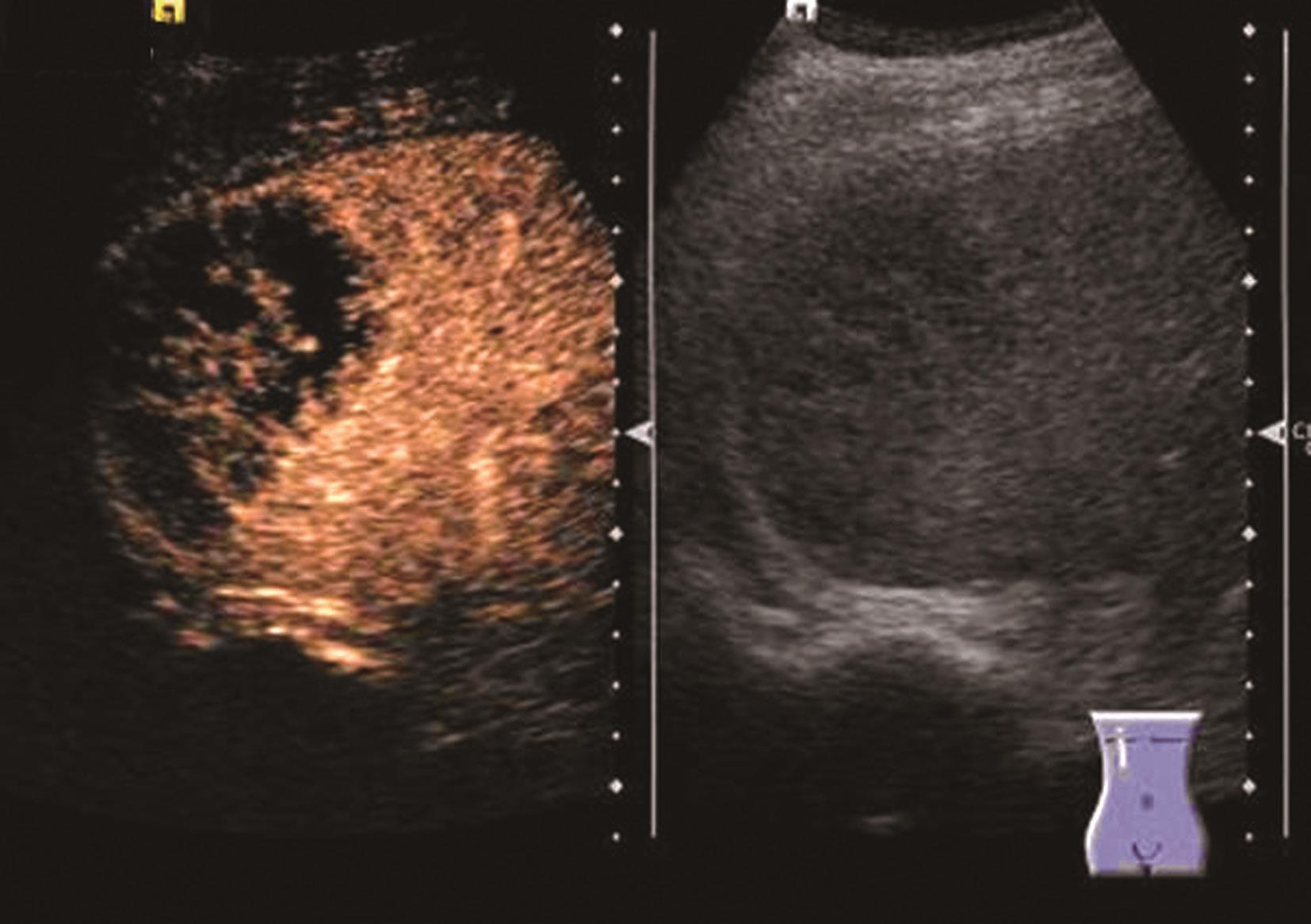
图5-21-10 肝脓肿超声造影静脉期
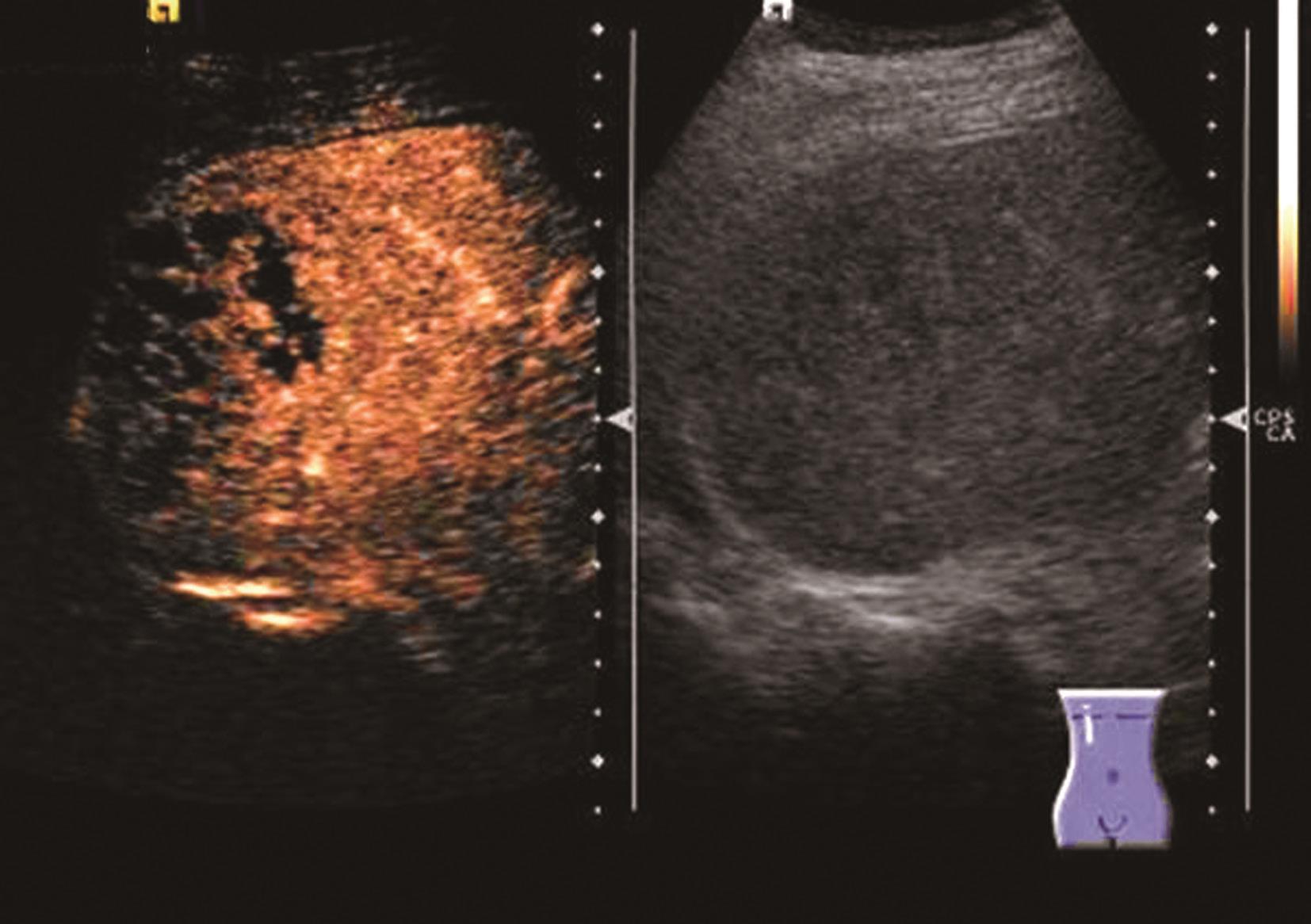
图5-21-11 肝脓肿超声造影延迟期
根据损伤的程度和部位分为三型。
1.肝包膜下血肿
肝实质的表面破裂,而肝包膜尚完整,则血液聚积在包膜下。灰阶超声显示肝包膜下的不定形或不规则的无回声区,或呈广泛的扁条状分布。彩色多普勒超声:肝血肿内一般无明显的血流信号。
2.肝真性破裂
肝实质的中央部分损伤破裂,表层组织仍完整,常伴有肝血管和胆管的断裂,形成较大的肝内血肿和胆汁潴留,压迫组织造成广泛坏死,也可以继发感染或与大的肝内胆管沟通,并发胆道出血。灰阶超声显示肝包膜回声连续中断,肝实质内血肿声像图呈混合回声,由血凝块的强回声及血液积聚区的无回声形成,无明显腔壁。腹腔及盆腔可探及积血所致的腹腔积液。彩色多普勒超声:肝血肿内一般无明显的血流信号。
3.肝中央破裂型
肝实质和肝包膜均破裂,血液和胆汁直接流入腹腔,但损伤程度和病理改变差别很大。肝中央出现无回声区或混合回声区,通常伴有腹腔积液。彩色多普勒超声:肝血肿内一般无明显的血流信号。
超声造影有助于外伤性肝血肿的诊断和鉴别诊断,肝血肿部位造影全程无增强,如有活动性出血,超声造影可见射流束;如继发感染则与肝脓肿声像图相似;慢性血肿可机化,肝内可见不规则的回声增强区,需注意与肝内其他占位相鉴别。
血管瘤是肝脏最常见的良性肿瘤,为肝血管的先天畸形,胚芽错构所致。
【声像图表现】
(1)二维灰阶图像:
典型的肝血管瘤二维超声图像为均一的高回声,通常直径小于3cm,圆形或卵圆形,边界清晰,周围无晕环,可位于肝血管旁,仔细查看结节内部有筛网状的结构,运用高频探头探查可见瘤体与肝组织间有小血管的管道相通。有的肝血管瘤后方可有增强(可能系内部丰富血窦血液所致)。在脂肪肝背景下,肝血管瘤可表现为低回声,边界清晰、规则,外周可有相对较厚的带状高回声环绕,厚度较为均匀,其内也可见不规则“等号”状血管断面回声,当其位于瘤体边缘时可形成所谓的“边缘裂隙征”,瘤体后方回声稍增强;直径大于5cm的较大海绵状血管瘤多呈混合性回声,周围可见线状高回声环绕,可不完整或厚薄不甚一致,瘤体内可见低回声、高回声及不规则无回声区混合存在。瘤体内部回声的强弱,是瘤内血管腔、血管壁及血管间隙之间纤维隔的多少和薄厚的综合回声特征。若瘤内血窦较大或丰富时,瘤体后方回声可轻度增强。若血管内产生血栓、纤维化、钙化等改变,则内部回声更为复杂。肝血管瘤二维灰阶图像如图5-21-12所示。
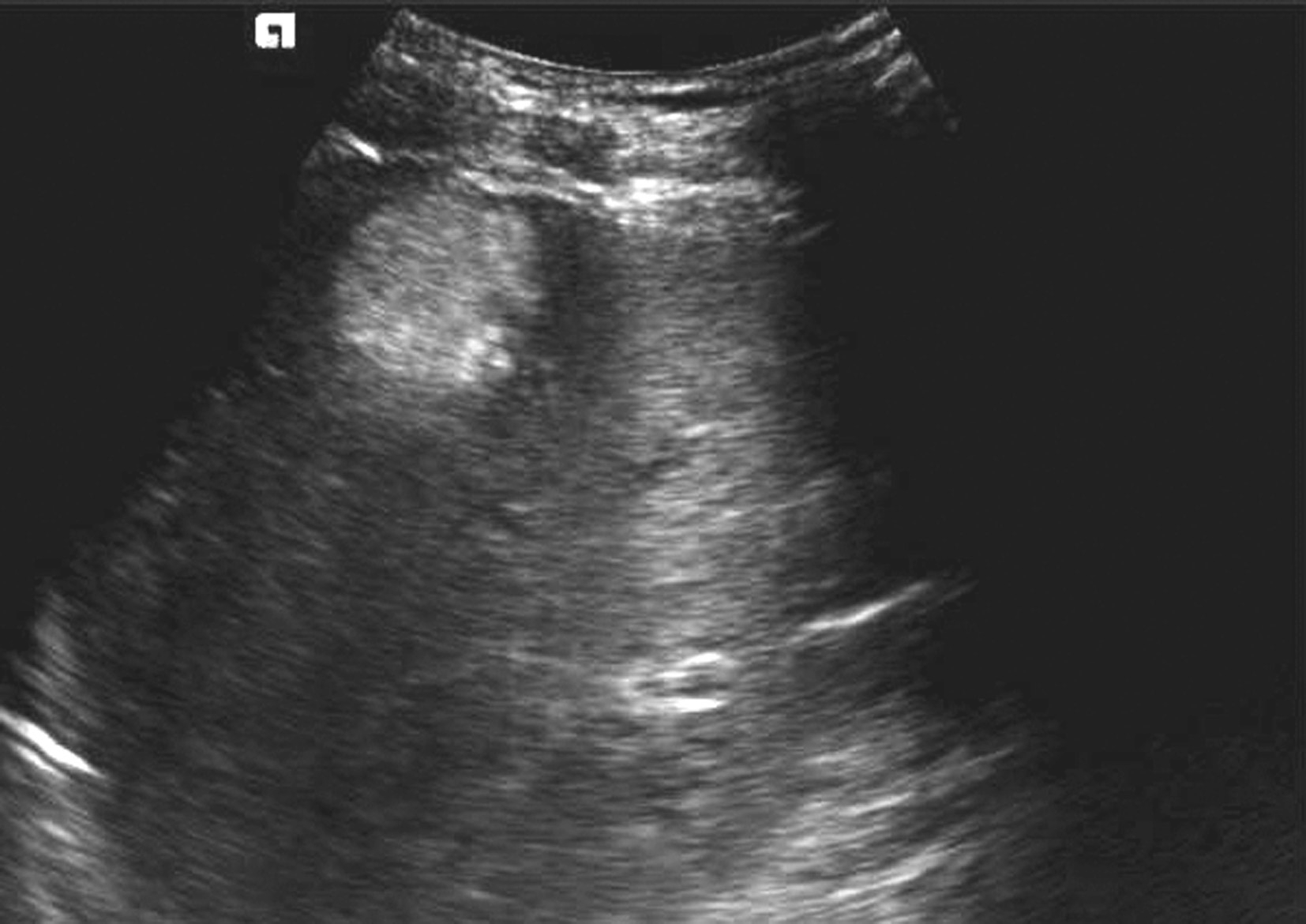
图5-21-12 肝血管瘤二维灰阶图像
(2)彩色多普勒超声:
尽管血管瘤内血管丰富,但血流速度极为缓慢,彩色多普勒可显示部分血管瘤内部或周边的斑状或短线状血管,频谱均为低速血流。对小血管瘤,尤其位于肝脏深部者则难以检测到血流信号。
(3)超声造影表现:
血管瘤典型的超声造影表现为:动脉相周边结节样或环状高回声增强,门静脉相和延迟相造影剂进行性向心性填充,填充可以是完全性的或部分性,60%~80%的肝血管瘤表现为这一典型特征。造影剂填充的速度根据血管瘤的大小而不同,小血管瘤只需1min,大的可能需要10min。20%~30%肝血管瘤内含有丰富的动静脉短路,充填时间会减短到1min甚至几秒,因此造影后的60秒内观察肝血管瘤的增强特征是非常重要的。如果瘤内有纤维化或栓塞,造影剂填充不完全,这种情况也可能发生在较小的血管瘤。如果有典型的造影增强行为可以诊断血管瘤,而不需进一步其他影像检查。肝血管瘤超声造影动脉期、静脉期及延迟期超声声像图表现如图5-21-13~图5-21-15所示。
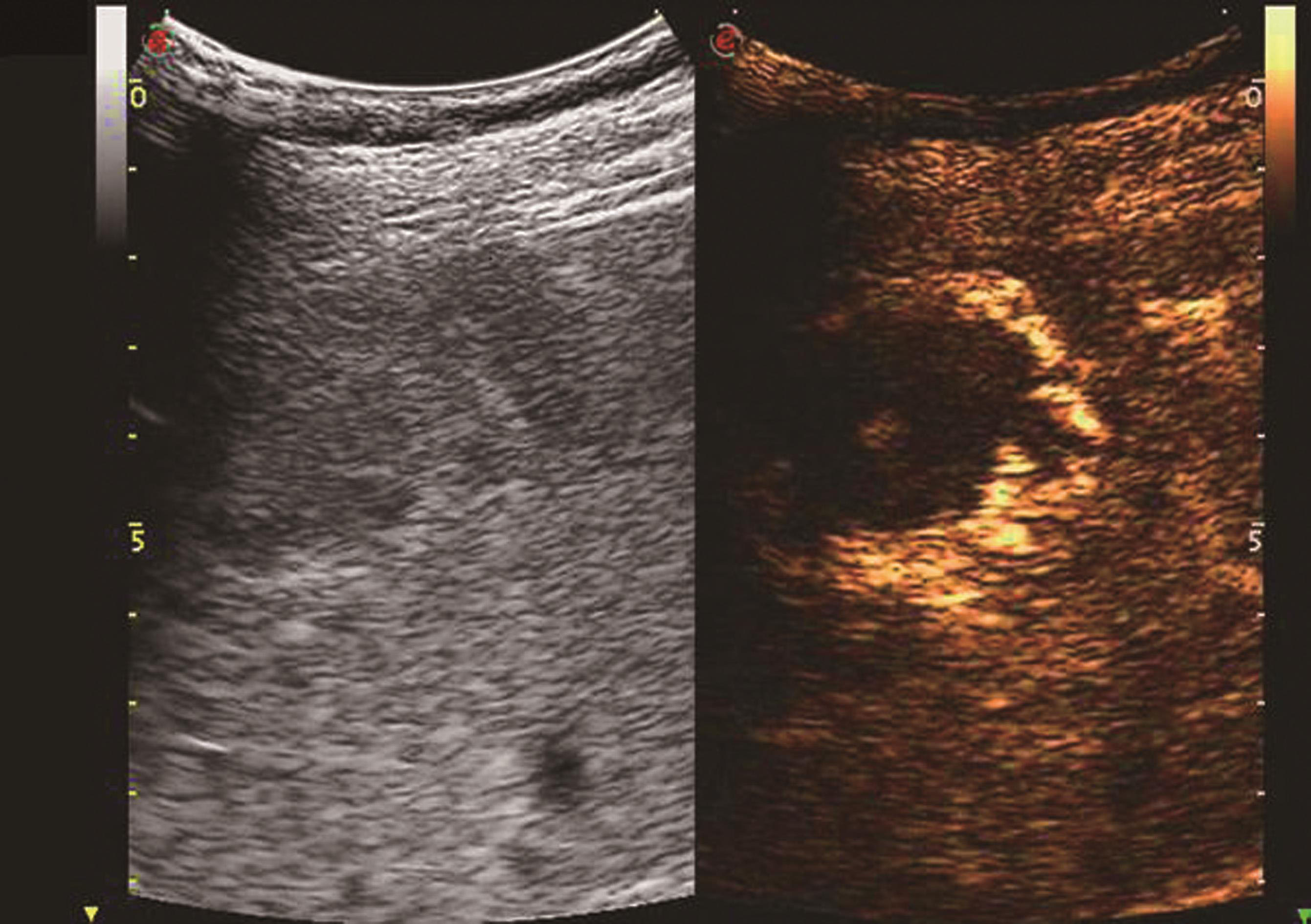
图5-21-13 肝血管瘤超声造影动脉期
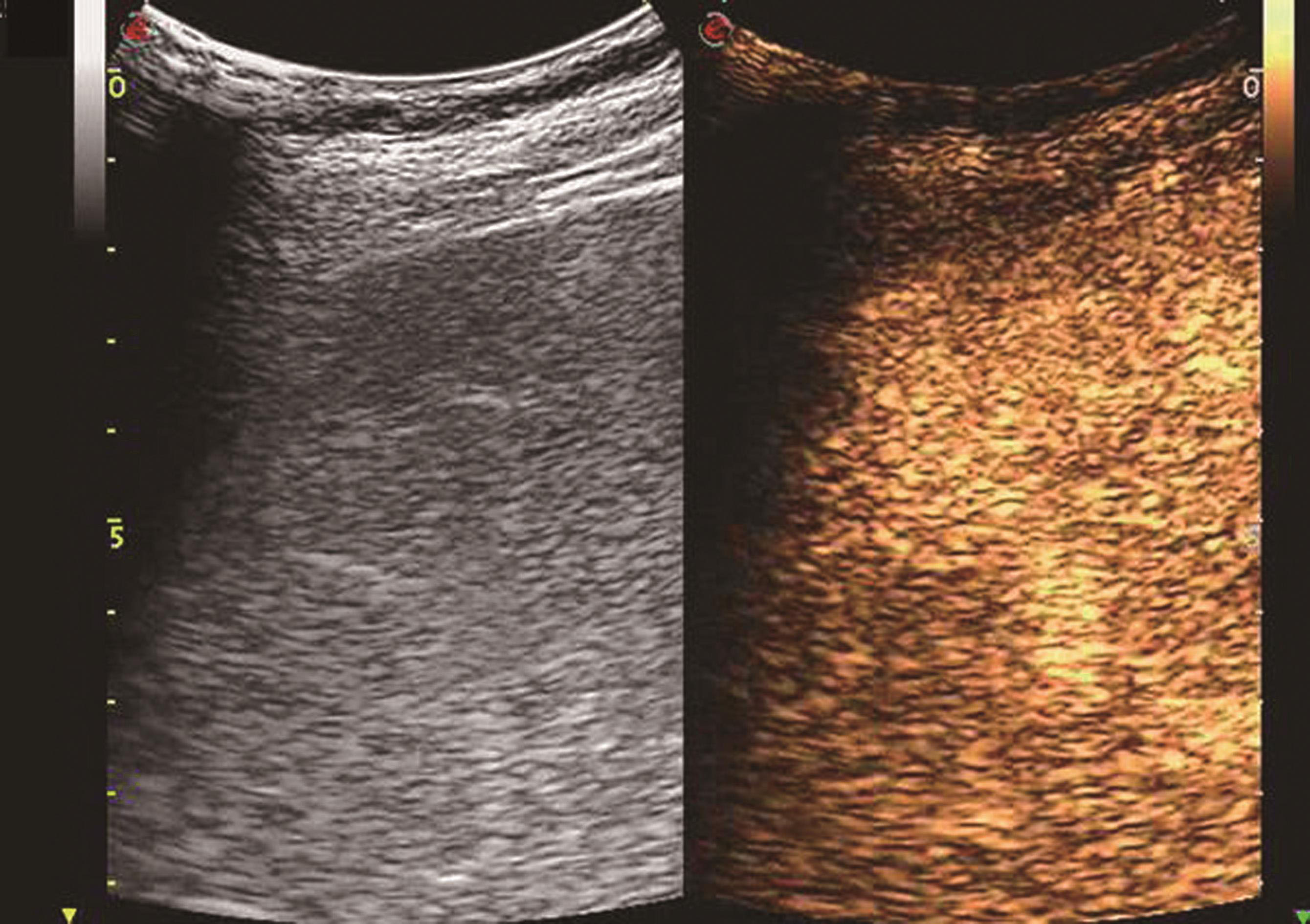
图5-21-14 肝血管瘤超声造影静脉期
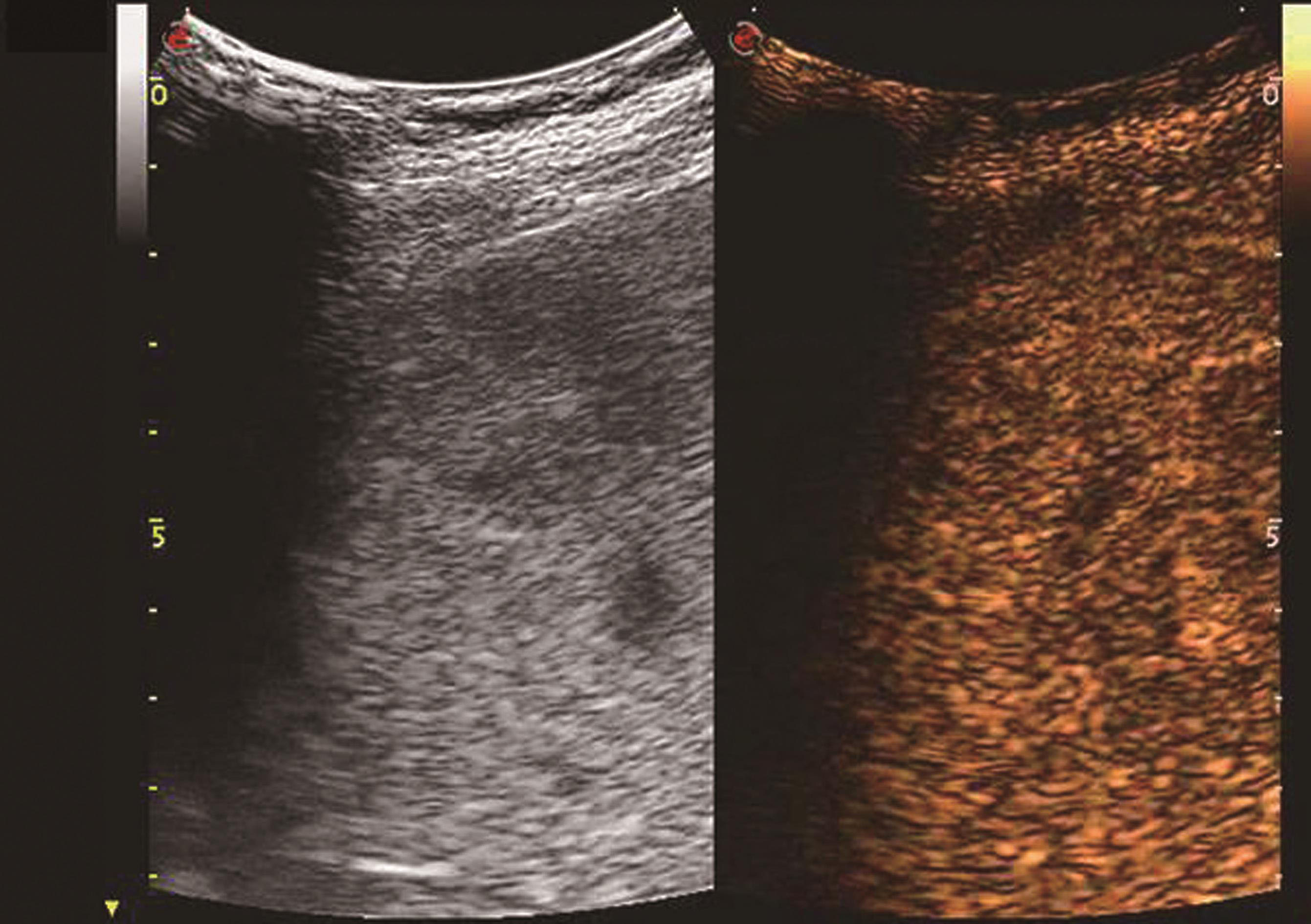
图5-21-15 肝血管瘤超声造影延迟期
局灶性结节增生(focal nodular hyperplasia,FNH)发生率只有1%~3%,多见于年轻女性。通常为无症状的偶尔发现的圆形、无包膜、单发的病灶。组织学FNH成分包括正常肝细胞、Kupffer细胞、胆管成分和纤维结缔组织,有50%的病例中心有一个星状纤维瘢痕。
【声像图表现】
(1)灰阶超声:
局灶性结节的声像图特征多变,肝内单个或多个病变,圆形或类圆形,境界清晰,无包膜,外周无声晕,常规灰阶超声多表现为低回声及均匀的实质回声,部分可有浅淡暗环,偶见低回声的星状瘢痕,总体上缺乏较特异声像图表现。
(2)彩色多普勒超声:
显示病变内外血供较丰富,可见一粗大的动脉血流伸入病灶中央并形成放射状或轮辐状排列,脉冲多普勒为低阻动脉血流频谱。具体如图5-21-16所示。
(3)超声造影表现:
动脉早期为高灌注性,因病灶大小有所差异,较大FNH动脉早期特征性轮辐状高增强,而后整体增强,较小FNH动脉早期整体高增强,大多数FNH门静脉相和延迟相时较周围肝组织呈高回声或等回声增强,少数病例延迟期可见造影剂轻度消退,主要与肝腺瘤、纤维层状肝细胞癌进行鉴别诊断。
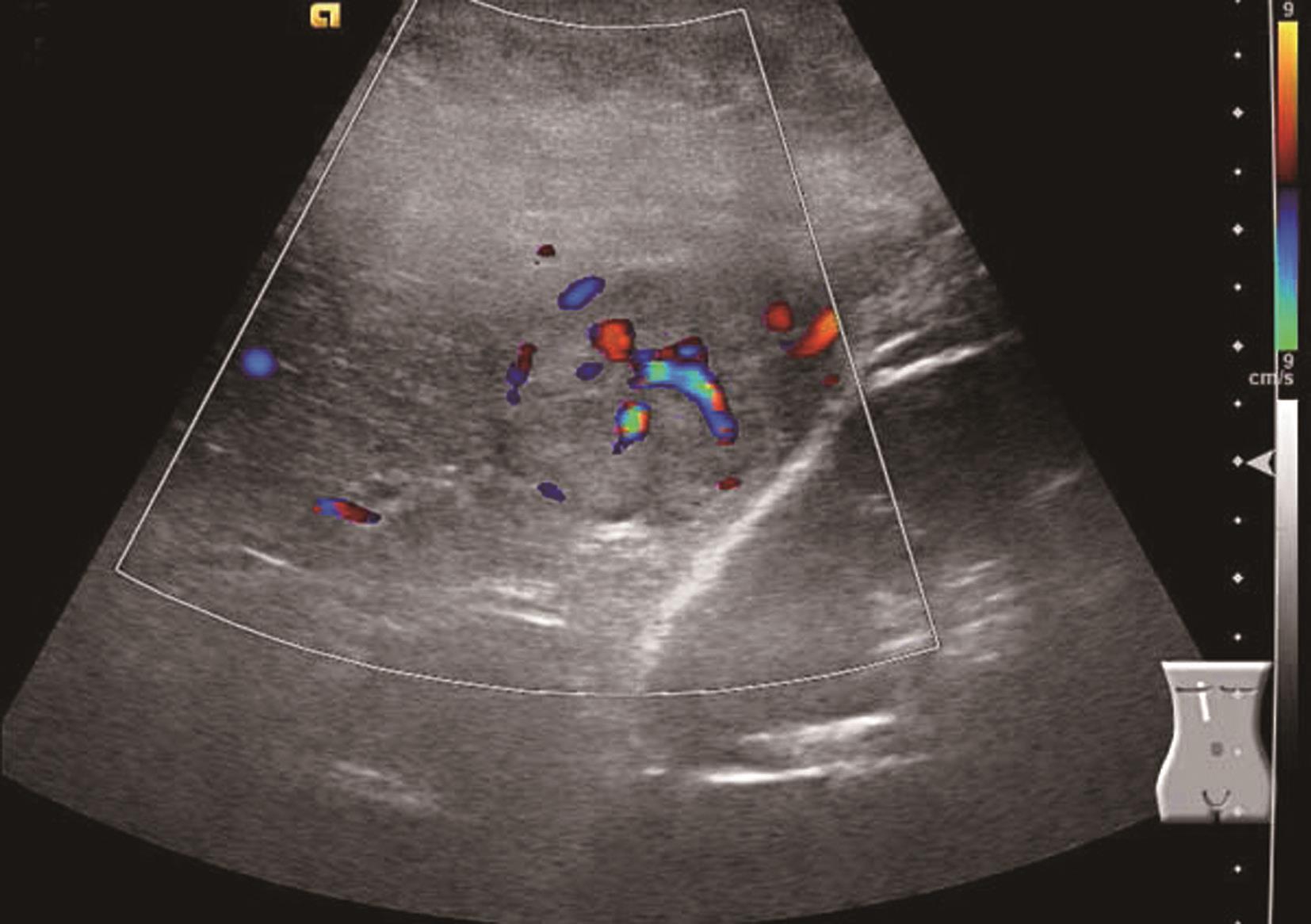
图5-21-16 肝脏局灶性结节增生彩色多普勒图像
为一种少见的良性肿瘤,好发于青壮年女性。
【声像图表现】
(1)灰阶超声:
小腺瘤不引起肝脏形态改变,且边界清楚,可见高回声纤维包膜,内部回声略高于周围肝脏组织,分布不均。大者肝腺瘤边界可不清晰、不规则,内回声不均匀,可见大小不等的团状高回声。瘤体内出血坏死液化时,可出现不规则无回声区。瘤体破裂,其周围甚至腹腔可见液性无回声区。
(2)彩色多普勒超声:
显示为肿块内有较丰富的门脉样血流及低速动脉样血流。
(3)超声造影表现:
由于以动脉高血流灌注为主,因此典型肝腺瘤表现为早期动脉相完全增强,不增强的区域可能是出血灶或钙化灶。与FNH增强方式相比,二者较难鉴别,只是肝腺瘤不表现为轮辐状造影增强方式。
各类致炎因子引起的以炎性结节增生为特征的非肿瘤性改变,常为间叶组织增生,无临床症状,多为体检过程中偶然发现。
【声像图表现】
(1)灰阶超声:
肝内1.0~3.0cm的低回声结节,内部回声不均匀,无细小管道样结构,境界欠清晰,无特征性表现。
(2)彩色多普勒超声:
偶可见点状彩色血流信号。
(3)超声造影表现:
为多样性,坏死型炎性假瘤三期均无增强,部分病例动脉期早期呈外周环形或结节整体增强,门脉期和延迟期增强消退,回声强度低于周围肝实质,与肝脏恶性肿瘤较难鉴别,必要时穿刺活检明确诊断。
【声像图表现】
(1)肝细胞癌(hepatocellular carcinoma,HCC):
是肝脏最常见原发性恶性肿瘤,绝大部分病例与乙、丙型肝炎和肝硬化有关,占肝恶性肿瘤的80%~90%,男性多见,与乙肝和黄曲霉素相关,分为块状型、结节型、弥漫型及小癌型。在肝硬化的患者中,小的局灶性病变几乎代表着早期肝细胞癌或增生结节。小肝癌二维灰阶图像如图5-21-17所示。
图5-21-17 小肝癌二维灰阶图像
1)灰阶超声:
A.肝脏外形:常随病变的部位及大小而变,较小者且位于肝实质内的肿瘤不引起肝脏体积及轮廓的改变。较大者或位于肝脏表面者可引起肝脏体积的增大或肝包膜局限性隆起形成“驼峰征”,使肝脏形态失常。约80%的原发性肝癌患者伴有不同程度的肝硬化,肝脏表面呈“锯齿样”改变。
B.包膜:多数癌结节具完整或不完整包膜。
C.肿块内部回声类型:①低回声型:肿瘤回声低于周围肝组织。常呈圆形或类圆形,边界较清,具有细包膜,病变较小,常仅1~2cm,内部回声欠均匀,后方回声略增强。②高回声型:肿瘤回声高于周围肝组织,内部回声多不均匀。外形可为圆形或不规则分叶状,部分有假包膜形成者界限清晰。此型癌肿多较大。③等回声型:此型回声肝癌与周围肝组织密度相似,仅有微弱分界,易漏诊。对可疑病灶可使用高频超声进行检查,增加病灶检出率。④混合回声型:此型多见于体积较大的肝癌,癌肿内可同时出现多种类型回声,多种回声交织混合成为一体;如癌肿内出现不规则无回声区,其内可见点状或斑状高回声,多为癌肿内出血、坏死或液化。⑤弥漫型:癌肿数目众多,呈弥漫散布于整个或局部肝脏,直径多在1cm左右。内部回声高低不均匀。该类癌肿常伴有肝硬化,在声像图上有时很难与肝硬化结节鉴别,但弥漫型肝癌易伴发门静脉及肝静脉内癌栓和肝脏深部组织回声衰减。
D.癌肿肝内转移征象:“卫星”灶癌结节,肝组织内巨块癌肿周围可见低回声结节,直径多在2cm左右。门静脉癌栓,门静脉主干或其分支内可见实质性回声。肝静脉与下腔静脉内癌栓。常见肝癌晚期,在静脉腔内可见均匀中、低回声团块,但管壁回声多为正常。
E.癌肿对周围组织的挤压征象:较大肿块可导致肝内血管形态失常,走行移位;肝内胆管扩张;位于肝脏膈面者可引起右侧横膈抬高或局限性隆起;位于肝表面者也可压迫右肾或胆囊等脏器,使之移位。
2)彩色多普勒超声:
多血管型肝癌可显示结节周围血管围绕,外周血管进入结节内部,结节内部血流丰富,分布如树枝状。少血管型肝癌仅结节周围血管围绕,结节内部常无血流探及。频谱多普勒测及动脉搏动型曲线,常为高速高阻血流信号。较大病灶液化坏死部分无彩色血流信号出现。门静脉、肝静脉及下腔静脉癌栓时可见血管腔内彩色血流信号充盈缺损。
3)超声造影表现:
HCC绝大多数为肝动脉供血,门静脉供血减少,超声造影表现为造影剂微泡动脉期快速进入肿瘤微血管内,使肿瘤快速增强,增强模式与增强CT/MRI检查类似,典型HCC超声造影表现为快进-快退,即动脉期高增强,门静脉期与实质期由于门静脉血供减少,并且由于病灶内缺乏Kupffer细胞或Kupffer细胞功能不全,不能摄取造影剂,而呈低增强。HCC非典型超声造影表现主要在两方面:首先表现为动脉期增强模式,肿瘤超声造影达高峰时非均匀性增强或环形增强;其次表现为增强时相上表现为慢进-慢出,即肿瘤开始增强时间晚,与肝实质同步,或消退时间晚,门静脉相及延迟相未减退。非典型增强模式多为分化较好的HCC,因其以门静脉供血为主,使得诊断困难,需要穿刺进行组织学进一步判断。肝细胞癌超声造影动脉期、静脉期及延迟期声像图表现如图5-21-18~图5-21-20所示。
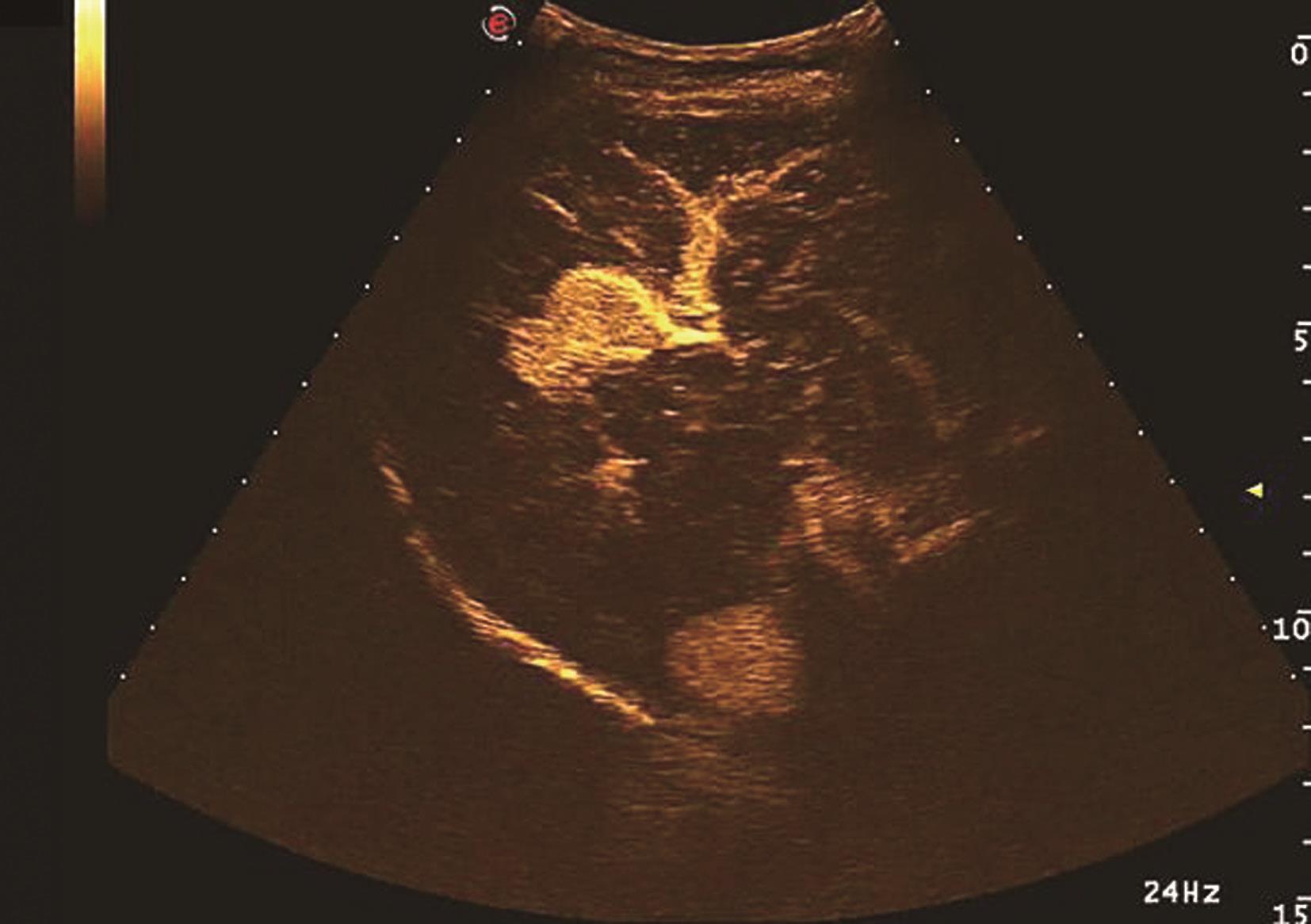
图5-21-18 原发性肝细胞癌超声造影动脉期呈高增强
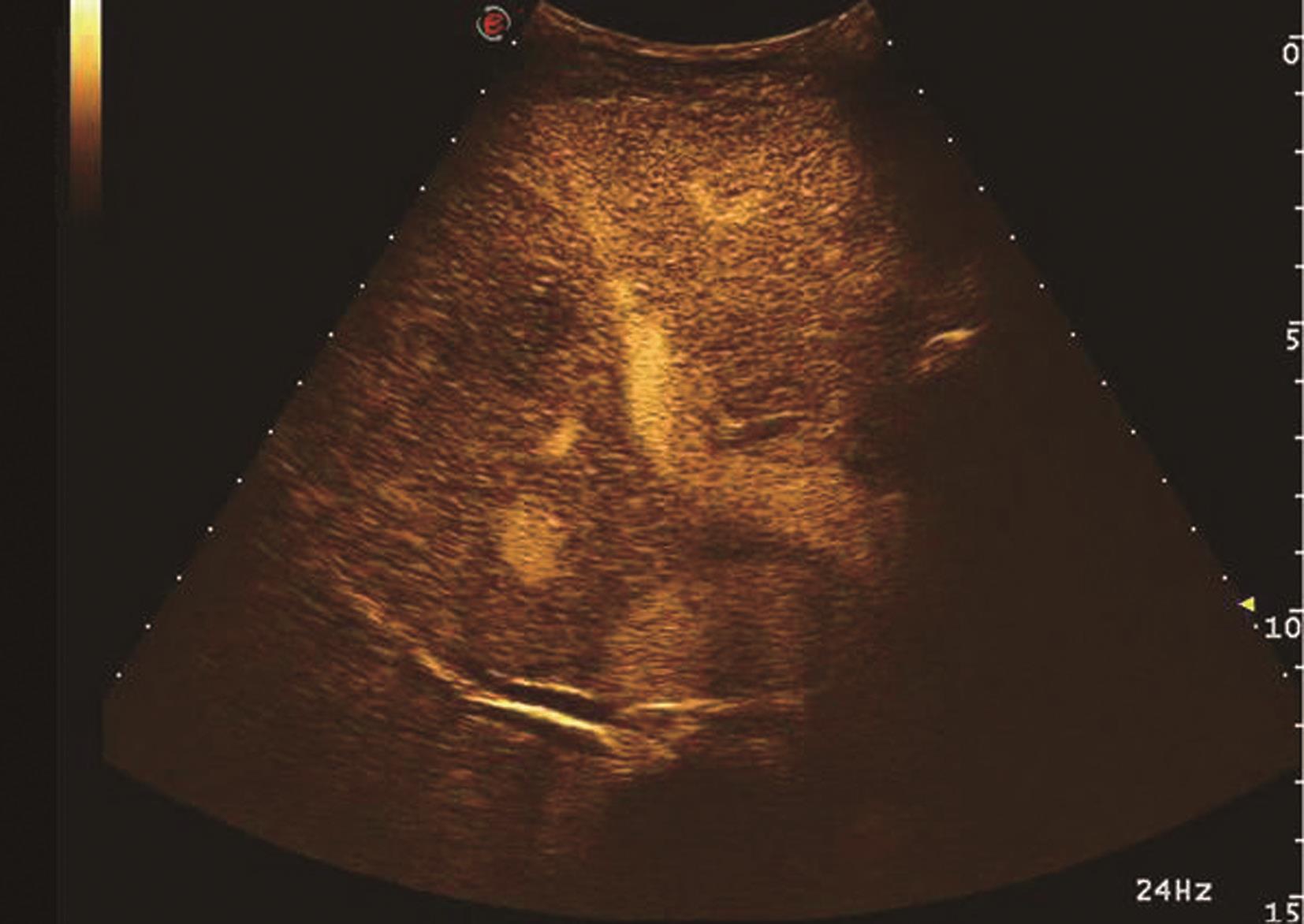
图5-21-19 原发性肝细胞癌超声造影静脉期呈低增强
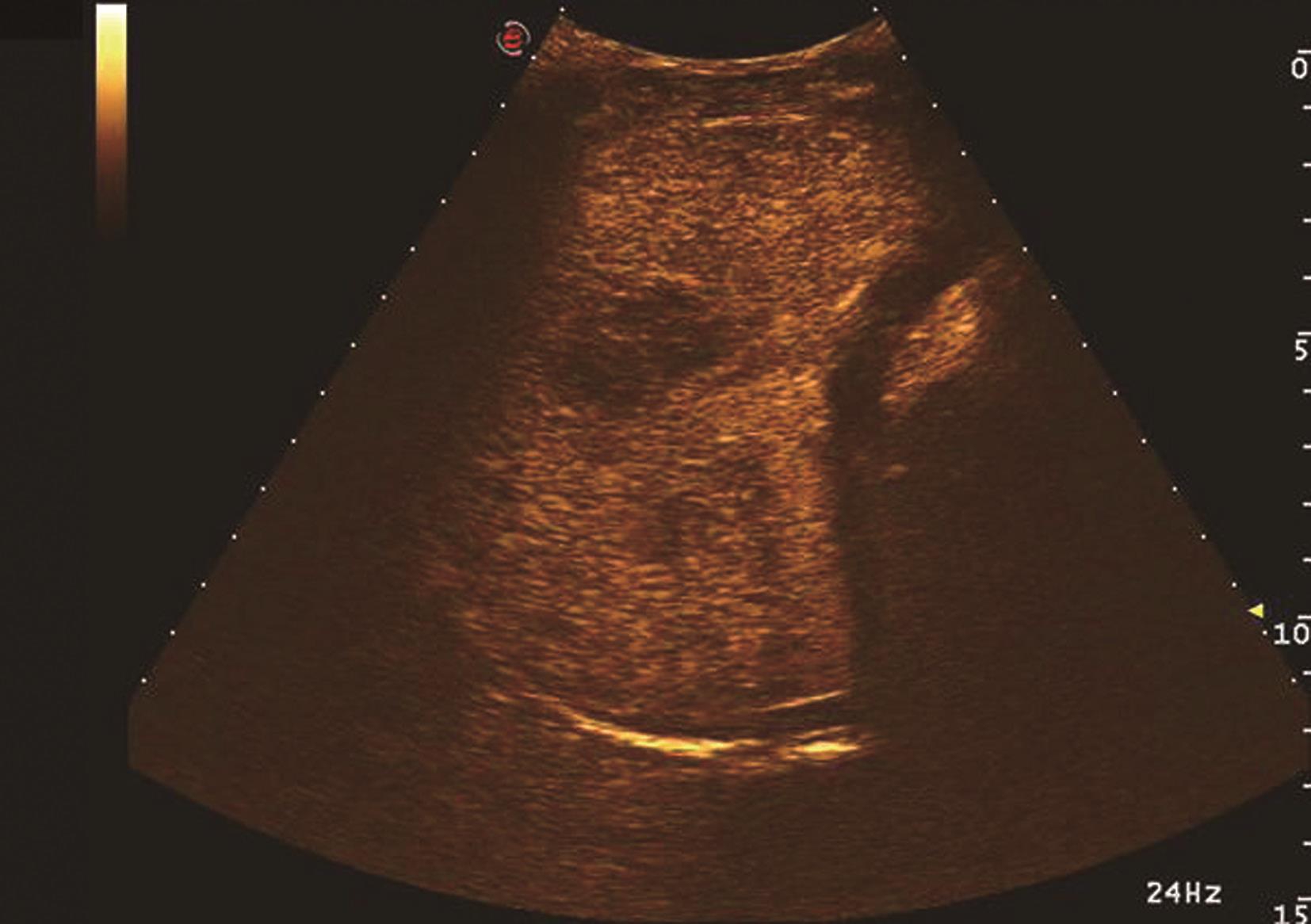
图5-21-20 原发性肝细胞癌超声造影延迟期呈低增强
4)穿刺活检:
凡是超声显示肝内局限性病灶,结合临床其他检查结果仍不能对其作出明确良、恶性鉴别诊断者,原则上都有指征进行细胞学检查或组织学检查。在超声引导下穿刺检查很大程度上减少了盲目性,可提高诊断阳性率。
(2)胆管细胞性肝癌(intrahepatic cholangiocarcinoma,ICC):
是由肝内胆管被覆上皮发生的一种原发恶性肿瘤,远较肝细胞癌少见,占原发性肝恶性肿瘤的5%~10%,常沿胆管浸润性生长,与肝内胆管结石、Caroli病、华支睾吸虫感染等有关,少数患者伴有胆汁性肝硬化。
【声像图表现】
1)灰阶超声:
通常无肝硬化背景,肿块回声与肝细胞癌类似,质硬无包膜。肝内胆管癌也可表现为肝内实性结节,这种胆管癌发生于周边小胆管,原发肿瘤结节周围可有小卫星灶。生长于肝门部胆管的胆管癌又称为Klatskin瘤,可伴有胆囊、胆总管及肝内胆管均可有相应增大或增宽。仅从二维超声来确诊肝内胆管癌一般较困难,需结合肝活检来确诊。肝胆管细胞癌二维灰阶图像如图5-21-21所示。
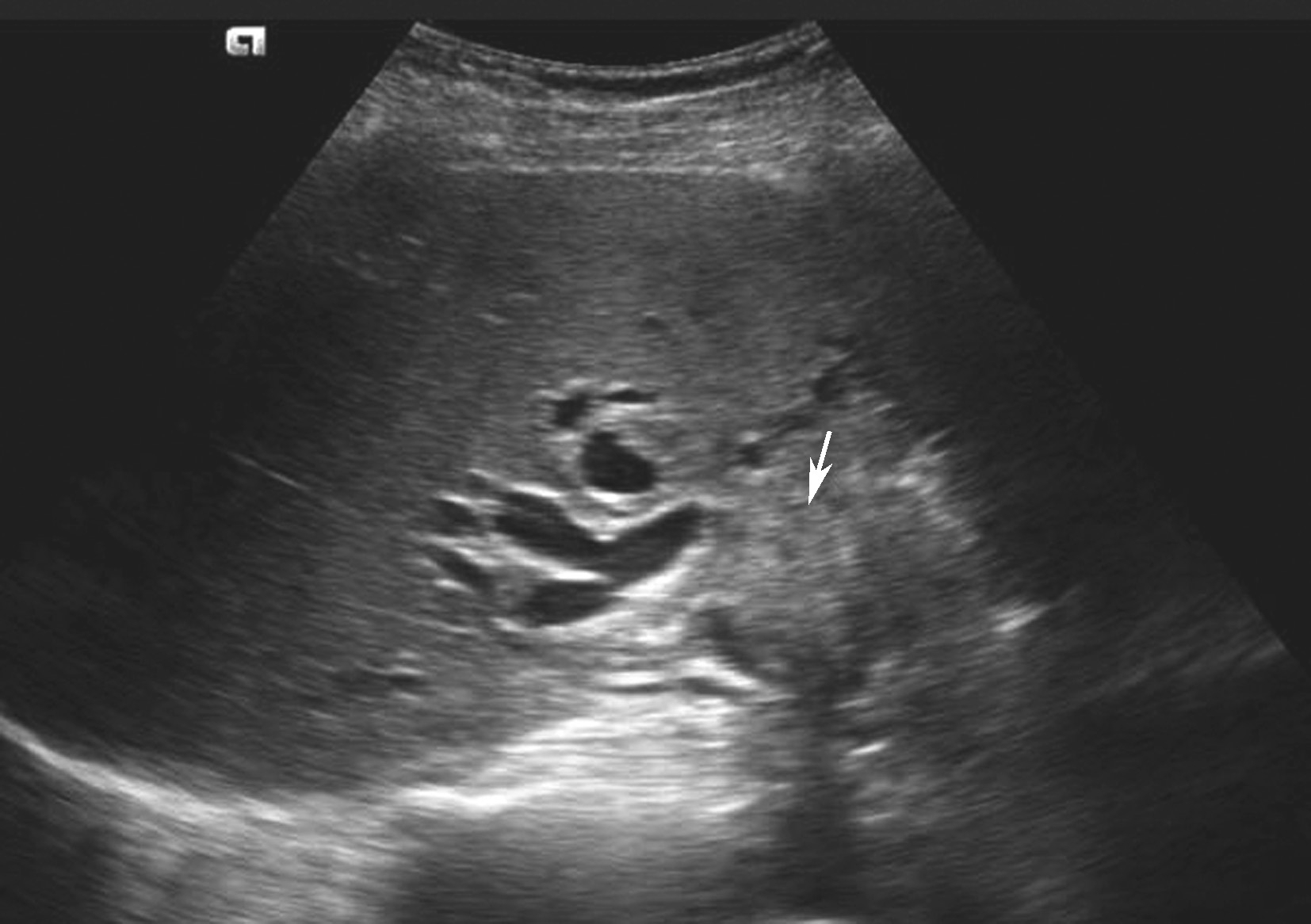
图5-21-21 肝胆管细胞癌二维灰阶图像
2)彩色多普勒超声:
肝内胆管癌的彩色多普勒表现可不同,大部分肿瘤表现为较丰富的血流信号。
3)超声造影表现:
早期动脉相的增强方式可不同,但大部分表现为高灌注状态,也就是整体完全增强或病灶周边环状增强,门脉期和延迟期表现为低回声,病灶造影表现为快进-快出增强模式,部分病例肿瘤较大,中央伴有大片坏死区,造影显示中央部分坏死,中央部分造影无增强。
发生在肝外的恶性肿瘤,通过血行播散或淋巴管转移至肝脏,为肝脏最常见的恶性肿瘤之一,多表现为累及全肝的大小不等的多发性结节,少数病例为弥漫性或为单发结节,病理形态与原发癌相似,较大肿块常伴变性坏死。
【声像图表现】
(1)分布部位:
早期多位于肝脏边缘或肝包膜下,常随病程进展数目增多,散在或弥漫分布全肝,单发少见。
(2)包膜:
转移性肝癌病灶通常无包膜。
(3)灰阶超声:
①“牛眼征”或“靶形”结节:即癌结节周边有较宽的低回声晕环;内部为较均匀的高回声或等回声;高回声中央部有小片状无回声区或低回声区,为出血或坏死所致。“牛眼征”被认为是转移性肝癌的典型声像图特征。此型可出现于任何转移性肝癌,但多见腺癌肝转移。②高回声型:癌肿边界清楚,形态欠规则,内部回声显著高于周围肝组织,甚至伴有钙化,后方回声可有衰减。各部位恶性肿瘤肝转移常表现为高回声型。③混合型:癌肿边界清楚,形态较规则。内部以高回声或等回声为主,近癌肿中心区因组织坏死出现范围较大的不规则无回声区。鳞癌肝转移有发生中心坏死的倾向。④低回声型:圆形、椭圆形或稍不规则形,癌肿边界清楚,可向周围组织伪足样生长,直径常小于3cm,内部呈低回声,与低回声型原发性肝癌相似,可见于各种肿瘤的肝转移。⑤无回声型:较少见,圆形、椭圆形或稍不规则形,癌肿边界清楚,内部可见稀疏的微弱回声,增大增益可出现微弱回声,后方回声增强,多见于淋巴瘤、乳腺癌、胰腺癌、卵巢癌、黑色素瘤及肉瘤等疾病。癌肿大部分溶解坏死时声像图表现酷似肝囊肿,但病灶边界多不规则,且常为多房性,其隔膜回声呈不规则增厚,少数肿瘤内壁有乳头状突起。⑥周围组织的继发征象:转移性肝癌罕见有门静脉、肝静脉或下腔静脉癌栓出现,此点与原发性肝癌易向门静脉播散的特点不同。此外,转移癌肿不断增大时,可发生与原发性肝癌类似的肝内肝外挤压征象。转移性肝癌二维灰阶图像如图5-21-22所示。
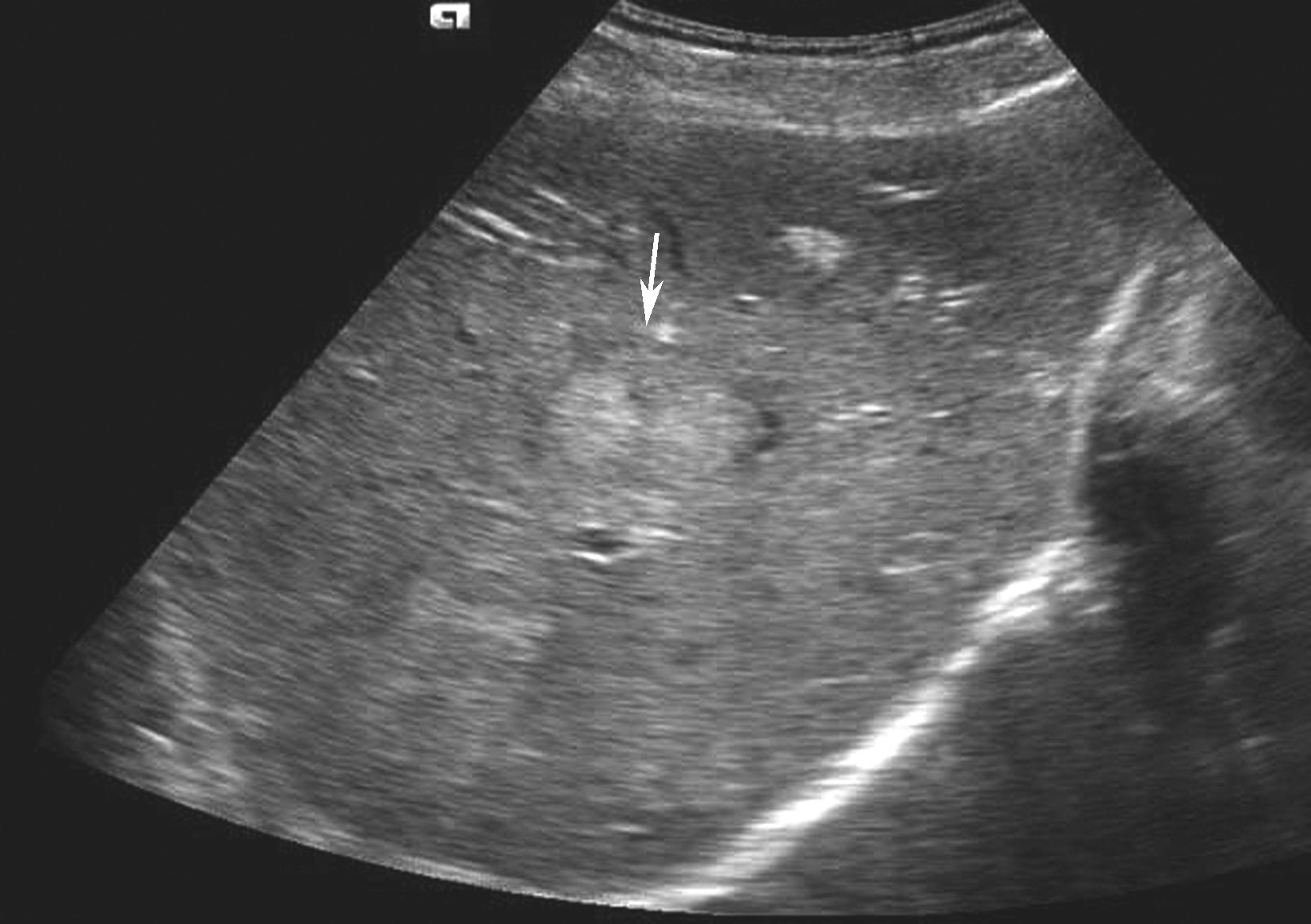
图5-21-22 多发性肝转移癌二维灰阶图像
(4)彩色多普勒超声:
无特异性,转移性肝癌肿块内血流信号稀少,病变外侧或边缘处可探及少许血流信号。
(5)超声造影表现:
根据原发病灶的不同特性而表现各异,在超声造影三个时相中表现出不同的特性。乏血供的转移性肝癌病灶中央常出现坏死灶,病灶在动脉期呈低增强和/或环形增强,富血供的转移性肝癌动脉期均匀性高增强,门脉期或延迟期低或无增强。主要表现以下三种形式:①动脉早期整体快速高增强,消退较周边肝实质迅速,动脉晚期、门静脉期和延迟期呈低增强,②病灶周边呈环形快速高增强,消退较周边肝实质迅速,门静脉期和延迟期呈低增强;③动脉期、门静脉均匀等增强,消退较周边肝实质迅速,延迟期呈低增强。多发性肝转移癌超声造影动脉期、延迟期声像图表现如图5-21-23、图5-21-24所示。
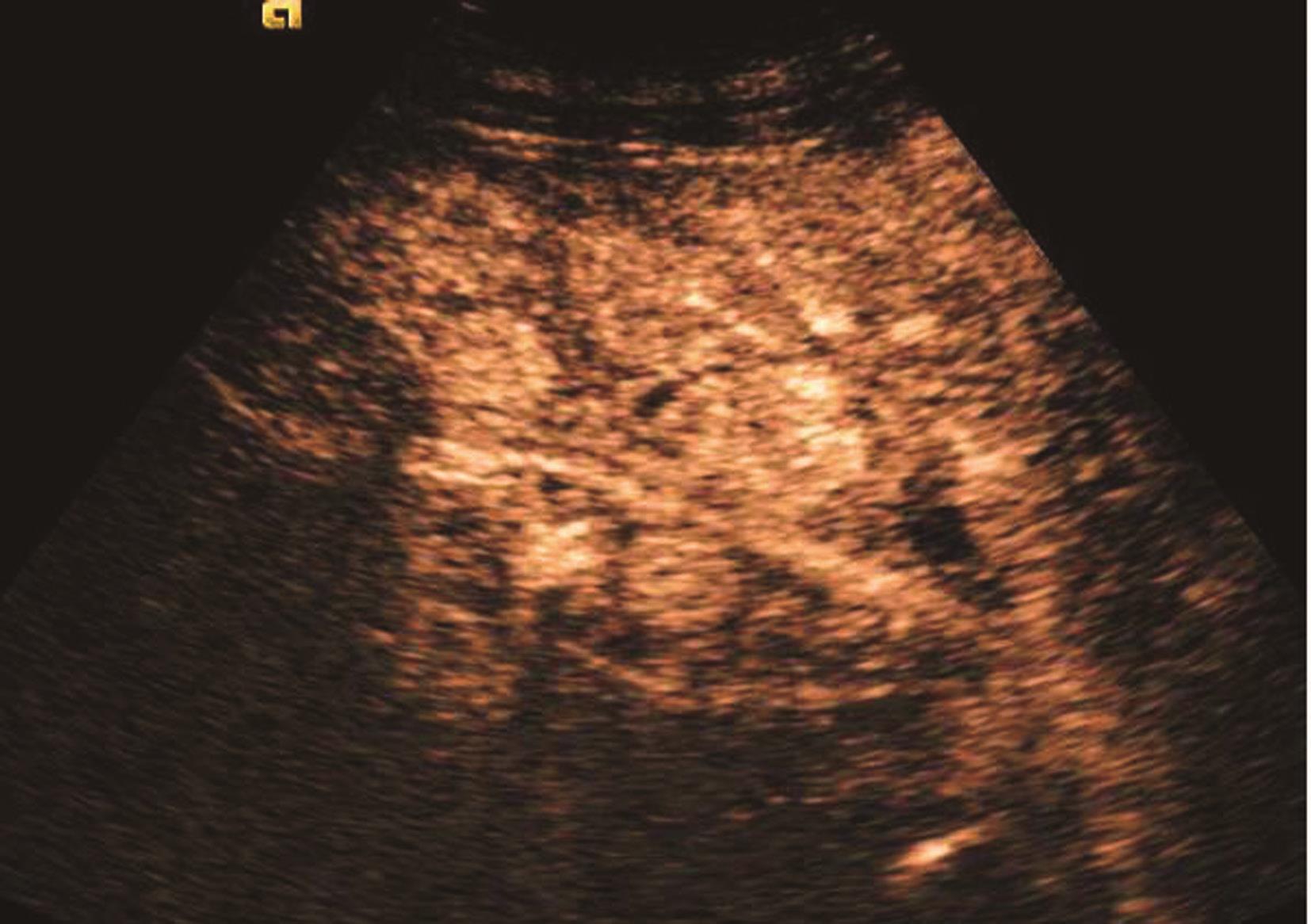
图5-21-23 多发性肝转移癌超声造影动脉期呈高增强
图5-21-24 多发性肝转移癌超声造影延迟期呈低增强
【声像图表现】
(1)灰阶超声:
肝淋巴瘤在超声影像上常表现为单发或多发低回声或极低回声,形态规则或不规则,单发者边界尚清,多发或弥漫者边界多不清,肿块小者回声多均匀,大者回声多不均匀。淋巴瘤肝转移,甚至可表现为无回声,伴后方回声增强。高回声的肝淋巴瘤罕见。
(2)彩色多普勒超声:
内部多有丰富的血流信号,也有研究者认为内部血流信号可多可少,阻力指数不具有特异性。肝淋巴瘤内的血流信号多稀疏于正常肝组织。还可观察到突然中断的血管及动静脉短路。
(3)超声造影:
早期动脉相的增强方式各种各样,在门静脉相增强减慢,可呈现为负性显影(由于血供较少),与正常肝组织相比回声不均匀。
(4)穿刺活检:
当临床发现肝脏肿瘤,特别是对于临床上无肝炎、肝硬化病史,癌胚抗原(CEA)、AFP阴性且怀疑肝恶性肿瘤的患者,如果具有发热、盗汗、体重减轻、乳酸脱氢酶增高等表现时,要警惕原发或继发肝淋巴瘤,应建议行超声引导下穿刺活检。
急性门静脉血栓是指门静脉血栓形成的早期。主要危险因素:肝硬化、腹部器官恶性肿瘤、腹部炎性病灶、腹部外科手术(特别是脾切除)、骨髓组织增殖性疾病、凝血酶原因子Ⅱ基因突变等。主要临床表现:腹痛和系统性炎症反应,严重者可发生肠梗死。持续的无名热和腹痛,血浆急性期反应物升高,早期肝功基本正常,部分患者血清转氨酶一过性轻度升高。
【声像图表现】
(1)灰阶超声:
门静脉及其分支扩张,血栓形成早期管腔内可见低回声或等回声团块阻塞血管,血栓后期机化呈实质性高回声充填管腔,具体如图5-21-25所示。
图5-21-25 门静脉癌栓二维灰阶图像
(2)彩色多普勒超声及超声造影:
显示门静脉内缺乏血流信号或充盈缺损。
门静脉海绵样变性是指门静脉主干或分支完全、部分栓塞,而后由其侧支静脉形成或管腔的再通所致。引起门静脉阻塞的常见原因是癌栓,其次是血栓。门静脉右支发生率高。临床上主要表现为门静脉高压症状,如脾大、腹水甚至胃肠道静脉曲张性出血。
【声像图表现】
(1)灰阶超声:
肝门区结构紊乱,肝外门静脉周围或管腔内可见多条弯曲成团的血管,呈蜂窝状或网格状无回声区结构,在结构紊乱的肝门部仔细辨认可见管腔狭窄、壁增厚回声增强的门静脉管道,管腔内可见癌栓或血栓,部分可压迫胆道系统造成肝内外胆管扩张。可出现继发门静脉高压声像图改变,如脾肿大、脾静脉及肠系膜上静脉增宽,严重者可见腹水。
(2)彩色多普勒血流显像:
在肝门区蜂窝状或网格状无回声区结构内充满色彩暗淡的彩色血流信号;门静脉狭窄者于门静脉内探及少许连续性彩色血流通过,其周围蜂窝状液性无回声区呈红、蓝相间的不连续彩色血流信号;完全闭塞或栓子充填的门静脉内则无彩色血流信号显示;如图5-21-26所示。
(3)频谱多普勒表现:
门静脉海绵样变性区域于蜂窝状或迂曲的管状无回声区内均可探及门静脉样连续状低速血流频谱;如图5-21-27所示。
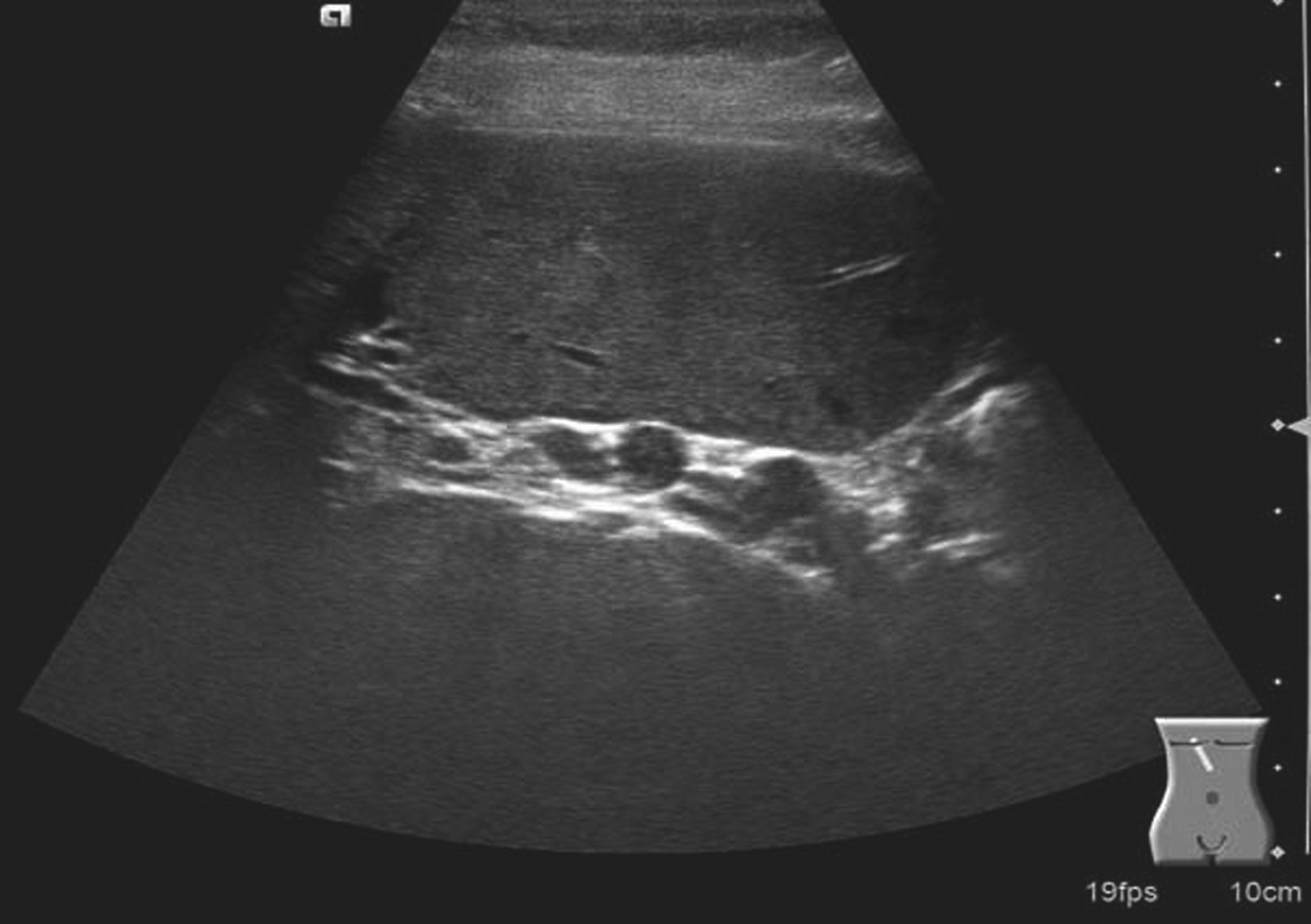
图5-21-26 门静脉海绵样变性二维灰阶图像
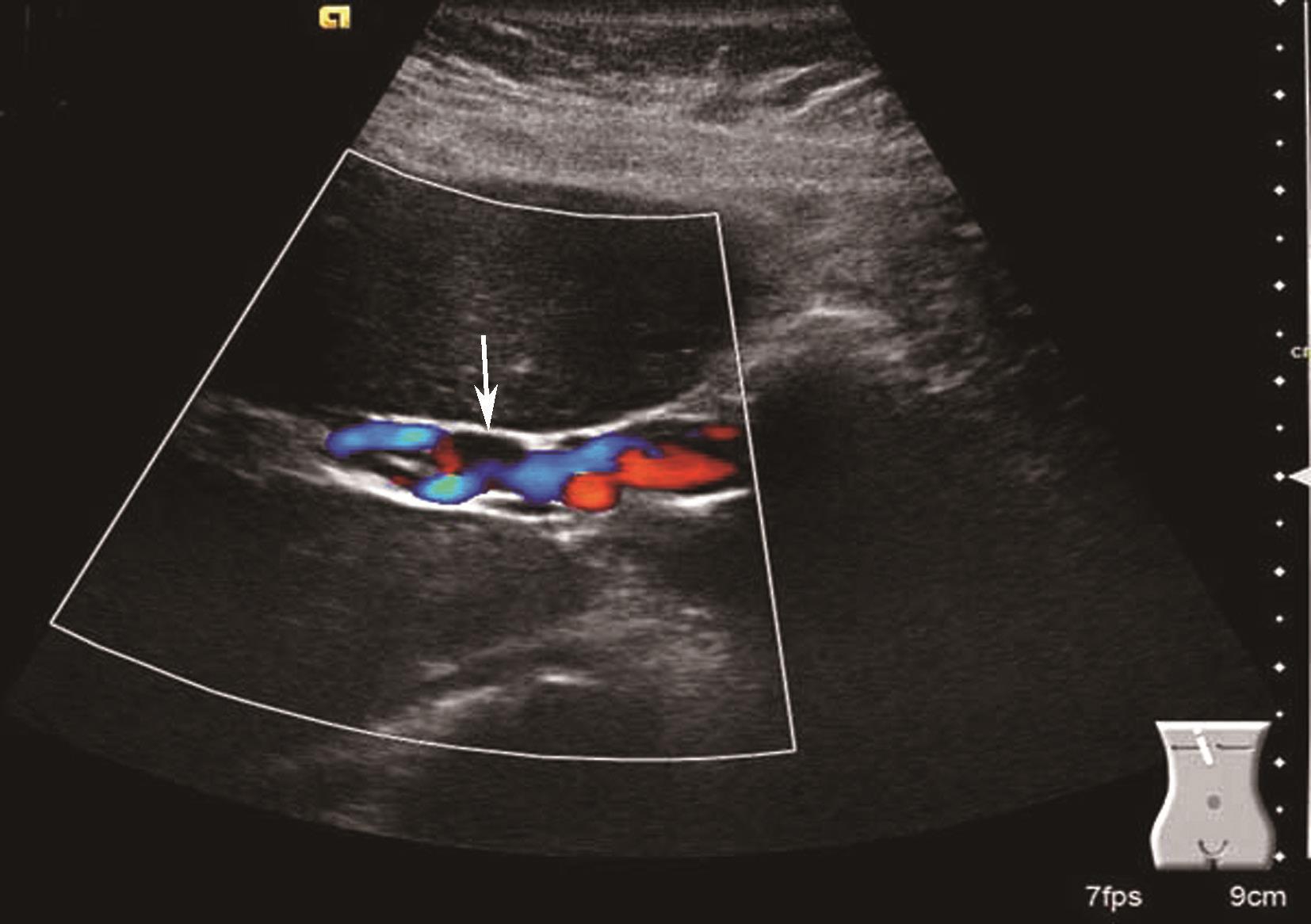
图5-21-27 门静脉海绵样变性彩色多普勒图像
门静脉海绵样变性的侧支循环有别于门静脉高压的侧支循环:前者侧支循环是不固定的,而后者的侧支循环则有固定分支;前者侧支循环血流流入肝内,而后者侧支循环则是将门静脉内血流分流至肝外体循环系统。
肝门静脉闭塞而引起肝内门静脉、肝动脉和肝静脉的形态学和血流动力学的广泛改变。其病因分为原发性和继发性。原发性是指门静脉结构先天性发育异常,门静脉管壁缺失,狭窄或闭锁,或脐肠系膜和肝静脉之间的静脉丛异常增生而来。继发性者原有正常门静脉的管腔结构,由于门静脉癌栓和血栓形成或门静脉内膜炎导致门静脉纤维化,此外,原发性肝癌或转移性肝癌以及周围脏器癌肿直接压迫门静脉也可引起此病。
1.灰阶超声
(1)门静脉平行管壁和完整的管腔消失,管径变细、扭曲、阻塞形成大量侧支循环呈虫蚀样、海绵样改变,甚至主干闭塞。肝实质回声增强,分布不均匀。
(2)肝动脉代偿性扩张,呈蛇行样改变。
(3)脾明显肿大,甚至出现腹水。
(4)继发于肝肿瘤者门静脉周边可见实性肿块。
2.彩色多普勒超声
门静脉血流频谱呈断续状,血流速度降低,血流量明显减少,甚至无血流频谱,处于完全闭塞状态;肝动脉血流加速,血流量明显增加。
根据肝动脉扩张的程度可分为Ⅰ、Ⅱ、Ⅲ度。Ⅰ度:肝内部分扩张;Ⅱ度:肝内明显扩张,肝固有动脉不扩张;Ⅲ度:肝动脉全程扩张。
巴德 -基亚里综合征(Budd-Chiari syndrome,BCS),是指因畸形、肿瘤压迫、肝静脉血栓形成或先天性膜性畸形造成不同程度的肝静脉或/和肝段下腔静脉部分或完全阻塞,引起肝静脉回流不畅,而造成淤血性肝肿大和门静脉高压症候群。BCS根据阻塞的原因分为原发性和继发性。原发性是静脉本身的原因,原因不明或先天性的肝静脉和/或下腔静脉狭窄、闭塞、膜狭窄或膜闭锁等所致;继发性为静脉外的因素,继发于肝原性或肝外疾患,如肿瘤、感染、造血系统疾病导致肝静脉的压迫或侵犯。本病发病男女比例约为2:1,青壮年患者多见。BCS 临床根据下腔静脉或肝静脉作为分型依据,以肝静脉作为分型可分为如下四型:
Ⅰ型:肝静脉阻塞型,占10%~20%,南方较北方多见。本型中段肝下腔静脉常有长条状狭窄,为肝尾状叶肥大所致的假性狭窄;可分a、b两种亚型,a型:肝静脉近心端膜性狭窄,远心端扩张;b型:肝静脉广泛狭窄闭塞。
Ⅱ型:下腔静脉阻塞型,占50%~70%。主要为肝段下腔静脉狭窄,而主肝静脉开口在狭窄段的远心端,肝静脉血回流困难,甚至出现逆流。
Ⅲ型:肝、腔静脉阻塞型,占20%~30%。是上述Ⅰ、Ⅱ型的综合体。
Ⅳ型:肝小静脉闭塞型,为肝小静脉广泛阻塞,主肝静脉和下腔静脉通畅,而肝静脉楔压降低,极少见。
1.灰阶超声
(1)肝脏弥漫性肿大,尤以肝尾状叶增大明显,以肝尾状叶及右肝肿大为主,随病程进展可有肝硬化表现。
(2)下腔静脉近心段(肝后段)狭窄或闭塞,如图5-21-28所示。表现为局部管腔变细、消失,管腔内有膜性、实质性梗阻物或腔外有肿瘤压迫。肝段或肝后段下腔静脉膜性狭窄者管腔内探及线状低回声隔膜斜行,根据隔膜上有无孔分为膜狭窄型和膜闭塞型,远段下腔静脉及肝静脉扩张。
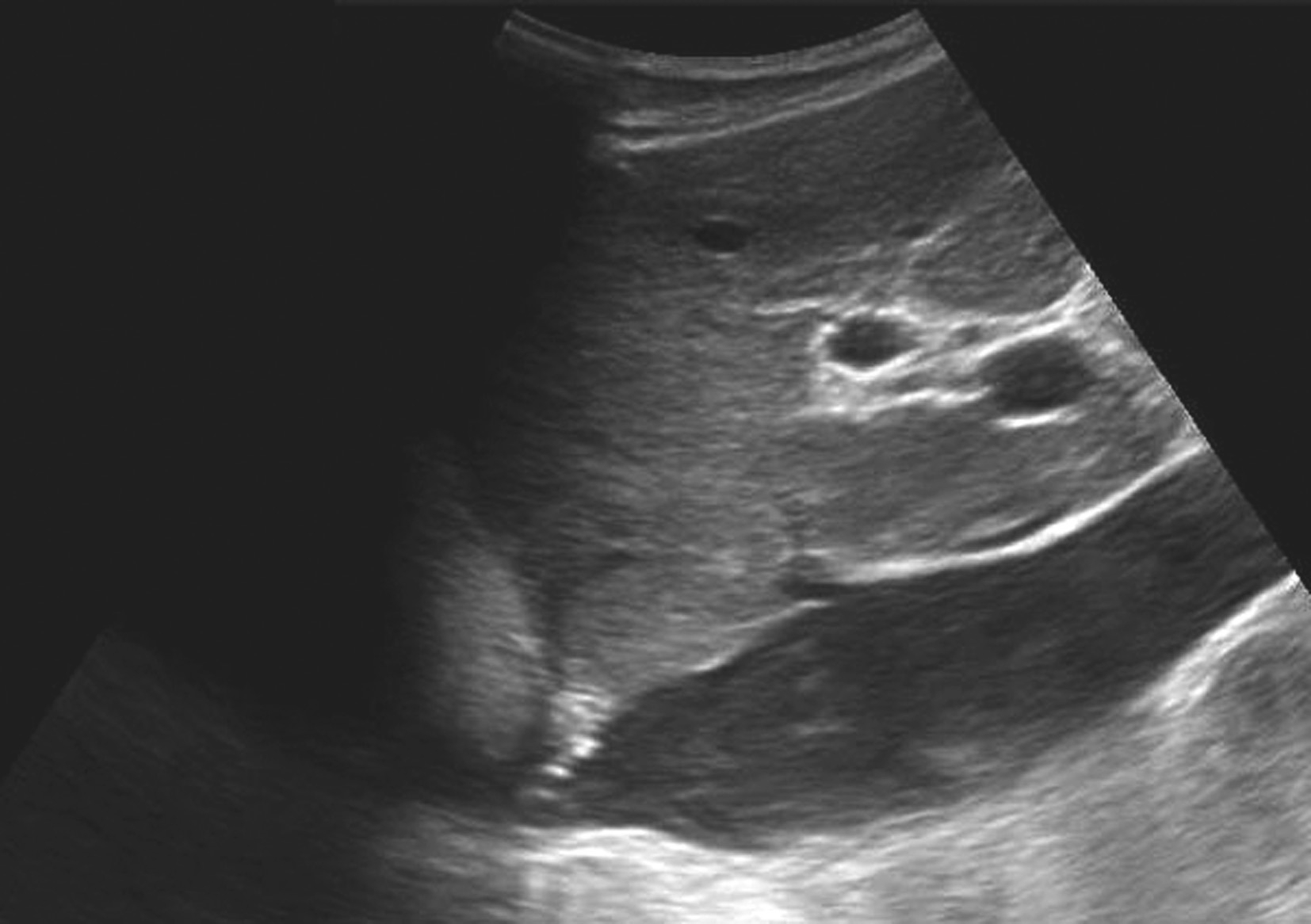
图5-21-28 原发性BCS:下腔静脉膜性梗阻二维灰阶图像
(3)肝静脉间交通支形成、扩张,副肝静脉开放扩张,如图5-21-29、图5-21-30所示。
(4)伴见脾肿大、腹水、胆囊增大。
2.彩色多普勒超声
彩色多普勒可见下腔静脉、肝静脉狭窄处近侧呈花色血流信号,流速增快,膜狭窄局部可探及喷射状高速血流信号,闭塞时管腔内无血流信号(正常下腔静脉内血流速度一般为5~25cm/s,Budd-Chiari综合征时血流明显加速,呈五彩镶嵌色,可超过100cm/s)。狭窄或闭塞远侧管腔扩张,血流淤滞,彩色多普勒信号暗淡,频谱显示三相波消失呈平直形,血流方向异常或速度减慢,闭塞时部分节段可探及逆向血流信号频谱;周围侧支循环丰富,血流方向异常流入侧支致侧支静脉曲张。继发性BCS的左肝静脉、下腔静脉及右心房癌栓致肝静脉、下腔静脉阻塞的超声图像如图5-21-31所示。
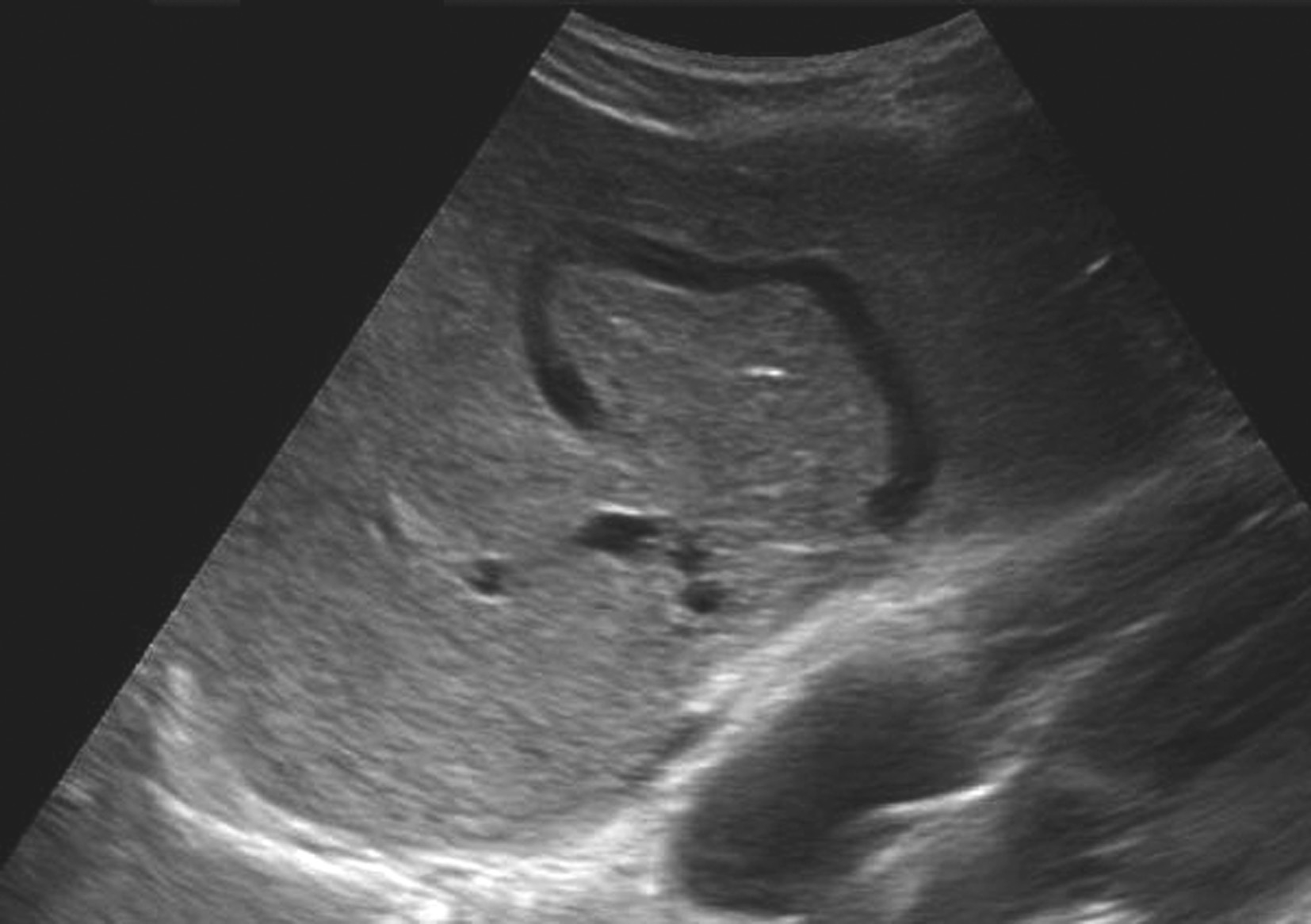
图5-21-29 原发性BCS:肝静脉发育异常二维灰阶图像
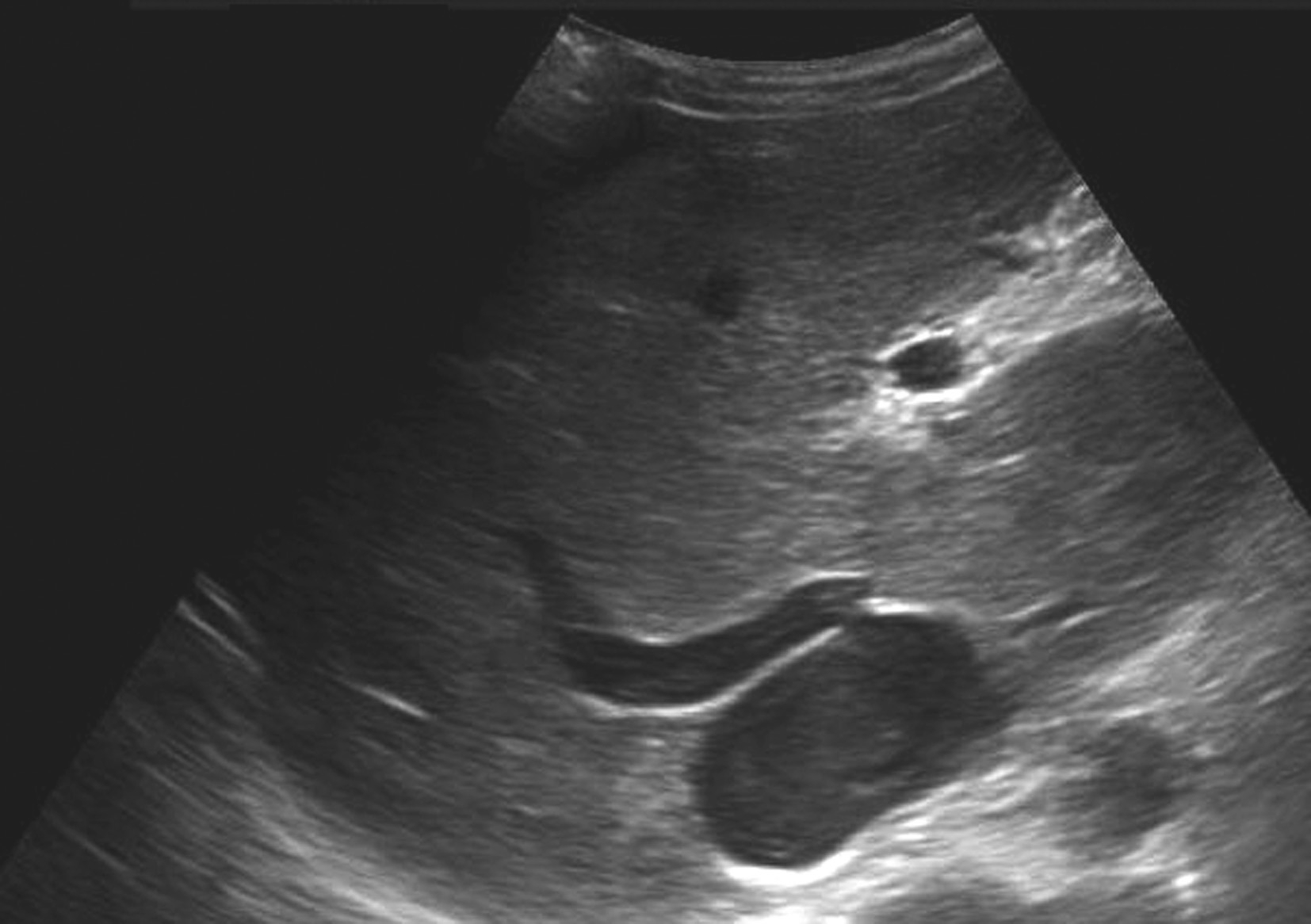
图5-21-30 原发性BCS:副肝静脉二维灰阶图像
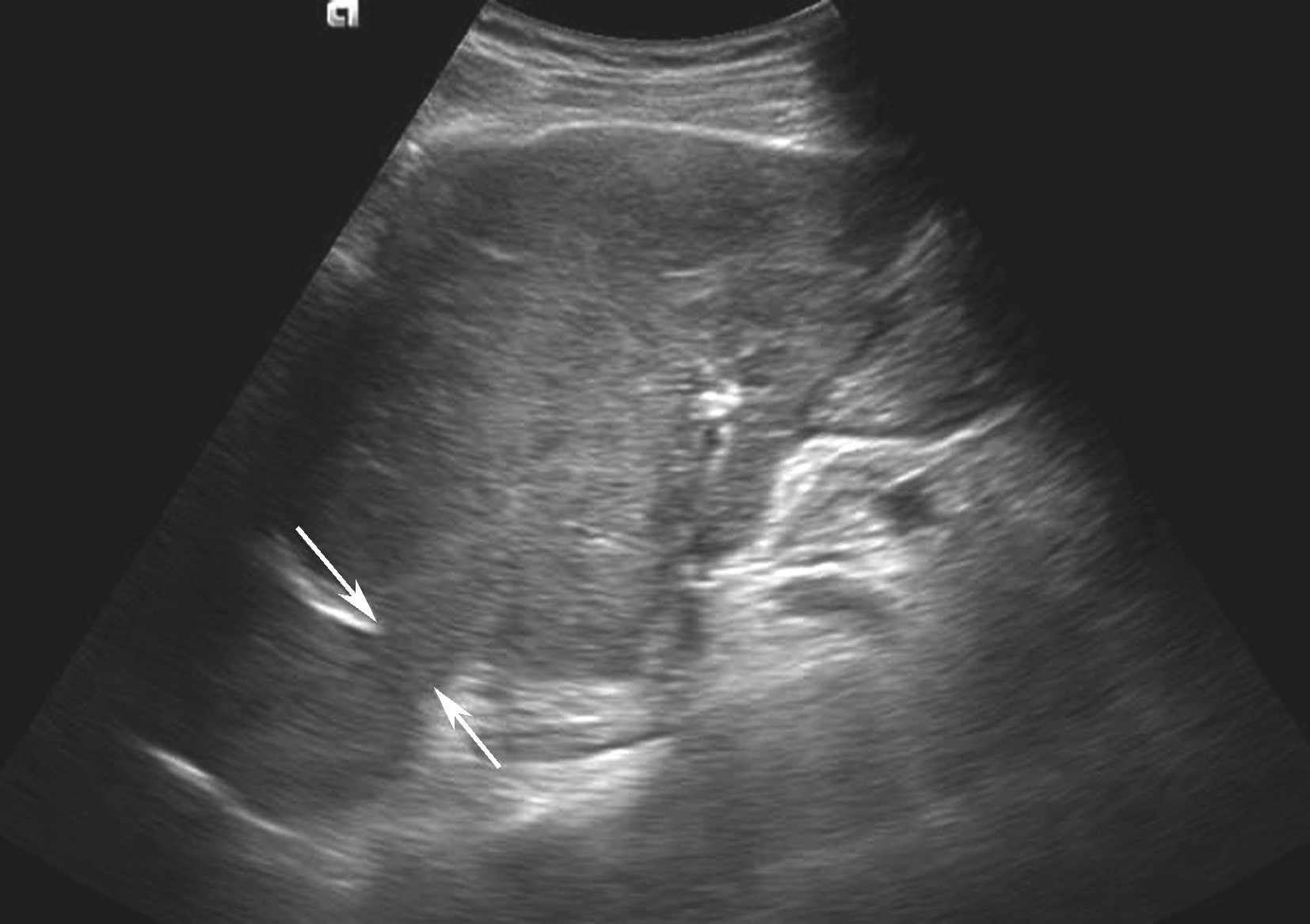
图5-21-31 继发性BCS:左肝静脉、下腔静脉及右心房癌栓致肝静脉、下腔静脉阻塞
先天性肝血管畸形较为罕见,其导致通过肝脏血流的异常分流。分三种类型:肝动静脉间(肝动脉至肝静脉)分流,肝动脉-门静脉间(肝动脉至门静脉)分流,门静脉-肝静脉间(门静脉至肝静脉)分流。胎儿发育过程中血管形成的改变导致畸形,可以是孤立性的病灶,也可是系统性疾病的一部分。如遗传性出血性毛细血管扩张症三种类型可同时存在。临床表现根据分流的类型和程度而不同。
孤立性先天性肝血管异常分流可再分为高流量分流,如动静脉畸形(arteriovenous malformations,AVM)和低流量分流(门静脉体静脉分流,淋巴管畸形)。
(1)先天性肝动静脉畸形(congenital hepatic arteriovenous malformations,HAVM):
一种先天血管畸形,分流的血液直接从肝动脉进入肝静脉,造成回心血量增加,异常血管之间无肿瘤组织。肝动静脉瘘通常发生在肝脏的某一叶段,多数患者临床症状不明显,多因体检偶然发现;分流量大者可发生高输出性心力衰竭、肺动脉高压、肝肿大、全身水肿、消耗性凝血病、贫血、门静脉高压等,死亡率达50%~90%。
【声像图表现】
肝实质回声减少代之以巢状扭曲增粗扩张的血管,病变处动脉血流流速下降,血流阻力指数减低;而静脉流速增高,频谱呈搏动性。超声可进行产前诊断,在胎儿肝脏中探及多个增大扭曲的血管。
(2)先天性肝动脉门静脉畸形(congenital hepatic arterioportal malformations,HAPM):
一种先天血管畸形,分流的血液直接从肝动脉进入门静脉,导致门静脉高压,发病罕见,在婴儿期和幼童时期所致的门静脉高压是可治疗的。先天性HAPM分为三种类型:①单支型(动脉血供为右肝动脉、左肝动脉或肝脏中动脉之一);②双支型(动脉血供为右肝动脉、左肝动脉或肝脏其他动脉分支中的两支);③复合型(动脉血供除肝动脉外还可有其他动脉,如胃动脉等,所形成的动脉血管丛)。临床表现为婴儿期和儿童期反复严重的上消化道出血,进行性肝脏杂音和脾肿大,也可产生腹水。单分支型约占总病例的50%,平均发病年龄约3岁(1周岁~16岁),单支型发病明显晚于双支型及复合型。
【声像图表现】
灰阶超声为肝动脉增粗,病变处节段性门静脉扩张,门静脉内测及搏动性血流,瘘口周围的肝实质可出现彩色斑点(振动伪像)。
(3)先天性门静脉肝静脉分流(congenital portosystemic shunts,CPSS):
一种先天血管畸形,是门静脉与体静脉之间的分流,是门静脉系统发育异常所致,发病罕见,常无门静脉高压,从解剖学上分为肝内、肝外分流。此病常伴有肝脏肿瘤,包括局灶性结节增生、肝腺瘤以及肝细胞癌。当分流量达到一定程度临床表现为门体静脉分流性脑病,部分患者存在高半乳糖血症、高氨血症、精神病学障碍、智力发育迟缓。
【声像图表现】
腹部超声显示肝静脉与门静脉之间可见囊性或管状无回声结构连接。多普勒超声是确定血管性质和分流率的最有效工具,当门静脉和脾静脉为三相或二相频谱时,应仔细观察是否有门体静脉分流的存在,一般认为门体静脉分流率小于24%~30%时不会引起肝性脑病,即使是肝硬化的患者。
为血管壁发育异常的常染色体显性遗传性疾病,又称为Rendu-Osler-Weber病,是一种全身血管发育不良性疾病,其主要病理特点为皮肤黏膜的毛细血管、小动脉、小静脉血管壁变薄,有的部位仅由一层血管内皮细胞所组成,周围缺乏弹性结缔组织支撑,以致形成血管的扭曲扩张,并可形成血管瘤,病变可累及皮肤、黏膜及全身各脏器,其中有8%~31%的病例可累及肝脏,临床表现为肝脏受累,弥漫性动静脉畸形。因流经肝动静脉瘘的血流量增多而出现肝肿大,可有肝区疼痛及一定程度的压痛,局部有时可触及搏动性肿块,触之有震颤,能闻及连续性血管杂音。动-静脉分流可产生高动力循环状态,并可产生高排量充血性心力衰竭,可因肺的动静脉瘘而引起低氧血症、继发性红细胞增多症。肝局部缺血,门静脉高压,慢性失血或频繁而大量出血可致缺铁性贫血。
【声像图表现】
(1)灰阶超声:
①肝动脉显著增宽,肝总动脉扩张内径>0.7cm,由于肝内血管过度扩张形成,肝内动脉增多扩张;②门静脉、肝静脉扩张;③肝脏肿大,患者可有肝硬化声像图改变,及其他一些局灶性病灶,如肝血管瘤、肝囊肿、局灶性结节增生、肝内动脉瘤等。
(2)多普勒超声:
肝内血管增多,肝门部动静脉增宽,流速增高,肝固有动脉血流速度>110cm/s,肝固有动脉 RI<0.6,门静脉最大血流速度>25cm/s。
肝动脉血栓常发生在肝脏移植的病例,而门静脉较易发生血栓和癌栓,血栓和癌栓发生率介于肝动脉和门静脉之间。
【声像图表现】
(1)灰阶超声:
病变血管腔狭窄或闭塞,管腔内为实质性回声;病变血管近端(下腔静脉则为远心端)血管内径可增宽。
(2)彩色多普勒超声:
显示病变部位彩色血流束不同程度变细且不规则,甚至消失,病变血管血流速度减慢。
本病少见,以肝外为主,肝内少见,病因多为动脉粥样硬化、感染、外伤或动脉壁中层先天性发育不良。声像图表现:
(1)灰阶超声:
显示肝外动脉一侧瘤样或梭形外凸,可有颈部与肝动脉相通,呈波动性囊状无回声区,壁薄,较大者可见附壁血栓回声。肝内动脉瘤表现为圆形或不规则无回声区,有时内部显示细小点状回声。
(2)多普勒超声:
显示瘤体与肝动脉相通,瘤体内可见杂乱的彩色信号,频谱显示瘤体内为搏动性湍流频谱,可与肝脏囊性病灶相鉴别。
经颈静脉肝内门腔内支架分流术(transjugular intrahepatic portosystemic stent-shunt,TIPSS)为经颈静脉途径,在肝静脉/下腔静脉与门静脉之间建立一条有效的分流通道,使一部分门静脉血直接进入体循环的放射介入性治疗技术,以达到降低门静脉压力、控制和防止食管胃底静脉曲张破裂出血和促进腹水吸收的目的。
1.灰阶超声
肝门静脉与下腔静脉之间显示置管区强回声管道结构,管腔内透声清晰,如图5-21-32所示。若血栓形成,可在支架内探及实性回声团块。
图5-21-32 TIPSS二维灰阶图像
2.多普勒超声
彩色多普勒超声显示置管内花色血流信号,频谱多普勒显示为连续性、高速、宽频带血流信号,流速可达70~200cm/s的入肝血流。若血栓形成,置管腔内可见充盈缺损甚至无血流信号通过。
肝脏移植术是治疗终末期肝病的唯一有效的方法。1963年Starzl施行了第1例成功的肝脏移植术,随着外科技术的进步,新型免疫抑制剂尤其是环孢素的问世,肝脏移植术取得了划时代的飞速发展,对于没有合理的内科或外科疗法选择的、不可逆的急性或慢性肝功衰竭的许多疾病都可进行肝脏移植术,已成为治疗终末期肝病的首选方法。肝脏移植术最主要的适应证是:肝硬化、淤胆性肝病、先天性代谢异常、暴发性肝衰竭和肿瘤。其中,肝硬化患者中肝炎后和乙醇性肝硬化是进行肝脏移植术最常见的类型。术后患者1年和5年生存率分别达到80%和65%,术后最长生存者已超过30年。超声医学检查具有无创、简便、直观、定位准确及可动态监测观察等优点,在肝移植术前受体评估、术中血管分离和重建、术后并发症诊断和疗效监测的过程中发挥重要作用,对临床及早治疗、保证肝移植成功具有重要的作用,是移植后监测的首选影像学检查方法。
1.移植肝大小、形态及实质回声、有无局灶性病变、有无脓肿及肝梗死。
2.肝动脉内径、管壁结构和回声、频谱、收缩期峰值流速、舒张末期流速和血管阻力指数,检测肝动脉血流有无增快或血流信号中断等改变。
3.肝门部门静脉最大内径、最大流速、平均血流速时间;肝静脉及下腔静脉血流频谱形态的观察,注意有无狭窄、异常频谱及血流中断。
4.下腔静脉血流通畅情况及门静脉、肝静脉和下腔静脉吻合口内径、平均流速及频谱。
5.胆总管内径、肝内外胆管有无狭窄或扩张、管腔内透声及吻合口连接情况。
6.肝脏周围、胸腔及腹腔有无积液。
7.脾脏、肾脏的形态、大小和内部结构回声及血流分布情况。
(1)肝移植后早期出现移植肝脏轻度增大,实质回声稍增强,回声分布欠均匀,约2周可恢复至正常回声。
(2)移植后胆管多在正常范围,少数可轻至中度扩张。
(3)肝门处肝动脉因重建通常扭曲,内径2~5mm,血流速度30~100cm/s,搏动指数0.80~1.50,收缩期加速度<0.08s,阻力指数根据术式不同而略有差异,端-端吻合阻力指数0.40~0.70,端 -侧吻合阻力指数0.50~0.80。
(4)肝门部门静脉8~14mm,吻合口处管壁可见高回声,管腔内径>7mm,远端略扩张。移植术后门静脉管壁呈强回声,管壁较厚,管腔内未见异常回声,彩色多普勒显示血流充盈良好,早期可呈红蓝相间的双向螺旋形血流信号,1~2周后恢复为入肝的单向血流信号。
(5)肝移植术后肝静脉通常显示良好,术后早期肝静脉内径略细,频谱多普勒超声显示为三相或双向波。
(6)下腔静脉吻合口处可见管壁缝线高回声信号,吻合口处内径略小于缝合处近、远端,频谱形态受心脏搏动的影响,近心端频谱多普勒超声显示为三相或双向波。
(1)急性排斥反应的症状可不明显。彩色多普勒超声判断标准:①肝移植后,肝静脉频谱形态变钝,呈低沉的单相波,可能与肝肿胀顺应性降低及中央内皮炎有关,但其他原因引起的肝细胞水肿也会产生类似波形的衰减,如胆道炎症、肝炎和上方的下腔静脉吻合口狭窄等。②移植后最初诊断正常者,后出现频谱变钝,对急性排斥反应诊断敏感性高达92%。经抗排斥药物有效治疗后,静脉波形可恢复原有的三相波,峰值速度增高。③肝内胆管及胆总管扩张。④肝动脉阻力明显减低者。总之,彩色多普勒超声不能确诊排斥反应,但能提示排斥反应的存在,并追踪其转归,急性排斥反应确诊需依靠穿刺活检。
(2)肝动脉血栓是肝移植后最严重的并发症之一,通常发生在移植后的5~10天。其发生与移植手术技术、血管细小、排斥反应、内膜分离、吻合口缩窄和成角等因素有关。肝动脉血栓的治疗效果主要取决于能否早期发现,彩色多普勒血流成像常能在移植肝出现明显肝功能损害前发现该并发症。肝动脉血栓或狭窄最可靠的诊断指标为阻力指数降低、收缩期加速度时间延长和频谱曲线形态改变。文献报道以肝动脉栓塞下游阻力指数(RI)<0.50,收缩期加速时间≥0.08s诊断肝动脉栓塞和狭窄,诊断敏感性为66%~81%,特异性为76%~86%。此外,门静脉可代偿性增宽、流速增快。Nolten等提出了彩色多普勒血流成像诊断肝动脉血栓的5条标准:①肝动脉血流信号完全消失。②在肝外动脉分支内直接看到动脉血流信号的突然消失。③肝外动脉消失,肝内动脉信号搏动降低。④延迟出现的上游动脉信号提示肝动脉血栓形成伴侧支循环形成。⑤在肝门区看到动脉侧支循环形成。
(3)肝移植后并发门静脉、下腔静脉、肝静脉狭窄、血栓的发生率,以下腔静脉狭窄、血栓为最多,彩色多普勒血流成像对下腔静脉血栓的诊断较容易作出诊断。门静脉血栓发生率约2%,原因与术中门静脉排列不良或残留段过长导致扭曲或狭窄、移植前已有门静脉血栓、高凝状态等有关。诊断依据为门静脉内血栓样回声和彩色多普勒信号充盈缺损或消失。
(4)胆道并发症亦是肝移植后常见的并发症之一,发生率为7%~38%,包括胆道梗阻、胆漏和胆道弥漫性改变,其中胆道梗阻最常见。胆泥是由浓缩、稠厚的胆汁和/或受损的胆管壁脱落的坏死组织集聚成带状梗塞物或铸型物。胆泥可引起胆道梗阻和上行性胆管炎,目前的发生率在10%~29%,是肝移植后危及生命的并发症。肝移植后胆泥形成的原因尚不清楚,有学者认为肝动脉栓塞、排斥反应和严重感染是引起胆泥的病因;还有学者认为供肝冷缺血时间超过10h,肝移植后初期的胆道水肿或胆道狭窄,以及后来形成的胆道梗阻亦是引起胆泥的主要原因。
彩色多普勒显像对于显示肝肿瘤内的血管和判断良恶性具有重要价值,目前已广泛应用于肝脏肿瘤的检查和诊断,但对于一些流速低、血供少的肝脏肿瘤,彩色多普勒超声不能提供满意的、有价值的血流信息,超声造影剂弥补了它的不足,提高了超声检查和良恶性判断的敏感性及特异性。肝局灶性病变的组织病理学基础决定了其在影像学上表现多样性和复杂性,病灶血流灌注和增强模式的评估有助于良恶性病灶的鉴别。超声造影可以实时显示肝局灶性病变血流灌注在不同时相中表现出的特征性和特异性的血管模式,与增强CT及MRI在不同血管时相采集对比增强图像的方式相似。因其能连续动态观察肝脏病灶组织的血流灌注过程,显著提高了肝局灶性病变超声诊断的准确性。增强模式有:①快进快出:动脉期部分或整体快速增强,门脉期或延迟期快速消退呈低增强。②快进慢出:动脉期部分或整体快速增强,门脉期、延迟期消退慢于或等于肝实质,呈轻度高增强或等增强。③慢进快出:动脉期部分增强或呈等增强,门脉期快速消退。④慢进慢出:动脉期部分增强、环状增强或呈低增强,门脉期或延迟期与肝实质同步增强、消退。⑤低增强:动脉期、门脉期、延迟期均呈低增强。⑥等增强:动脉期、门脉期、延迟期与肝实质同步增强、消退。
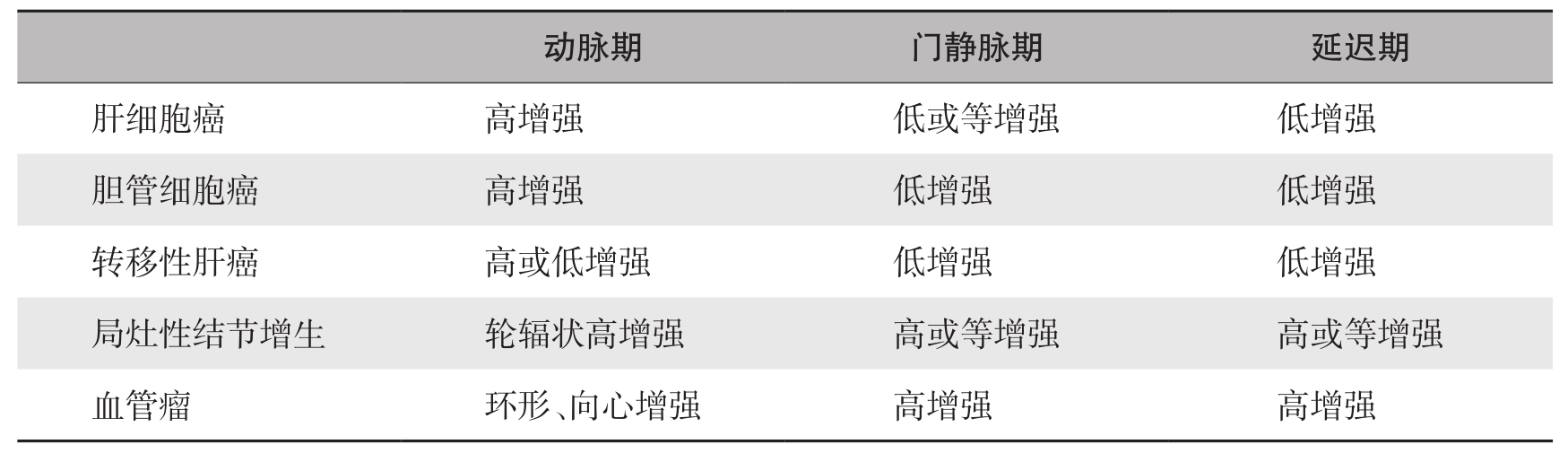
恶性病灶超声造影动脉相多表现为弥漫或环状增强,延迟相增强信号消退;与之相反,多数良性病灶延迟相仍持续增强。常见肝局灶性病变的超声造影特征见表5-21-2。
表5-21-2 常见肝局灶性病变造影特征
介入消融治疗肝脏肿瘤已广泛应用于临床,如:经皮无水乙醇注射(percutaneous ethanol injection,PEI)、经导管动脉栓塞术(transcatheter arterial embolization,TAE)、射频、微波、激光等热消融以及氩氦刀冷冻消融治疗,其中影像诊断和引导介入治疗起主导作用。主要用于:①病灶的探查和患者的选择;②治疗方案的选择;③准确引导电极针置入靶目标;④即时评估消融的效果;⑤远期效果的随访。肝脏肿瘤的消融治疗,通常是在超声的引导下完成,介入治疗过程中超声造影能实时、动态显示肿瘤的血液微循环,使得病灶更清晰、消融更准确,同时可以发现常规超声怀疑或未发现的病灶,在超声造影的引导下可进行准确活检,提高活检的准确率和检出率,并可在超声造影的引导下进行即时消融。由于增强CT和MRI一般不能在消融的同时进行监测,很难区分是凝固性坏死还是有活性的肿瘤组织以及残余的肿瘤病灶,而超声造影可以即时评估消融的效果,如有残余病灶,有典型的肿瘤超声造影表现,即刻进行再次治疗,增加一次性消融肿瘤的成功率。并且,超声造影极大地改善了局部消融肿瘤的各个步骤,使患者得到最佳处理和疗效。在肝硬化的患者中,肝实质回声不均匀,阻碍了常规超声对结节性病变的辨认,而且对TAE和PEI治疗后残余肿瘤和坏死组织无法区分,超声造影可以清楚地显示肿瘤的位置及肿瘤的血管以及治疗后残留的肿瘤,而且评估肿瘤的治疗效果不受碘油沉积的影响,这点明显优于其他影像诊断。
术中超声是评估局限性肝脏病灶最准确的技术,对肝脏肿瘤的手术方式有着很大的影响,且比CT和MRI有更好的空间分辨率。然而术中超声也有它的缺陷,不能确定病灶的良恶性和分化程度,不能提供肿瘤的血管和组织微循环的信息,不能发现很小的肝脏直结肠转移灶。而术中超声造影检查,可以提供局灶性结节的血管分布信息,并评估其良恶性和分化程度,其特异性和准确性都有很大的提高。特别是肝硬化的患者,可使病灶的发现率提高50%,从而影响着外科切除的手术方案。
在急性和慢性肝衰竭没有其他治疗方法时,肝移植是唯一的选择。准确的术前和术后肝脏血供的影像评估对增加肝移植成功率是非常重要的。彩色多普勒超声是肝脏、移植肝脏血流是否正常的首选探查方法,在肝移植术前后可以很好地评估肝脏的血管,但在晚期肝硬化时,由于技术自身原因彩色多普勒检查门静脉、肝静脉、肝动脉系统常常被阻碍。超声造影的发展,进一步改善了异常血流的探查率,减少了介入检查。超声造影剂可增强血管多普勒信号,术前发现是否存在门静脉栓子或门静脉海绵样变,并可区分是新形成的血栓还是低回声的低速血流,以便医生确定手术的方式,在肝移植的评估中起着重要角色。肝移植术后可以综合评估移植肝脏的排斥反应、肝动脉栓塞形成、肝动脉狭窄和假性动脉瘤的形成。使进一步的介入影像检查减少或推迟。
肝脏影像报告与数据系统(The Liver Imaging Reporting and Data System,LI-RADS)是美国放射学会(American College of Radiology,ACR)为了使肝脏影像征象描述和诊断报告标准化,减少报告的模糊性与多样性,加强与临床科室的沟通,于2011年发布了CT和MRI肝脏成像报告和数据系统(LI-RADS),主要对具有危险因素的肝脏病变发展为肝细胞癌的可能性进行分类,为肝细胞癌(HCC)的筛查、监测、诊断和治疗反应评估提供了标准化建议。10年来,LI-RADS进行了多次更新,增加了超声与超声造影肝脏影像报告与数据系统(US LI-RADS及CEUS LI-RADS)的内容,并被专业临床组织认可,2018年被美国肝病研究协会(American Association for the Study of Liver Diseases,AASLD)纳入 HCC 临床实践指南。LI-RADS的最新版本包括四种算法:常规超声(US)用于HCC监测、超声造影(CEUS)用于HCC诊断、计算机断层扫描(CT)/磁共振成像(MRI)用于诊断和分期以及治疗反应的评估。
超声相关LI-RADS主要有:
US-1类:阴性,超声检查无HCC证据。定义:没有观察到或只有绝对良性的观察结果,如:①单纯性囊肿;②胆囊窝周围局灶性肝脂肪沉积;③先前确认的血管瘤。
US-2类:亚阈值,检测到可能需要超声短期监视的观察结果。定义:直径小于10mm的病灶,不一定是良性。如:实性结节(任何回声)<10mm。
US-3类:阳性,检测到的观察结果有必要进行多时相对比增强成像影像学检查。定义:局灶性病灶≥直径10mm,不一定是良性或静脉内新栓子。如:①实性结节(任何回声)≥10mm;②实质变形;③静脉栓子,以前未确认为良性。
CEUS LI-RADS 1类:明确良性。定义:影像学特征诊断为明确良性的肝脏病灶或者随访过程中明确发现病灶自发消失。如:①单纯囊肿;②典型血管瘤;③明确的局灶性肝脏脂肪浸润;④明确的局灶性肝脏脂肪缺少。
CEUS LI-RADS 2类:良性可能性大。定义:影像学特征提示但非诊断良性的肝脏病灶结节,如可能为肝硬化再生结节或低级别不典型增生结节。标准:①各期均为等强化(a.<10mm的明确实性结节,b.任意大小的非明确实性结节);②既往探查为LI-RADS 3类,2年以上未增大。
CEUS LI-RADS 3类:HCC中度可疑。定义:不符合其他LI-RADS分类标准的明确实性结节。标准:①直径≥10mm,动脉期等强化、无任何类型廓清(各时相均为等强化)的明确实性结节;②动脉期低强化、无任何类型廓清、任意大小的明确实性结节;③直径<20mm,动脉期等/低增强、轻微/延迟廓清的明确实性结节;④直径<10mm、APHE(全部或部分,非轮状或周边不连续球形强化)、无任何类型廓清的明确实性结节。
CEUS LI-RADS 4类:HCC可能性大。定义:影像学特征提示但非诊断HCC的明确实性结节。标准:①直径≥20mm,动脉期低/等强化、轻微/延迟廓清的明确实性结节;②直径<10mm、APHE(全部或部分,非环状或周边不连续球形强化)、轻微/延迟廓清的明确实性结节;③直径≥10mm、APHE(全部或部分,非环状或周边不连续球形强化)、无任何类型廓清的明确实性结节。
CEUS LI-RADS 5类:明确HCC。定义:影像学特征诊断为HCC的明确实性结节。标准:≥10mm,APHE(全部或部分,非环状或周边不连续球形强化)、轻微/延迟廓清的明确实性结节。
CEUS LI-RADS 5V类:明确静脉内癌栓。分类:①静脉内明确的增强软组织,不论是否探及实性肿块/结节;②必须要有动脉期一定程度的明确强化,伴随廓清(不论廓清开始时间及程度)。
CEUS LI-RADS M类:明确或可疑恶性病灶,但不特指HCC。定义:具备1个或多个非HCC的恶性肿瘤影像特征的明确实性结节。分类:①至少动脉期存在一定强化(不论增强的形态特征和强化程度)的明确实性结节,且具备下述1项或2项:a.相对肝脏,在造影剂注射后60秒内发生早期廓清;b.廓清显著造成“凿孔样”外观。②动脉期环状强化伴随廓清(不论廓清开始时间及程度)。
介入性超声为介入性放射学的组成部分,指在实时超声的监视或引导下完成病灶的穿刺活检、抽吸、置管引流、肿瘤消融或注药治疗、X线造影等操作,避免某些外科手术而达到与外科手术相媲美的效果,其中肿瘤消融术是当前肝肿瘤的治疗热点,包括物理消融(微波、射频、激光和冷冻)和化学消融(无水酒精和醋酸)。同时,超声介入治疗在实时、可视状态下进行操作,从而能避免对大血管、邻近脏器的损伤,治疗过程安全性高,患者痛苦少。当前开展的项目主要有:
在超声引导下经皮、腹腔镜或剖腹术中将治疗介质注入肿瘤间质内,造成肿瘤细胞及间质组织溶解、变性、凝固坏死,达到原位灭活肿瘤的目的。细针穿刺安全,并发症少,依其液性制剂的不同可分为以下几种方法:PEI和经皮瘤内醋酸注射疗法。适应证主要是为小于<3cm的小肝癌患者,尤其适用于因肝硬化,或心、肝、肺、肾功能不全,或肿瘤位置不当等,或是因病灶多而不能手术切除的患者。对于>3cm以上、具有较完整的包膜者的肝癌或术后肿瘤复发者,可作为相对适应证。两者1、3、5年生存率分别为95%、70%、50%和90%、81%、61%。
肝癌常侵犯门静脉引起门静脉癌栓或肝动脉门静脉瘘,这是肝内播散转移的主要因素之一。预防和治疗门静脉癌栓对延长患者生存期具有重要作用,由于细针穿刺安全,超声又不需对比造影术即可显示肿瘤与门静脉之间的关系,进而可实现对门静脉的高度选择性栓塞化疗术,这样可达到既治疗肿瘤又不影响正常肝组织血供的目的。
目前,TACE主要在X线影像引导下实施,超声引导下行TACE的治疗对象主要为瘤周或瘤内存在扩张肝动脉的中、晚期肝癌患者,对直径2mm以上肝内肝动脉分支的经皮穿刺成功率可达100%。
超声引导下经皮穿刺将放射性核素准确导入肿瘤间质内部,利用放射性核素衰变过程中释放的各种射线束杀死肿瘤细胞,当前主要放射性粒子有 90 Y、 32 P和 131 I等,可有效避免损伤肿瘤周围的正常肝组织,最大限度的保护肝脏功能。
超声引导下将微波、激光、电能等各种物理能量准确导入肿瘤组织内部并在肿瘤间质内转化为热能,利用高温来促使肿瘤组织发生凝固性坏死。本法也包括直接导入低温来杀死肿瘤组织。
PMTC 为国内研究热点。在生物体中,机体的细胞内外液中含有大量的离子和水及蛋白质等极性分子,受到微波照射后,在微波场即交变电场的作用下,发生极化旋转或振动而导致组织自身生热,蛋白质发生凝固。从而达到肿瘤治疗的目的。
RA为在超声引导下把治疗用射频电极针刺入肿瘤间质内部,当射频电流达到一定频率时,引起组织内带电荷的离子运动,在电场中剧烈振荡摩擦而产生热能,使局部的温度迅速升高达60~115℃,造成组织的凝固性坏死,以达到破坏肿瘤细胞和周围组织的目的。治疗途径有经皮、经腹腔镜和经手术三种方式,引导方式有超声、CT、MRI以及近几年发展迅猛的融合成像,其中超声引导下射频消融作为小肝癌的首选治疗可达到与手术切除相似的疗效,也可用于良性实体瘤的治疗。有报道应用这种方法一次消融治疗肿瘤完全坏死率达到75%,接受二次消融治疗的肿瘤完全坏死率达到90%以上。
激光是局部热疗的一种,其基本原理是将光能转变为热能而被组织吸收,局部组织升温高达45℃以上并保持30min即造成肿瘤的不可逆坏死。与其他介入性治疗方法相比,激光消融最大的特点是光纤纤细,只有0.3mm。与传统的射频、微波消融相比,激光消融技术具有定位精准、效果显著、不产生焦痂、易于止血、周围组织热损伤小、不刺激组织增生等特点,能够快速安全的达到消融目的,但现有条件下激光消融凝固范围(约1.5cm),故对直径>3cm以上的肿瘤,单针难以达到肿瘤的完全性坏死。
(罗晓莉)
目前应用于肝胆疾病的影像学检查较多,主要的方法包括:普通放射、CT、MRI、PET/CT、超声、核素、血管造影、胆道造影及功能成像等方法。
常规采取仰卧前后位(图5-21-33A),必要时取直立前后位和侧位。
上包膈顶,下至肝下缘盆腔。
X线平片对肝胆疾病诊断价值有限且阳性率低,目前其临床应用明显受限。平片可大概了解肝脏的大小、形态、位置、密度和胆道系统的阳性结石。肝脏增大多见于肝炎、肝硬化早期、肝脏肿瘤、肝脓肿、肝寄生虫、血液系统疾病和巴德-基亚里综合征(Budd-Chiari syndrome,BCS)等,可表现为膈顶的升高、结肠肝曲、脾区下移,胃受压移位等。肝区密度异常:肝区高密度影包括肝内钙化灶和胆道系统阳性结石;肝区低密度影主要为肝内胆管积气、部分为肝实质内及门脉系统内积气等。
目的在于进一步了解肿大肝脏对胃、十二指肠和结肠肝曲的压迫和移位情况。肝癌患者常伴发肝硬化,应行钡餐检查除外食管、胃底静脉曲张,以及阻塞性黄疸与胃肠道的关系等。
检查前准备:行胃肠道钡餐患者常规均应检查前禁食和禁水6h以上,检查前3天不服用含铁、铋、钙等不透X线元素的药物,以免残留在肠道内影响观察。常规采用钡剂检查(图5-21-33B、图5-21-33C),如有新鲜消化道出血患者禁行钡剂检查,必要时可行泛影葡胺等碘水检查。
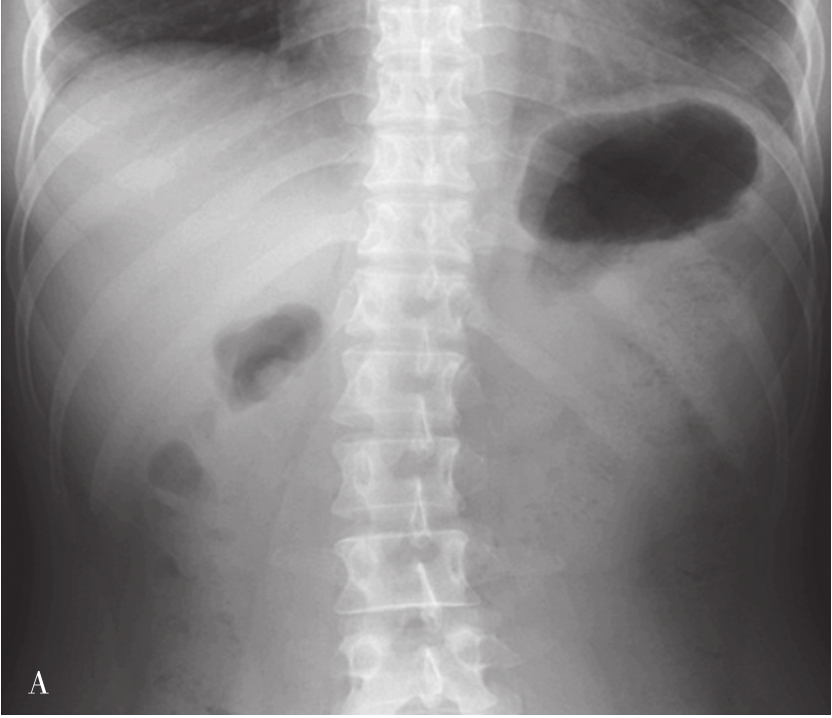
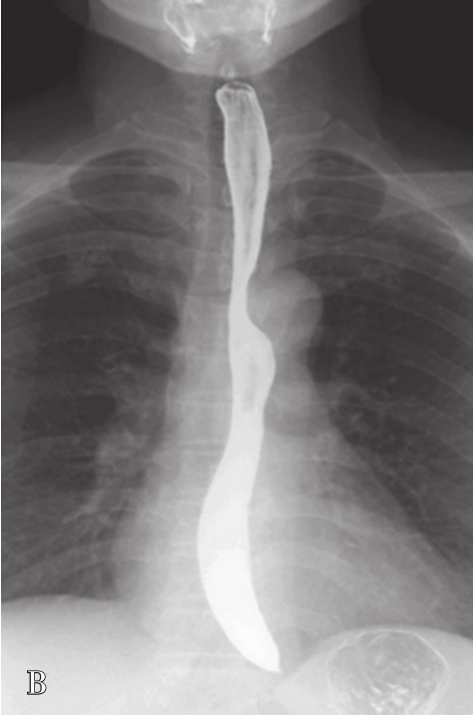
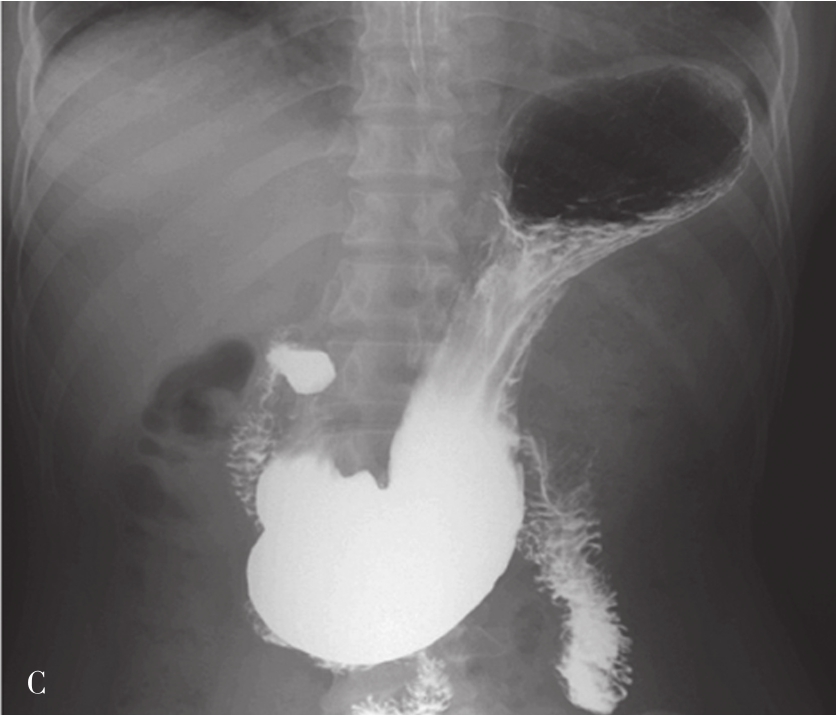
图5-21-33 胃肠道钡剂检查图片
A.正常上腹部仰卧前后位,可见胃及肠管内少量积气;B.正常食管充盈像;C.正常站立位胃充盈像。
常规腹部平片对肝硬化诊断价值非常有限,但胃肠道钡餐检查可显示中晚期肝硬化患者食管、胃底蚯蚓状扩张的静脉。食管静脉曲张是门静脉高压的重要并发症,最主要见于肝硬化、门脉系统的血栓形成及上腔静脉综合征。
上消化道钡餐检查可见食管及胃底多发串珠状或蚯蚓状充盈缺损,食管腔轻度扩张,管壁蠕动减弱,病变常始于食管下段,后延及食管中段及胃底,极少数可波及食管上段。按静脉曲张的范围、程度及食管蠕动功能分为轻度、中度、重度。①轻度:静脉曲张最初局限性于食管下段,表现为黏膜皱襞稍增宽,可呈浅锯齿样表现。管腔可收缩排空。②中度:随着静脉曲张的发展,曲张范围超过下段累及中段。静脉增粗迂曲突向管腔,正常平行的黏膜皱襞消失,代之以纵行粗大结节样条状影,进一步表现为串珠状或蚯蚓状充盈缺损,食管边缘凹凸不平,由于黏膜下明显静脉曲张,食管腔被撑开而略显增宽,食管收缩欠佳,排空稍延迟。③重度(图5-21-34):后期静脉曲张扩展到中上段,甚至食管全长。严重的曲张静脉占据食管壁,并使肌层受压迫而退变,食管明显扩展,不易收缩,腔内见形态不一的圆形、环状或囊状充盈缺损,管壁蠕动明显减弱,排空延迟,但管壁仍柔软可扩张。
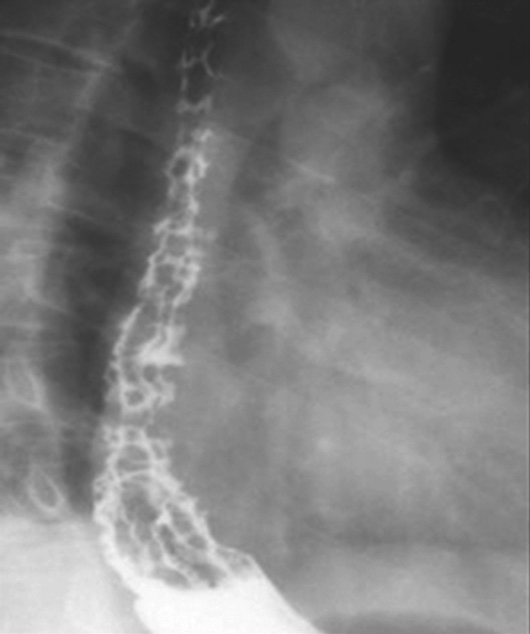
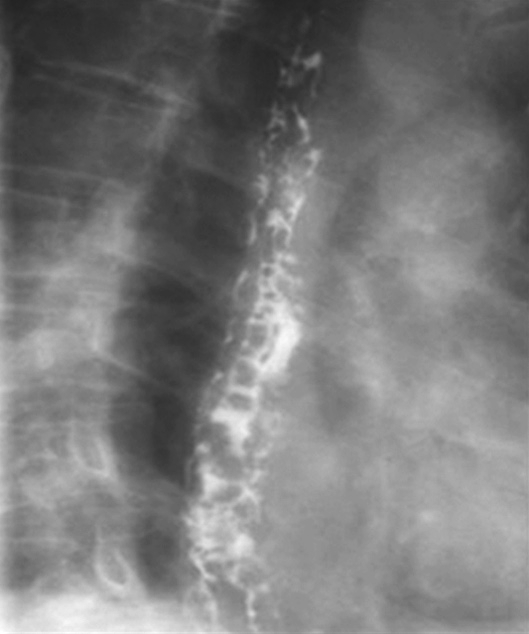
图5-21-34 重度食管静脉曲张钡剂检查结果
食管全长可见不规则蚯蚓状和结节状充盈缺损,食管明显扩展,蠕动明显减弱,排空延迟,管壁尚柔软
肝脏是人体最大的腺体,也是体内最大的消化腺,参与蛋白质、脂肪、维生素等物质的合成、分解;分泌胆汁;吞噬、防御功能及胚胎时期造血。
肝脏呈不规则楔形,分上、下两面,前、后、左、右四缘。第一肝门:在肝脏的脏面,有H形的3条沟,横沟内门静脉、胆总管、肝动脉出入肝脏的位置,称为第一肝门。第二肝门:腔静脉沟上端肝左、中、右静脉注入下腔静脉处。第三肝门:来自右半肝脏面的副肝右静脉和尾状叶的小静脉在腔静脉沟下段汇入下腔静脉。肝脏面H形的沟、裂、窝将肝脏分为:左叶、右叶、方叶、尾状叶。
(1)肝静脉系统:
肝左、中、右静脉、肝右后静脉及尾状叶静脉。
(2)Glisson 系统:
血管周围纤维囊包绕肝门静脉、肝动脉和肝管,三者在肝内分布、走行基本一致;
(3)肝8段划分法(图5-21-35):
Couinaud根据门静脉及肝静脉的分布将肝脏分为8段,门静脉分布于肝段内,肝静脉分布于肝段间。8分段法是临床外科和影像最为常用的分段法。以肝中静脉为界分为左、右半肝;以肝左静脉为界将左半肝分为左内(Ⅳ段)和左外叶(Ⅱ段+Ⅲ段);左外叶以门静脉左支为界水平分为上(Ⅱ段)下(Ⅲ段)两段;以肝右静脉为界分右半肝为前叶(Ⅷ段+Ⅴ段)和后叶(Ⅵ段+Ⅶ段);以门静脉右支为界将右肝横向分为上下两段分别为右前上段(Ⅷ段)、右前下段(Ⅴ段),右后下段(Ⅵ)和右后上段(Ⅶ段);肝尾状叶为单独一段(Ⅰ段)。
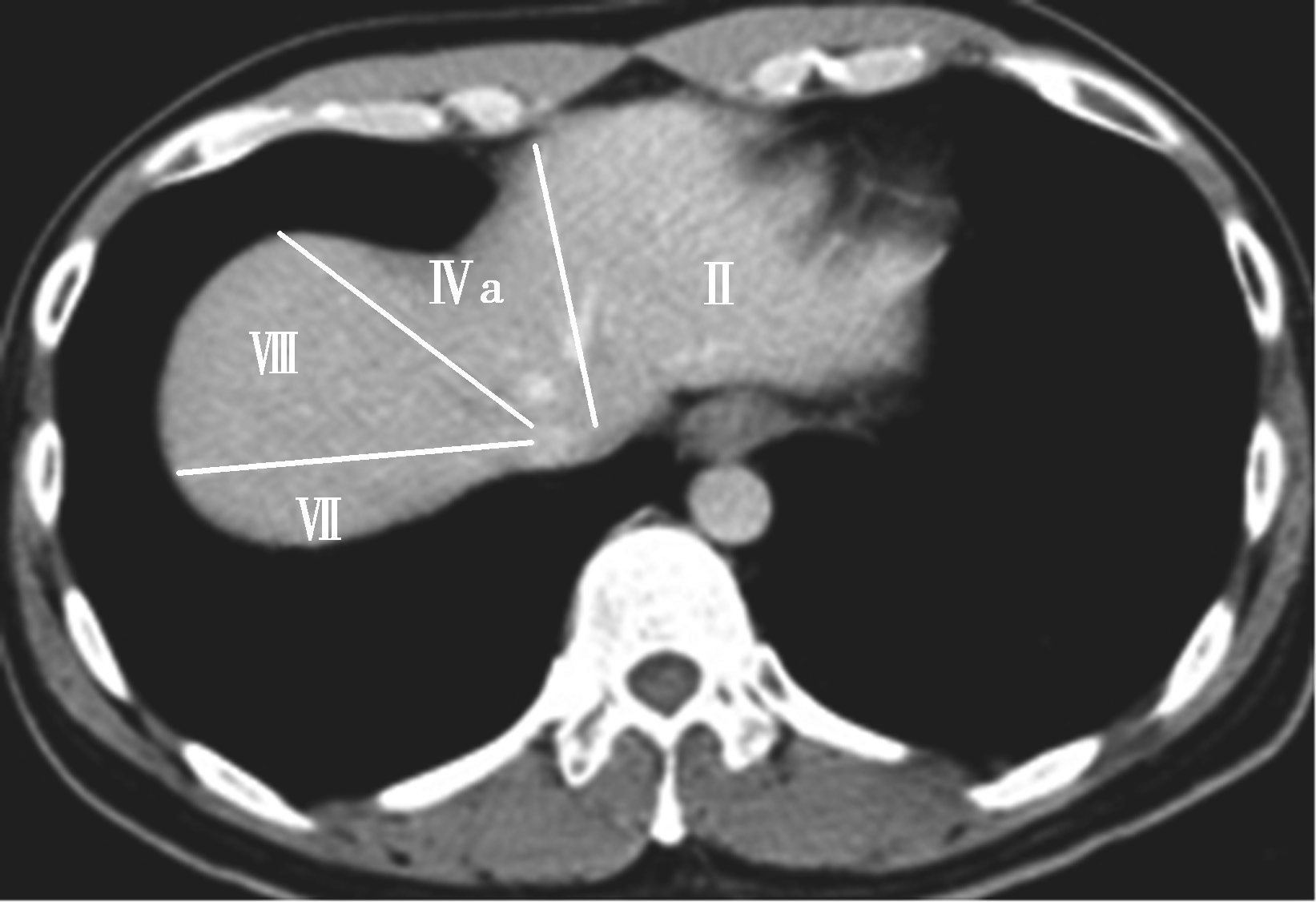
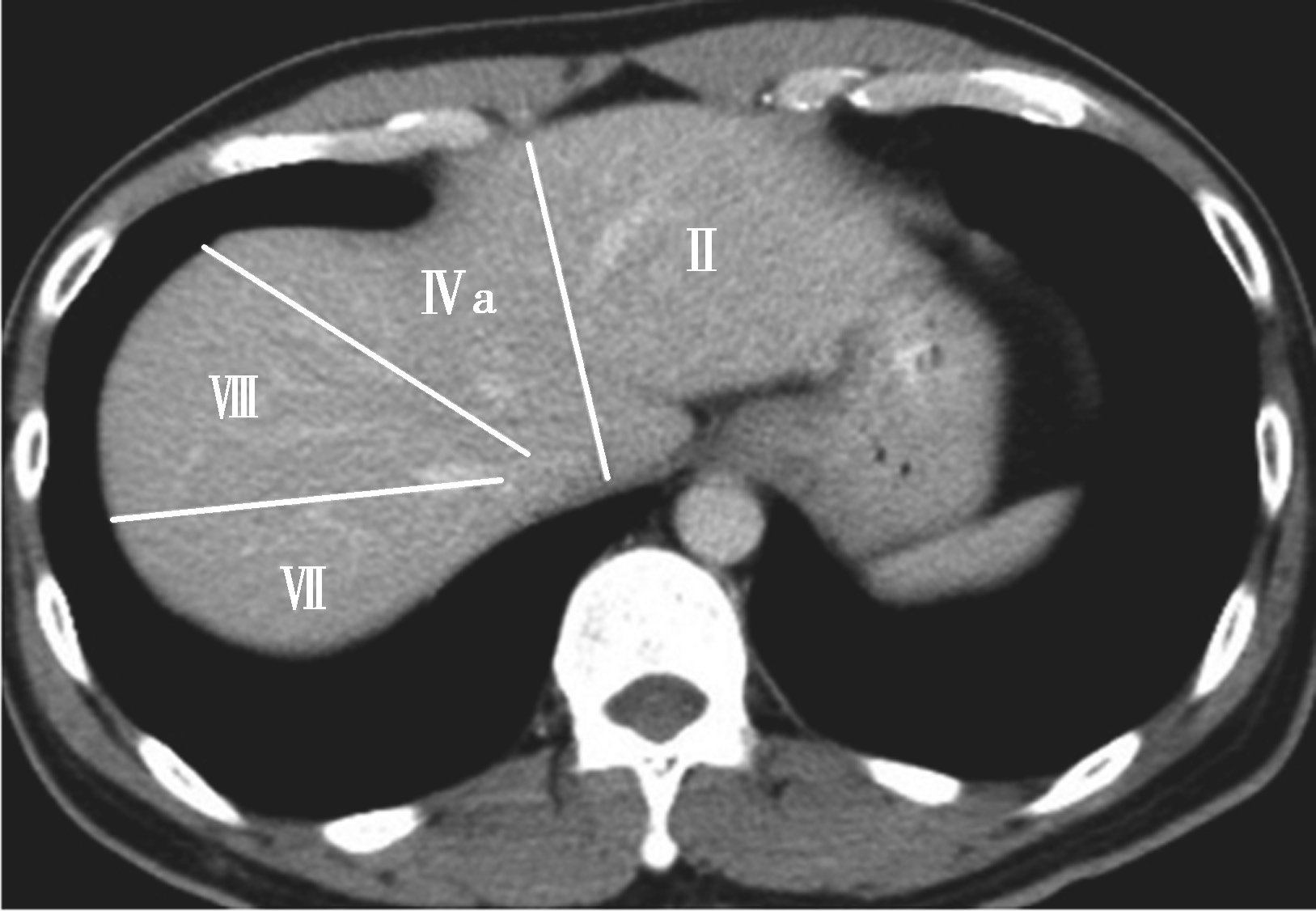
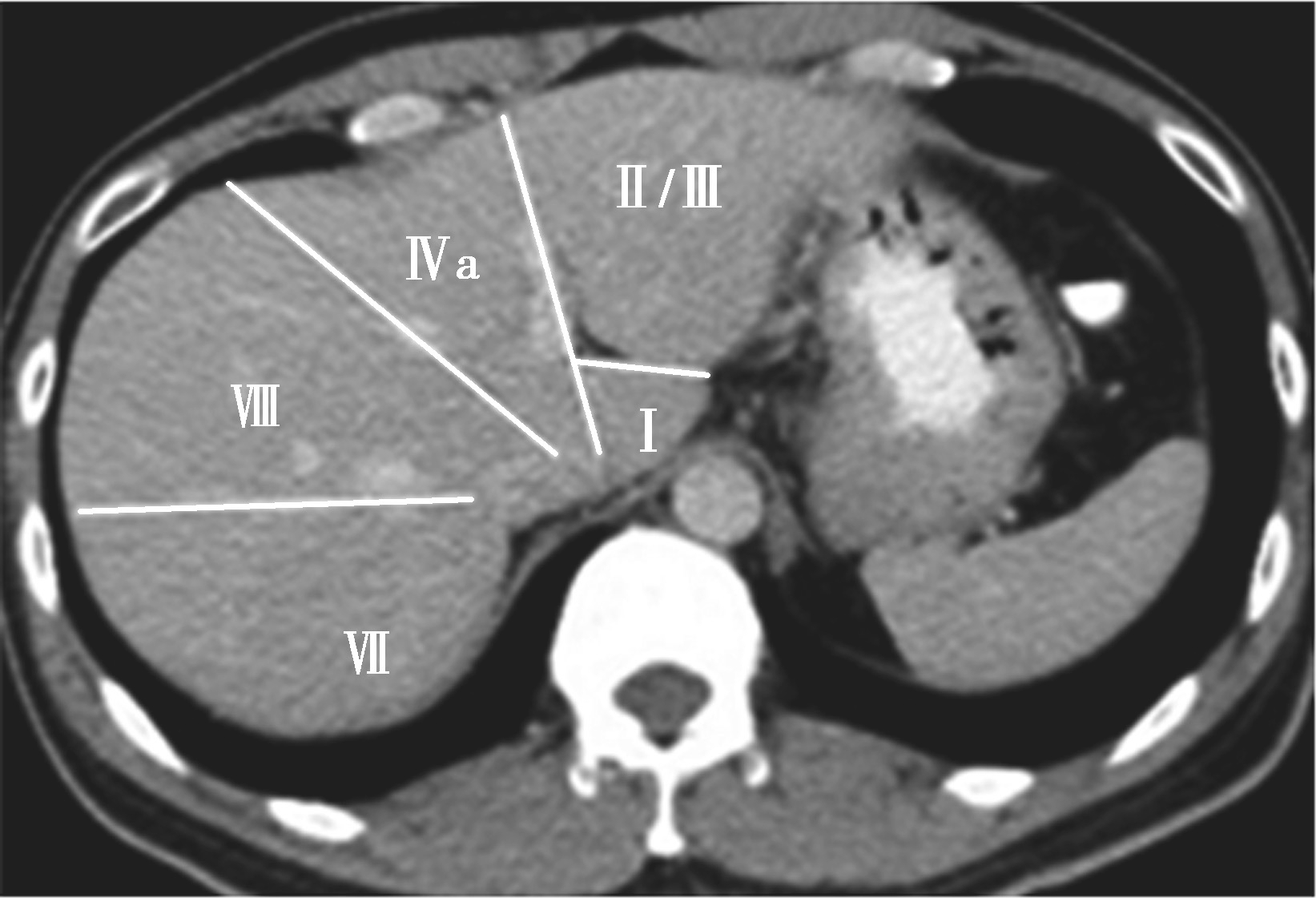
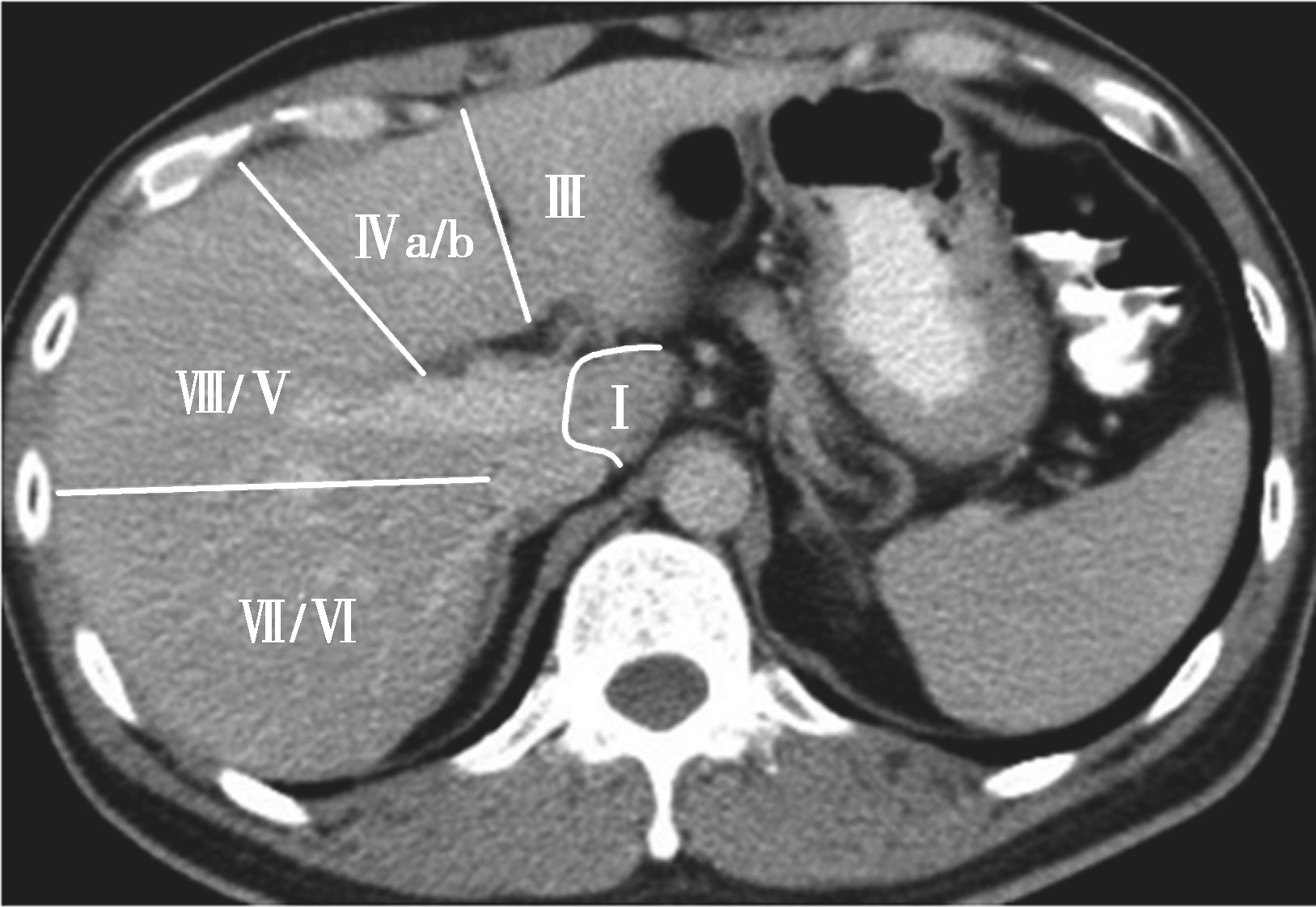
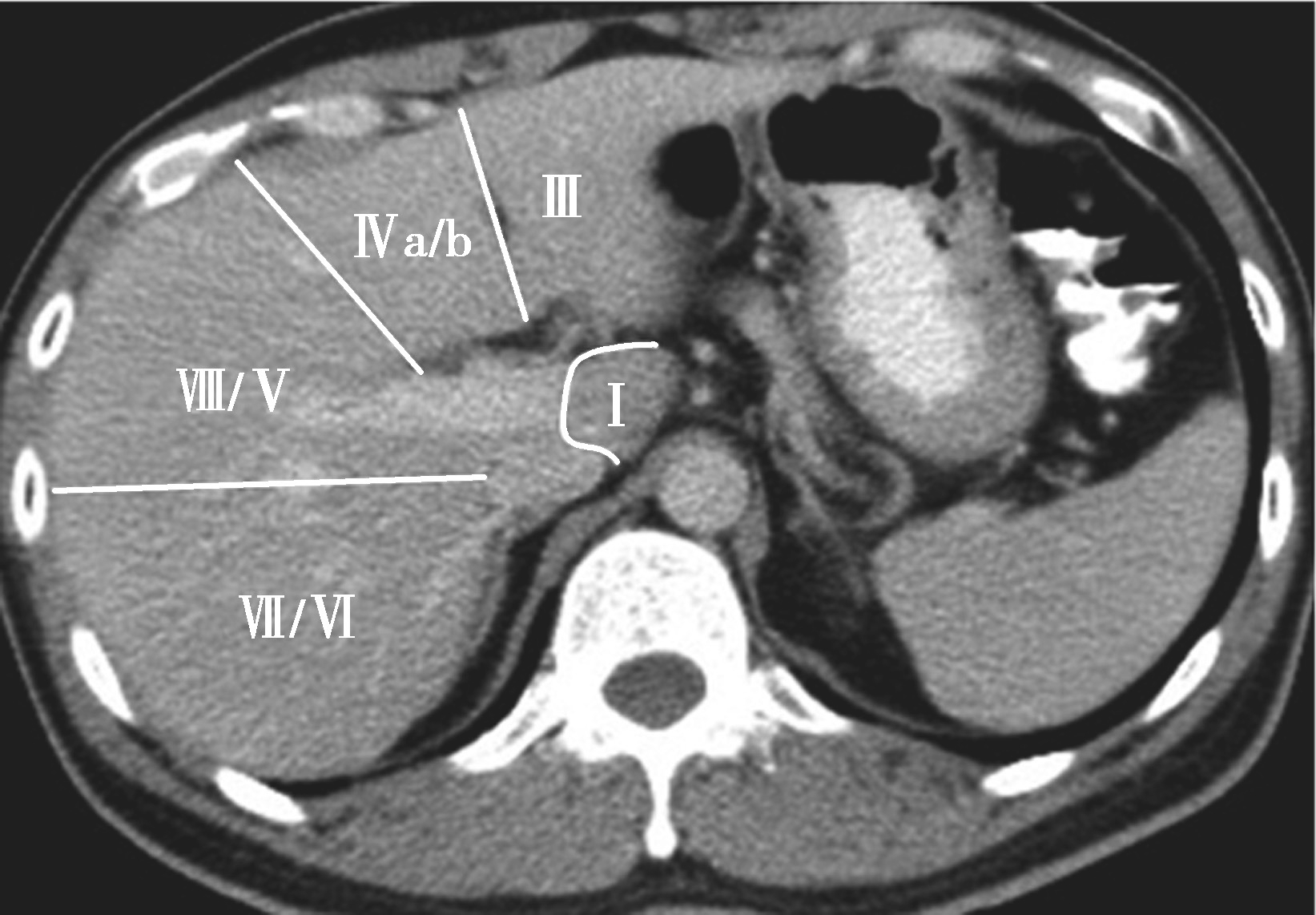
图5-21-35 肝8段划分法示意图
(1)检查前准备:
检查当天空腹,一般禁食4~6h。扫描前30min口服1.5%~3%泛影葡胺500~800mL,扫描前再口服200mL泛影葡胺,使胃和中上腹小肠适当充盈造影剂,便于辨认器官间毗邻关系,避免与腹部肿块相混淆。检查前需训练患者呼吸,以保证肝脏顺次扫描而无遗漏的区域。胃肠道内残留大量硫酸钡患者应排空后再行检查。
(2)扫描方法:
分CT平扫、多期增强扫描和CT血管造影(CT angiography,CTA)。常规体位为仰卧位,扫描范围包括全肝即肝脏上缘至肝角下缘。目前CT增强扫描一般采用非离子型碘对比剂,因其过敏反应发生率低,一般不主张行碘过敏试验,但必须有完备的抢救器材和药品,以及完备急救方案和人员预练。有过敏反应高危因素的患者,可检查前30min预先注射地塞米松10mg。一般非离子型碘造影剂无绝对禁忌证,但严重肝肾疾病患者、孕妇等慎用。增强方法目前多采用高压注射器静脉团注法,扫描动脉期、门脉期、静脉期及延迟期等期相。注意:由于碘过敏试验不能预测对比剂是否会发生严重或致命反应,所以建议不进行碘过敏试验。
(1)肝脏大小、形态:
在不同层面CT横断面图像,肝脏形态各异。在靠近横膈肝顶部,呈类圆形或椭圆形,面积小,占据腹腔的右半(图5-21-36A);在肝中部或肝门附件,近似楔形,面积较大,占据右侧腹腔(图5-21-36B);在肝下部形态类似于梭形或半月形(图5-21-36C)。
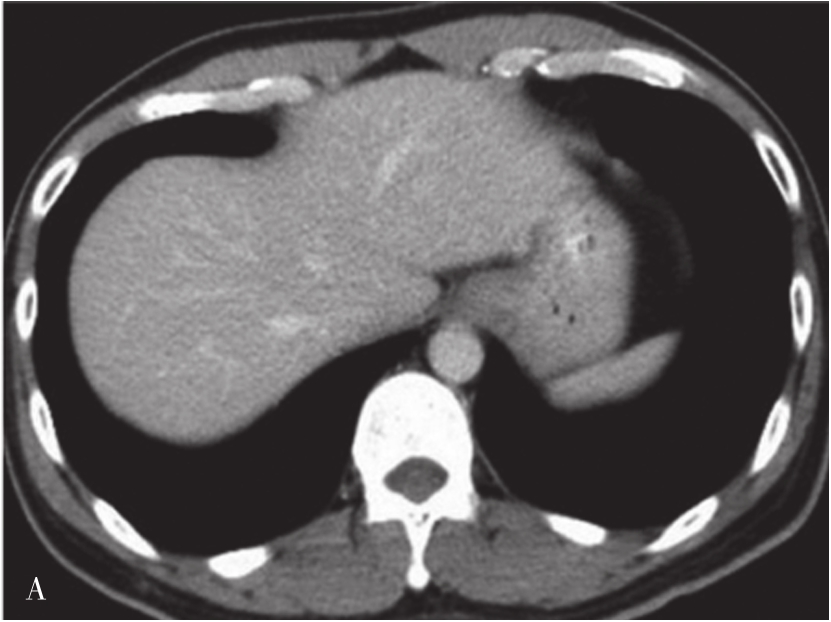
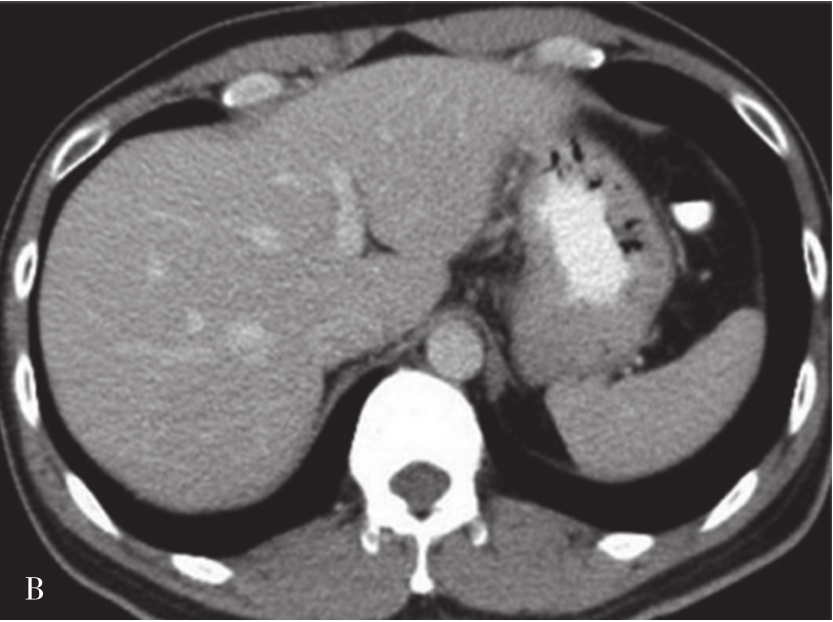
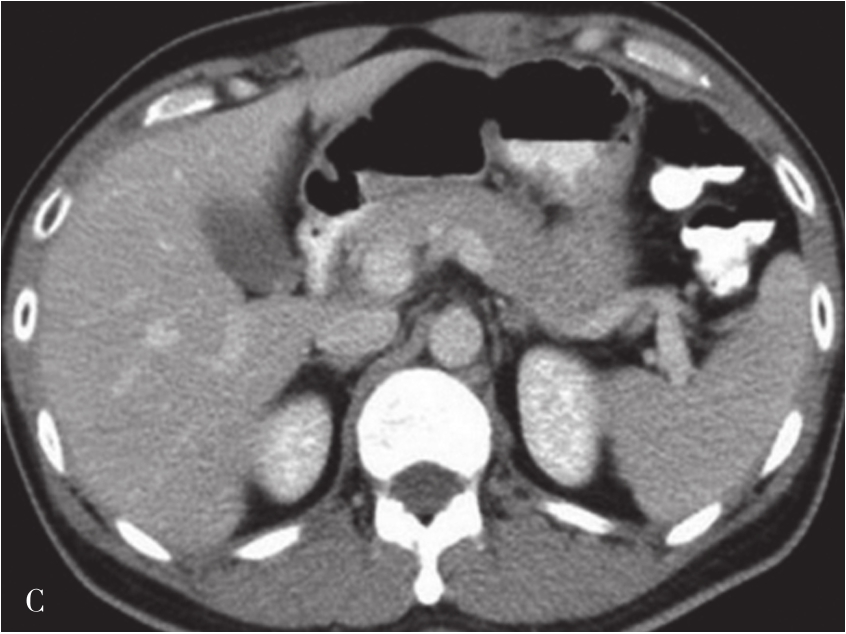
图5-21-36 正常肝脏CT表现
(2)肝脏各叶结构:
正中裂位于肝膈面,自胆囊切迹向后上方至肝左静脉入下腔处,此裂是区分肝左右的标志;在正中裂平面肝中静脉通过,该静脉在正中裂顶端注入下腔静脉,肝中静脉可作为肝顶部区分左、右叶的标志。左叶间裂又称圆韧带裂或纵裂,自脐切迹向后上方至肝左静脉入下腔静脉处,肝左静脉可单独或与肝中静脉汇合后注入下腔静脉右侧缘,其叶间支在裂内走行,是区分肝左内、外叶的标志。肝右静脉在后叶间裂地上部呈冠状走行,注入下腔静脉右侧缘,分隔肝右前、后叶。横裂由静脉韧带和肝门共同组成,呈左后斜向右前的低密度裂隙,其前方为左叶,后方为尾叶。
(3)肝脏实质密度:
正常肝实质密度较均匀,平扫CT值范围为40~70HU,高于脾脏、胰腺、肾脏,主要是因为肝细胞内含有高浓度糖原的结果。脂肪肝时平扫CT值低于脾脏。增强扫描能清楚显示肝左、中、右静脉及门脉主干及肝内主要分支,这些血管强化呈高密度影。门脉主干由肠系膜上静脉和脾静脉汇合而成,汇合点位于胰腺头部和颈部交界后方,向右上方斜行,通过肝十二指肠韧带进入肝门,分为门脉左右支入肝。
CT显示肝脏与周围脏器关系优于其他影像学检查。肝脏左侧脏面有胃以及胰腺等器官毗邻;右侧脏面有下腔静脉、十二指肠、胆囊、横结肠、右肾及右肾上腺等器官毗邻。在肝脏轮廓上可呈现这些脏器相应压迹。
肝硬化是一种由多个病因引起的肝脏弥漫性病变,其特征为弥漫性的肝纤维化、细胞坏死、变性伴假小叶及再生结节形成。因此,肝硬化确诊的必备条件是肝的纤维化和再生结节。
(1)肝脏大小和形态:
肝脏内的脂肪浸润及肝硬化再生结节使得肝脏体积增大,中、晚期肝硬化由于纤维组织增生又使得肝脏体积缩小,以肝裂增宽为主,胆囊窝扩大,肝脏表面呈波浪状改变。通常肝右叶缩小明显,而尾状叶及左叶则可出现代偿性的增大(图5-21-37)。
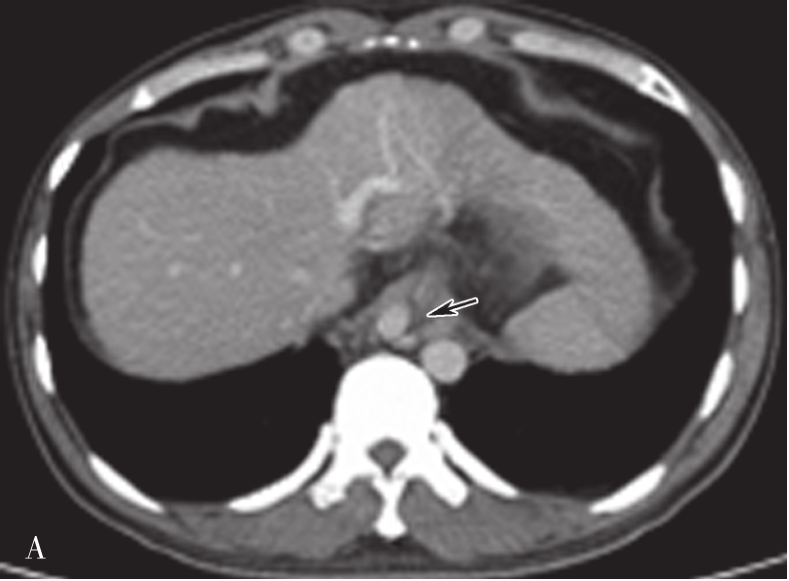
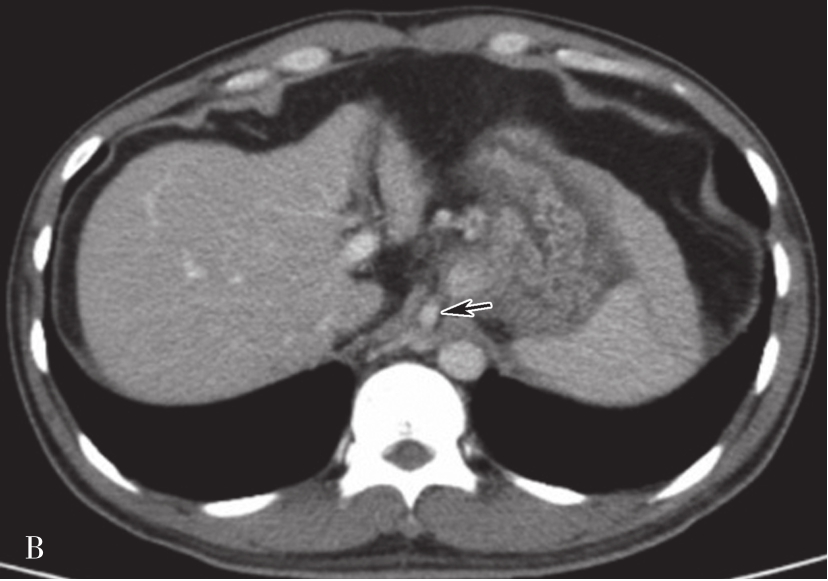
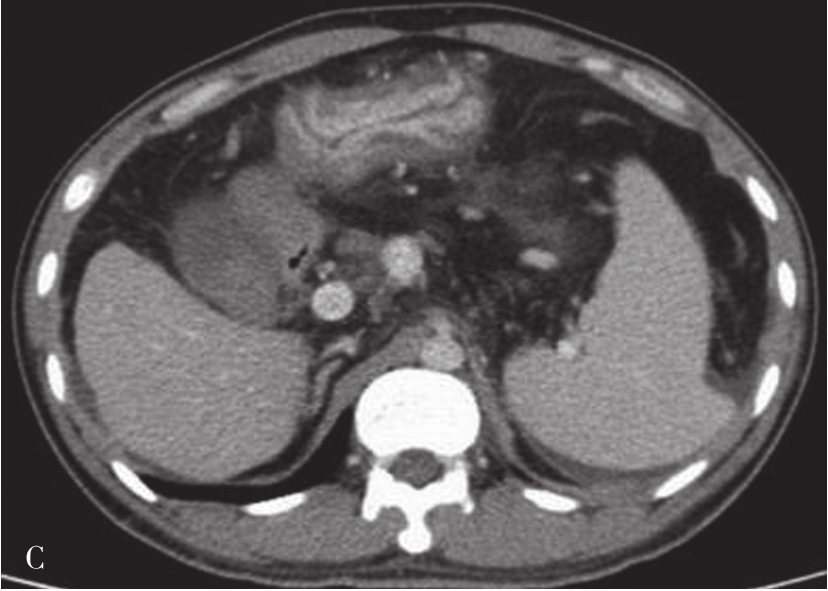
图5-21-37 CT增强扫描门静脉期图像
可见肝脏形态异常,肝裂增宽,肝叶比例失调,肝脏体积缩小,肝包膜增厚,肝脏边缘呈波浪状改变,门静脉主干管径增宽,直径约1.8cm。脾脏体积明显增大,脾静脉增粗,同时可见食管胃底静脉曲张(箭头),肝周、脾周可见弧形液性密度影
(2)肝脏密度:
肝硬化产生的纤维化、再生结节使得密度增高,肝细胞坏死及脂肪浸润使肝组织密度减低,局部脂肪组织浸润可出现局灶性的密度减低区。
(3)继发性改变:
包括门静脉高压所引起的脾肿大,腹水和食管胃底静脉曲张等。
目前,肝癌检查的影像方法主要包括彩超、CT、MRI、数字减影血管造影(digital subtraction angiography,DSA)及 PET/CT等。超声对肝癌也具有一定的诊断价值,由于检查方便、价格便宜,可作为普查和初筛的首选方法,但定性诊断不如CT和MRI。平扫加多期动态增强扫描的CT和MRI检查是目前诊断肝癌最常用、最有效、最安全、最可靠的检查手段,尤其是薄层扫描,对小肝癌的检出率明显较其他方法高,可诊断直径5mm左右的小肝癌。DSA尽管是有创性检查,但可行经导管动脉化疗栓塞术(TACE)而兼具有治疗作用,其诊断灵敏度达96%,但对再生性结节、小病灶和硬化伪影的诊断和鉴别诊断上仍有难度。PET/CT主要临床价值在于对肝癌患者的临床分期,而非肝癌本身的诊断。
(1)原发性肝细胞癌影像表现可分为四种类型:
①弥漫型:癌结节较小,弥漫分布于全肝,常伴有肝硬化,有时与肝硬化小结节难以区分;②肿块型:癌肿直径>5cm,如果肿瘤直径>10cm者称为巨块型:③结节型:病灶直径<5cm;④小癌型:单个病灶直径<3cm,或相邻2个癌结节直径之和小于3cm者。
(2)CT表现:
巨块型和结节型平扫表现为单发或多发、圆形、类圆形或不规则形肿块,呈膨胀性生长,绝大多数肝癌边缘有假包膜,因而多数瘤灶边界清楚,这是肝细胞癌CT诊断重要征象;弥漫型者结节分布广泛,境界不清;小肝癌表现为肝实质内3cm以下类圆形肿块。肿块多数为低密度,少数表现为等密度,或在脂肪肝背景衬托下可呈高密度。巨块型肝癌可发生中央裂隙状坏死而出现更低密度区,合并出血或发生钙化,则肿块内表现高密度灶;有时肿块周围出现小的结节灶,称为子灶。多数肝癌主要由肝动脉供血,增强扫描动脉期,病灶通常出现明显的斑片状、结节状早期强化;在门静脉期,门静脉和肝实质明显强化,而肿瘤无或仅少量门静脉供血则强化程度迅速下降;平衡期,肝实质继续保持较高程度强化,肿瘤强化程度则继续下降而相对低密度表现,增强过程表现典型的“快进快出”的特征性改变(图5-21-38)。少数肝癌为门静脉供血为主者,其强化方式相对不典型。如在动态CT系列图像上分别测定CT值并绘制时间-密度曲线,可见肝癌强化的时间-密度曲线呈速升速降形曲线。肿瘤的假包膜一般呈延迟强化表现。有门静脉、肝静脉或下腔静脉癌栓者则增强门脉期或静脉期出现静脉内低密度充盈缺损,部分患者可见转移性腹膜后和肝门区的淋巴结肿大,以及远处转移。
检查当天空腹,患者通常于检查前禁食6~8h,糖尿病患者血糖应控制在11mmol/L以内。静脉注射显像剂 18 F-FDG 5.55MBq/kg,休息约60min后进行PET/CT扫描。进入检查室前饮水500~800mL。
受检者检查时要求仰卧于检查床上,双手抱头,保持平静呼吸。CT扫描层厚5mm,必要时减薄为1.25mm;PET采用2D数据采集方式,层厚为5mm,扫描范围从肝脏上缘扫至肝脏下缘,包含全肝脏,一般采集2个窗位。数据采集后行图像迭代法重建,获得肝脏局部或全身的冠状位、矢状位和横断位的系列图像。
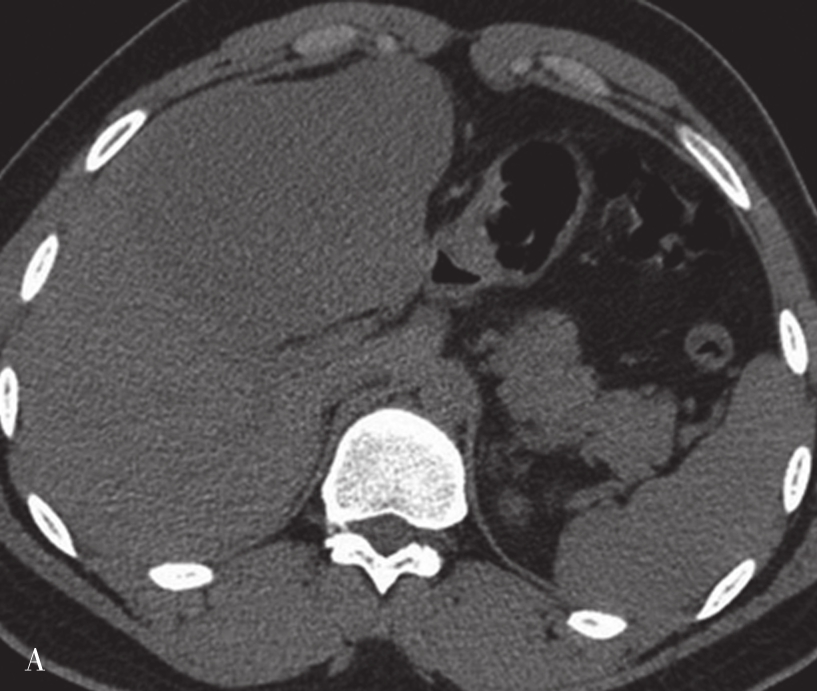
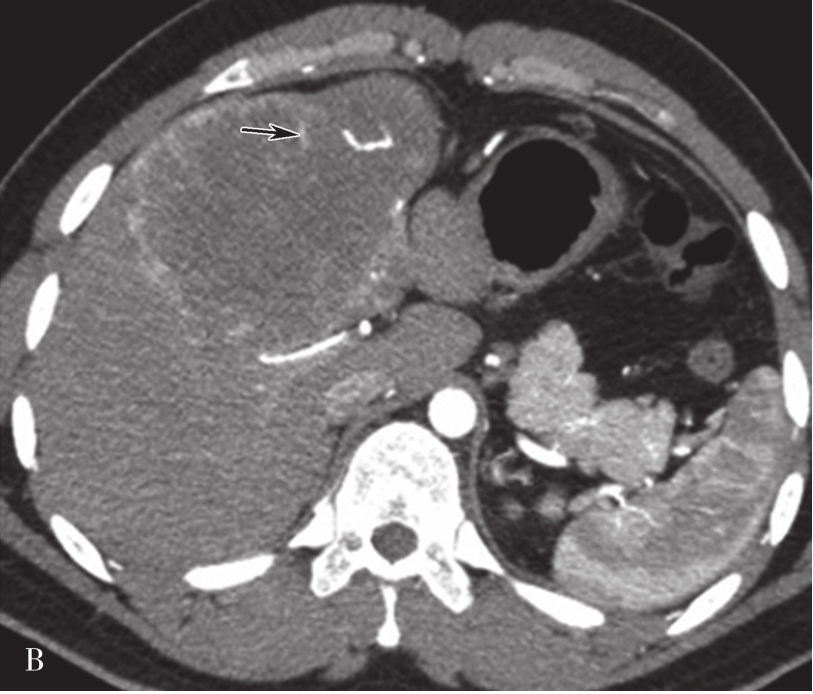
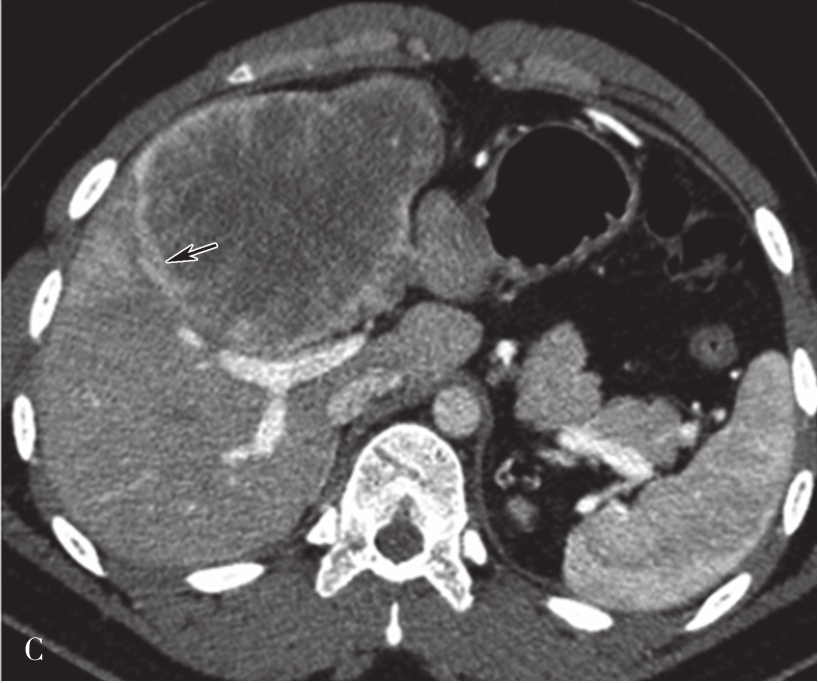
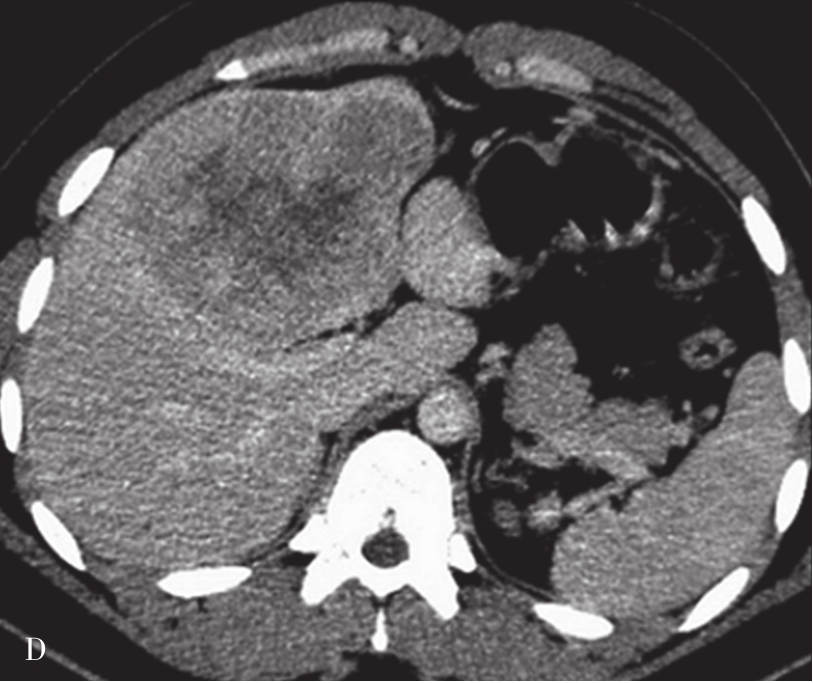
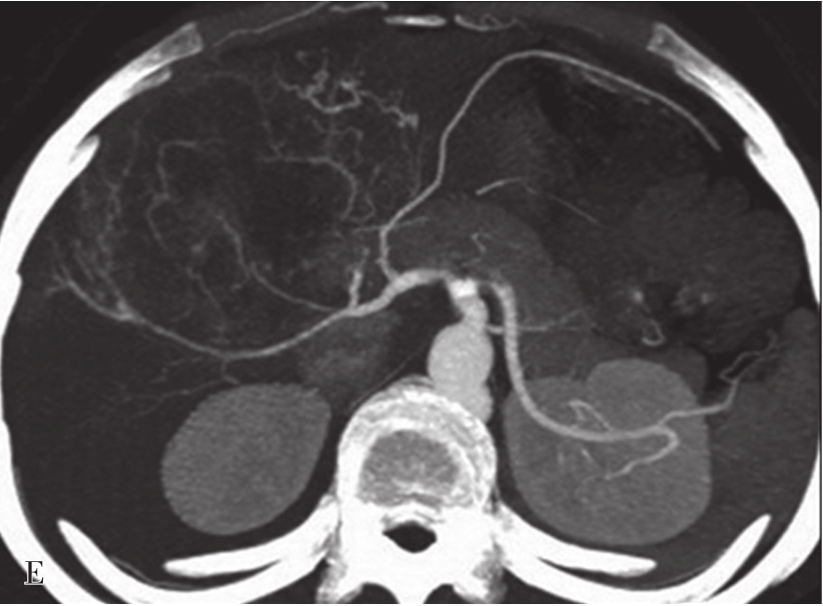
图5-21-38 HCC患者的CT平扫及增强图像
A.CT平扫图像,肝右前叶内可见巨块状稍低密度影,大小约10.5cm×8.3cm,CT值为36~46HU,其内密度不均,界限欠清,病灶内可见更低密度影;B.增强扫描动脉期,病灶不均匀强化,CT值约69HU,并见多量小刷状不成熟肿瘤血管影(箭头);C.增强扫描门脉期图像,病灶密度略低于肝脏实质,CT值约68HU,病灶假包膜厚薄不均(箭头);D.3min延迟期图像,随着时间的延长,病灶密度低于肝脏实质,CT值64HU,中央低密度区未见明显强化;E.动脉期最大密度投影法重建图像示肝动脉分支明显增多供应病灶
18 F-FDG PET/CT显像见肝脏放射性分布均匀、一致,SUV max 为2~3,其内未见异常放射学分布稀疏、缺损及浓聚改变。若采用 11 C-乙酸盐PET/CT显像肝肾皮质显影清晰,肝脏放射性分布均匀、一致,其内未见异常放射学分布稀疏、缺损及浓聚改变。
多数文献报道对于早期肝癌的诊断价值, 11 C-乙酸盐示踪剂要优于 18 F-FDG 示踪剂。 11 C-乙酸盐和 18 F-FDG示踪剂联合应用可以提高PET/CT显像对肝癌诊断的准确率,减少假阳性和假阴性,为肝癌患者的治疗方案选择及随访提供可靠的诊断依据。
肝细胞癌因肿瘤细胞分化程度不同而对FDG摄取的差别较大。主要由于正常肝细胞内葡萄糖-6-磷酸酶活性较高(K 4 较大),可使6-磷酸FDG在肝内去磷酸再成为FDG而逸出肝细胞。低分化和高恶性的肝细胞癌中K 4 往往减小,导致肝细胞癌灶FDG摄取活跃。而高分化和低恶性的肝细胞癌,则多少保留些正常肝细胞的功能,导致癌灶摄取FDG不高(图5-21-39)。因此,PET显像可以帮助评价肿瘤的分化程度,尤其在检查肝内、肝外转移灶具有独特的优势,以及疗效评判具有很大价值。联合应用FDG和 11 C-乙酸盐的PET/CT检查,可明显提高对肝癌诊断的灵敏度和特异性,但费时又费用高。目前,如何解决任何单一示踪剂的特异性不高及扫描中假阴性、假阳性的问题,是学者们研究的重点。
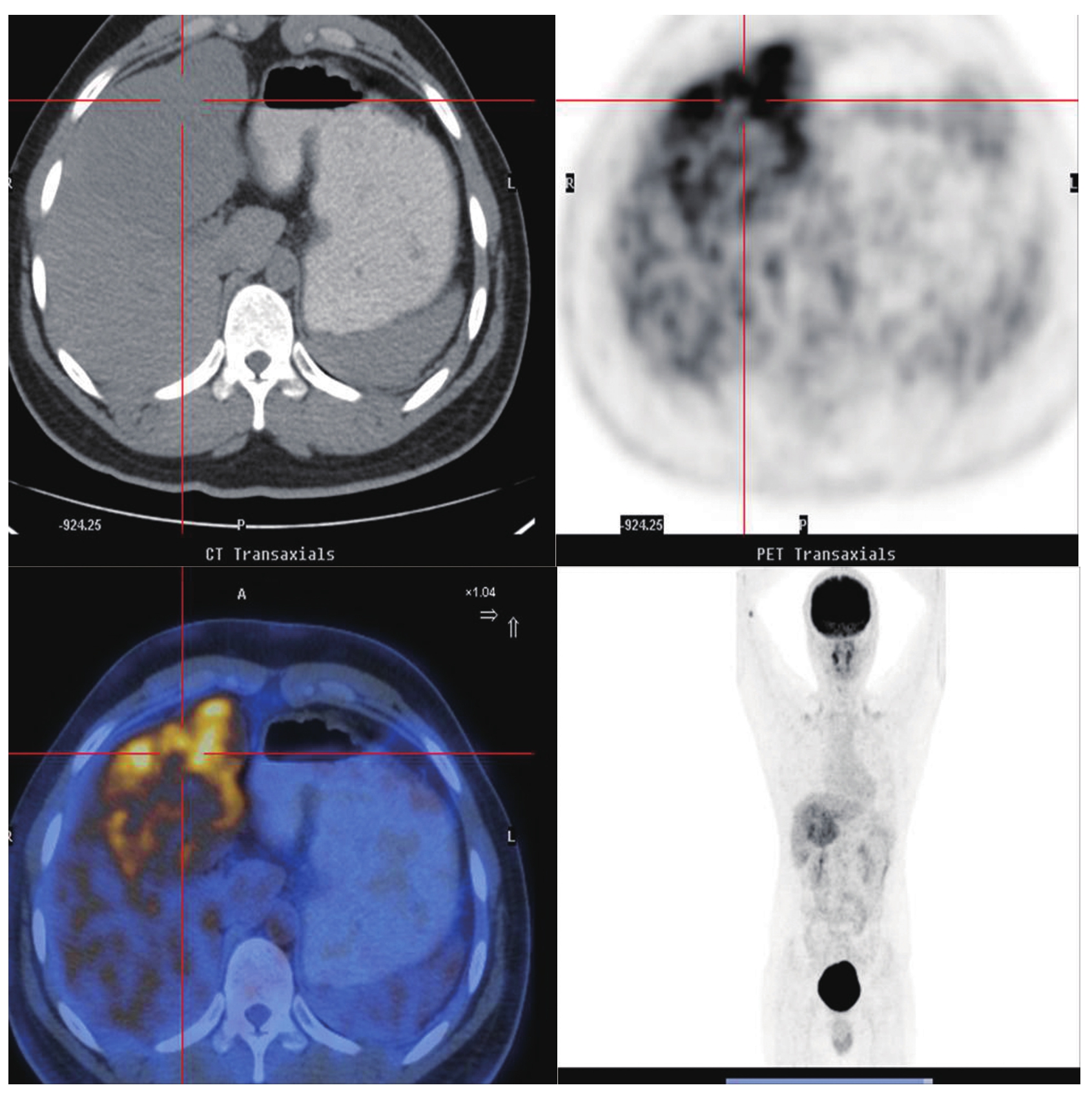
图5-21-39 HCC患者的 18 F-FDG PET/CT图像
肝左、右叶团块状、结节状稍低密度影,边缘尚清,较大者大小约10.7cm×8.8cm,CT值约45HU,PET显像见异常放射性浓聚,SUV max 7.1
检查前应空腹,一般禁食4~6h。对需行屏气扫描的患者,宜现训练屏气方法,并告知大约屏气时间。对需行增强患者可预置非金属套管针及抗凝导管。
常规采取仰卧位,将肝脏部分放置在体部线圈中央,用腹带加压上腹部,减少由腹式呼吸引起的伪影。扫描范围包括全肝即肝脏上缘至肝角下缘。平扫常用扫描序列:T 1 WI、T 2 WI横断面和冠状面,根据需要加矢状面,脂肪抑制T 1 WI、T 2 WI,T 1 WI双回波的正反相位、弥散加权成像(DWI)。增强扫描:一般选T 1 WI快速扫描系列,观察病灶增强后动脉期、门脉期、平衡期及延迟期等不同时相。注意:含钆对比剂应避免用于慢性、严重肾脏疾病、急性肾损伤、肝移植手术围手术期患者及孕妇,对碘过敏患者一般可行MRI增强检查。
MRI图像,正常肝脏蛋白质含量丰富,自由水含量较少,肝组织的T 1 、T 2 弛豫时间短,T 1 WI呈中等强度的灰阶,与脊髓及胰腺相仿,肝脏信号相对高于脾脏及肌肉(图5-21-40A);T 2 WI则低于脾脏(图5-21-40B)。肝内血管和胆管在T 1 WI通常表现为低信号,T 2 WI胆管呈高信号。第二肝门处3根静脉在肝实质衬托下呈“鸡爪状”向腔静脉聚集。正常肝总管及左右肝管一般不被显示,在扩张情况下表现为门脉前方与之伴行的管道结构,信号略高于门脉。MRI上观察肝脏是否正常,一般要从肝脏形态、大小、信号是否异常,肝的分叶分段是否俱全、轮廓是否光整、表现是否光滑、肝裂是否增宽、质地是否细腻、信号是否均匀、血管纹理是否走行自然等多方面去评价。
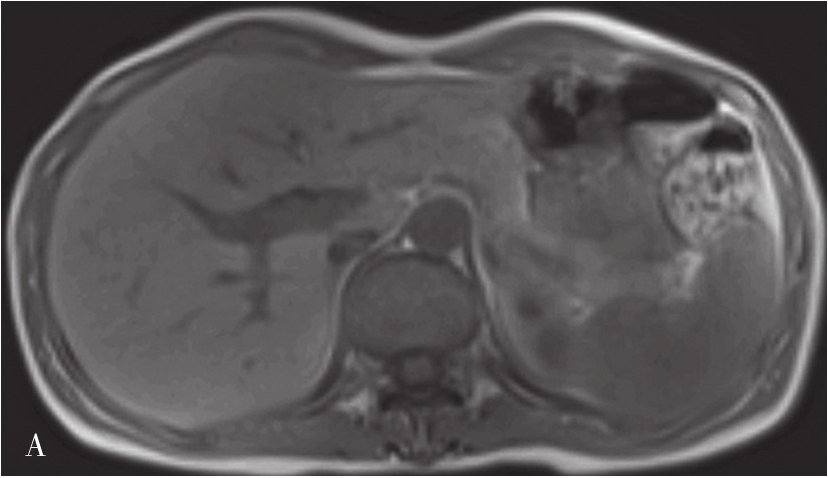
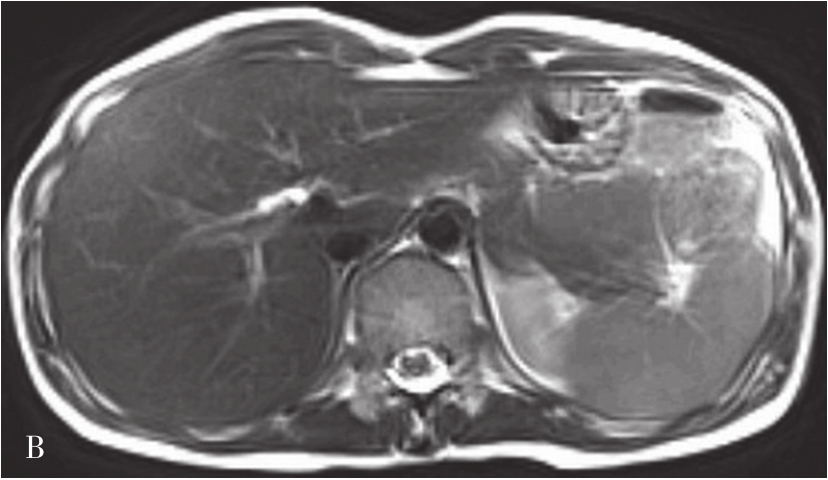
图5-21-40 正常T 1 WI及T 2 WI图像
A.正常T 1 WI图像;B.正常T 2 WI图像
临床怀疑病毒性肝炎患者合并肝硬化或肝癌,且无MRI检查禁忌证者可首选MRI检查。肝硬化早期即肝纤维化中早期阶段所引起的肝脏和脾脏形态学改变多数不明显,因此以解剖形态结构成像为主的常规影像检查无法提供有价值的诊断。近几年功能和分子磁共振成像技术快速发展,尤其是功能磁共振成像新序列的不断开发与应用,比如弥散加权成像(diffusion weighted imaging,DWI),体素内非相干性运动成像(intravoxel incoherent motion,IVIM)的 DWI序列和水通道蛋白(aquaporins,AQPs)DWI以及扩散峰度成像(diffusion kurtosis imaging,KDI)序列来研究肝纤维化分期。动态增强磁共振(dynamic contrastenhanced magnetic resonance imaging,DCE-MRI)、磁共振波谱成像(magnetic resonance spectroscopy,MRS)、磁共振灌注技术(perfusion weighted imaging,PWI)及磁共振弹性成像(magnetic resonance elastography,MRE)等新技术已逐步在临床上开展,多数已进入临床实质性的应用,在诊断和评估肝纤维化方面的应用前景将十分广泛,与肝穿活检有很好的一致性,优势日益突出,可应用于高危人群的监测随访,有良好的临床应用远景,有望成为真正无创的功能检查。除了功能和分子磁共振外,超声弹性成像也在临床应用较为广泛。
肝硬化的MRI表现(图5-21-41)在形态学改变方面与CT相似。肝硬化再生结节T 1 WI一般表现为稍高或等信号,T 2 WI表现为稍低信号或等信号,该信号改变与再生结节中含铁血黄素沉积有关,再生结节T 2 WI表现低信号,且DWI呈等或稍低信号较为特征,借此可与结节性肝癌或血管瘤鉴别。如发现低信号灶内出现高信号或原有的T 2 WI低信号再生结节灶转变为高信号,或DWI上信号增高,多提示结节癌变。门静脉高压表现为门脉主干扩张,其表现类似CT表现。侧支循环由于其内的流空效应,表现为明显扭曲扩张的血管或结节呈低信号灶。梯度回波序列则表现为高信号。无需使用造影剂即可识别,较CT平扫更具特征性。目前可通过静脉注射GD-DTPA后行门静脉MRI检查,可较清楚地显示扩张的门静脉,并能显示脾静脉及其门-体静脉周围侧支循环。
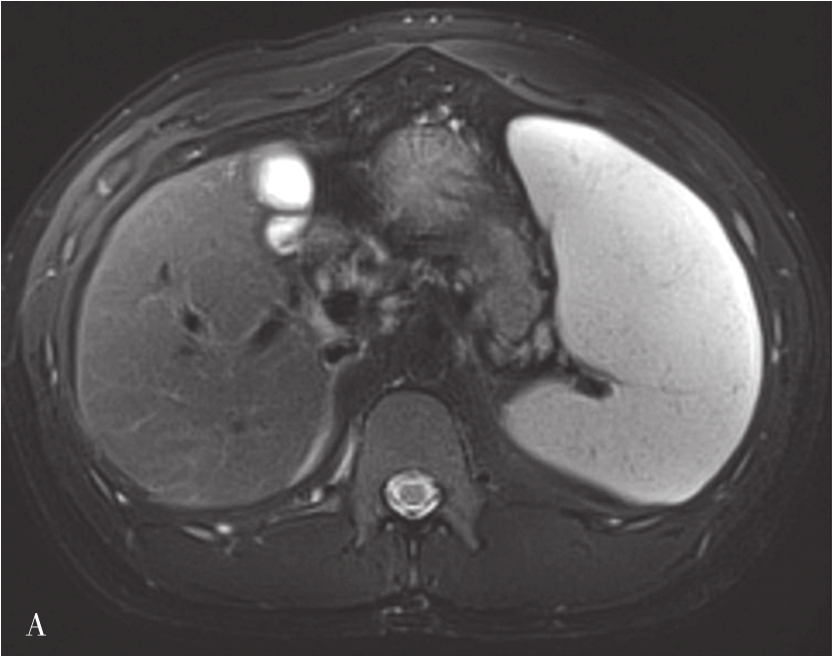
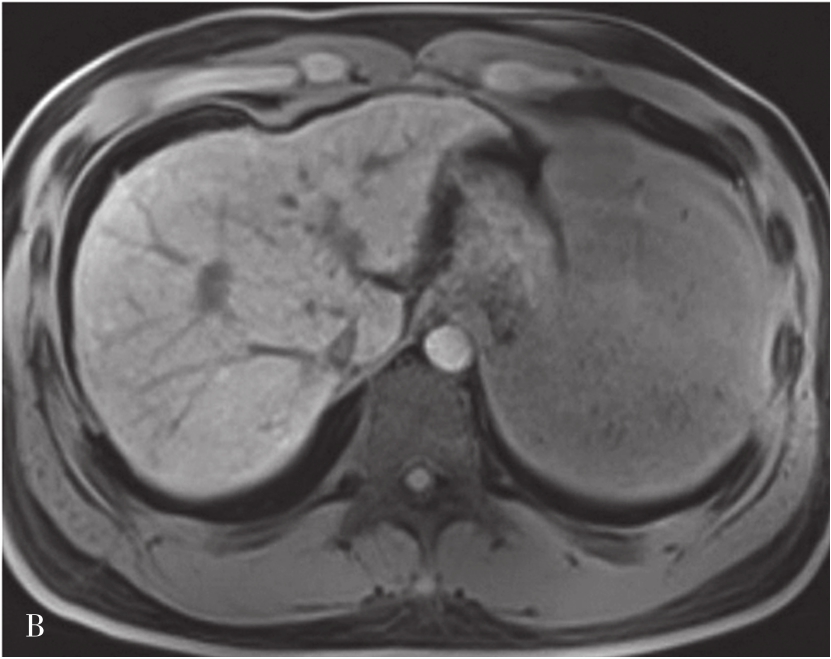
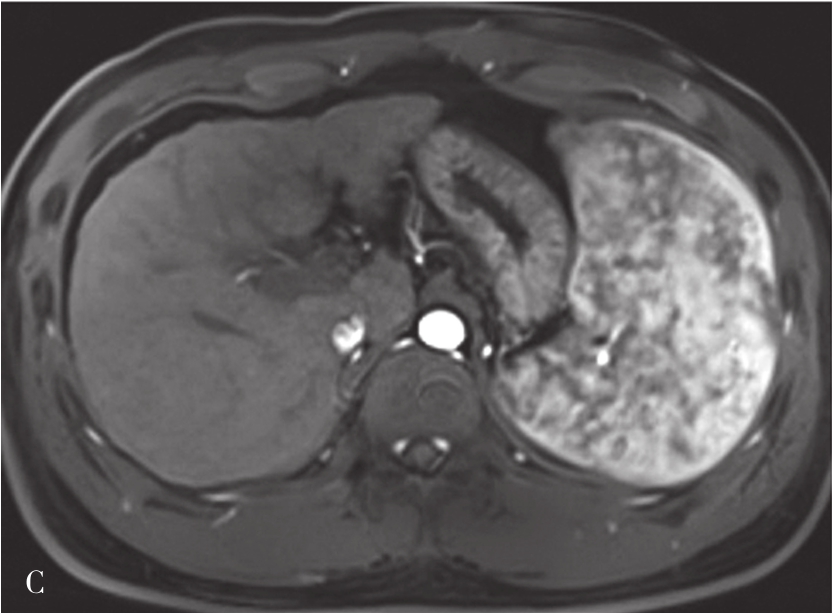
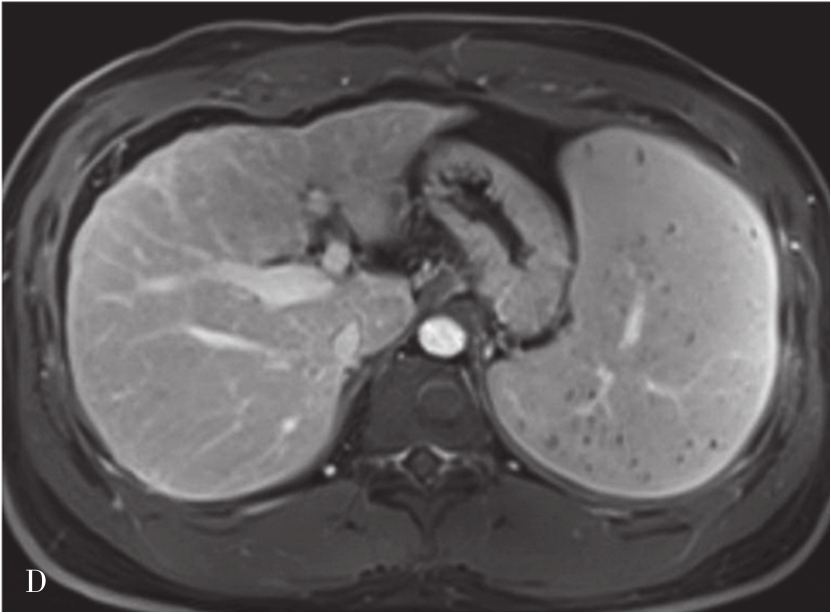
图5-21-41 肝硬化的MRI表现
A.肝硬化脂肪抑制T 2 加权像;B.T 1 加权像;C、D.增强扫描动脉期及门脉期图像:肝脏体积缩小,肝裂增宽,脾明显增大,T 1 WI图像可见多发略高信号肝硬化再生结节,门脉期示门静脉主干增宽
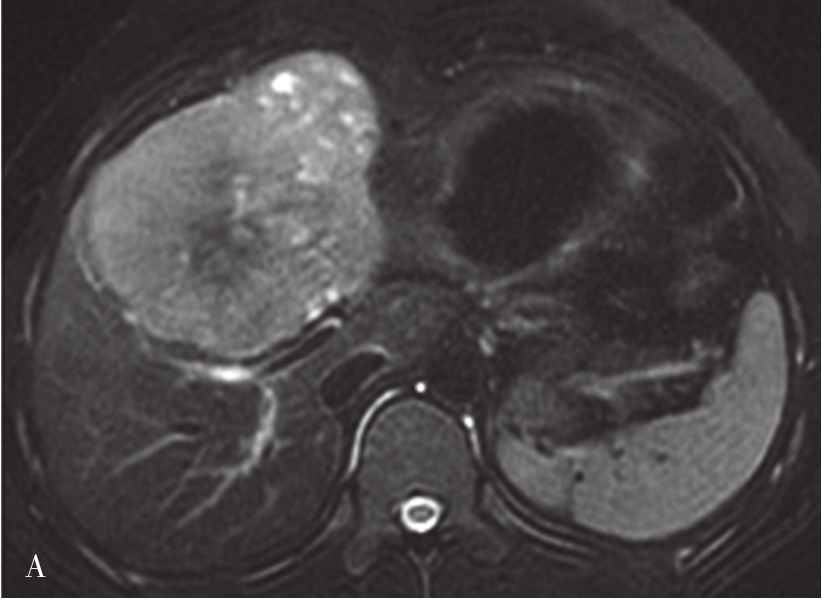
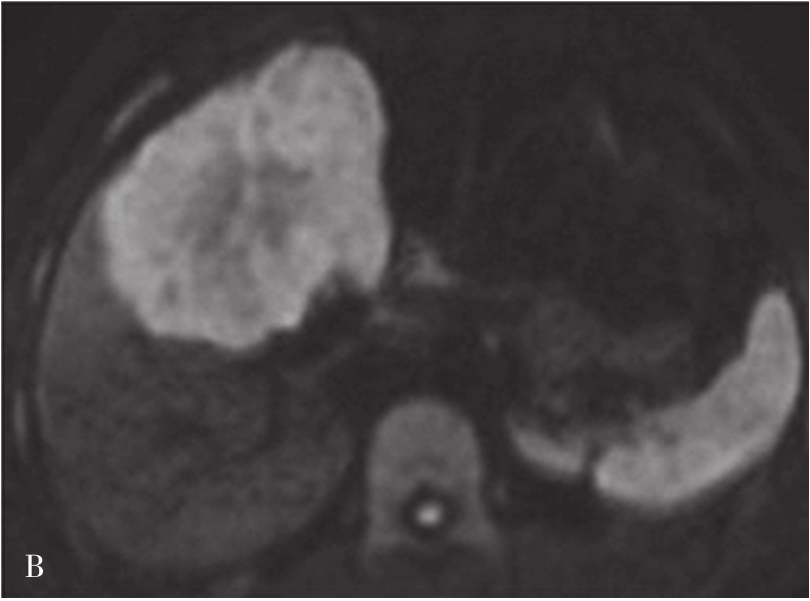
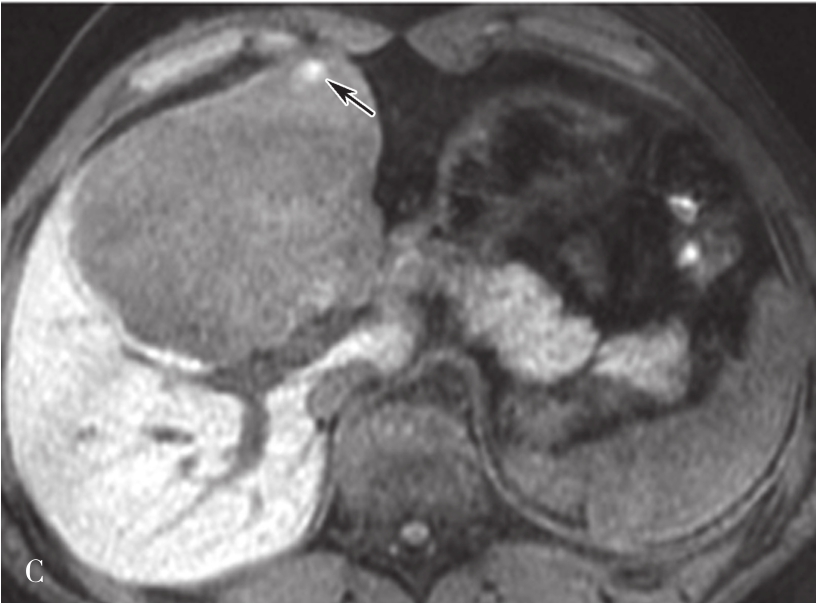
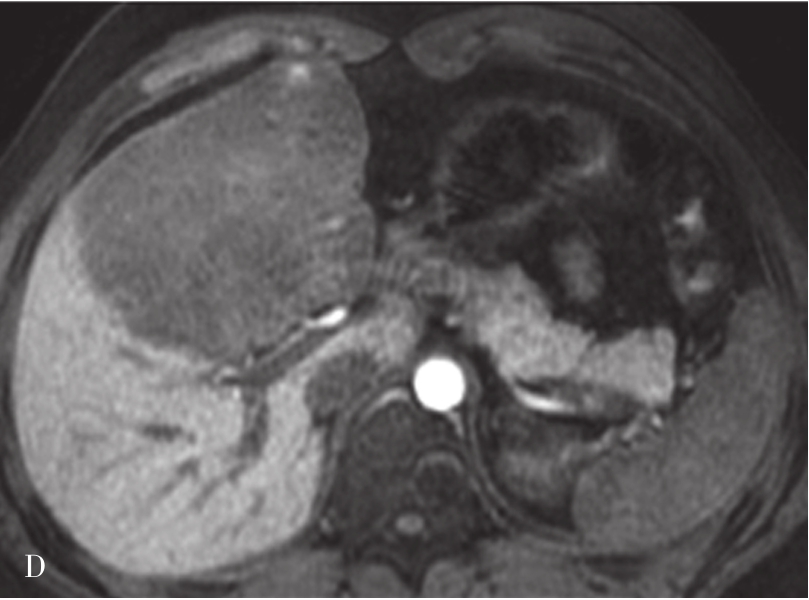
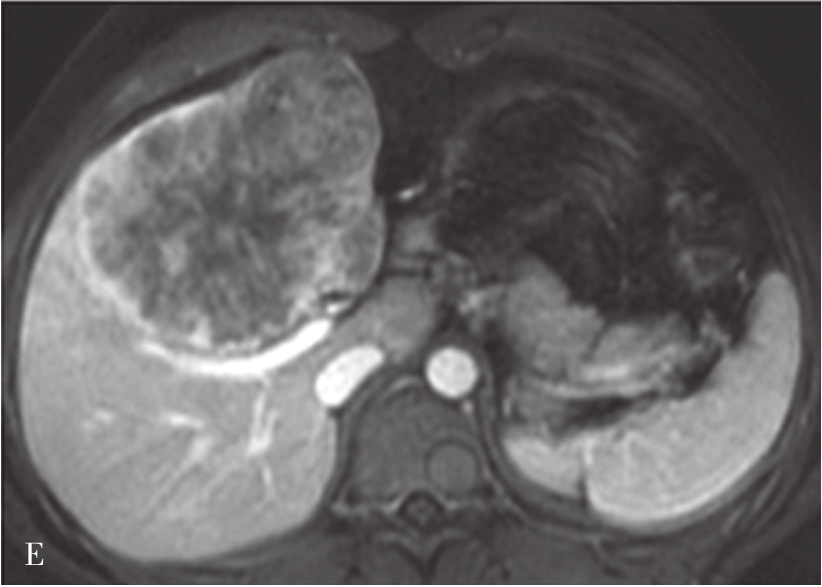
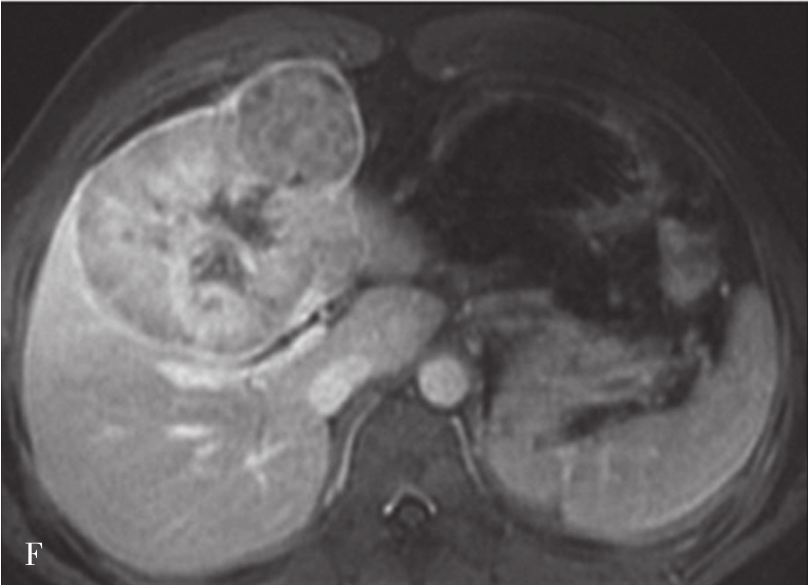
图5-21-42 HCC患者的MRI图像
A.T 2 WI脂肪抑制图像,可见肝右前叶内较大略高信号为主的病灶,内有点状更高信号影及中央低信号区,边界较清楚;B.600s/mm 2 时DWI图像,可见病灶为略高信号为主,中央略低信号;C.脂肪抑制图像,可见病灶为低信号影,边界较清楚,其内有一高信号影(箭头),为出血信号;D.增强扫描动脉期图像,可见病灶内轻微强化;E.可见门脉期图像病灶不均匀强化;F.可见延迟期图像病灶大部强化,中央无强化,假包膜清楚
HCC最常见的MRI表现为T 1 WI呈略低信号,T 2 WI呈略高信号,DWI呈高信号(图5-21-42)。有文献报道T 1 WI呈等信号者,多为分化较好的早期HCC,而脂肪变、出血、坏死、细胞内糖原沉积或铜沉积可导致病灶在T 1 WI上呈高信号,此外,在肝血色病基础上发生的HCC,由于肝实质在各脉冲序列图像上信号均很低,病灶一般都呈相对高信号。肿瘤假包膜可见于40%~70%的结节型和巨块型HCC。Gd-DTPA增强较为特征性的强化形式是对比剂“快进快出”,其原理为这些病灶70%的血供来自肝动脉,延迟相上出现宽0.5~3mm的包膜强化也颇具特征。采用特异性肝细胞摄取的对比剂,比如钆塞酸二钠(Gd-EOB-DTPA,普美显)不仅有其他钆类对比剂同样的动态增强外,在静脉注射10~30min内约有50%被正常肝细胞摄取,而不含正常肝细胞的HCC则很少或基本不摄取,而在肝特异性期呈低信号。有助于小HCC与肝硬化再生结节和其他良性病变的鉴别。大多数HCC在肝特异性期呈现相对低信号,但约10%的分化程度较好的HCC亦可呈等或高信号。
(许尚文)
核素显像(SPECT、PET显像)通过观测血流、功能、代谢、形态变化,为消化系统的肝胆器官、组织的生理功能和发病机制的研究、疾病的诊断等提供重要信息。通过定性、定位和定量分析,为肝胆疾病的诊断提供有效手段。迄今为止,对于病毒性肝炎的诊断主要依靠临床和实验室检查,核素显像一般不作为常规检查手段。但是,认识病毒性肝炎的核素诊断信息,有助于判断肝炎严重程度、明确有无肝硬化以及排除肝癌。
肝细胞自血液中选择性摄取放射性肝胆显像药物,并通过近似于处理胆红素的过程,将其分泌入胆汁,继而经由胆道系统排泄至肠道。应用肝胆显像可观察药物被肝脏摄取、分泌、排出至胆道和肠道的过程,取得一系列肝、胆动、静态影像,了解肝胆系的形态结构,评价其功能。
患者平卧,静注 99m Tc-EHIDA 74MBq,立即行肝胆动态显像。60s 1帧,共30帧,1h 行静态显像,若1h肠道无放射性,再分别于2、4、8、12、24h行延迟静态显像,观察肝摄取和胆道排泄功能,若肠道无显像,经治疗10~15天后再次肝胆显像检查。
按其动态显像顺序,可分为血流灌注相、肝实质相、胆管排泄相和肠道排泄相四期:
静脉注射后即刻至30~45s。心、肺、肾、大血管、肝脏依次显影。
注射后1~3min肝脏已清晰显影,并继续浓集放射性,15~20min达高峰。此期以肝细胞的摄取占优势。以后肝影逐渐变淡。
随着肝细胞将放射性药物分泌入胆道,注射后5min胆管内即可出现放射性。逐次显现左、右肝管、肝总管和胆囊管、胆囊影像。胆囊一般在45min内已显影。胆系影像随肝影变淡而更清晰,有时可见“胆道树”结构。
放射性药物被排至肠道。一般不迟于45~60min。使用胆囊收缩素评价胆囊收缩功能,若以0.2~0.3Ug/kg肌注,注射后15min排胆分数(GBEF)的正常值在35%以上。
由于乙型病毒性肝炎患者肝细胞受到不同程度损害,肝脏摄取和清除显像剂能力均存在障碍,乙型肝炎患者的肝管显像、胆囊显像、胆总管显像、肠道显像时间与正常人比较均显著延长,提示患者有明显胆道动力学异常。
淤胆型婴儿CMV肝炎核素肝胆显像表现为肝实质显像不清晰,心、肾放射性增加,肝脏持续显像,胆系显示不清晰,部分患者肠道延迟显像或肠道无显像,对肠道无显像者经治疗10~15天后再次显像检查均为肠道延迟性显像,随访黄疸逐渐减退,从而排除胆道闭锁。
弥漫性肝病、肝内占位性病变包括肝癌等肝脏可以呈不同程度的肿大,肝硬化晚期时肝脏外形缩小。当肝功能受损时,随受损程度的不同,肝影呈现程度不同的模糊不清改变。
肝脏是唯一接受双重血供的器官,流入肝脏的血量20%~30%来自肝动脉,70%~80%来自门静脉。在许多生理、病理和药物条件下,总肝血流量以及肝动脉和门静脉对肝血流的贡献均会发生改变,因而分别测定总肝、肝动脉和门静脉血流量以及门静脉-腔静脉分流分数具有重要意义。目前主要采用两类放射性药物,即能为肝脾主动摄取的
99m
Tc-胶体和不为肝脾主动摄取的
99m
Tc-高锝酸盐。
99m
Tc-胶体和
 显像评价肝血流动力学的主要优点是经济、无创、敏感、易获得,因而应用最广。
显像评价肝血流动力学的主要优点是经济、无创、敏感、易获得,因而应用最广。
作为总肝血流指标的胶体清除率正常人为0.369min -1 ,肝硬化者为0.28min -1 ,可见明显降低,但酒精性肝病者为0.368min -1 ,与正常人无显著差异。因此,总肝血流对肝病的诊断仅具有限的意义。目前一致认为AF(肝动脉灌注分数)和PF(门静脉灌注分数)诊断价值更高,许多患者在总肝灌注出现异常之前就有AF和PF明显改变。PF正常人为66%,而相应于血管造影Ⅰ、Ⅱ、Ⅲ、Ⅳ度的肝硬化患者则分别为52%、37%、15%和3%。经直肠门静脉分流指数(SI)对慢性肝病提供了较好的鉴别,正常人SI为4.1%,肝炎为7.1%,肝硬化为52.9%,有脑病者较无脑病者高( p <0.001),常常能发现无症状的轻度门静脉循环的异常。
测定总肝血流量,了解AF和PF,对门静脉高压术前患者筛选、预后估计和术后疗效随访均有重要价值。SI不但能测定门静脉循环的异常程度,某些患者甚至可在影像上显示门静脉侧支循环的部位。脾斜率/高度比值是观察脾血流出口阻塞的敏感指标。正常人该比值为-3.4±0.4,未手术的门静脉高压组和术后分流阻塞的患者明显增高(1.1±0.5),而术后分流通畅者比值正常。
无论原发或继发性肝癌,其生长和存活均依赖于动脉血供。因而通过动态闪烁血管显像可显示动脉血化增强的肝内新生物,确定其部位和范围,增强了常规肝显像诊断占位性病变的特异性。假若进一步计算AF,则可使敏感性明显增加。Leveson报道AF诊断肝转移癌的敏感性为96%。
以放射性浓聚区(“热区”)显示肝肿瘤病灶,是放射性核素肝肿瘤阳性显像的特征。其特点是利用与肝癌组织具有特殊亲和力的某些放射性核素、标记化合物或肿瘤特异抗体在肝癌组织中大量浓聚,病变组织呈阳性显像,直接显示肝癌,并显示其部位、大小、数量和形态,用于肝脏肿瘤包括原发性肝癌和转移性肝癌的定性和定位诊断。
目前用于阳性显像的“亲”肝肿瘤放射性核素有 67 Ga、 201 Tl及 111 In等。
约90%的肝细胞癌可选择性浓聚 67 Ga。 67 Ga在肿瘤内积聚的机制尚有待阐明。作肝肿瘤 67 Ga显像时特别注意对肝区放射性的观察,并与肝静态显像的结果相比较。正常肝组织本身可摄取 67 Ga,故可显示肝脏影像。肝静态显像所示放射性降低或缺损区有 67 Ga填充,其放射性等于或高于相邻正常肝组织者为阳性结果。
201 Tl也能在肿瘤组织中大量浓聚。尽管 201 Tl亲肿瘤的机制尚不清楚,但目前认为与细胞膜上Na + -K + -ATP酶有关, 201 Tl的生物学行为与K + 类似,因而能被摄入肿瘤细胞。 201 Tl肝肿瘤显像的注意事项同 67 Ga肝肿瘤显像。
标记抗肿瘤化疗药物如标记博来霉素,以及标记化合物 99m Tc-葡庚酸盐( 99m Tc-GH)、五价锝标记的二巯基丁二酸[ 99m Tc(V)-DMSA]、 99m Tc-甲氧异腈( 99m Tc-MIBI)等被用来作肝癌阳性显像。
免疫学和肿瘤相关抗原单克隆抗体技术的发展,促进了肿瘤放射免疫显像的迅速开展。近年来肿瘤放射免疫显像迅速成为研究热点,它是以放射性核素标记抗肿瘤抗体作为阳性显像剂的肿瘤定位、定性诊断方法。
18 F-FDG正电子发射断层显像除用于诊断肝癌外,亦用来估计肝癌患者的肿瘤存活情况和寻找肝外转移灶。恶性组织糖利用增强, 18 F-FDG是一种类似糖类的物质,可浓聚于代谢旺盛的肝肿瘤组织,摄入后用于PET成像。存活的肿瘤组织可主动摄取这一标记的参与代谢物质,而坏死组织则不能。使用另一种显像剂 11 C-乙酸可提高肝癌诊断的阳性率。Ho CL等联合应用 11 C-乙酸与 18 F-FDG扫描对肝癌诊断的效率进行对比研究,结果显示, 11 C-乙酸的探测灵敏度为87.3%, 18 F-FDG为47.3%。联合应用 11 C-乙酸与 18 F-FDG扫描,可克服 18 FDG PET诊断肝细胞癌上的不足,明显提高诊断原发性肝癌的灵敏度。胆管细胞癌病灶一般无 11 C-乙酸高代谢,却有明显的FDG摄取,能鉴别胆管细胞癌与肝细胞癌,提高PET检查的特异性。PET对肝癌的诊断、术后复发及转移灶的检测和分期,以及疗效评价具有重要的临床价值。
利用放射性核素标记的配体与相应的特异性受体相结合进行器官或组织显像,是近年来发展起来的核医学显像新技术。早在20世纪60年代后期就发现肝细胞膜上的肝结合蛋白(HBP)是血浆糖蛋白的受体,它们从肝血中结合血浆糖蛋白并将其转运到肝溶酶体。后来发现,血浆糖蛋白的碳水化合物部分多数终止于唾液酸,只有在酶的作用下去除唾液酸暴露处于倒数第二位的半乳糖残基,糖蛋白才能与HBP结合。因此,半乳糖残基是这种受体-配体结合的决定因素,应用 99m Tc-新半乳糖白蛋白或 99m Tc-半乳糖人血清白蛋白进行肝受体显像可以直接评价肝细胞功能,还可以应用于肝脏良、恶性病变的鉴别诊断和恶性病变恶性程度的评价,是核素肝显像的重要进展。
14 C标记的氨基比林进入体内后即经肝脏代谢被P450酶氧化产生甲醛,甲醛进一步氧化变成甲酸,最后以 14 CO 2 的形式呼出体外。氨基比林的代谢与P450酶的数量和活性有关,主要取决于肝细胞的数量。肝细胞数量的多少直接反映肝脏储备功能。受试者空腹,称体重后嘱呼气收集本底CO 2 ,然后口服氨基比林胶囊一粒(1μCi),收集2h后呼出的CO 2 。计算2h排出率。2h排出率>(7.5±1.5)%为正常。氨基比林试验能灵敏地反映各种原因引起的肝硬化、急慢性肝炎时的肝损情况,并可作为肝移植患者肝功能的评价。
(高荣光)
通过观察肝内胆管和血管的形态、位置及流动力学的状况是诊断肝胆管和血管疾病常用的方法之一,但常规的X线透视或摄片检查,不能显示肝内的胆管和血管。因此,需要将对比剂充盈到胆管或血管内,以显示肝内的胆管和血管,观察胆管和血管的位置、形态和胆汁或血流动力学情况,即为胆管和血管造影。肝脏炎症及其相关性疾病,如胆管炎、肝硬化和肝癌等,可有肝胆管和血管的异常,行胆管和血管的造影检查可显示肝胆管和血管的形态和病理生理的变化,为诊断和鉴别诊断提供依据。根据肝胆管和血管的解剖、生理和病理学特点,其造影的方法不同。
胆管是肝细胞分泌胆汁后排泄到肠道的通道。口服和静注对比剂,通过肝细胞分泌到胆管,或将对比剂通过插管直接注入胆管(如内镜逆行胰胆管造影和经皮肝穿刺法),都可显示胆管。前者为无创的检查方法,但对比剂进入胆道系统的量有限,且受常规X线分辨力的限制,胆管系统显示欠佳,现已被超声、CT和MRI检查所取代。插管将对比剂直接注入胆管,虽有创,但它可以清晰地显示胆道系统,还可观察胆汁的流动力学,为胆道疾病的微创治疗提供通道,仍是临床上常用的胆道检查方法。
通过口服对比剂,经胃肠道吸收后,通过肝细胞排泌到胆管和胆囊内,以显示胆管和胆囊的方法。具体方法为:检查前一天,患者宜吃多脂肪的饮食,使胆囊内陈旧胆汁排出,晚8时口服蓖麻油25~30mL,以排净大肠内的粪便。检查时再口服国产碘番酸3g,服药后14h取常规俯卧位拍胆区片,胆囊显影满意后,进脂餐,此后患者取俯卧右后斜10°~20°位置,分别于半小时、1h、2h及3h拍胆区片,观察胆囊排出功能和胆总管显影情况。正常胆管在X线片看起来边缘光滑、整齐,可以看到左右肝管和一些小分支,胆总管的直径不超过1cm,向下逐渐变细如鹅毛管状,还可以看到造影剂进入十二指肠。胆囊常为茄形或梨形致密影,长7~10cm,宽3~4cm,位于右上腹肝下缘下方(图5-21-43)。如胆管显影不良通常可判断为病理性胆管。对于严重肝功能损害、黄疸为禁忌证,不宜进行此检查。
将对比剂从静脉注入体内,肝脏能将这种对比剂经胆汁排入胆道,而使胆管显影。目前常用的胆道对比剂为胆影葡胺。本法进行胆囊和胆道造影往往比口服法要清楚。适用于口服造影时胆囊不显影者、有胃肠道疾病造影剂不易进入肠道或在肠道内不能很好吸收者。具体方法为:检查前的准备与口服法相同。检查时将对比剂采用滴注或者推注的方法,在20min内注入静脉,每隔半小时摄片,一共4张。如患者未做过胆囊切除,胆囊显影良好,可进脂肪餐,然后再拍片,以观察胆囊的收缩情况。一般在注药后30~40min胆总管及肝总管显示较为清楚,以后渐不清晰。于1~2h胆囊显影良好,密度均匀。正常胆管和胆囊的形态同口服法造影(图5-21-44)。静注法适用于观察胆管形态以及口服法胆管造影不良者。对于碘过敏、甲状腺功能亢进、严重心肝肾功能不全和恶性肿瘤引起的重度阻塞性黄疸者为禁忌证。
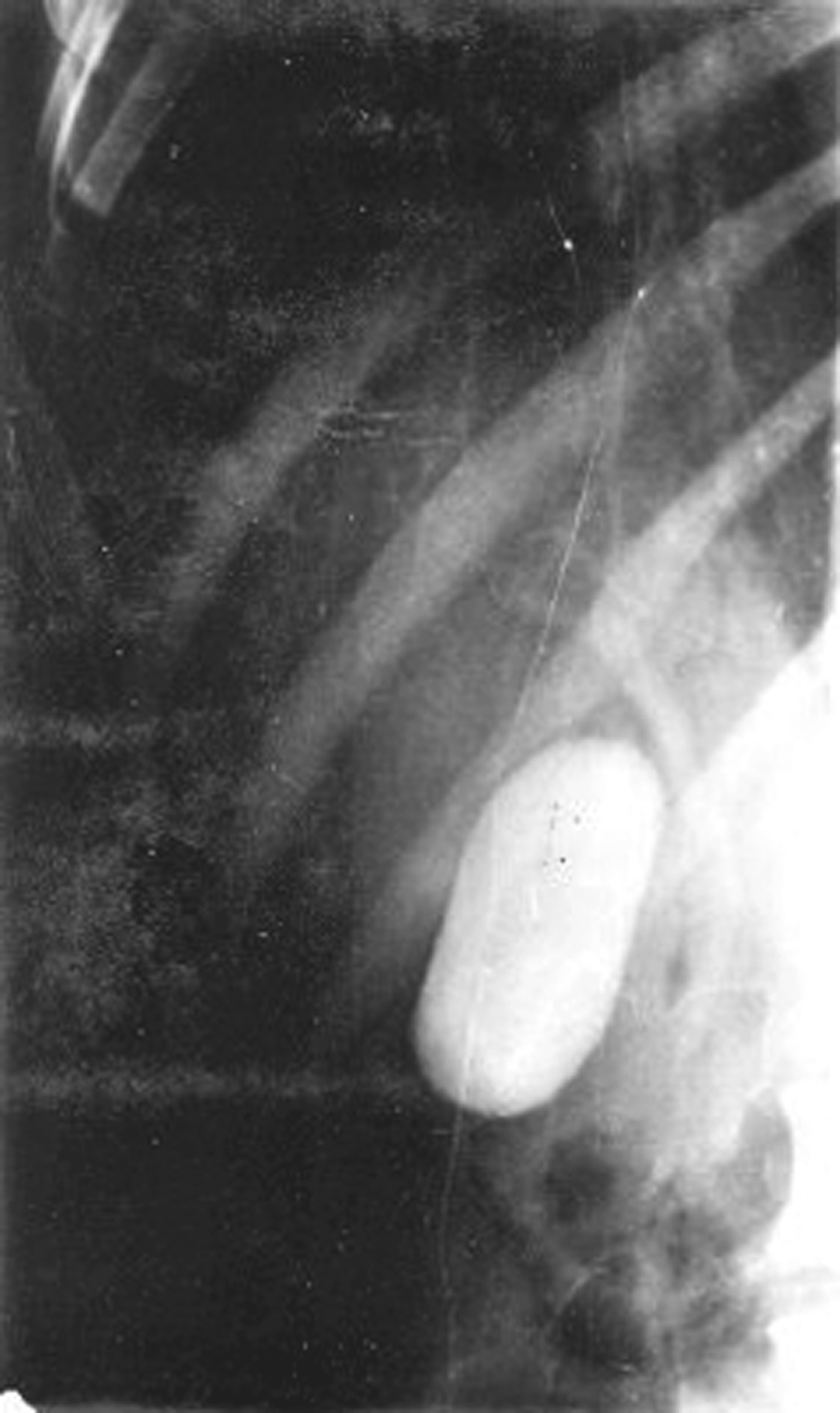
图5-21-43 口服法胆道造影
口服胆囊造影下可显示胆囊大小形态及肝总管、胆总管,二级分支及以下显影欠清晰
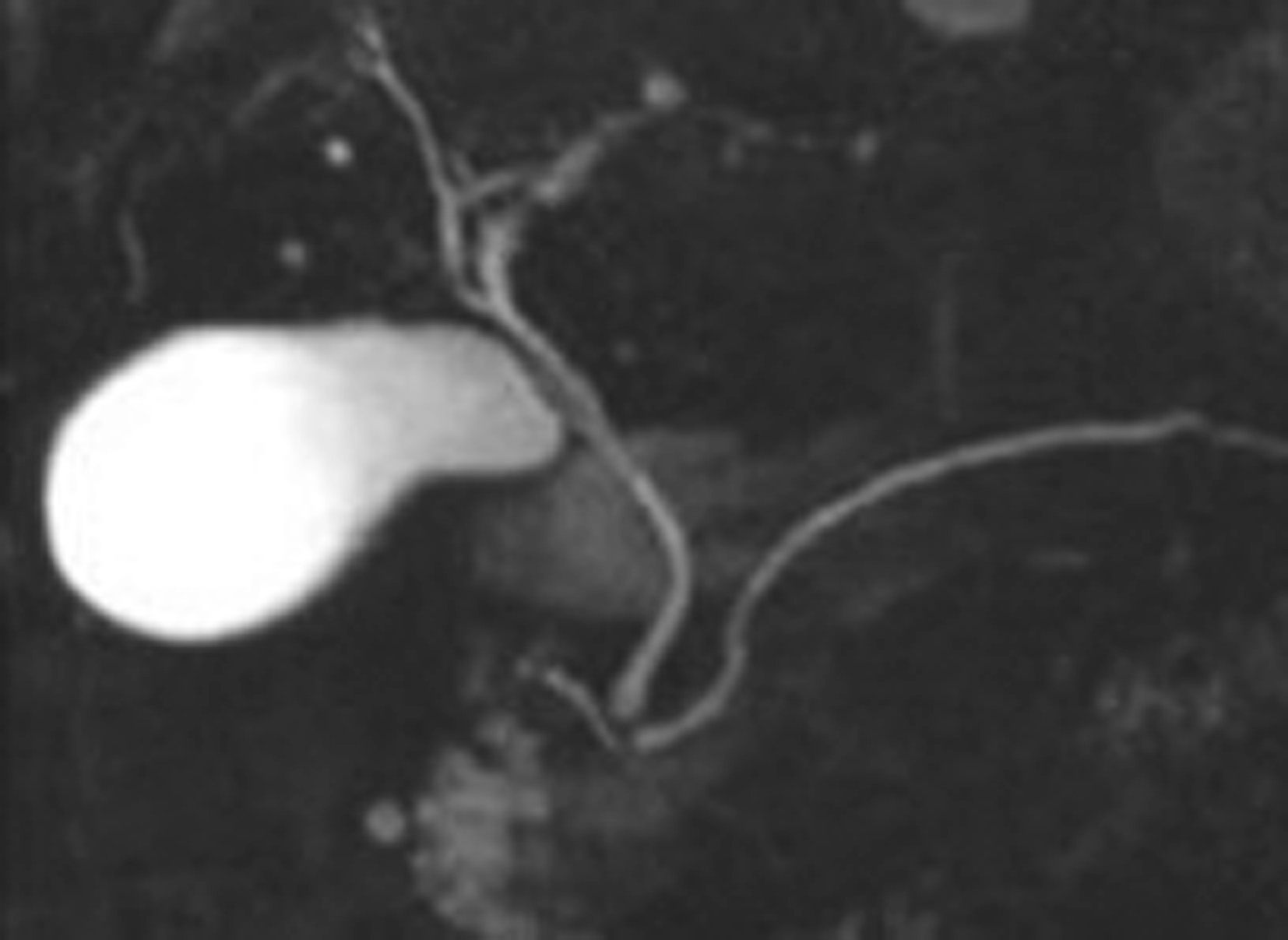
图5-21-44 静注法胆道造影
静脉胆道造影下可清晰显示胆囊及胆系树枝状影像
内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)指将十二指肠镜插至十二指肠降部,找到十二指肠乳头,由活检管道内插入造影导管至乳头开口部,注入造影剂后进行X线透视和摄片,以显示胰胆管的技术。临床上是显示胰胆管的主要方法之一。它使成像的胆管系统可达到最大可能的范围,若插管成功,注入造影剂,可见内镜逆行胰胆管造影(图5-21-45)。同时可以进行各种治疗程序。如胆总管结石的诊疗中,以往需要外科手术治疗,存在手术创伤大、术后恢复慢、结石残余或复发等难题。在采用ERCP后只需通过十二指肠乳头小切口,即可对肝外胆管结石(图5-21-46)进行碎石、取石、清理等操作。ERCP最早的报道在1968年,随着器械和技术的进步,而在临床上得到推广应用。目前,临床上应用ERCP并不是单纯为了诊断胆管系统的疾病,因为已有了更微创和有效的手段,如磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)和超声内镜(endoscopic ultrasound,EUS),而主要应用在处理胆道的疾病。适应证主要有胆道梗阻引起的黄疸,如急性胆管炎、胆总管结石、胆道狭窄、胆漏、胆道出血和Oddi括约肌功能紊乱等。内脏穿孔为绝对禁忌证,凝血功能异常、无并发症的急性胰腺炎和心肌梗死都是相对禁忌证。以下简述其技术方法:
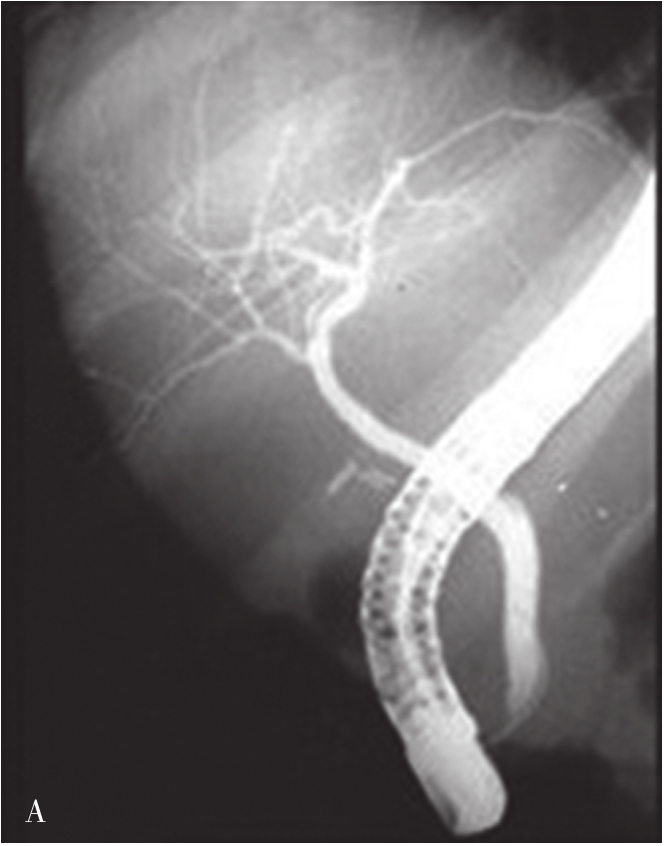
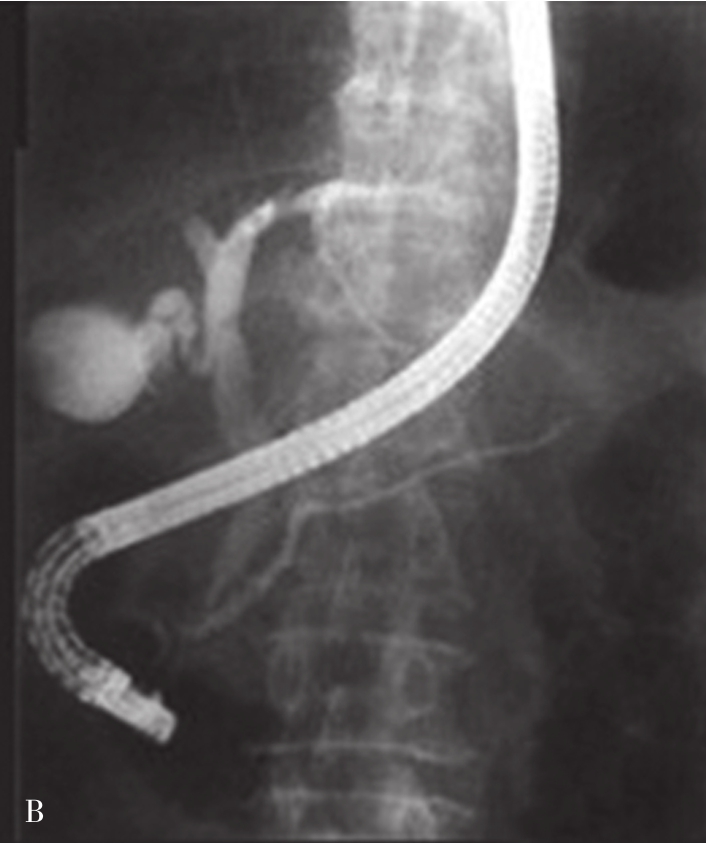
图5-21-45 内镜逆行胰胆管造影法示胰胆管
可见胆囊及胆系树枝状影像,并清晰显示胰管走行
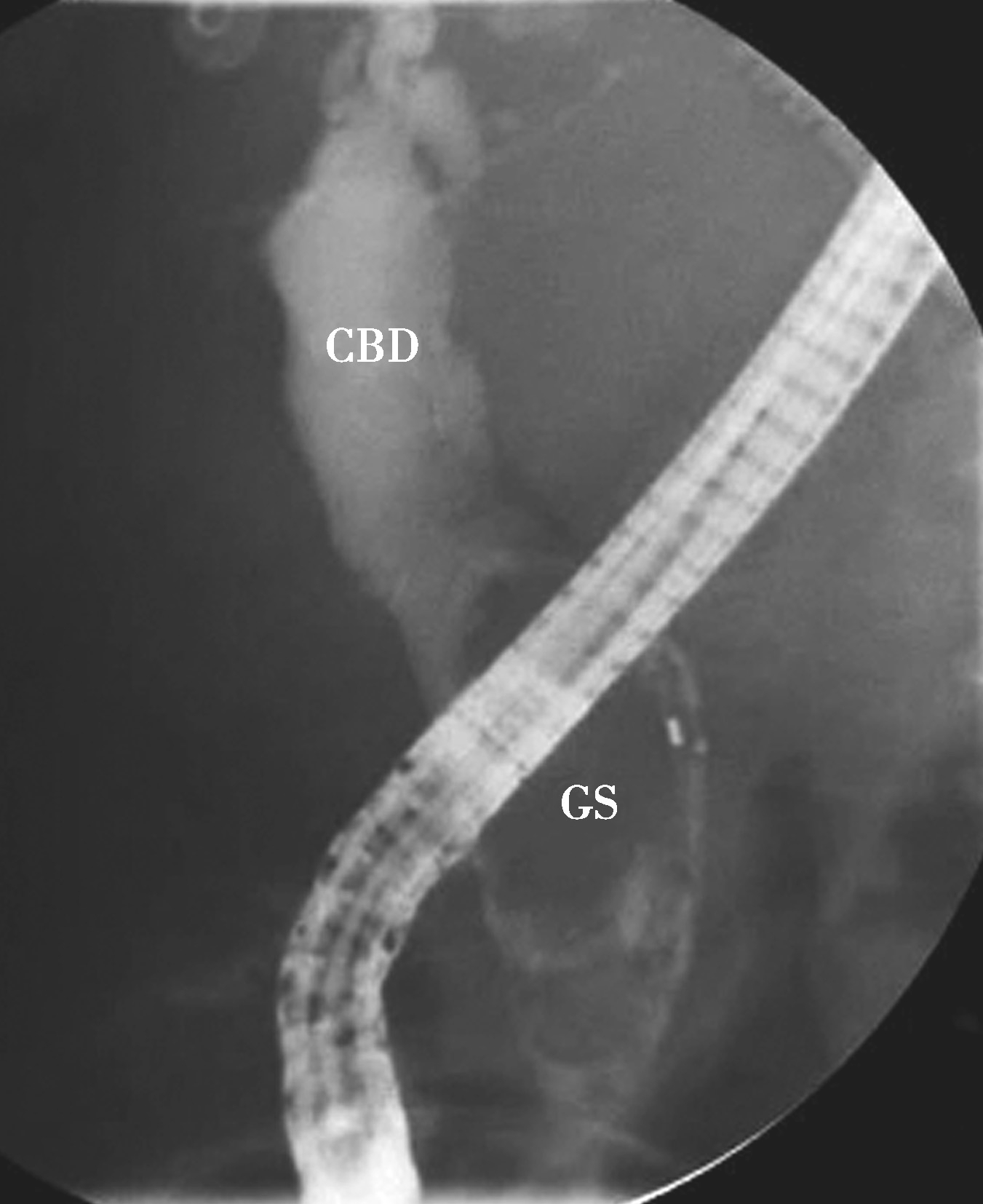
图5-21-46 内镜逆行胰胆管造影法示肝外胆管结石
可见胆总管(CBD)内结石(GS)影像(直径大于2cm)
仔细复习患者的临床资料,包括所有的影像学检查。术前8h禁食、禁水。告知手术的必要性、基本步骤和风险,并签署手术同意书。选择合适的麻醉和镇静的方法,并签署同意书。对有胰胆管梗阻的患者,可以术前预防性应用抗生素。监测生命体征的变化,包括:心率、血压、呼吸和肢端血氧饱和度等。
ERCP采用有侧视(side-viewing)的十二指肠镜,经口送入十二指肠后,通过灯光观察到十二指肠乳头,并且可以侧视孔插管进入胆总管内。操作需要在透视下完成。胆管插管成功后,可以注入造影剂显示肝内外胆管(图5-21-47)。正常胆总管直径小于6mm。胆囊切除术后和年龄大于70岁者,胆管直径可能达到9~10mm。也可以引入导丝和其他器械,以进行诊断和治疗。应用括约肌切开器切开十二指肠乳头,有利于其他器械引入到胆管内。
有经验的内镜医生ERCP的成功率可达90%~95%,行Billroth Ⅱ胃肠吻合术后,技术成功率可下降到60%。ERCP不成功的患者,可以选择经皮肝穿刺胆道造影。ERCP也是一种有创的手段,且可发生并发症,最常见是急性胰腺炎,发生率为2%~5%。另外,还可能有出血或穿孔等,发生率均低于1%。
经皮肝穿刺法(percutaneous transhepatic cholangiography,PTC):即使用细穿刺针,自右腋中线或剑突下径路,在超声或X线监视引导下,穿刺入肝内胆管,再注入造影剂以显示肝内外胆管,可了解胆管的形态,胆管病变部位、程度和范围,观察胆汁的胆管内流动和分布的情况,为诊断胆管病变提供影像学证据(图5-21-48)。PTC是一种具有悠久历史的检查方法,最早于1937年被报道。但随着器材和引导技术的进步,直到近30年在临床上才得到广泛重视。PTC主要用于梗阻性黄疸患者,以了解胆管梗阻部位、范围和原因。不能纠正的出凝血功能严重障碍是本术的禁忌证。近期心肌梗死病史,间位结肠和大量腹水患者是相对禁忌证。本术系有创性检查,亦可造成腹腔出血、胆瘘、胆汁性腹膜炎等并发症。目前,临床上已少用PTC单纯诊断胆管病变,而是为后续的经皮肝穿刺胆道引流(percutaneous transhepatic cholangial drainage)或进行其他的胆道疾病的处理打下基础。以下简述其技术方法:
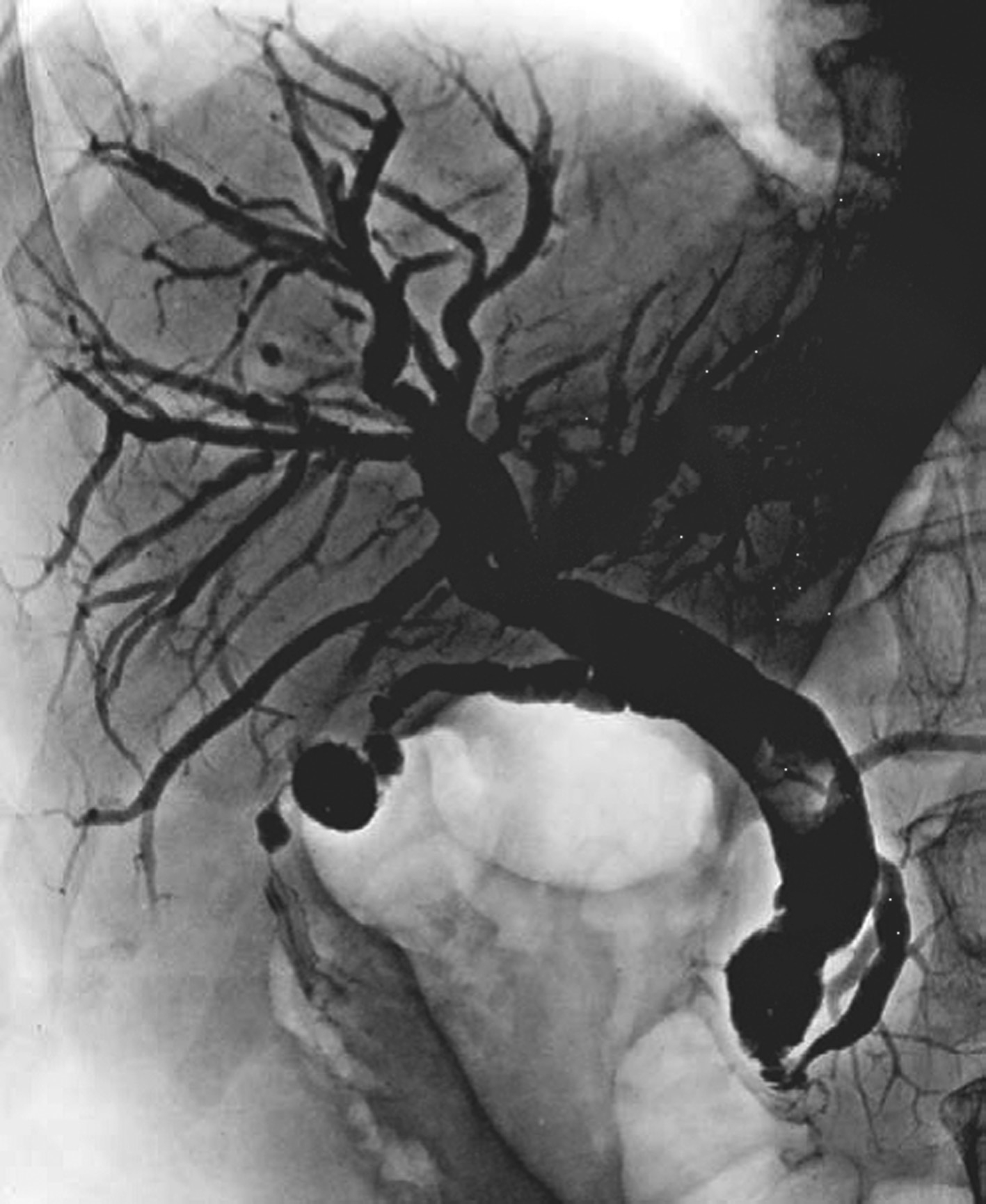
图5-21-47 ERCP拔除内镜后显示肝内外胆管及胰管
拔除内镜后可见肝内外胆管和胰管显影。胆总管内结石影,直径大于6mm
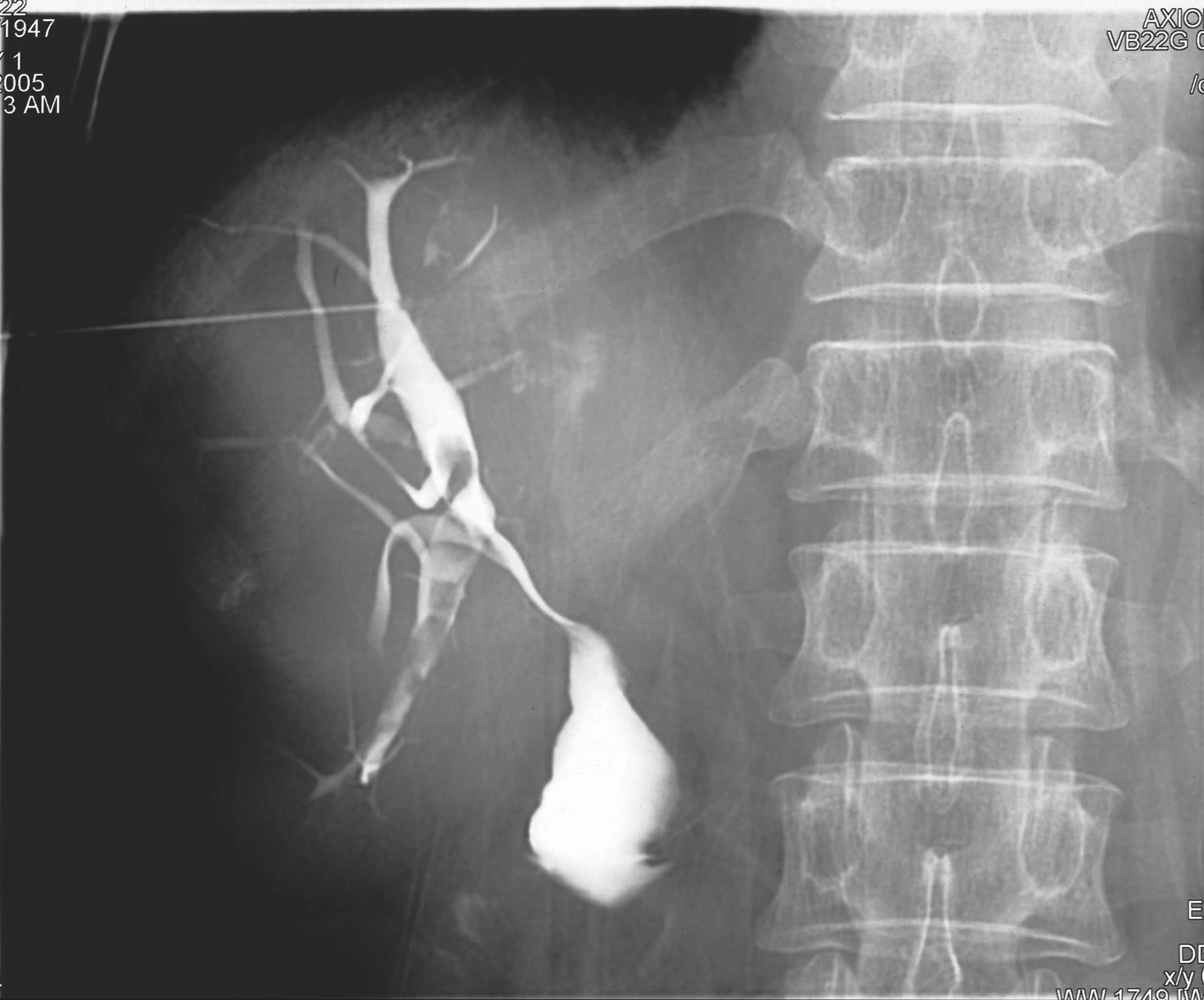
图5-21-48 经皮肝穿刺法胆管造影
胆囊切除胆肠吻合术后,经皮肝穿刺法(PTC)获得的肝内外胆管形态影像,并可观察到肝胆管内结石和胆汁在胆管内流动的情况。
基本与ERCP相同。行本术还需密切关注患者的出凝血功能。凝血时间延长者,术前予以改善,如给予维生素K,输注新鲜血浆和血小板等。
皮肤进针点的确定多优先选择右腋中线,如果患者扩张大胆管主要在左叶,或者大量腹水和间位结肠等原因,可以选择剑突下入路。常规消毒铺巾局麻后,选用21gauge(0.7mm)穿刺针(Chiba针)穿刺外周(3~4级分支)的扩张胆管。穿刺可选择超声或者透视引导下完成。成功后,注入少量的对比剂,显示胆管及其对比剂的流动方向。明确后引入导丝和导管,再次注入对比剂,以观察肝内外胆管的情况。通道亦可以扩张后(可达12~16F),引入其他器械,以进行诊断和治疗。
胆管扩张的患者成功完成PTC,可达95%以上。采用超声引导,或者结合透视引导,成功率会提高。胆瘘和胆道出血是本术较为常见的并发症。胆管内留置合适的引流管和建立通畅的胆汁引流途径,可以减少其发生。提高一次穿刺胆管的成功率是减少并发症的关键。穿刺时造成肝动脉或者门静脉的损伤,形成肝动脉胆道瘘或者门静脉胆道瘘是胆道出血的常见原因。肝动脉胆道瘘者,需要行肝动脉造影,明确后行栓塞治疗。肝门静脉胆道瘘者多可自愈。因皮肤或者肠道的细菌进入胆道,可造成感染,严重者可造成败血症和感染性休克。需要建立良好的胆汁引流通道和抗生素治疗。
两者均为插管进入胆管内,注入对比剂,以直接观察肝内外胆管的方法。一般认为ERCP较PTC具有更加小的侵袭性,而PTC具有较高的成功率,两者具有很强的互补性。多数学者认为ERCP作为一线的方案。但胆管梗阻部位较高,如肝门部或者2级以上分支,或者已行胃肠道胆道手术后解剖位置改变者,可首选PTC。
无创的影像学检查方法,如超声、增强CT和MRI等,可以较清楚地显示肝脏的血管。但诊断的“金标准”仍然是肝的血管造影。血管造影可以更加清晰和全面显示肝脏的血管,且可以观察血流动力学情况,为诊断提供更加准确和全面的信息,亦可以为治疗建立通道,在临床上得到了广泛的应用。
采用Seldinger技术穿刺股动脉成功后,插管入肝总动脉,行动脉造影,常规采用非离子碘对比剂,以6~8mL/s,总量20~30mL的速率注入,并连续摄片12秒以上,以观察肝总动脉及其分支,动脉供养器官的实质期和静脉回流的情况(图5-21-49)。如需要进一步观察肝脏的情况,可以超选择插管进入肝固有动脉或者肝左、右动脉。如经股动脉插管不成功,亦可选择经肱动脉和桡动脉等上入路。显示肝动脉和肝实质及回流静脉的情况,可有:①常规X线摄片检查,已被数字减影血管造影(digital subtraction angiography,DSA)取代;② DSA,是应用计算机辅助成像。动脉插管成功后,注入造影剂之前,首先进行第一次成像,并用计算机将图像转换成数字信号储存起来。注入造影剂后,再次成像并转换成数字信号。两次数字相减,消除相同的信号,得知一个只有造影剂的血管图像。这种图像可以更清晰和直观显示血管结构。显示血管的情况,除插管进入动脉后注入对比剂外,亦可经静脉注入对比剂后,根据对比剂的循环时间观察其显示的相应的血管。如CT动脉造影(CT angiography,CTA),将CT增强技术与薄层、大范围、快速扫描技术相结合,通过合理的后处理,清晰显示全身各部位血管细节,具有无创和操作简便的特点,对于血管变异、血管疾病以及显示病变和血管关系有重要价值。
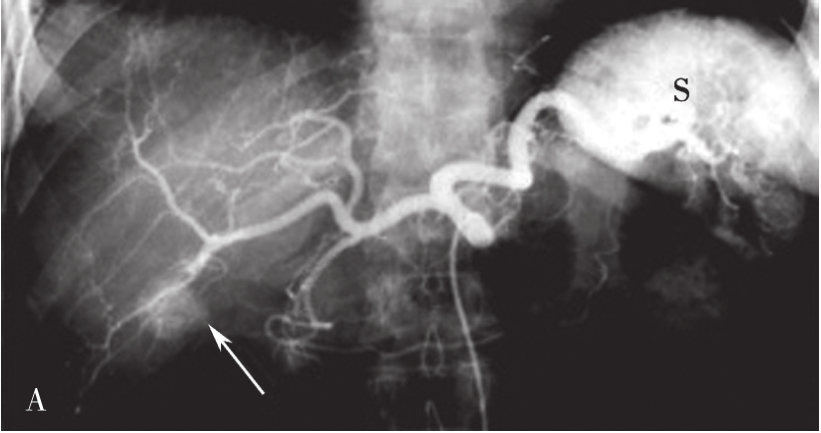
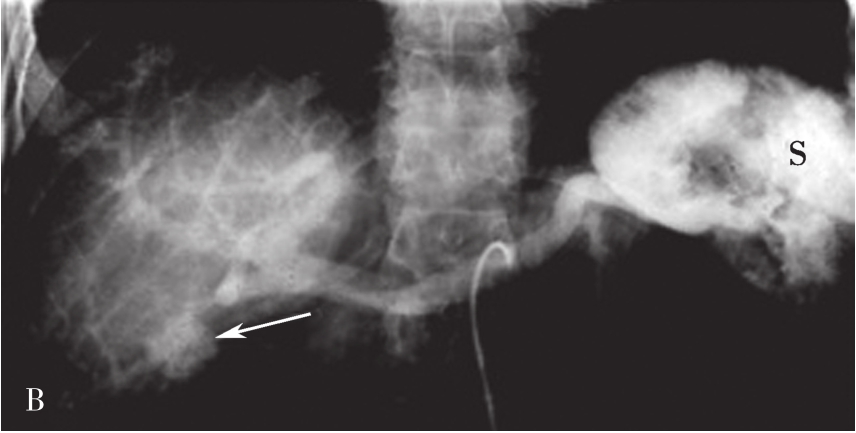
图5-21-49 经股动脉穿刺行肝总动脉造影
A.可观察肝总动脉及其分支,动脉期可见肝右下富血供性占位病变(白色箭头);B.静脉期可见脾静脉和门脉干及其分支显示
本节主要介绍的是临床上常用的DSA。其适应证主要是:①观察肝脏动脉和门静脉等血管的病变和解剖变异,如血管畸形、动静脉瘘、血管狭窄或动脉瘤。②为肝脏占位性病变的位置和性质的诊断提供影像学证据(图5-21-50)。对富血供的病变,有可能发现直径小于5mm的病灶。③为经肝动脉的治疗建立了途径。如肝肿瘤的化疗栓塞、出血动脉的栓塞等。其禁忌证是相对的,主要是出凝血功能严重障碍和肾功能衰竭。肝动脉造影虽然是有创的检查,但其严重并发症的发生率低于1%。主要与动脉穿刺插管、对比剂的应用等相关。
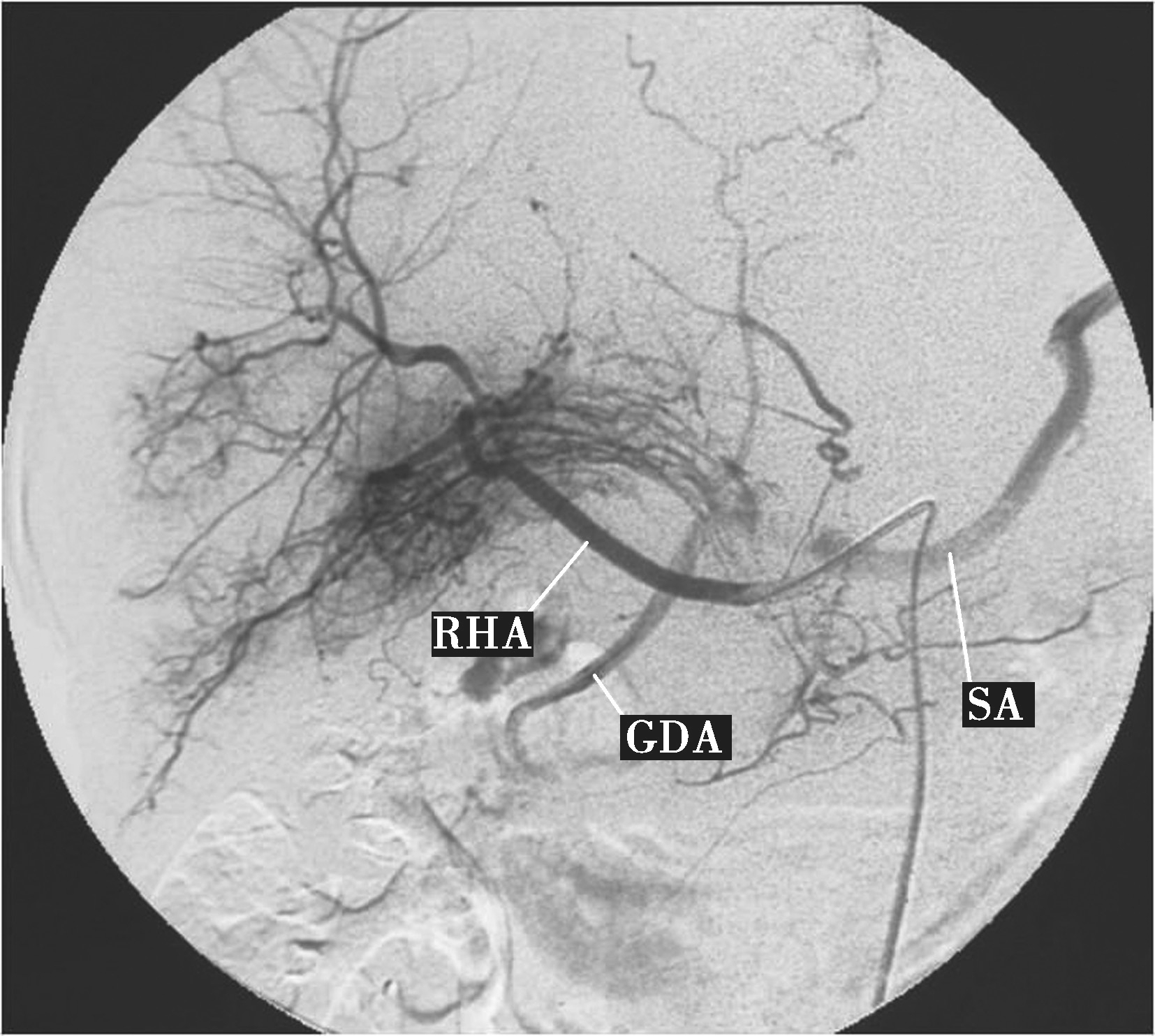
图5-21-50 肝动脉造影
显示肝癌并门脉右支及主干癌栓,动脉期可见供养静脉癌栓的数条并行细小动脉(条纹征),为癌栓的供养动脉。RHA:肝右动脉;GDA:胃十二指肠动脉;SA:脾动脉。
对比剂进入并显示门脉系统的形态分布,包括:门脉属支(肠系膜上、下静脉和脾静脉及其分支)、门脉干和门脉的分支(门脉左支和右支及其分支),同时可以观察门脉血流动力学状况。门脉造影可以为门脉相关疾病的诊断提供依据,也为经门脉的治疗提供解剖学基础和途径。根据对比剂进入门脉的方法不同,可有以下3种途径:
间接门脉造影即插管入脾动脉和/或肠系膜上动脉后,注入4~5mL/s,总量25~30mL造影剂,延长观察时间,不仅观察动脉期和实质期,还要观察对比剂回流后显示的门静脉期(图5-21-51)。间接门脉造影的操作相对简单,但通过对比剂的回流显示门脉,可受门脉循环时间和对比剂量的影响,且无法用来测量门脉压力。
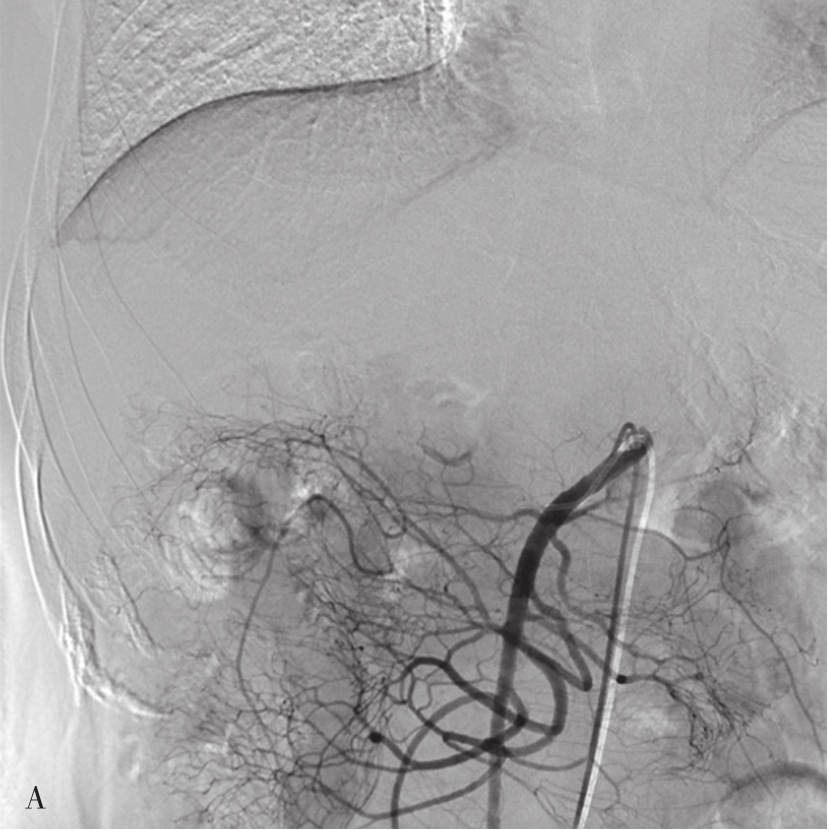
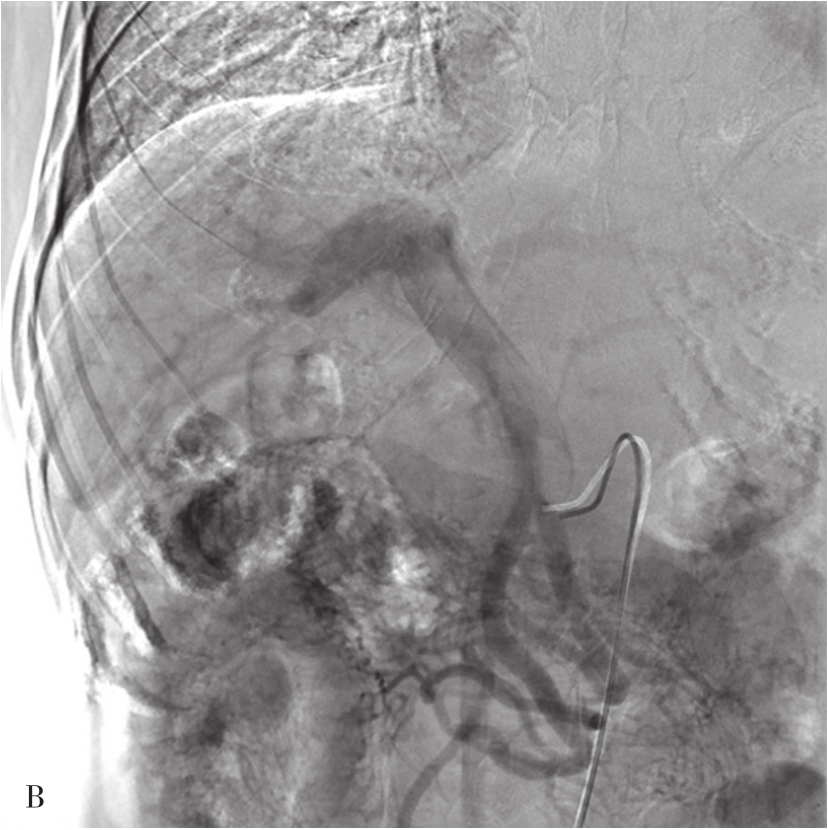
图5-21-51 经肠系膜上动脉间接门脉造影
A.插管入肠系膜上动脉注入造影剂;B.经肠系膜上静脉回流后,可显示肠系膜上静脉、门脉干和门脉的分支
直接门脉造影即通过穿刺插管进入门脉的属支或门脉干,然后注入对比剂,造影观察门脉系统的情况和门脉血流动力学,可作为诊断门脉病变的“金标准”,也可作为门脉系统病变的治疗途径。其入路有:①经皮肝途径。多首选经右腋中线附近,采用21~22g的穿刺针穿刺门脉的右支及其2~3级分支,成功后引入导管进入门脉干。困难时,亦可选择经剑突下穿刺门脉左支及其分支(图5-21-52)。②经左腋中线附近采用21~22g的穿刺针穿刺脾静脉分支,然后插管进入门脉干(图5-21-53)。③经颈静脉,采用特殊的穿刺针经肝静脉穿刺肝内门脉分支[transjugular intrahepatic portosystemic stent-shunt(TIPSS)途径,图5-21-54]。④其他少用途径。如通过外科手术的方法,分离出肠系膜上静脉的分支,然后直视下插管入门脉等。常用的是经皮肝入路。穿刺可以在超声或(结合)透视引导下完成。门脉插管成功后,可注入适量的对比剂,行门脉DSA,显示门脉的情况,同时可经导管测量门脉的压力。采用导管导丝技术,可行超选择性插管进入门脉的属支或者门脉的分支内,同时可造影和测压。本法虽有一定的创伤,但是诊断门脉病变的“金标准”。其适应证为:①观察门脉系统,包括:门脉属支、门脉干及其分支血管的病变和解剖变异,如门静脉瘤、门静脉狭窄或闭塞、门静脉侧支循环的开放和门静脉海绵样变等。②为门静脉高压的诊断提供证据。测量门静脉压力持续升高(>10mmHg),即为门静脉高压。③为经门静脉的治疗建立了途径。如肝恶性肿瘤区域门静脉的栓塞以促进正常肝的代偿,出血门静脉分支的栓塞,建立肝内门静脉和腔静脉的分流道(TIPSS)以降低门脉压等。其禁忌证是相对的,主要是出凝血功能严重障碍和肾功能衰竭。门脉系统慢性完全性闭塞并血管成条索状改变,可能导致门脉穿刺插管失败。本法的并发症主要来源于穿刺插管途径的损伤造成的出血,栓塞造成的门脉血栓形成等。采用有效的方法准确的栓塞肝内的穿刺入路,可减少出血的发生,如用明胶海绵条、钢圈和组织胶等。穿刺过程中损伤肝动脉的分支亦是术后出血的原因之一,必要时行肝动脉造影明确和行栓塞术。
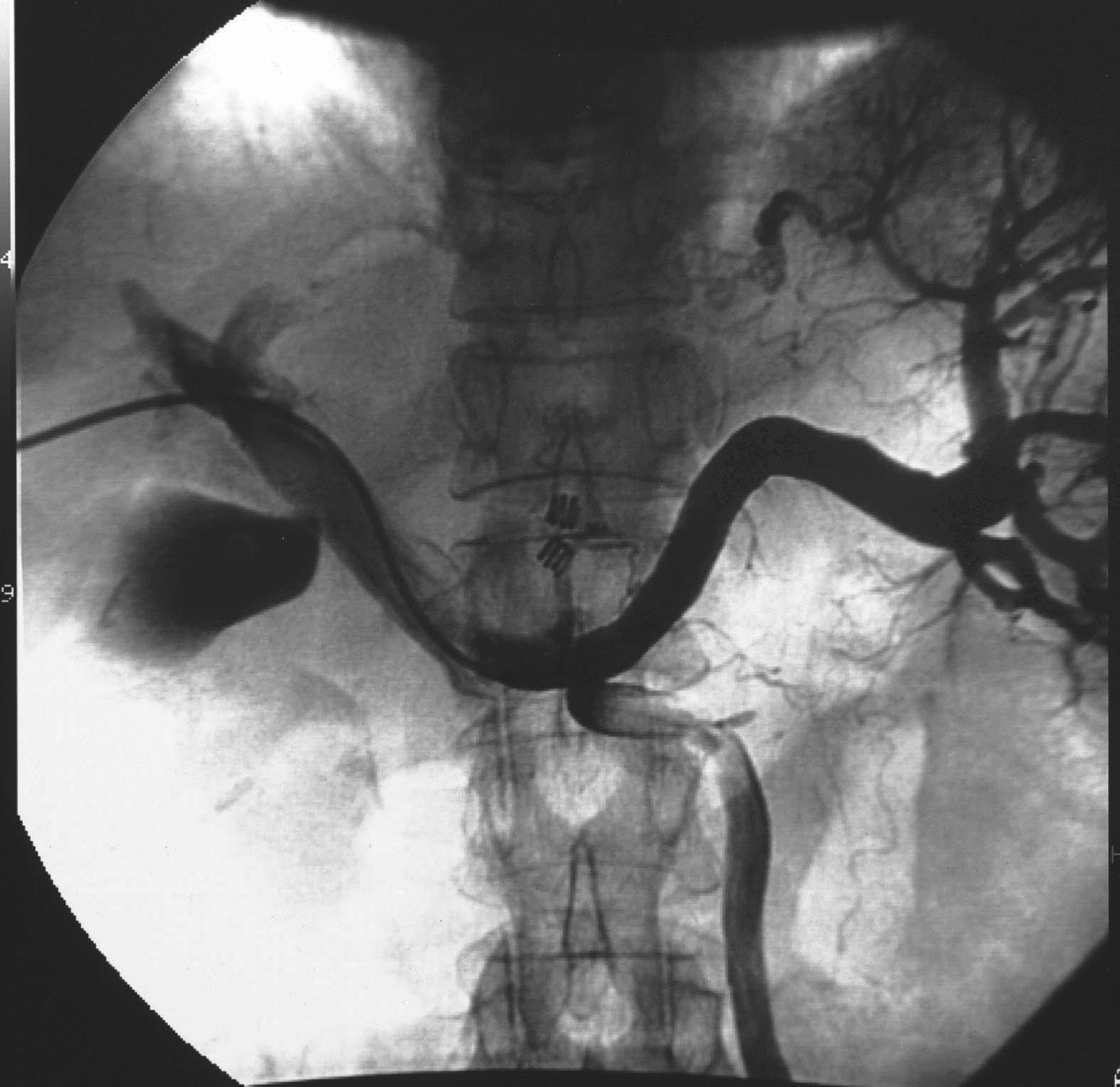
图5-21-52 经皮肝途径门脉造影
经皮肝穿刺门脉干成功后,引入导管,造影显示脾静脉、肠系膜下静脉和门脉干及其分支。并行钢圈栓塞胃冠状静脉
经颈静脉导管(多用球囊导管)送入并楔入肝静脉内,然后通过专门设计的二氧化碳注射装置,注射一定量黏滞性极低的对比剂CO 2 (多为20mL),CO 2 通过肝实质逆行进入门脉内,并在门脉内弥散,通过DSA可显示门脉系统。亦可通过21~22g的穿刺针,直接穿刺肝实质,然后注入CO 2 。完成造影后,CO 2 气体会迅速与血红蛋白结合,通过肺部进行呼吸交换排出体外。CO 2 造影具有无毒性、无致敏性、可溶解等优点,而且经济实惠、创伤小。但图像有时不如碘对比剂显示清晰。多用于TIPSS中,行“侦查性”显示门脉系统的解剖位置,以利于门脉的穿刺。
穿刺插管进入肝静脉后造影可以显示肝静脉系统并测静脉压,包括:肝左静脉、肝中静脉、肝右静脉和肝短静脉等(图5-21-55)。其入路有:经颈静脉、经股静脉和经皮肝穿刺。主要用于诊断和鉴别诊断巴德-基亚里综合征和心源性门静脉高压等。
肝静脉压力梯度(hepatic venous pressure gradient,HVPG):经颈静脉插管测定肝静脉楔压与游离压,两者之差即为HVPG,反映门静脉压力的大小。正常HVPG < 5mmHg,若HVPG > 10mmHg则为门静脉高压。其方法为:常采用经颈静脉途径,穿刺成功后,在导丝的引导下,将导管选择性插入肝右静脉或肝中静脉,由于肝中静脉斜行汇合到下腔静脉,往往易于插管成功。然后,经导丝更换Fogarty导管(5~7F)引入到肝中静脉,注入稀释的碘对比剂充盈Fogarty导管的球囊,阻断肝静脉的血流(图5-21-56)。经Fogarty导管的尾端测量肝静脉楔压。然后抽瘪球囊,恢复肝静脉的血流,再次经Fogarty导管的尾端测量肝静脉压(即游离压)。
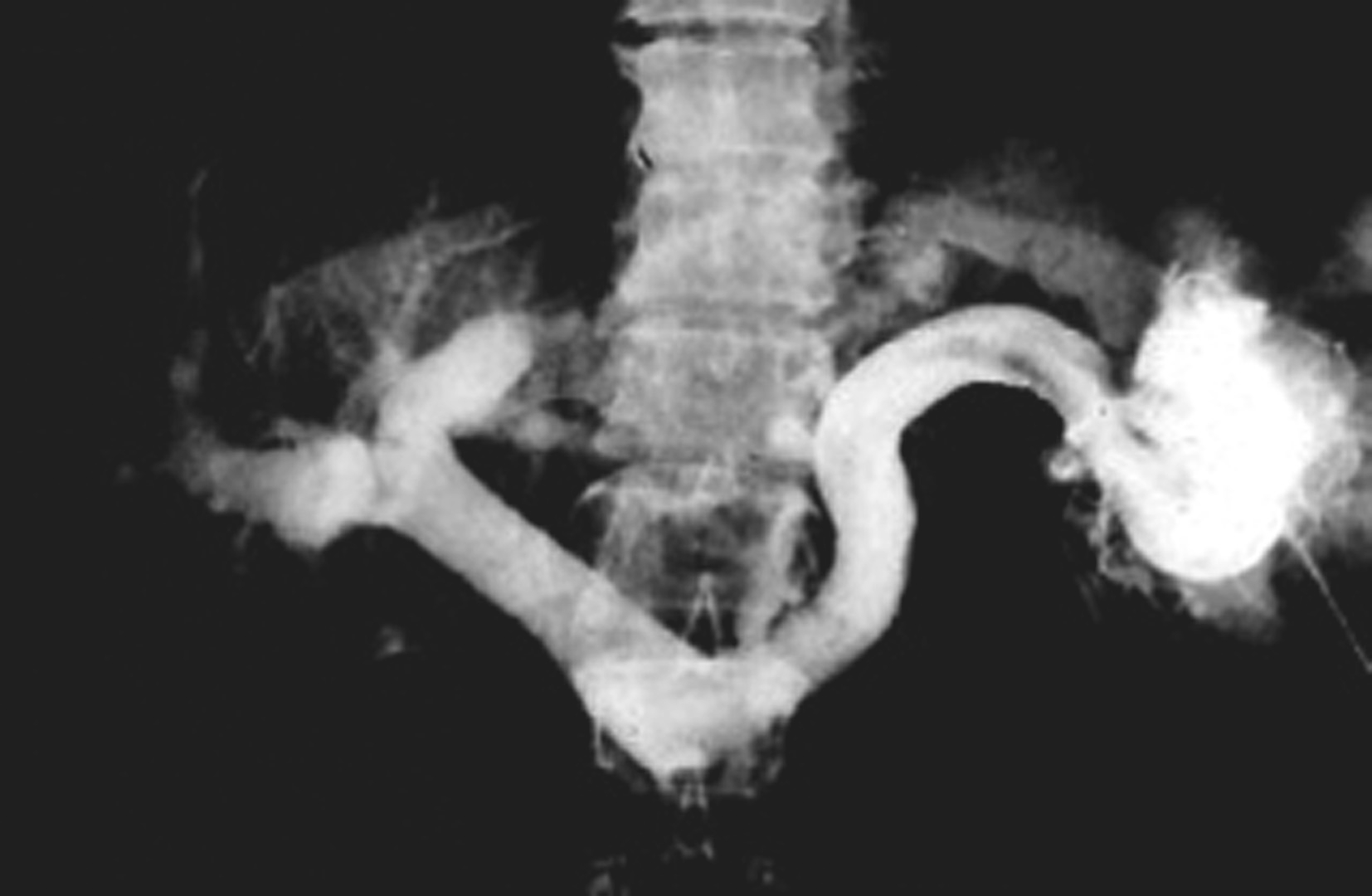
图5-21-53 经皮脾穿刺门静脉造影
经皮脾穿刺行门脉造影,可显示脾静脉、门脉干及其分支
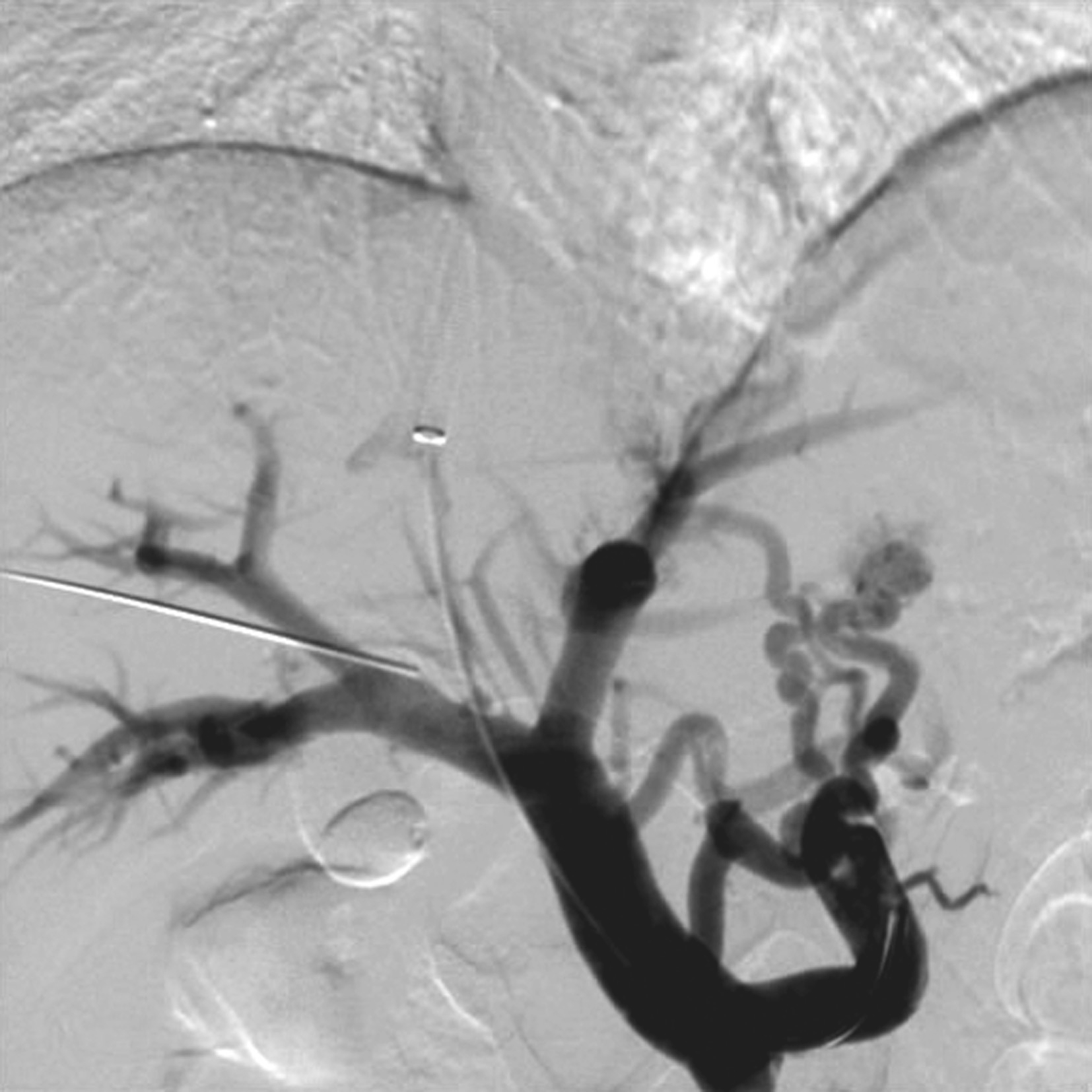
图5-21-54 经IPS途径门静脉造影
经TIPSS途径穿刺门脉成功后,置管于脾静脉造影。可清晰观察门脉系统及其侧支的情况及门脉血流动力学状况
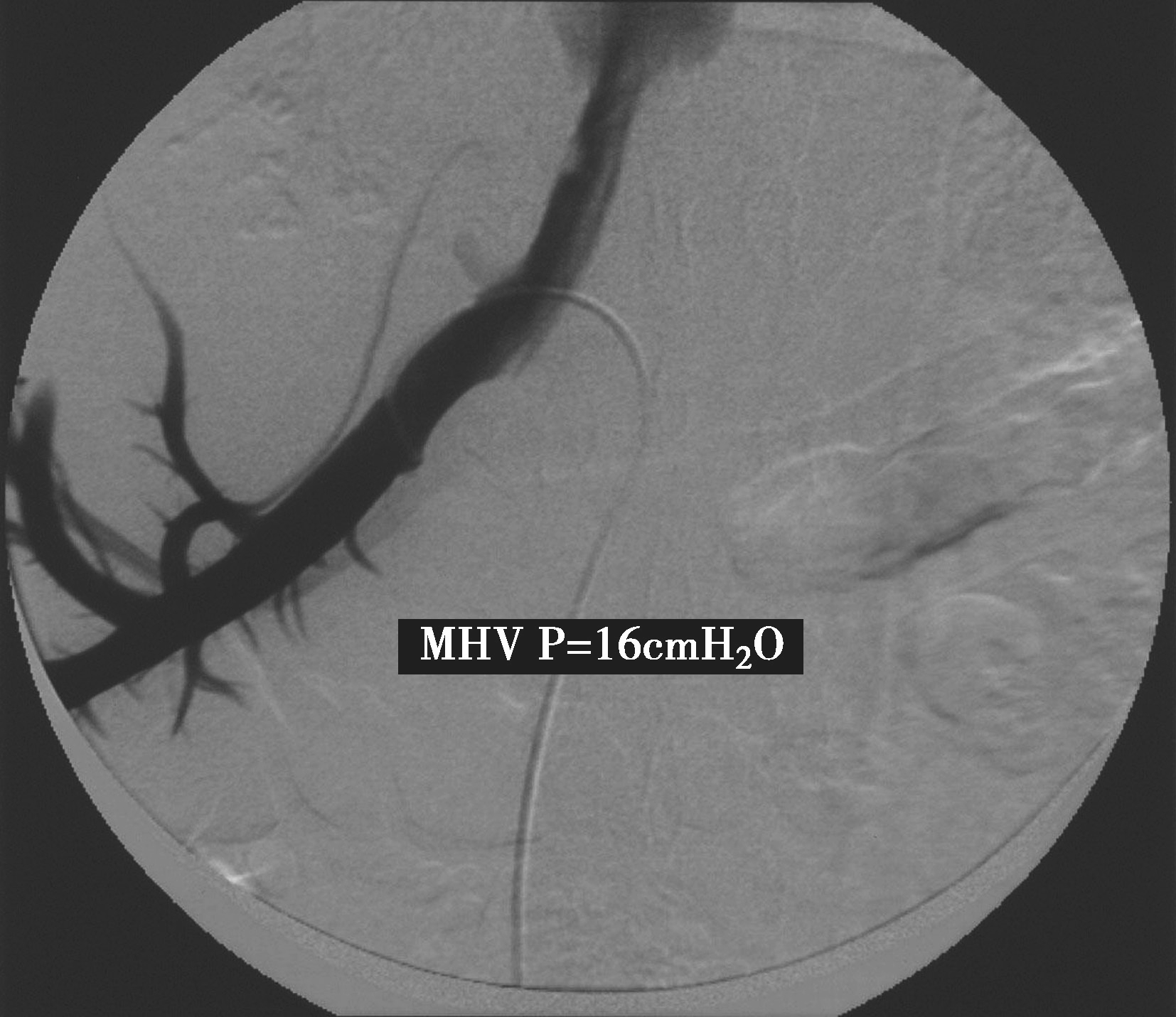
图5-21-55 肝静脉造影
经股静脉途径插管进入肝中静脉(MHV)行造影,可观察肝静脉形态、血流动力学的情况。
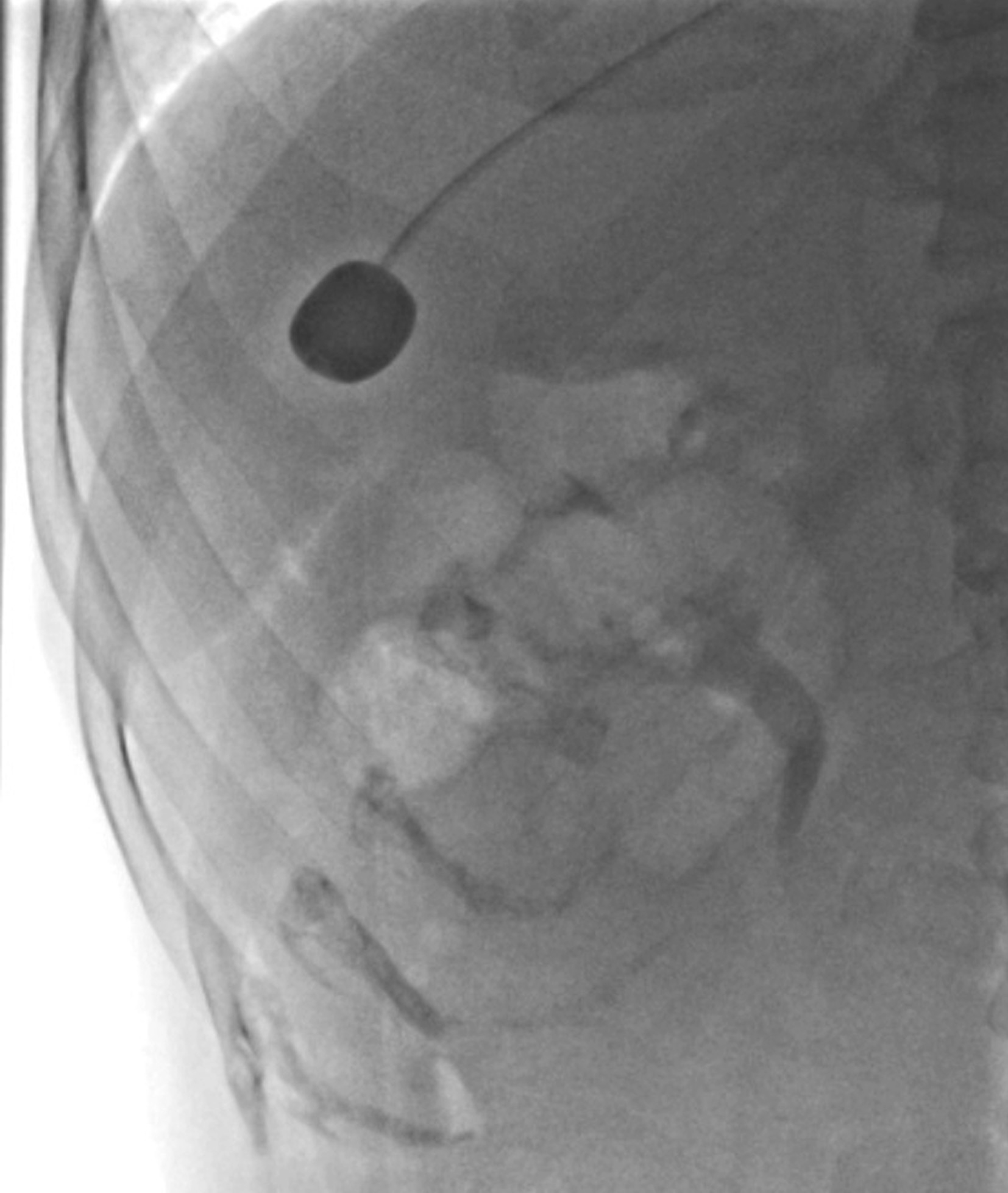
图5-21-56 肝静脉压力梯度(HVPG)测定方法
Fogarty导管送入肝中静脉,其球囊被稀释的造影剂充盈,阻断肝静脉的血流。可测量肝静脉压力梯度
(陈勇)
肝纤维化是各种病因导致肝组织慢性损伤与修复反应的共同重要病理过程。目前肝纤维化的诊断主要依靠肝穿刺活组织检查、血清学及影像学。作为肝纤维化的“金标准”的肝穿刺活组织检查,因存在取样误差、观察者偏倚、不适合多次进行等缺点限制了其临床应用。血清学单一指标及构建多个指标的无创预测模型,因其特异性低,无法准确地反映肝纤维化程度。B超、MRI等影像学手段无法对肝纤维化定量,且灵敏度不高。近年来,基于肝脏瞬时弹性成像(transient elastography,TE)的 FibroScan 技术,通过肝脏硬度值(liver stiffness measurement,LSM)检测来判断肝纤维化,已广泛应用于临床。
瞬时弹性成像仪是基于超声原理和瞬时弹性图技术,探头前端的超声转换器是固定在电动力转换器上的,电动力转换器产生瞬时的震动,产生剪切波,低频瞬时剪切波在不同硬度的组织中传播速度有明显不同,通过低频检测剪切波速度与组织硬度正相关的特征,来准确定量地计算组织硬度,从而反映纤维化程度。TE技术检测肝脏组织的范围相当于肝穿刺活组织检查取材标本量范围的100倍,在反映肝脏纤维化病变程度上更有代表性。由于其无创、快速、定量、可重复的优点,该技术已经被广泛应用于肝纤维化的诊断中。目前瞬时弹性成像技术已经被欧洲肝病学会、美国肝病研究协会、亚太肝病学会以及中华医学会肝病学分会列入临床指南。法国某公司最初在2002年研制的一维瞬时弹性成像系统称为FibroScan,2003年法国学者首先报道利用肝脏瞬时弹性成像技术测量肝脏硬度值(LSM),对肝纤维化程度进行定量评估。早期TE缺点是:检测位置选择依赖于操作者经验;无法很好地避开大血管等影响因素;对于肥胖患者检测失败率高等。近年来,XL-TE型探头瞬时弹性仪解决了部分肥胖患者因肋间隙窄或脂肪厚度原因导致的检测失败,提高了成功率。
2013年研发了新一代瞬时弹性成像技术,结合B超影像技术定位的肝纤维化诊断仪(FibroTouch)用于临床,降低了对于肥胖患者的检测失败率高的问题。它的特点是,二维影像引导可以帮助操作者避开大血管、囊肿、结节等影响因子,选择均匀、厚度合适的肝组织进行弹性检测,使得检测结果准确性和成功率都得到提升。第三代瞬时弹性成像算法,在提高计算准确度的同时,将单次肝脏测定时间缩短至1秒之内;宽频探头技术保证了信号对皮下脂肪的有效穿透,从而保证了对于高体重指数(BMI)患者的检测成功率。此外,FibroTouch利用声能量衰减与肝组织脂肪含量的关系,定量给出肝组织脂肪变参数,有助于脂肪肝患者脂肪变和肝纤维化的并行定量检测。目前FibroTouch也得到了临床的验证。
1.评估的结果以LSM和四分位间距(interquartile range,IQR)表示。可靠的TE评估应符合以下3个特征:①至少测量10次;②测量成功率≥60%;③IQR和中位数的比值(IQR/M)≤0.3。并且建议每一位患者至少进行10次有效测量。
2.TE检测应按照与现有指南一致的标准方案进行操作,患者取仰卧位,右臂完全外展。TE检测的参考位点是腋中线肝浊音界上限下方第一肋间隙,并应注意呼吸相对肝脏位置的影响。
3.TE和禁食 FibroScan的早期操作说明中不要求禁食。但近来研究提示进食可影响肝脏硬度,确切机制不明,可能与进食后门静脉和肝动脉血流改变等因素有关。进食后LSM的增加值与肝纤维化程度有一定的相关性。无论肝纤维化程度如何,肝脏硬度在进食后2h均能回归基线水平。
2003年首次研究中对照了91例HCV患者肝活检以及TE检测结果,研究者观察到:TE在肝硬化患者中一致性达99%,在进展期肝纤维化患者中有效性达88%。通过TE数值的评估表明肝脏硬度测定和Metavir肝纤维化评分密切相关。2008年另一项研究对照了150例CHC患者肝活检及TE检查结果,发现在判断F≥2、F≥3或者肝硬化的患者中,其工作特征曲线下面积(AUROC)值分别为0.91、0.99和0.98。另一项纳入1202例HCV患者的研究中,采用TE来判断肝纤维化程度,结果提示判断 F1、2、3、4的 AUROC 分别为0.879、0.889、0.941和0.970。多中心研究及荟萃分析(meta分析)显示:在HCV患者中TE判断明显纤维化的AUROC为0.86,灵敏度和特异性分别为75%和84%;而在判断肝硬化方面,AUROC为0.94,灵敏度和特异性分别为86%和89%。欧洲肝病学会(EASL)关于CHC的处理指南指出:TE可用来评估CHC患者的肝纤维化;联用多种血液学试验,或联用TE和一种血液学试验,有助于提高诊断准确性,减少肝穿刺活组织检查的必需性,从而解决诊断不确定的问题。
曾对161例CHB患者比对肝脏活组织检查和TE测量值,研究结果显示F0期的AUROC是0.85,≤F2期的AUROC是0.87,≤F3期的AUROC是0.93;另一项研究发现采用TE来判断肝纤维化,判断F≥2、F≥3和F=4的AUROC分别为0.85、0.91和0.90。一项荟萃分析显示,TE判断F≥2、F≥3和F=4的AUROC分别为0.859、0.887和0.929,灵敏度分别为74.3%、74.0%和84.6%,特异性分别为78.3%、63.8%和81.5%。但在实际工作中,多数国内医师认为TE对CHB患者肝纤维化的判断准确率不可靠:对于明确肝硬化患者TE处于高值区域,但对于纤维化2~3级的患者测量TE可信度较差。此外,ALT升高等多种情况均影响到TE值的测量,更降低了TE的可靠性。
一项对234例非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)[目前国际专家共识已用“代谢相关脂肪性肝病(MAFLD)”取代“非酒精性脂肪性肝病”的名称。本书暂时沿用非酒精性脂肪性肝病一词。]患者进行肝纤维化评估的研究结果显示,FibroScan诊断肝纤维化的有效性仅52.56%;另一项前瞻性研究纳入219例NAFLD患者,结果表明TE对肝纤维化诊断的可靠性比CHC患者低。TE对NAFLD患者显著肝纤维化的评估,其AUROC是0.80,灵敏度是76%,特异性是80%;对肝硬化的AUROC是0.94,灵敏度是78%,特异性是96%。值得注意的是,对于严重肝纤维化(F3)和严重脂肪变性(≥33%)的NAFLD患者来说,LSM的值比预期的要低,却和轻度的肝纤维化(F1)及很少的脂肪变性(<33%)的患者相似。在NAFLD患者中LSM的界定有待于更多的研究证实。
许多研究提示在CHB抗病毒治疗后LSM下降。但由于多数研究缺乏再次肝穿刺活组织检查,因而难以区分抗病毒治疗后LSM的改善与肝脏坏死性炎症活动度下降和肝纤维化改善各自的相关性。有研究对53例经肝穿刺活组织检查或临床证实的进展性肝纤维化和肝硬化患者进行抗病毒治疗平均51个月,结果发现所有肝硬化患者在入组时LSM≥11.0kPa,而在治疗后LSM<7.2kPa、8.1~10.9kPa和≥11kPa的比例分别约为35%、12%和53%。我国台湾地区小样本(71例)研究表明CHB患者LSM的下降并非肝纤维化组织学改善的可靠标志。因此,澳大利亚肝病学会关于TE在CHB患者中的应用中建议:肝纤维化评估仅是决定处理策略、治疗建议和随访计划的诸多因素之一,TE结果的解读应当只作为专科医师需要了解的信息之一。
日本学者研究以FibroScan手段对516例输血后CHC患者随访,试图确定TE测量是否可以用于预测HCC发生,研究发现共225例在随访期发展为HCC。未进展至HCC的CHC患者,其TE值与疾病进程有关;进展到HCC的CHC患者TE值明显高于未患肝细胞癌的患者。我国台湾地区一项前瞻性队列研究建立LSM-HCC评分模型以预测HCC发生可能性,指标包括TE、年龄、白蛋白和HBV DNA水平,研究发现LSM-HCC评分系统可预测HCC的发生。因此TE也可预估HCC风险,但这方面仍需要进一步研究LSM在预测中的权重。
门静脉高压是慢性肝病常见的并发症之一,评估门静脉高压的方式包括内镜检查及肝静脉压力梯度测量值。TE作为一种非侵入性方法用来评估门静脉高压是一种新颖的尝试,LSM和HVPG及食管静脉曲张的出现有很好的相关性。曾有研究对183例肝硬化患者进行FibroScan及胃镜同时检测,肝硬化患者LSM中位数为33.66kPa,存在重度食管静脉曲张患者 LSM(51.24kPa±1.61kPa)明显高于其他患者(9.81kPa±1.82kPa)。另一项117例代偿性肝硬化患者的横断面研究中,发现LSM 对于鉴别临床显著的门静脉高压的患者(HVPG>10mmHg;AUROC 0.88)是最佳的非侵入性诊断变量。需要指出的是,这些研究的可靠性尚需进一步证明。
尽管目前国内外临床资料显示超声弹性成像是一种较有价值的无创诊断肝纤维化的手段,但超声弹性成像好坏取决于仪器性能、操作者水平等因素;在肥胖、肋间隙狭窄、腹水等患者操作的失败率较高,患者的转氨酶与胆红素水平对肝脏硬度值的准确性也会产生影响。目前FibroScan对纤维化分期的数据有较大的重叠,对限定值的划分不统一,需进一步加大采集样本资料。其能在多大程度上取代肝穿刺活检尚无统一的定论。
(曾达武 董菁)