




肝脏(liver)是机体最大的腺体,成人肝约占体重的2%。肝脏具有复杂多样的生物化学功能。肝细胞产生的胆汁作为消化液参与脂类和脂溶性物质的消化;肝细胞合成多种蛋白质和脂类物质直接分泌入血;由胃、肠吸收的物质在肝细胞内进行合成、分解、转化和贮存;胚胎时期的肝脏有造血功能,成人肝脏除了具有潜在的造血功能外,还参与造血的调节;肝内存在大量的巨噬细胞,可清除从胃、肠进入机体的微生物等有害物质。
目前,对于肝脏疾病的诊断,越来越多地应用了肝穿刺活检。近年由于肝脏瞬时弹性成像技术等非侵入性诊断肝纤维化的发展,2017年欧洲肝病学会(European Association for the study of the Liver,EASL)新指南建议,将此代替肝穿刺活组织检查诊断肝纤维化和肝硬化,但肝活检仍是诊断肝脏纤维化的“金标准”,可是由于活检组织小、局限性大,需十分审慎地观察肝活检组织中的各种基本病理变化,熟悉肝脏组织发生和正常肝脏组织学,从胚胎发育的全过程及病变发生发展的特征性形态变化作出正确病理学诊断。
人胚胎发育第4周初,前肠末端腹侧壁的内胚层上皮细胞增生,向外突起形成一囊状肝憩室(hepatic diverticulum),或称肝芽(hepatic bud),是肝和胆囊的原基。肝憩室迅速增大并长入到原始横隔(septum transversum)内,肝憩室末端膨大并分为头、尾两支,头支较大,形成肝的原基,尾支形成胆囊和胆道的原基。头支生长迅速,上皮细胞增殖,形成树枝状分支并互相吻合呈网状的细胞索,即肝索。肝索随后上下叠加分化成肝板、界板及肝内各级胆管。穿行于原始横隔内的卵黄静脉和脐静脉亦反复分支并互相吻合,在肝索间形成毛细血管网,即肝血窦。大约第6周,肝细胞之间出现胆小管。第9~10周,呈放射状排列的肝板与肝血窦围绕中央静脉,共同形成肝小叶。
原始横隔中的间充质分化为肝内结缔组织和肝被膜。卵黄管外表面为中胚层细胞,在胚胎演化过程中,这些中胚层细胞大部分变成血管组织并承担胚胎时期的造血功能。另一部分中胚层细胞演变为原始横隔并随后被拉长形成系膜。当肝芽生长伸入横隔间叶组织时,横隔间充质组织则充塞于肝板与肝窦之间,形成肝脏的支持性结缔组织及肝被膜;另一部分间充质细胞分化为血窦内皮细胞、肝巨噬细胞(又称库普弗细胞)和造血细胞。目前认为库普弗细胞是单核巨噬细胞系统的成员,由骨髓造血干细胞分化的单核细胞从血液输送到肝窦中而形成。
在胚胎第5~6周时,肝板的肝细胞膜逐渐凹陷,细胞间出现间隙,并互相吻合形成胆小管。同时门管区边缘肝板上的肝细胞再分化形成胆管上皮细胞,它们与肝细胞构成一管道,该管道在靠近肝板一侧衬以胞质红染的肝细胞,在靠近间质纤维组织一侧则衬以肝细胞再分化形成的胆管上皮细胞,胞质淡染。这一管道连接胆小管和小叶间胆管。在形成这一管道时,间叶组织伸入并分隔胆管与肝板,而形成包括小叶间胆管的门管区。肝细胞再分化成为胆管上皮的发育概念,可以解释为何肝细胞癌及胆管细胞癌中混杂有胆管上皮型或肝细胞型的癌细胞。
肝内血管最初的起源为各处的间充质细胞,这些间充质细胞先演变成经过及穿过人肝脏的肝外原始血管。然后逐渐演变成肝内动脉和肝内静脉。
胚胎发育中,来自卵黄囊的左、右卵黄静脉和来自胎盘的左、右脐静脉均穿过原始横膈回流至心的静脉窦。肝在横膈中不断生长及扩展,使部分卵黄静脉和脐静脉被改建成许多细小的窦腔,构成肝窦。肝窦再汇成左、右肝心管,随后左、右肝心管分别演变成肝左静脉、肝右静脉和下腔静脉的肝后部。左、右卵黄静脉在靠近入肝处,形成3个横向的交通支,经演变后与新生的肠系膜上静脉及脾静脉沟通,共同组成门静脉,门静脉再通过各级分支注入肝窦。
在胚胎发育中腹腔动脉逐渐分出肝总动脉,再分出肝固有动脉左、右支穿入肝的间质,并分成小分支,最后移行至肝窦。
肝的结构和功能与其他消化腺不同,肝细胞排列分布特殊,不形成类似唾液腺和胰腺的腺泡;肝内血窦丰富,肝动脉血和门静脉血均汇入肝血窦内。
肝表面大部分覆以浆膜,其下方为一层致密结缔组织被膜。肝门部的结缔组织随门静脉、肝动脉和肝管的分支深入至肝实质,将实质分隔成许多肝小叶。肝小叶之间各种管道密集的区域为门管区。正常肝脏在显微镜下的基本组织结构和功能单位为肝小叶。
肝小叶(hepatic lobule)为肝的基本结构单位,立体形态呈多角形棱柱体,高约2mm,宽约1mm,成人肝有50万~100万个肝小叶(图4-16-1),小叶之间以少量的结缔组织分隔。有些动物(如猪)的肝小叶之间有较多纤维结缔组织,故分界明显,而人的肝小叶之间的结缔组织纤细,相邻的肝小叶常连成一片,分界不甚清晰。肝小叶中央有一条中央静脉(central vein),中央静脉周围是大致呈放射状排列的肝细胞和肝血窦。肝细胞以中央静脉为中心,向周边呈放射状排列成凹凸不平的板状结构,称为肝板(hepatic plate)。相邻肝板吻合连接,形成迷路样结构。在切片中,肝板的断面呈索状,称为肝索(hepatic cord)或肝细胞索(图4-16-2)。在肝小叶周边的肝板,其肝细胞体积较小,嗜酸性较强,称为界板(limiting plate)。肝板之间的空隙为肝血窦,血窦经肝板上的孔互相通连,形成网状管道。肝细胞相邻面的质膜局部凹陷,形成细微的胆小管。由此,肝板、肝血窦和胆小管在肝小叶内形成各自独立又彼此密切相关的复杂网络。
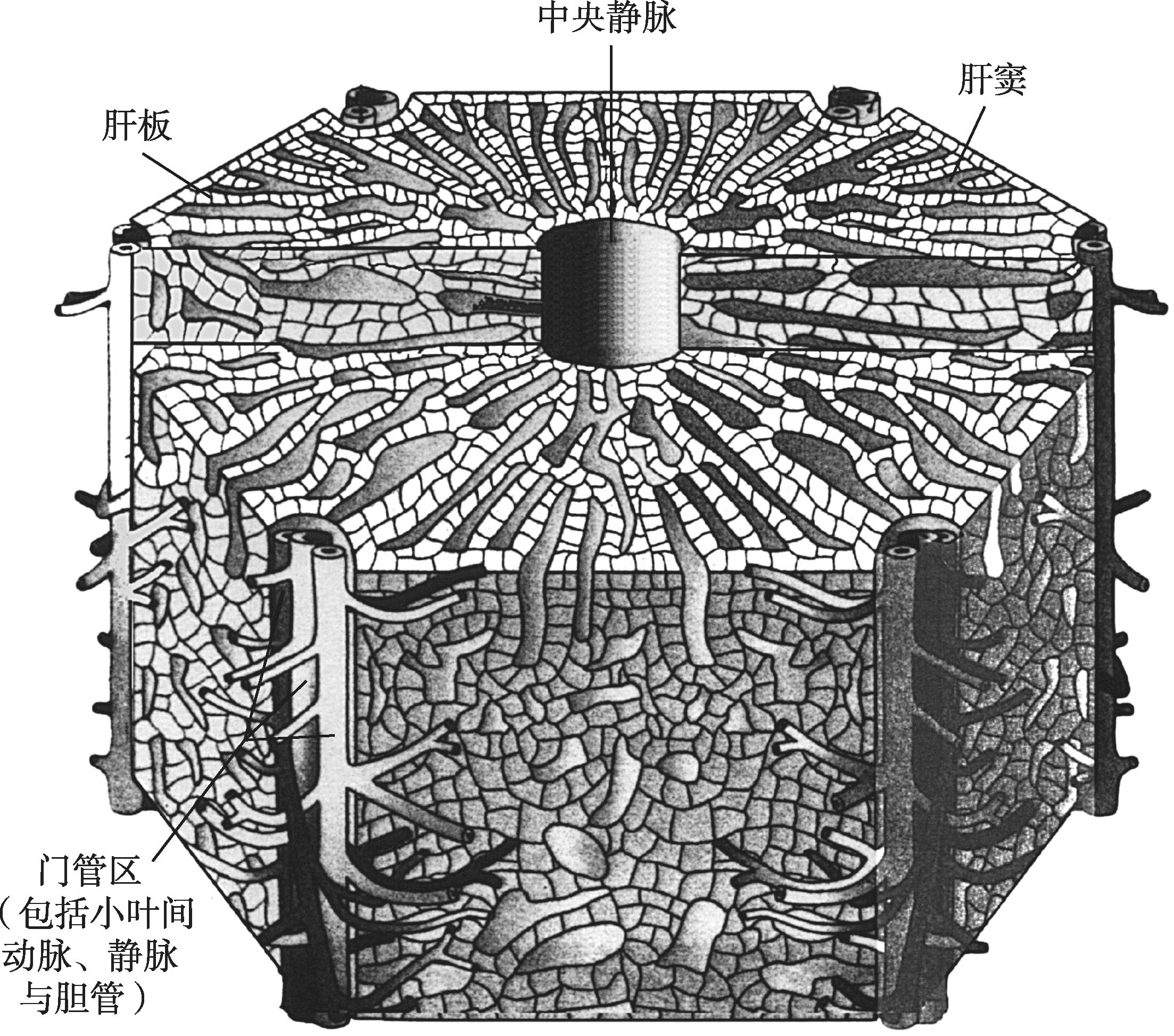
图4-16-1 经典肝小叶模式图
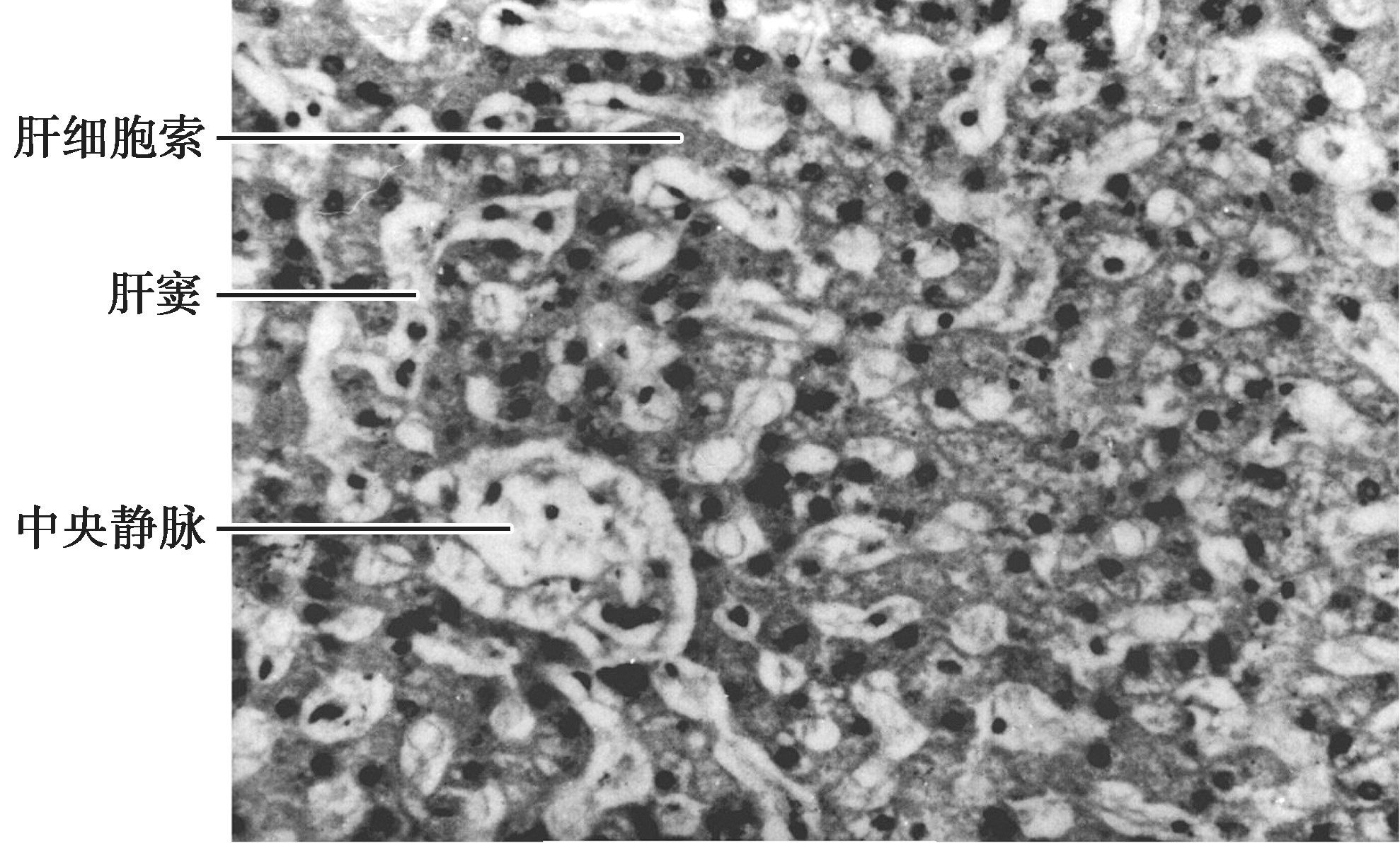
图4-16-2 正常肝组织
是组成肝脏的最主要细胞,占肝内细胞总数的70%~80%。肝细胞呈多面体形,直径15~30μm。肝细胞有三种不同的功能面,即血窦面、胆小管面和细胞连接面。血窦面和胆小管面有发达的微绒毛,使细胞表面积增大,有利于同血液进行物质交换。相邻肝细胞之间的连接面有紧密连接、桥粒及缝隙连接等结构。有些肝细胞之间还有贯通的细胞间通道。
肝细胞核大而圆,位于细胞中央。双核细胞较多,为处于再生及有活跃功能活动的细胞。常染色质丰富,核仁一个或多个。肝的特点之一是多倍体肝细胞数量多,成人肝的4倍体肝细胞占60%以上,这可能与肝细胞长期保持活跃的多种功能有关。
核结构的改变是细胞在衰亡及损伤过程中的重要表征,主要表现为核膜和核染色质的改变。肝细胞坏死时可出现:①核浓缩(染色质在核浆内聚集成致密浓染的大小不等的团块状);②核碎裂(染色质逐渐边集于核膜内层,形成较大的高电子密度的染色质团块,起初核膜尚保持完整,之后则在多处发生断裂,核逐渐变小,最后裂解为若干致密浓染的碎片);③核溶解(致密块状的染色质最后完全溶解消失)。核溶解也可不经过核浓缩或核碎裂而一开始即独立进行。在这种情况下,受损的细胞核很早就消失。上述核结构的改变为细胞不可复性损伤的标志,提示活体内细胞死亡。
肝细胞的胞质丰富,多呈嗜酸性。当蛋白质合成旺盛时,胞质内出现弥散分布的嗜碱性物质。电镜下可见胞质内含有丰富的细胞器和内涵物。
(1)线粒体:
线粒体是细胞内主要的能量形成部位,由于肝细胞的功能活跃,需要大量的能量,因此肝细胞胞质内散布多量的线粒体。线粒体多为线状、长杆状、卵圆形或圆形小体。肝细胞线粒体的外界膜内含有的酶较少,主要为单胺氧化酶以及糖和脂质代谢的各种转移酶,而内界膜上的酶较多,主要为呼吸链和氧化磷酸化的酶类。肝小叶周围的肝细胞内线粒体多且长,而近中央静脉附近的则少而短。
线粒体是肝细胞内极为敏感的一种细胞器,无论在生理情况还是病理状态下都具有十分重要的意义。在饥饿、急性缺氧、中毒、肝炎和胆汁淤积等条件下,线粒体可发生数量、大小、形态等方面的改变。线粒体数量减少常见于急性细胞损伤时,线粒体崩解或自溶。缺氧、微生物毒素、各种毒物、渗透压改变等可引起线粒体肿胀,线粒体变大、变圆,基质变淡,嵴变短、变少甚至消失。在极度肿胀时,线粒体可变为小空泡状结构。在急性肝细胞损伤时线粒体嵴常被破坏,在肝细胞慢性损伤时,线粒体的蛋白合成受障碍,可导致线粒体不能形成新的嵴。
(2)粗面内质网:
呈板层状成群排列分布于胞核和线粒体周围,合成多种重要的血浆蛋白,包括白蛋白、纤维蛋白原、凝血酶原、脂蛋白和补体等。在病理状态下,肝细胞的粗面内质网可发生量和形态的改变。在细胞再生和病毒感染时,粗面内质网增多。在肝细胞变性和坏死过程中,粗面内质网的池一般出现扩张,较轻的和局限性的扩张只有在电镜下才能见到,重度扩张时则在光学显微镜下可表现为空泡形成。
(3)滑面内质网:
由许多散在小管和小泡构成,其膜上有多种酶系规律地分布,如氧化还原酶、水解酶、转移酶、合成酶等。肝细胞摄取的有机物在滑面内质网进行连续的合成、分解、结合和转化等反应,包括胆汁合成、脂类代谢、糖代谢、激素代谢以及从肠道吸收的有机异物(如药物、腐败产物等)的生物转化。在肝细胞损伤时滑面内质网可出现小管裂解为小泡或扩大为大泡状。
(4)高尔基复合体:
从粗面内质网合成的蛋白质和脂蛋白中,一部分转移到高尔基复合体加工后,再经分泌小泡由肝细胞血窦面排出。近胆小管处的高尔基复合体尤为发达,与胆小管面质膜的更新及胆汁的排出有关。
(5)溶酶体:
是由单层脂蛋白膜包绕的内含一系列酸性水解酶的球形或卵圆形小体。溶酶体功能活跃,其不断与吞饮小泡融合,消化异物,并自噬细胞内退化的线粒体、内质网等结构和某些过剩的物质(如糖原等)。溶酶体在肝细胞结构更新和正常功能的维持中起重要作用,还参与胆色素的代谢转运和铁的贮存过程。在饥饿、肝炎等情况下,溶酶体明显增多。
(6)过氧化物酶体:
肝细胞内的过氧化物酶体(微体)发达,其数量和体积较其他细胞的大。过氧化物酶体是由单层界膜包绕的圆形小体,大小不一,常分布于胆小管或高尔基复合体附近。过氧化物酶体内含有多种消化酶,其中以过氧化氢酶和过氧化物酶为主。过氧化物酶体在肝细胞内的主要功能可能是防止产生过量的过氧化氢,以免引起细胞中毒。另外,可能参与肝细胞中脂肪转化为糖类的过程。在病毒性肝炎及慢性酒精中毒等情况下可见过氧化物酶体增多。
(7)内涵物:
肝细胞内有糖原、脂滴、色素等内涵物,这些物质的含量可因生理和病理状况的不同而异。进食后肝糖原增多,饥饿时肝糖原减少。正常肝细胞内脂滴很少,肝脏疾病时脂滴可增多。肝细胞胞质内的色素有胆色素、含铁血黄素和脂褐素等。在靠近中央静脉的肝细胞胞质中,可见棕黄色细小颗粒的胆色素,一般在光镜下难以发现。在胆汁淤积情况下,胆色素含量增多易于识别出,在肝移植后常有弥漫性肝细胞内胆色素沉积。细胞内胆色素可用Van Gieson法染色显示出棕绿色颗粒,或由胆小管的胆栓存在而证实。
肝血窦(hepatic sinusoid)位于肝板之间的陷窝内,互相吻合成网状管道(图4-16-2)。肝血窦腔大而不规则,无基底膜。肝脏小叶间动脉和小叶间静脉的血液,流经肝血窦后汇入中央静脉。肝血窦内含有4种类型细胞:内皮细胞、肝巨噬细胞、大颗粒淋巴细胞和贮脂细胞,总称为血窦细胞(sinusoidal cell)。内皮细胞约占血窦细胞总体积的44%,是构成肝血窦壁的主要边界成分;肝巨噬细胞约占33%,位于肝血窦内;贮脂细胞约占20%,位于窦周隙内。
(1)肝血窦内皮细胞:
肝血窦内皮细胞(hepatic sinusoidal endothelial cell)是构成肝血窦壁的主要成分,细胞扁而薄,含核的部分凸向管腔,腔面可见少量微绒毛及小凹陷(图4-16-3)。细胞核呈扁圆形,体积较小,染色深,突向肝血窦腔。内皮细胞间连接松散,电镜观察可见内皮细胞间常有0.1~0.5μm的间隙。胞质内细胞器较少,但吞饮小泡较多,说明肝血窦内皮细胞具有较强的物质摄取能力。肝血窦内皮细胞的明显特征是在细胞不含核的扁薄部分有许多窗孔,孔上无隔膜,因此肝血窦的通透性大。内皮细胞窗孔是窦周隙物质交换的重要通道,对维持肝细胞微环境的稳定具有重要意义。在慢性肝炎或肝硬化中,内皮细胞窗孔明显减少,细胞质膜边缘有断续的基底膜形成,使肝血窦逐渐演变为毛细胞血管,导致物质交换障碍。对肝血窦内皮细胞的研究发现,其细胞内含有微管和微丝,参与调节内皮细胞窗孔大小的变化。
肝血窦内皮细胞和毛细血管内皮细胞不仅形态上有别,其表型亦不同。内皮细胞具有很强的吞饮功能,胞质中有丰富的吞饮小泡,它在肝细胞与血液间转运蛋白质、糖蛋白、脂蛋白等血浆成分中起重要作用。它可吞饮多种内源性和外源性颗粒及大分子物质,但它不能吞噬细菌和脂类。近年来的研究发现,体外培养的肝血窦内皮细胞可分泌调节细胞功能的因子,如前列腺素E 2 、血管紧张素转换酶等。另外,肝血窦内皮细胞可能演变为成纤维细胞和肌成纤维细胞,因而认为肝血窦内皮细胞可能与肝胶原纤维增生有关。
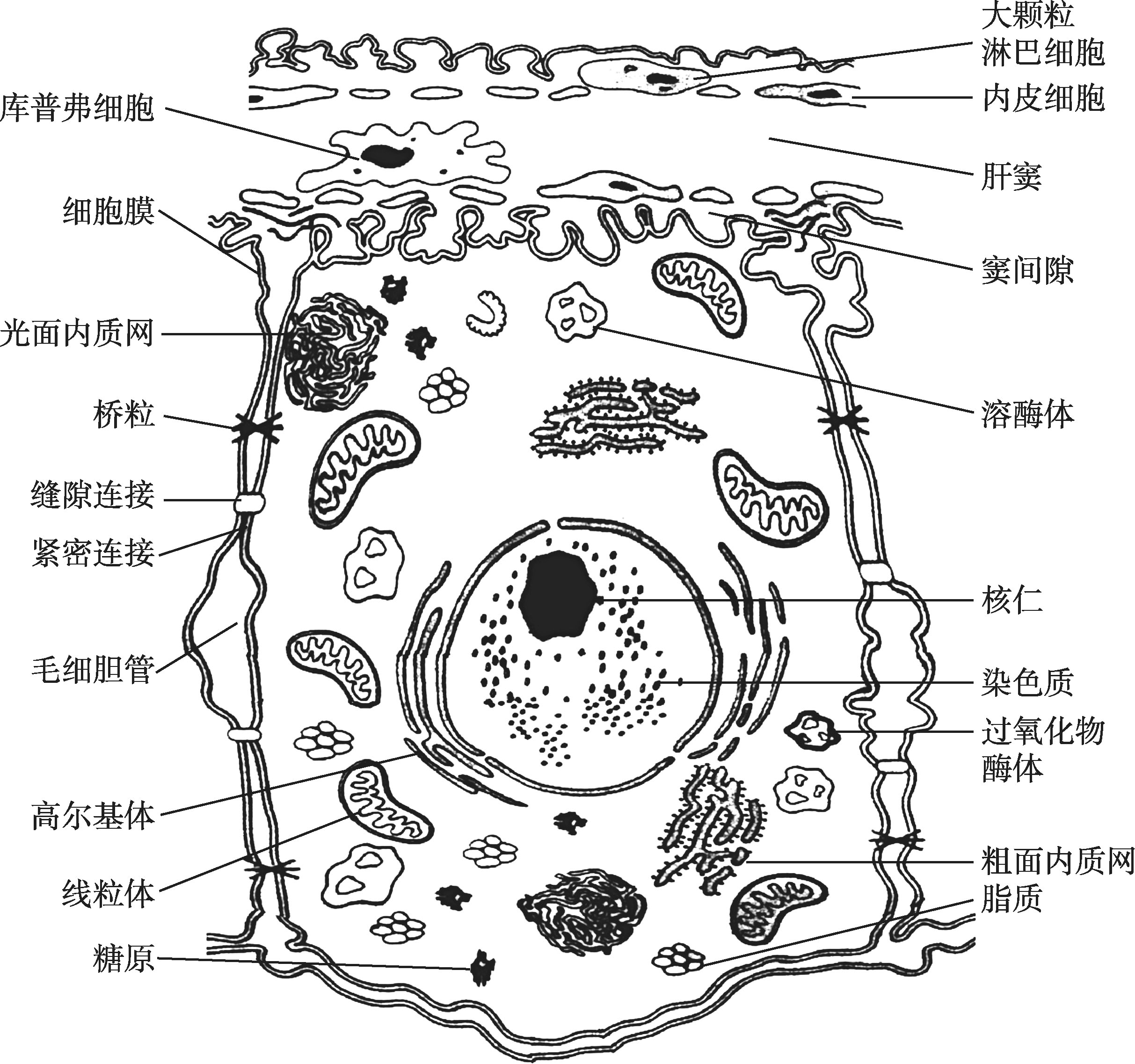
图4-16-3 肝组织超微结构模式图
(2)肝巨噬细胞:
肝巨噬细胞又称库普弗细胞(Kupffer细胞),是机体定居于组织内的巨噬细胞中最大的细胞群体,约占细胞总数的50%。Kupffer细胞体积较大,形状不规则,从胞体伸出许多板状或丝状伪足附在内皮细胞上,或穿过内皮窗孔和细胞间隙伸入窦周隙内。电镜观察见细胞表面有皱襞、突起或微绒毛(图4-16-3),胞质内溶酶体发达,并常见吞噬体和残余体。肝巨噬细胞来源于骨髓造血干细胞,后者分化为单核细胞,进而分化为肝巨噬细胞。Kupffer细胞具有强大的吞饮、吞噬及游走功能,可吞噬和清除从胃肠进入门静脉的细菌、病毒和异物,还具有吞噬清除衰老、破碎的红细胞和血小板等功能。此外,肝巨噬细胞还有识别肿瘤细胞特异性抗原及抑制和杀伤体内肿瘤细胞的作用。在各种肝脏疾病中,Kupffer细胞的形态、数量和功能都可发生变化,在某些疾病的诊断上是一项重要指征。
(3)大颗粒淋巴细胞:
肝大颗粒淋巴细胞(large granular lymphocyte,LGL)是肝特有的NK细胞,位于肝血窦内,直接与血液相接触,并牢固地附着在内皮细胞或肝巨噬细胞上(图4-16-3)。细胞表面有短的伪足样突起,突起穿过内皮细胞进入窦周隙中。LGL胞质内含有较多致密内分泌样颗粒,核深染。肝LGL具有NK细胞活性,能溶解和杀伤多种肿瘤细胞。慢性活动性肝炎时,LGL可游出至肝窦周隙中,与肝细胞接触后可能有细胞毒性作用,使肝细胞变性及损伤。
窦周隙(perisinusoidal space)又称Disse间隙,是肝血窦内皮细胞与肝细胞之间的狭小间隙(图4-16-3),宽约0.4μm。由于肝血窦内皮细胞通透性大,因此窦周隙充满血浆,肝细胞血窦面的微绒毛伸入窦周隙浸于血浆中。窦周隙是肝细胞和血液之间进行物质交换的场所,对肝脏的新陈代谢有重要作用。在某些病理情况或实验条件下肝窦周隙可增宽。
窦周隙中还含有细胞外基质成分,包括纤维连接蛋白(fibronectin)、层粘连蛋白(laminin)、各种糖蛋白,以及Ⅲ、Ⅳ、Ⅴ、Ⅵ型胶原纤维。Ⅲ型胶原纤维是窦周隙壁上胶原纤维的主要成分,用嗜银染色可显示出网状纤维支架结构,从中央静脉周围呈放射状排列。肝窦周隙壁上无弹力纤维存在,用传统的弹力纤维染色呈阴性反应。
窦周隙内有一种形态不规则的贮脂细胞(fat-storing cell),又称Ito细胞,位于窦周隙和肝细胞间陷窝内。细胞形态不规则,有突起附于内皮细胞基底面及肝细胞表面,或伸入肝细胞之间。其最主要的特征是胞质内含许多大脂滴。在石蜡包埋HE染色切片中贮脂细胞难于识别,用锇酸固定树脂包埋半薄切片和冷冻切片脂肪染色或免疫组织化学染色可清楚显示。贮脂细胞主要有两个功能,一个是贮存脂肪和维生素A,人体摄取的维生素A 70%~80%是贮存在该细胞脂滴中;另一个是产生细胞外基质,窦周隙内的网状纤维即由它产生。在慢性肝炎、慢性酒精中毒等肝脏疾病,贮脂细胞可异常增殖,肝内纤维增生,可导致肝硬化。
胆小管(bile canaliculus)是相邻两个肝细胞之间局部胞膜凹陷形成的微细管道,在肝板内连接成网。胆小管腔隙细小,在苏木精-伊红染色(hematoxylin and eosin staining,HE染色)切片中通常不易被识别,用银染法或ATP酶组化染色可显示出胆小管的网状分布图像。电镜下可见肝细胞的胆小管面形成许多微绒毛,突入管腔。靠近胆小管的相邻肝细胞膜形成由紧密连接、桥粒等组成的连接复合体,可封闭胆小管周围的细胞间隙,防止胆汁外溢至细胞间或窦周隙。当肝细胞发生变性、坏死或胆道堵塞而内压增高时,胆小管的正常结构被破坏,胆汁则溢入窦周隙,继而进入肝血窦,导致机体出现黄疸。
作为肝的结构和功能单位,除了以中央静脉为中心的经典肝小叶外,有学者还提出了门管小叶和肝腺泡的概念。门管小叶(portal lobule)立体形态大致为三角形柱体,它是以门管区为中轴,即小叶间胆管及伴行的小叶间动脉和小叶间静脉贯穿中轴,这些胆管和血管发出分支进入肝实质形成小叶结构(图4-16-4),周围以三个相邻的经典肝小叶的中央静脉连线为界。门管小叶的概念着重强调肝的外分泌功能,肝板似腺泡,胆小管似腺泡腔,而小叶间胆管似腺泡的导管。胆汁从门管小叶周边向中央汇集,流向小叶间胆管,构成一个肝外分泌小叶。门管小叶是胆汁分泌功能上的单位,习惯上较少用。
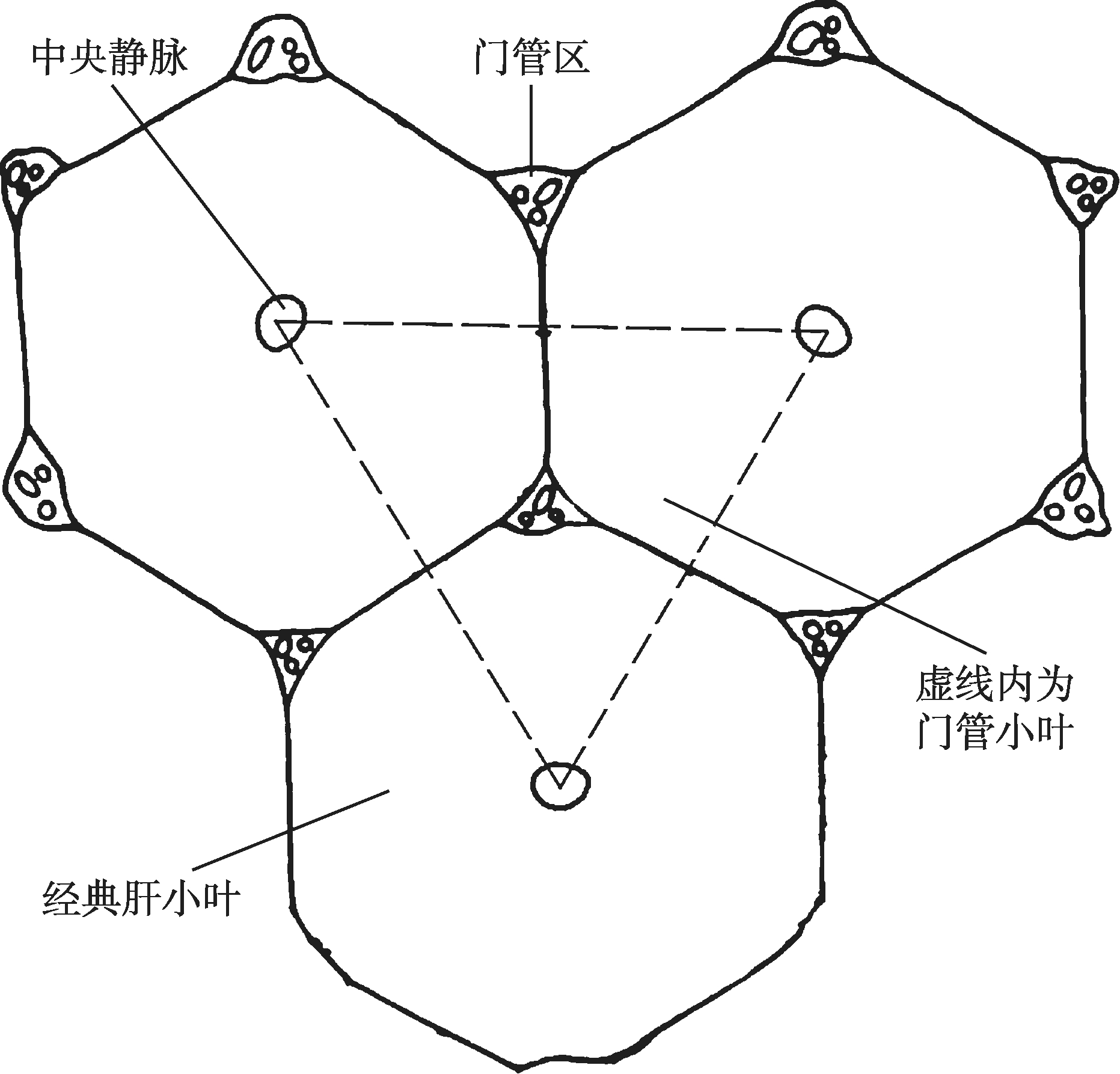
图4-16-4 门管小叶模式图
肝腺泡(liver acinus)是Rappaport等在1954年提出的肝脏结构单位的一种概念,是基于肝微循环与病理和再生关系而提出的。这一概念将肝结构和功能相结合,提出肝腺泡是肝脏结构和功能的最基本单位。肝小叶的血液来自周围几支终末血管,一个肝小叶分泌的胆汁也分别汇入周围几个胆管,因此Rappaport等认为肝小叶不是肝脏功能的最小单位,而提出肝腺泡的概念。肝腺泡体积较小,立体形态似橄榄,纵切面呈卵圆形。肝腺泡以门管区血管及胆管分支的终末支为中轴,两侧以邻近的两个中央静脉为界(图4-16-5)。每个肝腺泡接受一支终末血管的血供,分泌的胆汁汇入一个终末胆管,因此肝腺泡是肝脏微循环及胆汁分泌的最小结构及功能单位。
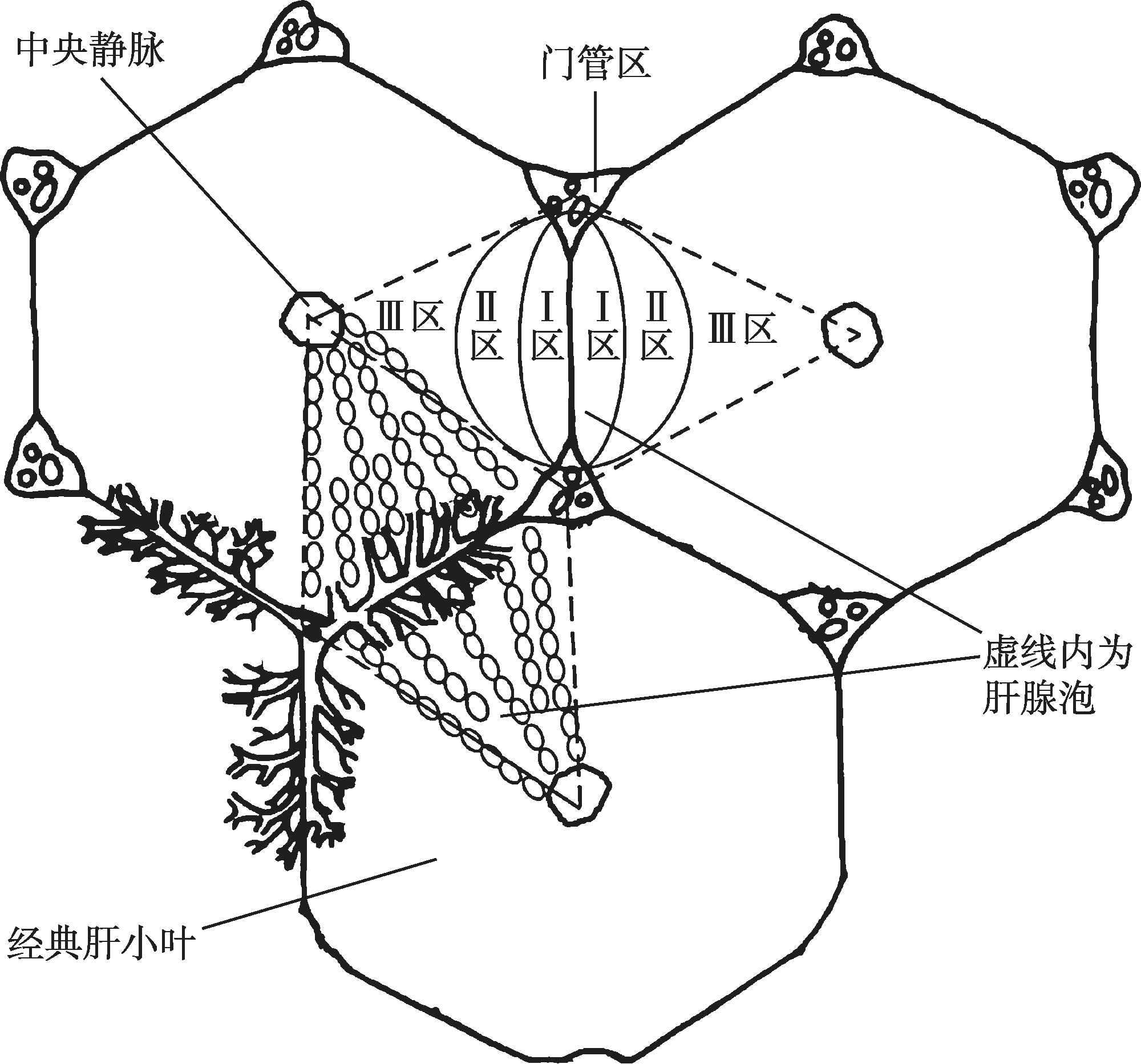
图4-16-5 肝腺泡模式图
肝腺泡内的血流是从中轴单向性流向外周,根据血流方向和肝细胞获得血供先后优劣的微环境差异,可将肝腺泡分为3个区:近中轴血管部分为Ⅰ区;近中央静脉的外侧部位为Ⅲ区;介于以上两者之间为Ⅱ区。在Ⅰ区,肝细胞优先获得富于氧和营养成分的血液供应,细胞代谢活跃,再生能力强;Ⅲ区血供条件最差,血液成分已发生变化,肝细胞再生能力较弱,对某些有害物质的作用较为敏感,易发生病理性损害;Ⅱ区肝细胞的营养状况、对有害因素的抵抗能力和再生能力等介于Ⅰ~Ⅲ区。研究表明,Ⅰ区和Ⅲ区的肝细胞超微结构和生化代谢存在某些精细的差异。一般3个单一的肝腺泡组成一个复合腺泡(complex acinus),它们的中轴是门管区(图4-16-6),3~4个复合腺泡组成更大的腺泡团块(acinus agglomerate)。
肝腺泡的结构单位及其病理学意义已被学术界证实和接受。它对肝脏微循环、肝细胞的异质性、肝病理损伤机制的研究均有重要意义。如肝脏血液供应障碍首先影响Ⅲ区肝细胞;中毒性损伤首先累及Ⅰ区肝细胞;病理形态学上所见的桥接坏死是Ⅲ区肝细胞发生坏死;肝脏受损后肝细胞的再生分裂首先出现在Ⅰ区。在对肝脏的研究中还发现,在肝腺泡不同区域的肝细胞,还存在酶活性和分布的差异,进一步说明了肝腺泡这一概念越来越显示出其生命力。
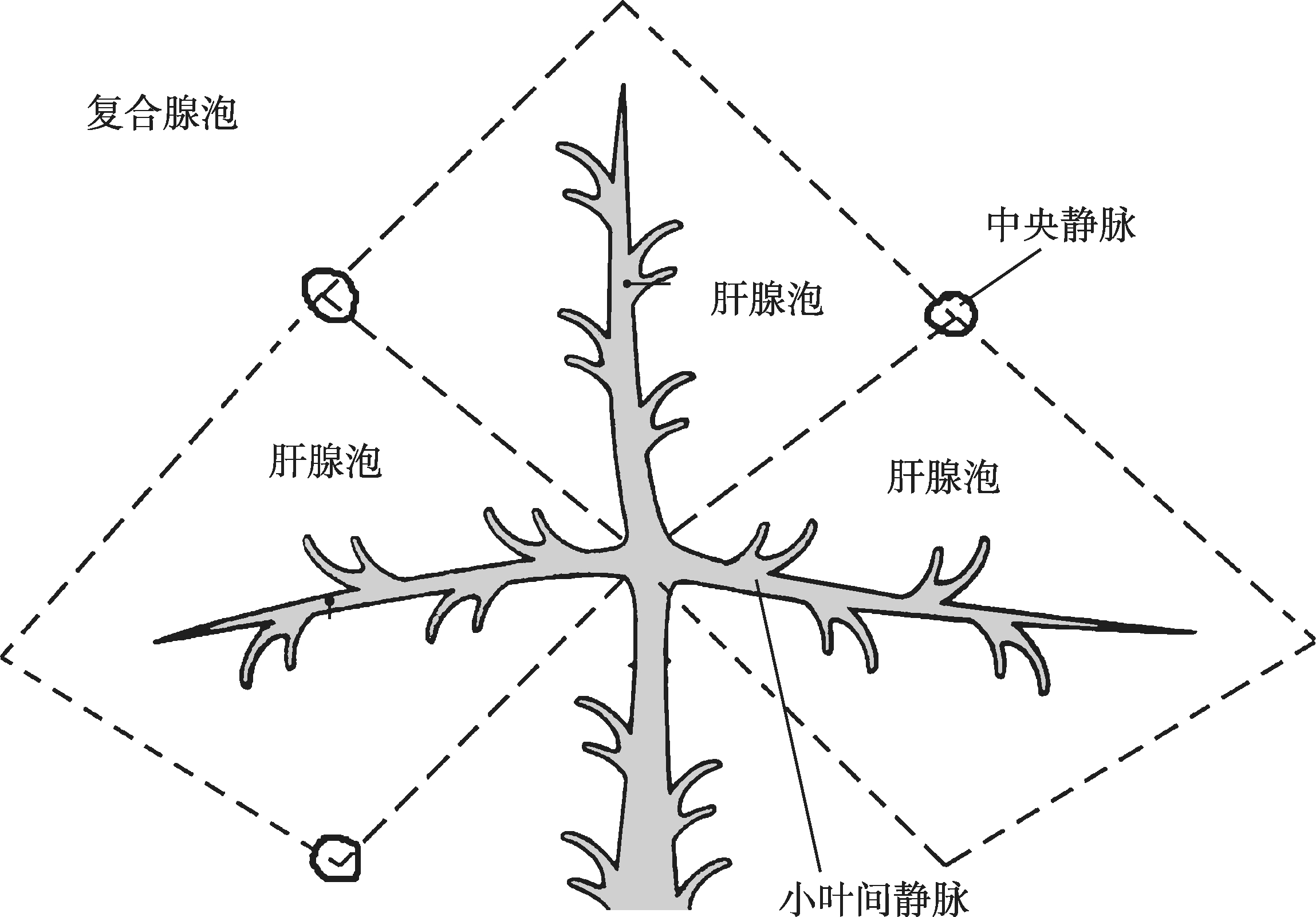
图4-16-6 复合腺泡模式图
相邻肝小叶之间呈三角形或椭圆形的结缔组织小区,称门管区(portal area),每个肝小叶周围一般有3~5个门管区。门管区内可见到三种主要的管道分支,即小叶间动脉、小叶间静脉和小叶间胆管(图4-16-4)。小叶间动脉(interlobular arteriole)是肝动脉的分支,管径较细,管腔较小,管壁相对较厚,内皮细胞外有数层环形平滑肌;小叶间静脉(interlobular vein)是门静脉的分支,管腔较大而不规则,管壁薄,内皮细胞外仅有少量散在的平滑肌;小叶间胆管(interlobular bile duct)是胆管的分支,管壁为单层立方上皮衬附,管腔狭小,它们向肝门方向汇集,最后形成左、右肝管出肝。
在非门管区的肝小叶间结缔组织中,还有单独走行的小叶下静脉,由中央静脉汇集形成,它们在肝门部汇合成肝静脉。
肝的纤维结缔组织主要分布在肝小叶之间的血管和胆管周围,门管区纤维结缔组织呈围管状包绕血管及胆管的分支。这些纤维结缔组织主要为网状纤维,还含有胶原纤维(主要为Ⅰ型胶原)及弹力纤维,偶见成纤维细胞。小叶间纤维结缔组织通常连接着2个或2个以上的肝小叶。
网状纤维特殊染色显示,肝小叶内肝细胞的周围有网状纤维,电镜观察在窦周隙内也可见到分散的网状纤维。在肝小叶内的网状纤维起着支持肝细胞并使血窦保持开放的作用。
肝损伤时,如果网状纤维支架尚完好,则肝细胞的再生较快,通过肝细胞的再生修复,受损肝组织的结构可基本恢复正常。
由于肝脏是人体重要的物质代谢器官,所以肝脏的血管分布极其丰富。血流量也大,成人肝血流量每分钟可达1500~2000mL。血液由门静脉和肝动脉流入肝脏,由肝静脉流出肝脏。与其他脏器不同,肝血液循环有三个系统,即动脉系统、门脉系统和静脉系统。
肝动脉是肝的营养性血管,为肝提供氧及其他器官的代谢产物。它进入肝门后分支,至门管区形成小叶间动脉与门静脉的分支小叶间静脉伴行,其终末支穿过界板,通入肝血窦。小叶间动脉还发出小分支营养被膜、间质和胆管。肝动脉及其分支受阻可导致肝脏发生缺氧性病变。
门静脉是肝脏的功能性血管,门静脉的血液来自消化道,含有丰富的营养物质,可供肝细胞代谢、贮存和转化。与肝动脉相似,门静脉进入肝后,沿小叶间结缔组织分支,形成小叶间静脉与小叶间动脉伴行。小叶间静脉又不断分支,形成的终末支穿过界板注入肝血窦。肝窦内的血液自小叶的周边向中央缓慢流动,使肝细胞能充分进行物质交换。
位于肝小叶中轴的中央静脉为肝静脉的终末支,它们收集了肝小叶的静脉血,汇合入小叶下静脉。小叶下静脉单独走行于肝小叶间结缔组织中,进而汇合成2~3支肝静脉,出肝后汇入下腔静脉。中央静脉内皮细胞外无平滑肌,只有少量结缔组织。
肝细胞吸收血浆中的胆红素后,经滑面内质网内的葡萄糖醛酸转移酶的作用,转化为水溶性的结合胆红素,释放入胆小管,与胆盐及胆固醇等共同组成胆汁。成人每天可分泌胆汁600~1000mL,胆小管内的胆汁从肝小叶的中央流向周边。胆小管在肝小叶周边移行汇集为若干短小的管道,称闰管或Hering管。闰管较细,上皮由立方细胞组成,细胞着色浅,胞质内的细胞器较少。目前认为闰管上皮细胞分化较低,肝细胞再生时闰管上皮细胞增殖并能分化为肝细胞,具有干细胞性质。闰管在门管区汇入小叶间胆管,小叶间胆管向肝门方向汇集,最后形成左、右肝管出肝,在肝外汇合成肝总管,再由胆囊管入胆囊,或经胆总管入十二指肠。
小叶间胆管衬以立方或低柱状上皮细胞,外有基底膜,直径30~40μm,PAS染色阳性。角蛋白CK8和CK18染色在胆管细胞和肝细胞都呈阳性反应,但胆管细胞有角蛋白CK7和CK19阳性表达,肝细胞则呈阴性反应,表明两种上皮细胞所含的中丝角蛋白的分子结构有所不同,以此可作鉴别。
肝的重要特征之一是它具有强大的再生能力。正常人体的肝细胞是一种长寿命细胞,极少见分裂象。但在肝受损伤后,尤其是在肝大部分切除(切除2/3)后,在残余肝不发生炎症和纤维增生的情况下,肝细胞可迅速出现活跃的分裂增殖,并能精确地调控自身体积的大小,其功能也可完全恢复。动物实验证明,肝脏被切除3/4后,肝的生理功能仍可维持,并逐渐恢复原来的重量。肝病患者施行大部或部分肝切除后也具有再生能力,但因病变情况而异,一般可在半年内恢复正常肝体积。
在肝脏病理情况下,肝组织内可出现一种圆形细胞,称卵圆细胞(oval cell),在肝病理性损害后的再生过程中常可见到卵圆细胞的增生。一般认为,卵圆细胞是肝内的干细胞增殖而成的未分化细胞,其结构与终末胆管上皮细胞相似,参与形成肝细胞和胆管细胞。目前已成功制备特异性的单克隆抗体,用以检测卵圆细胞,研究它与肝细胞的分化、再生和癌变的关系。
儿童及老年人的正常肝脏,由于其经历了发育或衰老的过程,在组织形态学上与成年肝脏相比可出现某些变化。在进行肝组织病理诊断中,特别在肝穿活检组织中易被误认为是病理性反应。
在妊娠末期,胎儿肝小叶结构已发育成熟,有正常的中央静脉和门管区结构。胎儿出生后,原来由脐带来的血流中断,使门静脉成为肝脏的主要血流系统。因胚胎期肝脏还具有造血功能,所以新生儿肝组织结构与成人肝脏所不同的最突出特点是肝血窦及门管区可见造血细胞存在,此为髓外造血的残留。出生后,胚胎期的有核红细胞迅速分化成熟为无核形态。在幼儿期,肝小叶的肝板绝大多数是由2~3层肝细胞组成。至4~5岁,才逐渐成为单层肝细胞构成的肝板结构。儿童肝脏中肝细胞及细胞核的大小一致,与成人相比变化小。儿童肝脏门管区周边的肝细胞中,有时可出现丰富的糖原和空泡等变化,这并不是糖尿病引起的。有些肝细胞胞质中可见脂褐素颗粒,一般在10岁以后,应极少见到脂褐素颗粒。
在老年人肝脏的肝小叶中,与成人肝脏相比最突出的特点是肝细胞和细胞核的大小不一,有的细胞核极度增大,核仁增多,出现多倍体核等,但这些细胞不是异型增生的细胞。老年人肝细胞内可见少量脂肪空泡,这些脂肪空泡的出现与肥胖或饮酒无明显关系。部分老年人肝脏有灶性肝细胞水变性、含铁血黄素沉着或核空泡变等,都属于正常现象。老化的肝细胞内有大量脂褐素沉着和肝细胞萎缩。肝脏门管区的纤维结缔组织可随年龄的增长而更加致密,小叶间动脉管壁可增厚,这些形态学变化与老年人肝脏代谢功能变化相一致。
(陈丽红)