




肝脏是一个独特的器官,不仅是人体最大的代谢、解毒和内分泌器官,还在胚胎期承担造血作用。近年发现,肝脏富含各类免疫细胞,参与固有和适应性免疫应答,是一个特殊的免疫器官。肝脏免疫组织结构及肝内免疫细胞种类不同于外周免疫器官组织。此外,肝脏是多种免疫分子的主要来源,如炎症性细胞因子、补体成分、急性期蛋白及趋化因子等,在病毒性肝炎的发生及转归中扮演着重要的角色。深入认识肝脏免疫微环境对于病毒性肝炎等疾病的防治具有重要的意义。
肝脏的血液循环体系比较特殊,具有双重的血供,80%血供是通过门脉系统从肠道获得,20%血供来自肝动脉系统。肝门静脉、肝固有动脉与肝管通过肝门进入肝脏,三者及其各级分支在肝内伴行。三者在肝小叶间结缔组织内的汇集部位称为门管区或汇管区(portal tract)(图3-11-1)。
肝脏的免疫应答之所以复杂,还在于肝窦状隙(hepatic sinusoid)这个特殊的组织结构。肝血窦是相邻肝板之间的腔隙,是一种无基底膜的特殊的毛细血管。肝血窦壁由肝细胞的细胞膜构成,其通透性较大,不仅有利于免疫细胞的渗出和迁移,也有利于免疫细胞与肝脏细胞、肝星形细胞等进行接触,从而与嗜肝病原体进行多样化的相互作用,包括免疫清除、免疫抑制和免疫耐受的发生。肝血窦内皮细胞与肝细胞之间有一狭窄间隙,称Disse腔隙(space Disse),是肝细胞与血浆之间进行物质交换的场所(图3-11-1)。
肝脏的淋巴液引流有两条通路:①上行通路,肝小叶中央区域的淋巴液被引流至与肝筋脉并行的淋巴管中,最后进入胸内淋巴结;②下行通路,肝小叶周围Disse腔液体进入毛细淋巴管,被引流至门静脉伴行的淋巴管,汇入肝脏淋巴结。约80%的肝内淋巴液通过下行通路进入肝淋巴结,进而引流至十二指肠韧带淋巴结。人肝脏淋巴结主要沿着肝门部位的肝总动脉排列。慢性肝炎及某些自身免疫性肝病患者的门脉区常常可见类似淋巴滤泡的组织结构,含有生发中心,是B细胞活化增殖及克隆选择的场所,称为门脉相关的淋巴组织(Portal tract-associated lymphoid tissue)。慢性丙型肝炎比慢性乙型肝炎及自身免疫性肝病门脉相关的淋巴组织及生发中心的形成更明显。该区域可能是肝脏局部免疫应答的场所,是肝脏淋巴循环的第一道防线。
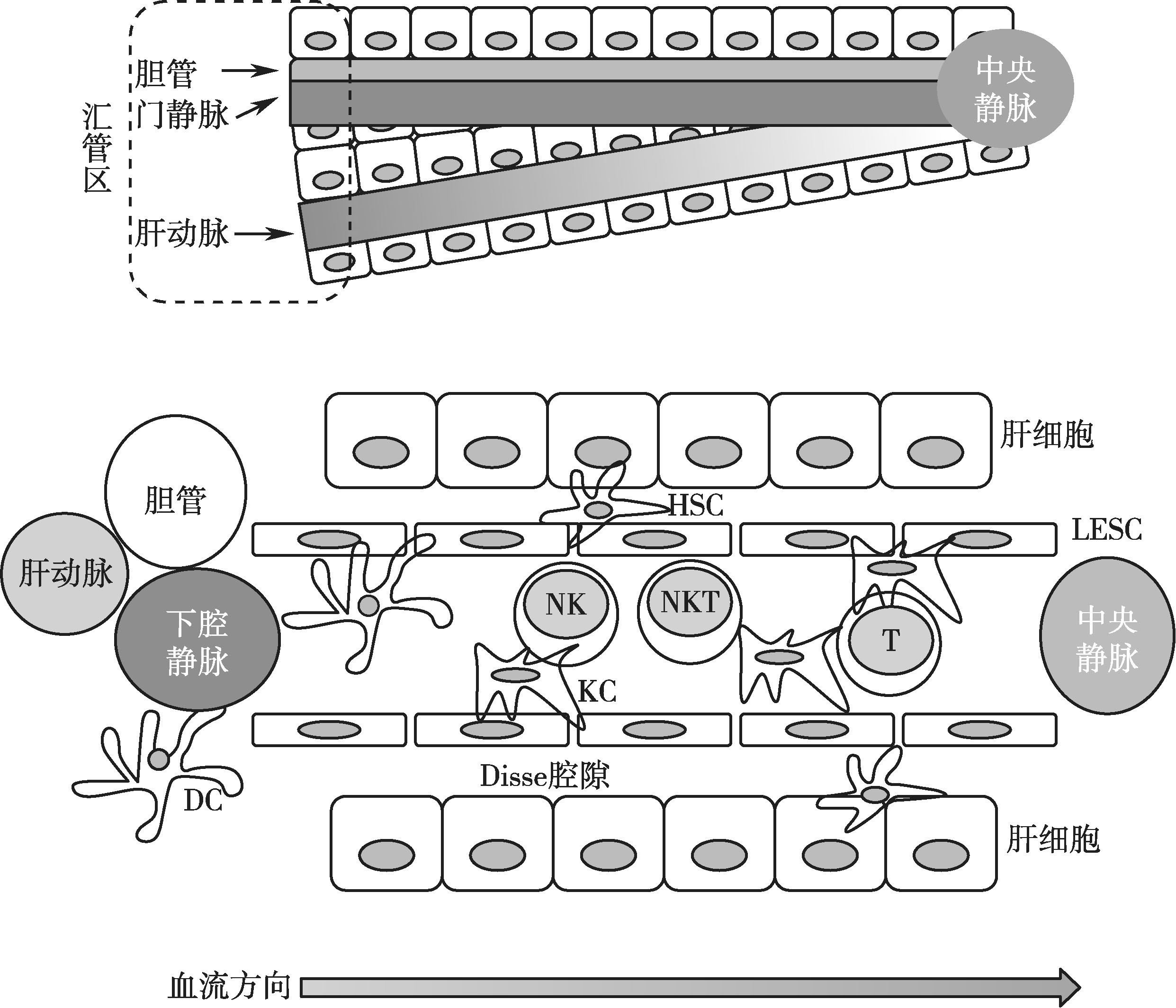
图3-11-1 肝脏内免疫细胞的种类及肝血窦隙结构示意图
注:肝汇管区由小叶间静脉、小叶间动脉和小叶间胆管汇集,肝内血流从肝动脉和门静脉经过各级分支到汇管区的小叶间动静脉,然后全部汇入肝血窦,血窦的血液从小叶周边汇入中央静脉(参见示意图血流方向)。相邻肝板之间的间隙称肝血窦,肝血窦内富含各类免疫细胞,包括NK细胞、NK T细胞、T淋巴细胞、DC、KC(库普弗细胞)等。Disse腔是血窦内皮细胞(LSEC)与肝细胞之间的狭小的间隙,也称窦周间隙,是肝细胞表面和血浆直接进行物质交换的场所。肝星形细胞(HSC)位于Disse 腔内,胞质内富含维生素A和甘油三酯的脂滴,与肝纤维化发生发展相关
肝细胞和肝非实质细胞共同构成肝脏免疫微环境由,二者相互左右和相互制约,共同维持肝脏的免疫稳态,在病毒性肝炎及其他肝脏疾病进展中发挥不同的作用。肝非实质细胞中富含各类免疫细胞,占肝脏细胞总量的20%~40%,包括自然杀伤细胞(natural killer,NK细胞)、NK T 细胞(natural killer T cell)、T 淋巴细胞、调节性 T 细胞(regulatory T cell,Treg)、B 淋巴细胞、树突状细胞(dendritic cell,DC)、库普弗细胞(Kupffer cell,KC)、肝星形细胞(hepatic stellate cell,HSC)、肝窦内皮细胞(sinusoidal endothelial cell,LSEC)等,构成纷繁复杂的固有免疫和适应性免疫应答景象。根据其参与免疫应答的特征及功能分为固有免疫细胞、抗原提呈细胞及适应性免疫细胞三大类。
肝脏具有独特的循环体系,可以接受从门脉系统及肝动脉来源的多种抗原性物质。因此,肝脏必须拥有一套快速选择性的反应机制以应对这些进入肝脏的各类潜在“危险信号”。固有免疫反应作为入侵病原菌的一线防御机制,在接受各类“危险信号”后,迅速做出应答,通过产生一系列的细胞因子(如干扰素等)、急性期反应蛋白及防御性分子而发挥作用。既往病毒性肝炎的研究重点多关注适应性免疫,尤其是细胞毒性T淋巴细胞在急性肝细胞损伤及慢性肝炎进展中的作用。近年来研究发现,肝组织中存在一系列固有免疫细胞,如库普弗细胞、树突状细胞、γδT细胞、NK T细胞和NK细胞等。在外周血中,NKT、NK细胞和TCR γδT占淋巴细胞的17%,而这些细胞占肝内淋巴细胞池的65%以上。这些细胞在病毒性肝炎进展中发挥着重要的作用。
在正常人肝脏淋巴细胞池中,NK细胞占30%~40%,该比例显著大于其在外周血淋巴细胞中的比例(5%~10%),提示NK细胞在病毒性肝炎进展中扮演着重要的角色。NK细胞通过细胞表面的活化型及抑制型受体与病毒感染的靶细胞或肿瘤细胞的相应配体特异性地识别,启动一系列胞内信号通路,各种信号的整合最终决定NK细胞是杀伤靶细胞还是处于抑制状态。早在1991年,西班牙学者Echevarria等就发现急性乙型肝炎(AHB)患者病程早期外周血NK细胞的活性和IL-2的水平显著升高,两者成正相关,恢复期两者水平逐渐复常。随后发现,肝内的NK细胞可识别MHC-Ⅰ类分子低表达的肝细胞(“非己”识别机制)而被活化,释放IFN-γ、TNF-α等细胞因子,通过非溶细胞机制杀伤病毒感染的肝细胞。因此,NK发挥的细胞毒作用可能是早期控制HBV感染的关键因素。在慢性乙型肝炎患者肝脏内富集活化并表达TRAIL的NK细胞,其肝细胞表达TRAIL死亡诱导受体的水平也升高,肝脏NK细胞可通过TRAIL途径诱导HBV感染的肝细胞发生凋亡。在病毒特异性IgG抗体存在的条件下,NK细胞也可以通过表面IgG Fc受体(FcγRⅢ)介导γ,通过抗体依赖细胞介导的细胞毒作用(antibody dependent cell mediated cytotoxicity,ADCC),识别杀伤与 IgG抗体特异性结合的肿瘤或病毒感染的靶细胞。然而,在慢性乙型肝炎的进展过程中,NK细胞的细胞毒作用及释放IL-2及IFN-γ的活性均被抑制。在急性HCV感染中发现,HCV E2蛋白可导致CD81分子交联,从而抑制NK细胞释放IFN-γ;在慢性HCV感染中,NK细胞表面活化受体NKp46和NKp30表达均下调;这些机制可能是HCV逃逸免疫攻击的重要机制。
新近研究发现,肝脏内存在一群驻留型自然杀伤细胞(liver-resident NK cell)。这群细胞与传统NK细胞(conventional NK cell)不同,具有适应性免疫细胞的免疫记忆功能特征。这群细胞的发现有助于揭示NK细胞在病毒性肝炎等疾病中新机制。
NK T细胞在肝脏中的含量也十分丰富,小鼠NK T细胞占肝脏淋巴细胞的30%~50%,而其在脾和外周血中的比例只有0.15%和0.11%。NK T细胞兼有NK细胞和传统T细胞的表面标志,人NK T细胞表达CD56 + CD3 + ,小鼠NK T细胞表达NK1.1 + CD3 + 。NK T细胞表面表达TCR密度较低,多为TCRαβ型,且缺乏多样性。NK T细胞表面的TCR可通过识别靶细胞表面CD1d分子(MHC-Ⅰ类分子相关抗原)提呈的脂类和糖脂抗原而活化,活化的NK T细胞可通过分泌穿孔素或Fas-FasL途径杀伤靶细胞。因此,NK T细胞在肝炎病毒感染早期发挥清除病毒作用。
此外,NK T细胞在病毒感染时起着固有免疫与适应性免疫之间的桥梁作用。不同于NK细胞和naïveT细胞,NK T细胞表达丰富的IL-12受体复合物,成为IL-12作用的首要目标。DC分泌IL-12对NK T细胞的活化及随后的IFN-γ分泌至关重要。在小鼠,a-Galcer是NK T细胞活化剂,激活的NK T细胞通过释放IFN-α/β控制HBV转基因小鼠体内HBV的复制。活化NK T细胞亦分泌IFN-γ,后者在整个HBV及HCV的感染过程发挥中重要的作用。IFN-γ可诱导肝实质细胞及非实质细胞(库普弗细胞、浸润的炎症细胞)表达趋化因子CXCL9及CXCL10,继而趋化一系列表达CXCR3的炎症细胞(单核细胞、中性粒细胞等)浸润肝脏,导致肝脏的炎性损伤。在HBV慢性感染患者外周血中,NK T细胞数量随着肝损伤程度的加重而明显减少。
TCRγδ T细胞是在1986年发现的一类特殊的T淋巴细胞,其表面的淋巴细胞受体是由γ和δ链构成。该群细胞仅占外周血淋巴细胞的1%~5%,主要分布于皮肤的皮下组织及小肠、肺、泌尿生殖器官等黏膜固有层中,是上皮内淋巴细胞(intraepithelial lymphocyte,IEL)的主要成分之一,在黏膜免疫中起着重要作用。已有研究发现,肝脏淋巴细胞也富含γδT细胞,在正常小鼠的肝组织TCRγδ T细胞占到淋巴细胞总数的3%~5%,占肝细胞总数的15%~25%。病毒性肝炎患者肝组织中TCRγδ T细胞亦明显高于健康对照者;肝荷瘤小鼠TCRγδ T细胞所占的比例亦明显升高。在急性乙型肝炎病毒感染小鼠早期(第1及第10天)即可观察到γδT细胞的水平上升,提示γδT细胞参与肝炎病毒感染早期非特异性清除过程。
在人外周血中,γδT细胞主要分为两个亚群:Vδ2T细胞亚群占50%~90%,Vδ1T细胞亚群占10%~50%。国内重庆医科大学任红及中国人民解放军总医院第五医学中心的王福生课题组深入研究了人γδT细胞不同亚群与HBV感染的相互关系。结果显示:与同健康对照和免疫耐受组患者相比,慢性乙型肝炎免疫活化期患者外周血和肝脏的中Vδ2T细胞亚群比例均显著降低,Vδ2T细胞比例且与转氨酶水平酶和肝脏炎症程度显著负相关。体外研究证实,慢性乙型肝炎患者外周血来源γδT细胞的杀伤能力及释放IFN-γ的能力均较健康对照者低。由此推测,γδT细胞数量减少和功能障碍可能是HBV感染慢性化的重要因素。
肝炎病毒是一类嗜肝性病毒,肝内多种细胞都可作为抗原提呈细胞作用,包括肝细胞、肝血窦内皮细胞、库普弗细胞及树突状细胞等。不同的抗原提呈细胞在肝炎病毒感染的不同时期通过不同的机制发挥作用。
树突状细胞(dendritic cell,DC)是目前已知体内抗原提呈能力最强的APC,是唯一可直接活化naïve T细胞(初始T细胞)的APC,广泛分布于脑以外的全身各脏器。树突状细胞在细胞免疫应答的启动、控制和病毒感染的清除过程起着枢纽的作用。人肝脏DC最早于1981年由Barbatis发现,其表达MHC-Ⅱ类分子高于库普弗细胞,具有较强的体外扩增和向刺激淋巴细胞组织定向迁移的能力,但不能刺激初始T淋巴细胞活化和增殖。肝内DC高表达CD45分子,但缺乏DC特有的表面标志(CD11c分子)。与脾脏及骨髓来源的DC不同的是,肝脏DC表达MHC-Ⅱ类分子水平较低,提示肝脏DC处于分化的不成熟阶段,故其无法诱导初始T细胞活化。这一特性有利于维持肝脏免疫耐受的微环境。
库普弗细胞(Kupffer cell,KC)是肝脏的巨噬细胞,占全身巨噬细胞总数的80%~90%,是体内最大的巨噬细胞群。库普弗细胞定居于肝血窦,存在于肝血窦内皮细胞之上或之间,并通过突入内皮细胞下Disse间隙的胞质突起与肝细胞直接接触,约占肝窦细胞总数的30%。库普弗细胞生存期为4~16周,其主要的功能是吞噬清除作用。在生理条件下,库普弗细胞具有吞噬和清除血流中细菌、异物等不可溶性废物的作用。库普弗细胞与脾脏和淋巴结的巨噬细胞不同,不增强抗原免疫原性,反而能消除抗原免疫原性。这一特性促使肝脏的免疫状态倾向于免疫耐受而非免疫反应。
肝血窦内皮细胞(liver sinusoidal endothelial cells,LSEC)是衬附于肝血窦内表面的一层微血管内皮细胞,将肝血窦内的血细胞与肝细胞分隔开,使二者不能直接接触。LSEC在肝内的含量十分丰富,约占肝内非实质细胞的50%。LSEC是最先接触肝脏血流的细胞群,具有很多其他内皮细胞所不具备的特性。LSEC上有许多直径约为100nm的小孔,即窗孔,这些窗孔成簇分布而构成筛网结构,在肝细胞和血液间形成一个通透性屏障。LSEC筛网结构有利于血液和肝细胞的物质交换,也有利于免疫细胞的渗出和迁移。
肝细胞(hepatocyte)亦可以作为抗原提呈细胞活化T淋巴细胞。肝细胞表达MHC-Ⅰ类分子的含量比其他抗原提呈细胞低得多,需要比其他抗原提呈细胞高100倍的抗原含量才能激起相同的CD8 + T细胞活化。体外试验表明,肝细胞可以提呈病毒抗原并激活CD8 + T细胞,CD8 + T细胞在激活后第3~4天迅速发生凋亡。其可能的原因是肝细胞缺乏协同刺激信号,接触抗原活化后易发生凋亡。肝细胞不仅表达MHC-Ⅰ类分子,在肝脏发生炎症反应时,肝细胞还表达MHC-Ⅱ类分子,激活CD4表达。与DC活化CD4细胞不同的是,由于肝细胞不表达协同刺激信号,提呈外源性抗原后,诱导CD4 + T处于无能状态。肝细胞低表达MHC-Ⅰ类分子及缺乏协同刺激分子的特性,诱导大量T细胞激活后迅速发生凋亡,尤其是与MHC-Ⅰ类具有高亲和力结合的CD8 + T细胞。此外,肝细胞和库普弗细胞还可分泌大量的精氨酸酶1,导致低精氨酸的肝内环境,抑制T细胞等效应的活化。
肝星形细胞(hepatic stellate cell,HSC)位于 Disse腔隙内,紧贴着肝窦内皮细胞和肝细胞,约占肝脏所有细胞的13%。因其胞质富含维生素A和甘油三酯的脂滴,又称为肝贮脂细胞(fat-storing cell,FSC)、脂细胞(lipocyte)、维生素 A 贮存细胞(vitamin A-storing cell)、窦周细胞(persinusoidal cell)、Ito细胞等。正常情况下,肝星形细胞处于静止状态;当肝脏受到炎症或机械刺激等损伤时,肝星形细胞被激活。目前的观点认为,肝星形细胞的激活与增殖参与肝纤维化及肝再生过程。在肝组织内,静息HSC具有储存类视黄醇类物质(如维生素A)及产生胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的作用。在病理条件下,通过旁分泌、自分泌刺激因素的作用,肝星形细胞增殖并激活,激活的HSC逐渐失去静息型HSC具有的储存类视黄醇类物质的功能,开始表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、波形蛋白(vimentin)及结蛋白(desmin)等基质蛋白,成为肌成纤维细胞(myofibroblast),称之为“激活型”或“转移分化型”,同时拥有静止和激活状态特征的过渡期细胞。当肝实质细胞受到损伤时,邻近的肝细胞、库普弗细胞、肝血窦内皮细胞和血小板等通过旁分泌作用释放多种细胞因子,如肿瘤坏死因子α(TNF-α)、转化生长因子β(TGF-β)、胰岛素生长因子(IGF-1)、肝细胞生长因子(HGF)、血小板源性生长因子(PDGF)等,激活并促进HSC增殖等。激活后的肝星形细胞可自分泌TGF-β、PDGF等细胞因子使得HSC活化得以持续。肝星形细胞持续活化是肝纤维化发生发展过程中的关键环节。一方面,激活与增生的肝星形细胞通过分泌细胞外基质参与肝纤维化的形成和肝内结构的重建;另一方面,细胞因子使得肝窦内压升高,最终导致肝纤维化及门静脉高压症的发生。
肝脏含有大量肝内淋巴细胞(intrahepatic leukocytes,IHLs)。机体的淋巴细胞总数为10 12 ~10 14 个,正常成人肝脏可分离淋巴细胞总数为10 9 ~10 11 个,主要分布于肝实质和门静脉内。肝内淋巴细胞种类较多,除了上述NK T细胞、NK细胞、TCRγδ T细胞等固有免疫细胞外,还有TCRαβ T细胞(CD4 + Th、CD8 + Tc)及B淋巴细胞等适应性免疫细胞。
肝内TCRαβ T细胞约占小鼠肝脏淋巴细胞总数的35%,CD8 + Tc比例高于 CD4 + Th,CD8 + Tc生理条件下多处于耐受状态。肝内的NK细胞及NK T细胞等固有免疫细胞活化后可释放大量的细胞因子,具有招募外周血T细胞的作用,但招募后的淋巴细胞进入肝脏后易发生凋亡。肝内大多数T细胞凋亡的原因,有两种假说。第一种称为“墓地假说”。在肝内发生凋亡的T细胞在外周已经被激活(高表达CD25及CD69),以一种非特异的方式进入肝脏,由于肝内库普弗细胞及肝细胞高表达FasL,活化T细胞表达Fas,接受凋亡信号发生凋亡。第二种假说认为可能由于肝细胞具有提呈抗原的功能,但又缺乏协同刺激分子,T细胞在肝内被激活而迅速发生凋亡。
肝内B细胞约占小鼠肝脏淋巴细胞总数的30%,占人肝脏淋巴细胞10%左右。肝内B细胞表型与脾的B2细胞相似(CD5 - CD19 + )。肝内B细胞可以在T细胞的协助下,分化成抗体形成细胞,产生的抗体可抵御嗜肝病毒的感染,亦介导病毒性急性重型肝炎及促进肝纤维化等免疫病理损伤。
肝脏是体内最大的免疫耐受器官。肝脏免疫耐受不仅表现在肝脏局部免疫耐受微环境,使得进入肝脏的病原体容易发生慢性感染,更重要的是优先进入肝脏的抗原可诱导全身免疫耐受。主要的临床和实验依据有:①肝移植成功率高,排斥反应相对于其他实质脏器相对弱;②肝脏移植成功后,受者对来自同一供体的其他器官移植排斥反应显著减弱;③在肝细胞异位表达自身抗原甘露糖结合蛋白(mannose-binding protein,MBP)的实验小鼠体内,难以诱导实验性自身免疫性脑脊髓炎模型(EAE);④对HBV慢性携带者接种HBV表面抗原,不能触发免疫应答。
诱导肝脏产生局部及全身免疫耐受的机制尚不十分明确。肝内有多种不同的抗原提呈细胞,其表达不同的病原体相关分子模式识别受体不尽相同,不同病原体进入肝脏诱导免疫耐受的机制各异。
肝脏实质细胞及肝内免疫细胞均可发挥免疫调节作用,共同维护肝内环境的稳定。肝内免疫细胞亦可与全身外周免疫细胞相互作用,构成复杂的免疫调控网络。不同类型的细胞免疫调节的作用机制不同。
肝脏免疫应答具有固有免疫优势状态及免疫耐受的趋势。深入分析这一独特区域免疫微环境的特性及免疫细胞、免疫分子相互作用机制,对于阐明肝脏疾病发生发展的机制并探索肝病诊疗策略具有重要作用。
(张秋玉)