




乙型肝炎病毒是一种种属特异性和组织特异性极强的DNA病毒。人HBV只感染人及高等灵长类动物(如黑猩猩等),不感染医学研究中常用的哺乳类实验动物,亦不易感染体外培养的细胞株。HBV感染具有组织特异性,特异性地感染人类原代肝细胞。由于体外条件下,肝细胞表面HBV受体丢失或细胞结构和生长环境的改变,一直难以建立稳定的肝脏源性细胞HBV体外感染模型。因此,建立高效的体外细胞模型成为HBV研究的关键。
目前建立的HBV细胞模型主要分三类:可直接感染HBV的细胞模型;通过分子生物学技术、基因工程技术改造肝癌细胞基因获得的可感染HBV的重组细胞模型和HBV功能性受体钠离子-牛磺酸共转运蛋白高表达的新型细胞模型。
人肝癌细胞(如PLC/PRF/5、Huh7、HepaRG)及永生化肝细胞HepG2的转染与感染细胞模型的建立,为HBV的研究提供了体外试验条件。不同模型各有优缺点,具体见表1-7-1。
表1-7-1 不同HBV细胞模型的使用范畴及局限性

续表

黑猩猩等高级灵长类动物的感染模型是评价HBV疫苗和治疗药物的可靠动物模型。此外,低灵长类的树鼩、禽类的鸭、啮齿动物土拨鼠及HBV转基因小鼠等均证实可以作为HBV感染模型,用于等研究病毒感染细胞、病毒的复制及生活周期、抗病毒药物的评价等。
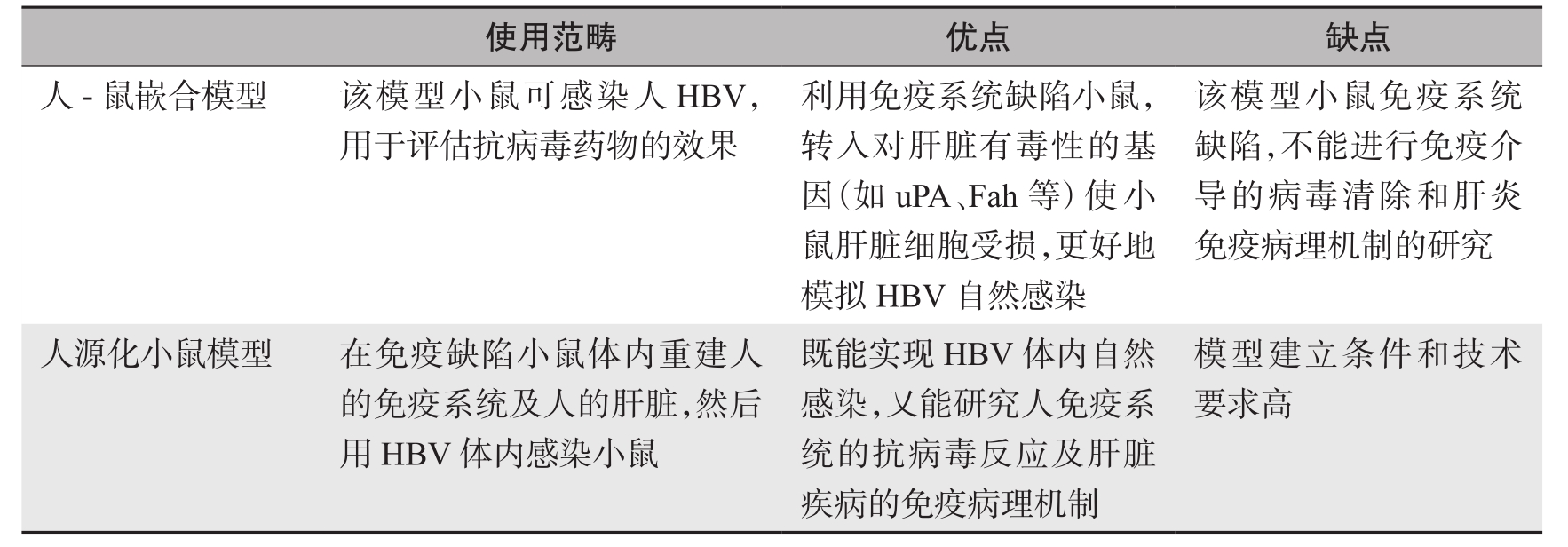
不同HBV动物感染模型的使用范畴、优点及局限性见表1-7-2。
表1-7-2 不同HBV动物感染模型的使用范畴、优点及局限性
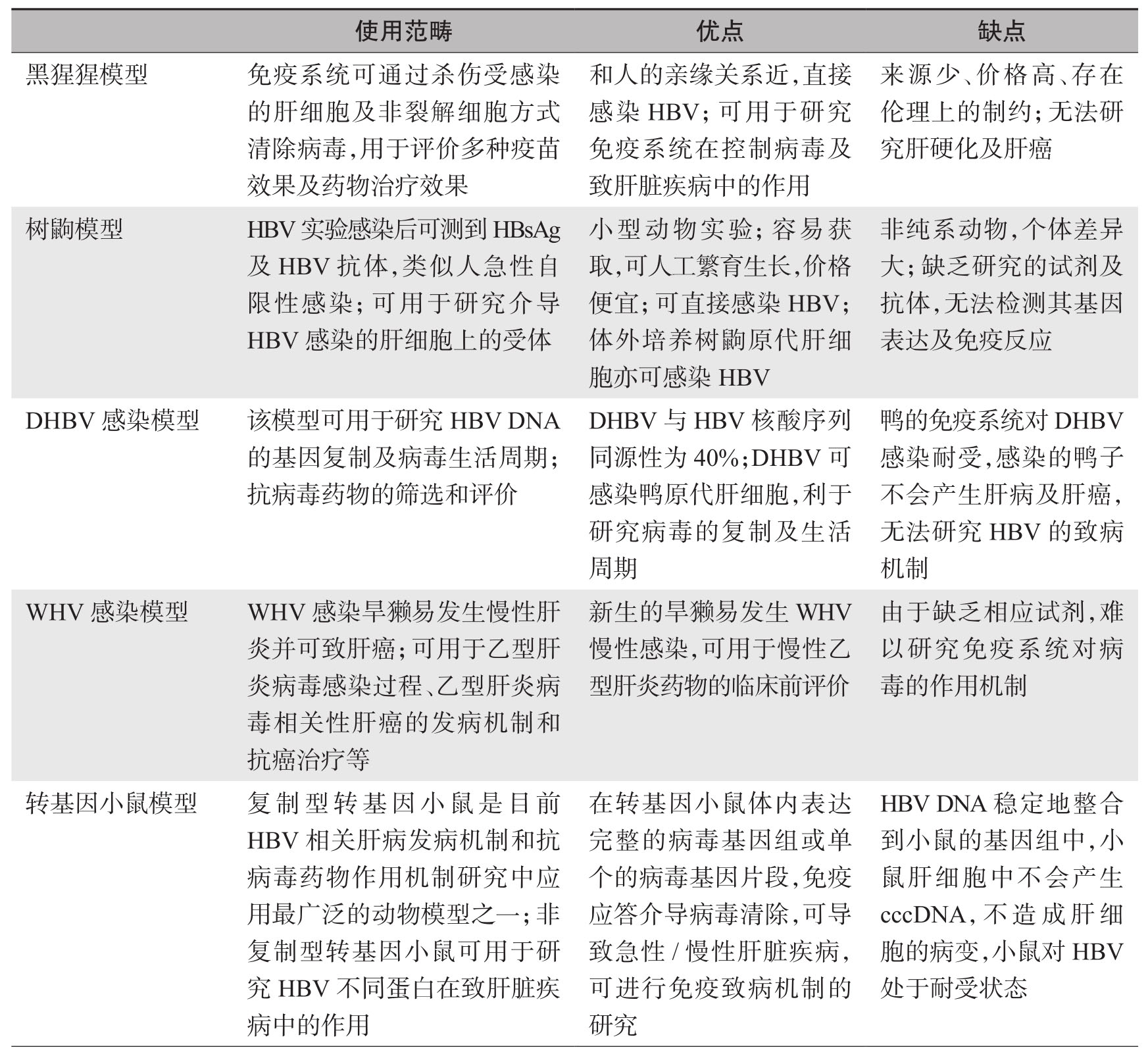
续表
(张秋玉)
长期以来,黑猩猩是唯一的非人类的体内HCV感染复制模型,经多年的努力,从只有复制阶段到具有整个病毒生命过程的体外复制模型逐渐建立。最近,由于HCV的感染与复制机制的逐渐阐明,体内动物模型也逐步建立和完善,尽管仍存在诸多问题,但为阐明HCV复制过程和致病机制以及为药物和疫苗研发提供了极有利的工具。
25年来尤其是近9年来,HCV体外细胞培养系统研究已经取得了巨大进展,目前已有HCV 复制子系统(replicon)、HCV 假病毒(hepatitis C virus pseudo-particles,HCV pp )、反向互补 HCV 颗粒(trans-complemented HCV particles,HCV TCP )和 HCV 细胞培养系统(HCV cell culture,HCVcc)等多种体外研究模型,这些模型的应用促进了HCV-宿主相互作用的研究、抗病毒靶点的发现及药物的开发以及疫苗的制备和评价等工作的深入开展。
1999年Ralf Bartenschlager研究组在 Science 上首先报道了选择性双顺反子亚基因组HCV RNA复制子系统,建立了在肝癌细胞系Huh7细胞中可以高水平自主复制的亚基因组复制模型(复制子),为HCV致病机制研究及抗病毒药物评价提供了一个新的途径。该复制子是一段可以在细胞内自我复制的RNA,包含1b型Con 1分离株的非结构蛋白基因NS3-NS5B以及两个非翻译末端5'-UTR和3'-UTR(图1-7-1)。HCV的内部核糖体进入位点(internal ribosome entry sites,IRES)下游是外源筛选标记——新霉素磷酸转移酶(neomycin phosphotransferase,neo)基因;脑心肌炎病毒(encephalomyocarditis virus,EMCV)的 IRES 则控制下游NS3-NS5B的翻译。通过G418药物筛选,可以筛选得到稳定表达的细胞系。目前已成功构建多种基因亚型的亚基因组复制子,如1a(H77)、1b(Con1、HCV-N、HCV-BK、HCV-J4、1B-2/HCV-O 和1B-1/M1LE)、2a(JFH1)、3(S52)、4(ED43)、5a 和6a。除新霉素磷酸转移酶基因外,其他抗性筛选基因如嘌呤霉素乙酰转移酶基因、潮霉素磷酸转移酶基因或报告基因如萤火虫荧光素酶基因(firefly luciferasec,Fluc)、海肾荧光素酶基因(renilla luciferase,Rluc)、绿色荧光蛋白(green fluorescent protein,GFP)基因等均可插入亚基因组复制子载体上,从而满足不同实验需要及高通量筛选,并可鉴定抗病毒药物的靶点。与感染性HCV系统相比,亚基因组复制子系统具有不受基因型限制的优势。
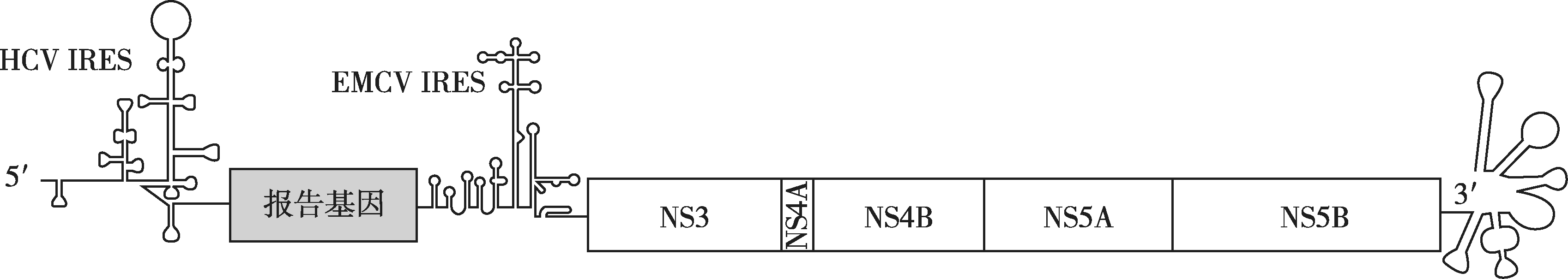
图1-7-1 HCV亚基因复制子
在亚基因组复制子基础上,人们构建了全基因组复制子系统。虽然基因1型来源的全基因组复制子可以在Huh7细胞内复制,但其复制效率显著低于亚基因组复制子。
虽然亚基因组复制子由于缺乏HCV结构蛋白,没有感染性子代病毒颗粒产生,复制子系统的建立及其应用发挥了重要作用,为目前直接抗病毒药物(direct-acting antiviral agent,DAA)的发展起了很大的推动作用,也促进了HCV复制机制的研究,并发现或验证了多种参与HCV RNA复制的宿主因子,如磷脂酰肌醇4-激酶Ⅲα、microRNA-122、亲环素A等,加深了HCV与宿主之间相互作用的认识。
2003年Bartosch B等建立了HCV假病毒系统。该系统利用逆转录病毒(或慢病毒)载体包装系统,通过同时转染3种质粒(HCV蛋白E1和E2、HIV或MLV的Gag-Pol和含有荧光素酶或GFP等报告基因的逆转录病毒基因组)至细胞中,即可制备出带有HCV包膜蛋白E1和E2的感染性病毒颗粒。利用HCVpp系统获得的可感染性HCV假病毒颗粒广泛地应用于HCV入侵的机制研究及疫苗开发研究中。如HCV的受体Claudin-1和闭锁蛋白(occludin)就是用这个系统发现的。但HCVpp表面没有脂蛋白,故不能完全模拟真实的HCV入侵过程。目前主要通过HCVpp和HCVcc相结合的方式对HCV的入侵过程进行研究。
2008年Steinmann E等发现稳定表达HCV亚基因组复制子的细胞系中加入了辅助JFH-1病毒后可以在上清液中检测到有感染性的病毒颗粒,继而发现在稳定表达亚基因组复制子的人肝癌细胞系中互补表达HCV core、E1、E2和NS2蛋白后,可在上清液中检测到有感染性的病毒颗粒,这种反式包装出的病毒颗粒被称为HCV TCP 。HCV TCP 只能感染一次而不能产生新的病毒颗粒。HCV TCP 系统是非常有用的工具,可以用于单轮感染的检测分析,也可以单独用于HCV包装释放、HCV入侵的研究。
HCV在1989年得到鉴定,但直到2005年Charles M.Rice研究组在 Science 上才宣告全基因HCV在细胞内培养成功,病毒能成功自然感染Huh7.5细胞并产生大量具有感染性的病毒颗粒,这为HCV致病机制研究和抗病毒药物评价及疫苗研究提供了一个全新手段,具有划时代的意义,HCV的相关研究进入了新纪元。该系统的构建归功于特殊的HCV分离株JFH-1(2a亚型),JFH-1是从一位罕见的患有急性重型肝炎(fulminant hepatitis)的日本患者体内分离得到的,但其在Huh7细胞培养中的感染复制能力差。通过用干扰素α治愈含有HCV复制子的Huh7细胞从而获得的子代细胞系Huh7.5细胞,此细胞支持JFH-1自然感染并高效复制,得到了高感染力的病毒粒子,解决了长期以来HCV不能在体外培养的难题。
由于其他基因型HCV在细胞培养内复制效率低,因此在JFH-1的基础上构建了一系列嵌合体JFH-1病毒,也建立了不同基因型的HCVcc,如1a、2a、2b和3a亚型等,但含有其他亚型的病毒在细胞中的复制能力不如JFH-1的强。在现有水平下,嵌合体病毒是研究不同基因型HCV感染致病性及药物筛选的替代选择。
为方便检测及高通量筛选,随后构建了一系列感染性HCV报告病毒。具体可分为:①双顺反子单报告病毒。将报告基因Fluc或分泌型荧光素酶[高斯荧光素酶(Gaussia luciferase,Gluc)]等基因置于HCV IRES控制下。②双顺反子双报告病毒,即在上述单顺反子单报告病毒基因组上再整合另外一个报告基因。如将GFP基因插入NS5A的C端DⅢ结构域使NS5A与GFP形成融合蛋白。③单顺反子单报告病毒。将报告基因如GFP或荧光素酶基因插入HCV基因组的相应位置即可。GFP一般插入NS5A的C端D Ⅲ结构域;而荧光素酶(如Rluc或Gluc)基因可以插入p7与NS2之间或core的N端,荧光素酶与HCV序列之间插入可以自我剪切的手足口病病毒2A蛋白序列以保证正确剪切。④单顺反子双报告病毒,即将荧光素酶基因与GFP报告基因均整合入HCV基因组的相应位置。
HCV 可感染人胚胎肝细胞(human fetal liver cells,HFLC),相比于感染成年人肝细胞,病毒复制水平更高,但其复制效率远低于在肝癌细胞系的,且复制效率还与供体细胞有关。
最近研究显示,HCVcc可感染来源于诱导多能性干细胞(induced pluripotent stem cells,iPSC)的肝细胞样细胞(hepatocyte-like cells)和人胚胎干细胞(human embryonic stem cells,hESC),这为研究宿主因素对HCV致病性的影响提供了很好的研究工具。
理想的HCV感染体内模型的建立,不仅有利于研究HCV的致病机制,还为抗病毒药物和预防性疫苗的研发提供了更有效的技术途径。但长期以来,缺乏理想的研究动物模型,使HCV研究和相关药物研发相对滞后。黑猩猩是用于HCV自然感染研究的重要模型动物,然而由于其有诸多限制,发展新型实验动物模型迫在眉睫。近年来,以啮齿类等动物为替代模型取得了不少进展,应用转基因等实验技术使替代动物感染了HCV,并成功应用于多个学科领域的研究,但各种模型都有其优势和缺陷(表1-7-3),应合理选择应用。
表1-7-3 HCV体内研究模型
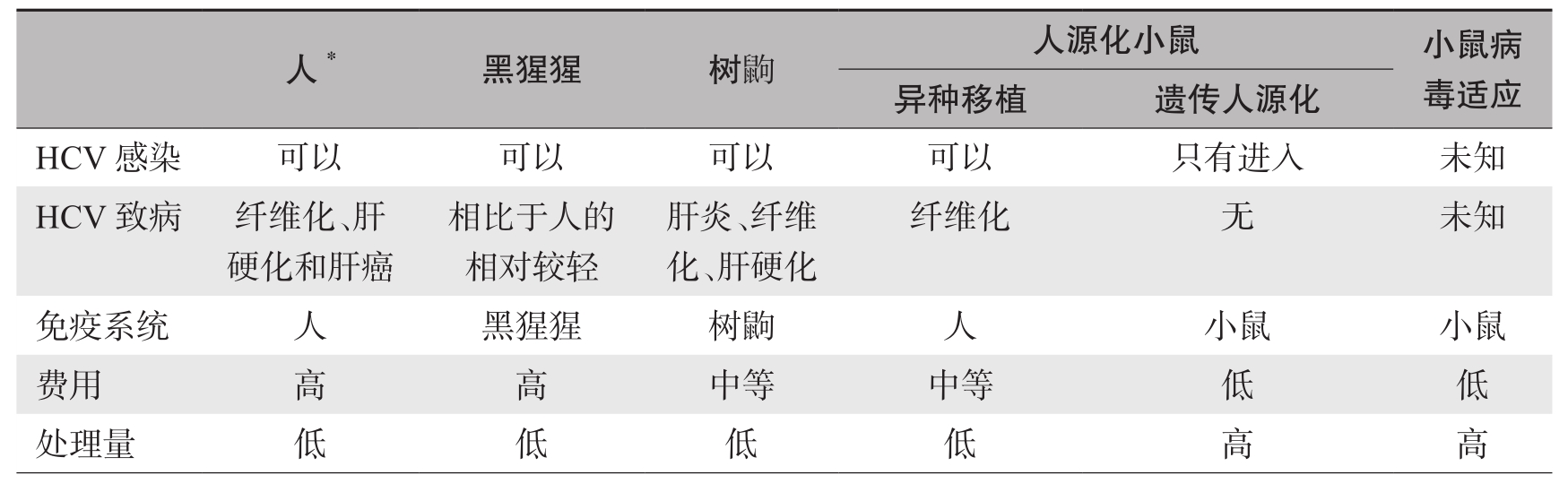
续表
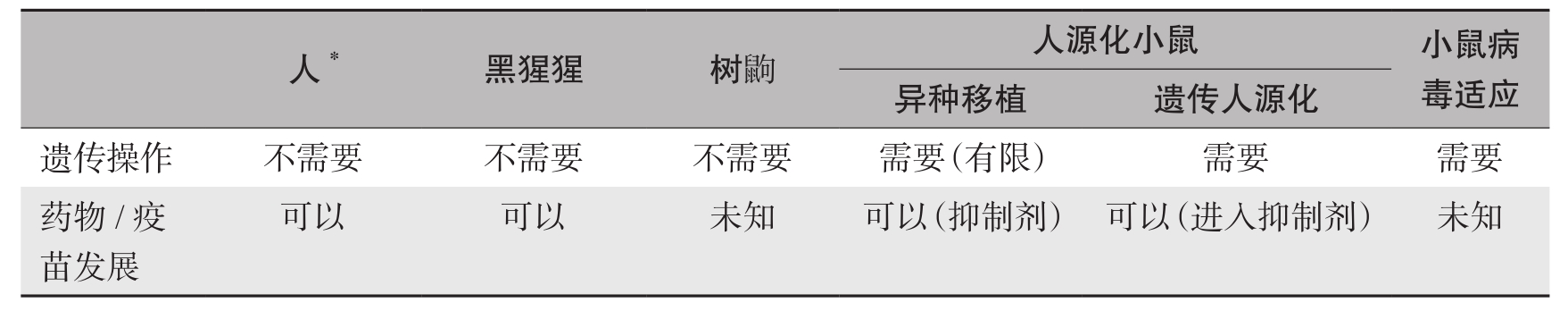
注: * 主要为临床研究用对象。
到目前为止,HCV仅能感染除人类之外的极少数物种,如黑猩猩以及非啮齿类的小型哺乳动物树鼩等。
黑猩猩与HCV的发现史密切相关,是研究病毒与宿主抗病毒免疫反应的关系、免疫发病机制及预防性疫苗评价的最佳模型动物。但人和黑猩猩感染HCV后的临床症状有所不同,如HCV慢性感染在人身上的发病率高达80%,而在黑猩猩上却只有30%~40%;并且HCV慢性感染后的黑猩猩并不会发展为肝纤维化及肝硬化,而是一些相对较温和的症状。尽管如此,相关研究也极大地提高了我们对HCV感染过程中机体免疫应答的认识。在黑猩猩体内记忆性T细胞、NK细胞以及Ⅰ型/Ⅱ型干扰素可阻止HCV的再次感染;此外,中和抗体虽能预防动物感染HCV,但在人体内的预防效果却不理想。
虽然有诸多不足之处,黑猩猩仍然是用于HCV研究的重要模型动物,是其他动物模型的一个“金标准”。然而黑猩猩作为濒临灭绝的物种且价格昂贵,并受到伦理上的争议,使得其在生物医学方面的应用受到了极大的限制。因此,发展合适的替代动物模型用于HCV相关的研究迫在眉睫。
树鼩是一种非啮齿类小型哺乳动物,能自然感染HCV,可用于HCV感染研究。人或小鼠细胞表达来源于树鼩的HCV进入因子CD81、SR-BⅠ、CLDN1和OCLN能够促进HCV假病毒颗粒或者HCVcc进入,树鼩的原代肝细胞可感染HCVcc并能产生具有感染性的子代病毒。但树鼩对HCV的感染率较低,且病毒血症很弱并极少能够保持下去,即使能够在HCV感染的动物中检测到肝损伤及HCV core蛋白的表达,但在血清中却检测不到HCV RNA以及抗-HCV的抗体。
尽管树鼩在获取方面比黑猩猩要简单得多,然而也受到了饲养的费用高以及所用试剂的特殊性的限制。但树鼩作为HCV感染动物模型的优势是:树鼩在免疫系统及神经系统方面与人类有较高的同源性,有可能替代黑猩猩模型,在进化上较小鼠更接近于人类。
(1)狨猴和小绢猴:
狨猴和小绢猴是一种小型灵长类动物,易感GB病毒B型(GBV-B),这是一种与HCV同源性较近的且能诱发其病毒性肝炎的黄病毒科病毒,这使得狨猴与小绢猴有可能成为HCV自然感染的替代模型。但GBV-B与HCV间存在一定的差异,GBV-B与HCV的多聚蛋白同源性很低,而在5'及3'非编码区的同源性则更少,使得GBV-B用于抗HCV药物研发上存在局限性。为克服这些不足之处,将HCV结构蛋白基因(CE1E2p7)或是完整的包膜蛋白基因(E1E2p7)替代GBV-B上对应的基因,构建了两种HCV/GBV-B嵌合体,其可在肝细胞内复制及表达并能释放到外周血中。研究结果显示,在所有HCV嵌合体感染的狨猴体内可被刺激产生特异性的免疫反应,提供了检验抗HCV疗法的新模型。
但此模型存在一定的使用限制,因为这些病毒并不能够完全模仿HCV的复制周期,以及嵌入到GBV-B序列中的HCV部分不能精确地反映其在HCV基因组中所起的作用。虽然如此,也为我们提供了一个新型的用于研究病毒宿主相互作用、研发疫苗及抗HCV药物的替代黑猩猩的小型动物模型。
(2)犬科/非灵长类丙型肝炎病毒:
犬科丙型肝炎病毒(CHV)是从犬的呼吸道中分离出来的,是演化中与HCV最为相近的病毒,其自然感染的宿主范围更广,实验验证CHV可引发病毒性肝炎。与之非常相近的非灵长类丙型肝炎病毒(NPHV)也已在马体内得到了鉴定。这些新型肝炎病毒的遗传学及生物学特征将会增进人们对人类感染HCV起源的认识,也因此可能发展为新型替代动物模型。
啮齿类替代动物如小鼠能够自然抵抗HCV的感染,其肝细胞不支持HCV的进入和复制。在鼠科动物细胞内,HCV不能完成其复制循环,其感染程度也因物种而异。值得注意的是,相比于HCV复制的早期阶段,在小鼠肝细胞中HCV的组装与释放并不受到限制。随着转基因技术的出现,逐渐出现了用于HCV感染的多种小鼠模型。
(1)异种移植人源化小鼠模型:
2001年Mercer DF等构建了首例人鼠嵌合肝感染模型。该模型的特点:①采用过表达尿激酶型纤溶酶原激活基因(urokinase-type plasminogen activator gene,uPA)的严重联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠;②将人肝细胞移植入uPA-SCID小鼠体内,形成人鼠嵌合肝模型。uPA-SCID小鼠由于其肝脏内过量表达uPA而能够有效地移植人源肝细胞继而易感染HCV。这种人肝嵌合小鼠对HCV易感,感染后病毒滴度高达10 7 IU/mL,且可持续10个月之久。因此这种小鼠模型可用于评价HCV感染的预防或治疗。但是其应用具有局限性,首先是uPA-SCID小鼠的死亡率很高,且移植需要在其生下来的2周内进行,因其生来就是肝细胞致死性的表型。其次,部分小鼠uPA转基因也容易丢失,出现一定程度的免疫功能恢复,此为SCID小鼠渗漏现象,但不遗传,只与小鼠年龄、品系、饲养环境有关。再次,这个动物模型缺乏功能性的适应性免疫,不能产生功能性的T细胞和B细胞,因此不能将其用于适应性免疫反应的研究。为解决这些难题,科学家先后构建了其他新型人鼠嵌合肝模型,如MUP-uPA/SCID/Bg转基因小鼠、Fah -/- Rag2 -/- γ-c -/- (FRG)小鼠模型和 AFC8-huHSC/Hep小鼠等。特别是 AFC8-huHSC/Hep小鼠模型,尽管其缺乏病毒血症,但是HCV阳性小鼠肝脏中存在人免疫细胞渗透及HCV特异的CD4、CD8 T细胞反应。且半数HCV阳性小鼠会发展为肝纤维化,这是HCV首次在小型动物模型感染上呈现了HCV特异性的适应性免疫以及首次诱导了免疫致病机制。尽管这种小鼠在研究HCV感染的具有完全免疫活性小鼠模型上具有重大突破,但不足的是无血清HCV和缺失功能性B细胞,然而这却是评价潜在抗病毒药物及疫苗的重要因素之一。此外,虽然对来源于人HSC的免疫系统已在鼠科主要组织相容性复合体上进行了研究,但是人免疫细胞在小鼠上是否能够识别HCV感染的HLA表达的人肝细胞仍不清楚。
(2)遗传人源化小鼠模型:
人源化转基因小鼠模型的代表是人源宿主因子转基因小鼠模型,又称为表达人源HCV受体的转基因小鼠模型,是将HCV感染必需的人源宿主因子通过转基因技术移入小鼠基因组内,构建HCV感染小鼠模型。与之前的模型相比较,此模型具有完整的免疫系统及肝脏。为了克服病毒进入的种属特异性及实现小鼠肝脏对于HCV的易感性,Dorner等人在小鼠体内肝细胞中转染腺病毒载体来表达产生HCV的进入因子CD81、B 类Ⅰ型清道夫受体(scavenger receptor class B type Ⅰ,SR-B Ⅰ)、CLDN1和 OCLN,约有5%的小鼠肝细胞能完全表达这4种进入因子,且能检测到病毒入侵。鉴于HCV在小鼠体内并不能高效复制,Dorner等人重新设计病毒使之进入小鼠肝脏后能够表达HCV core蛋白,表达后将会导致loxP-flanked荧光素酶报告基因在Rosa26-Fluc小鼠中表达,其表达强度反映了病毒入侵肝细胞的复制能力。
这个动物模型首次用于研究不同基因型的HCV嵌合体在生物体内入侵肝细胞,并成功地评估了抗CD81、E2抗体的抗-HCV复制作用。这是第一例报道的用于研究HCV感染的具有完全免疫活性的小动物模型,且到目前为止,这个模型也是唯一有效的与免疫相关的小鼠模型,同时它也是免疫系统与感染的肝细胞间的主要组织相容性复合体(major histocompatibility complex,MHC)有较好的匹配度的小鼠模型,使我们能更好地认识由病毒诱导的全部免疫反应。
但是该小鼠模型也存在其局限性。首先,由于这些细胞内病毒复制效率较低,导致感染小鼠肝细胞中检测不到病毒产物,这使得这种模型并不适于DAA或以病毒周期中组装及释放为靶点的抗病毒药物的筛选。其次,通过腺病毒载体引入人源的进入因子会引起小鼠对这些载体的免疫排斥反应。因此,此模型不适于研究HCV诱导的免疫学发病机制。尽管如此,利用人进入因子的转基因小鼠的后续研究,具有深入探索HCV的发病机制的潜在价值。
(3)HCV适应的具有免疫活性的小鼠模型:
由于小鼠的肝细胞对HCV感染具有抵抗性,通过基因工程的手段改造病毒以克服病毒感染中物种特异性的限制,使病毒在普通的小鼠肝细胞内可以完成它的整个生命周期,包括进入、转录、复制和释放等环节。Bitzegeio等将源于HCV基因2a亚型的病毒株HCV Jc1改造,以适应鼠科的进入因子CD81。与野生型的Jc1相比,变种可进入表达鼠源CD81的肝细胞。尽管如此,它并不能在小鼠肝细胞内进行复制,说明宿主因子限制了病毒进入细胞后下游的持续感染。证据表明这可能是固有免疫干扰了HCV的复制,因而在小鼠细胞内感染效率很低。为更精确地模仿人体的免疫反应,人们尝试应用HLA表达小鼠,然而这个方案的主要缺陷是难于模仿人体内HLA组合的可变性,仍不能确定小鼠对病毒的免疫反应与人体内的是否具有可比性。
斑马鱼基因与人类基因的同源性达到87%,这意味着在其身上做药物实验所得到的结果在多数情况下也有可能适用于人体,因此它受到生物学家的重视。因为斑马鱼的胚胎是透明的,所以生物学家很容易观察到药物对其体内器官的影响。此外,雌性斑马鱼可产卵200枚,胚胎在24h内就可发育成形,这使得生物学家可以在同一代鱼身上进行不同的实验,进而研究病理演化过程并找到病因。有研究表明HCV的亚复制子被设计为带有两个载体,其中之一为HCV NS5B及红色荧光蛋白基因,另外一个包括HCV 5'-UTR、core蛋白、3'-UTR和绿色荧光蛋白。含有亚复制子的载体被注入斑马鱼的受精卵中,高表达HCV RNA及核心蛋白,但并不引起斑马鱼生长发育过程中的不良反应,且能够引发同人类肝细胞相近的基因表达。两个已知的抗HCV的药物:利巴韦林和氧化苦参碱,能够通过降低HCV RNA及核心蛋白的量来抑制亚复制子的表达。由于这个模型在技术方面具有较好的再现性且易于操作,因此,斑马鱼有可能成为HCV感染宿主的新的模式生物,并且斑马鱼/HCV(亚复制子)系统有可能成为抗HCV药物筛选与评价的替代动物模型之一。
(彭宗根)