




人类早期胚胎发育过程中,高度特化的精子和卵子经过受精作用形成全能性的受精卵,又称为合子(zygote),自此开启生命历程。在接下来的两周内,受精卵经历植入前胚胎发育(preimplantation development)和胚胎植入(implantation)等阶段建立与母体的联系。该过程为胚前期发育,是哺乳动物特有的发育过程。第3周进入胚胎期,经过原肠作用(gastrulation)胚胎形成三胚层,这是成功妊娠的关键。据估计人群中高达50%~70%的胚胎因不能植入而自发流产;此外,成功植入的胚胎中多达16%发育异常,是造成早期流产和出生后重大缺陷的重要原因(Sadler,2017)。因此,人类早期胚胎发育研究不仅可以加深对生命起始的认识,还对生殖疾病的诊断和治疗至关重要。
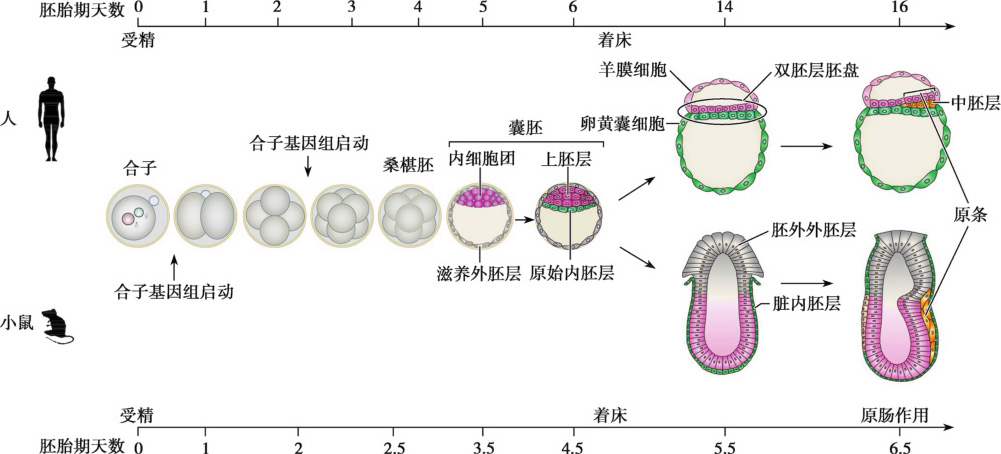
图1-1-1 人和小鼠围植入期胚胎发育
植入前胚胎发育发生在输卵管中,受精卵经过表观修饰、合子基因组启动、卵裂和细胞命运分化等一系列过程。对小鼠等模式动物的植入前胚胎发育研究大大提高了对人类植入前胚胎发育的认识,促进了现代辅助生殖技术的产生。
受精作用(fertilization)是单倍体的精子和卵子相互结合和融合形成二倍体合子的过程,是有性生殖生物个体发育的起点(图1-1-1)。哺乳动物的受精作用发生在输卵管的壶腹部,主要包括精子获能、精卵接触与识别、卵子的激活和雌雄原核形成等一系列过程(杨增明 等,2019)。
精卵结合形成合子标志着哺乳动物发育的起始。合子经过卵裂形成2细胞、4细胞、8细胞、桑葚胚及囊胚,并分化形成内细胞团和滋养外胚层两种不同细胞群,即第一次细胞谱系的分化。植入后(人在1周左右,小鼠在胚胎期4.5日左右),胚胎细胞快速增殖分化,出现第二次细胞分化,形成上胚层和下胚层。人类胚胎中,上胚层和下胚层组成盘状结构,称为双胚层胚盘。第二次细胞分化后,胚胎进一步通过原肠作用(人起始于15日左右,小鼠起始于胚胎期6.5日左右)形成内、中、外三个胚层,并最终发育成各种组织器官(张卫红,2018)。
哺乳动物精子获能是指射出的精子在雌性生殖道中获能因子的作用下,精子膜发生一系列变化(如吸附于精子膜表面精清蛋白的去除、膜表面蛋白的重构等),进而发生生化和运动方式等的改变。获能后的精子穿越卵丘细胞和透明带的能力提高。精子获能现象由美籍华人科学家张明觉和奥地利学者Austin先后发现,为现代生殖医学中体外受精技术的发展奠定了基础(Chang,1951;Austin,1952)。
获能的精子穿过卵丘细胞后,首先与卵子周围的透明带识别并结合,触发其自身发生顶体反应,释放水解酶,促进精子穿过透明带。穿过透明带的精子到达卵周隙,其头部赤道段质膜与卵质膜发生融合,精子头部进入并激活卵子恢复减数分裂,排出第二极体,同时触发卵子发生皮质反应。皮质反应可以改变透明带和卵质膜的结构,是阻止多精受精的重要环节。随着精卵质膜融合,精子核直接与卵胞质作用,精子的核膜破裂,染色质去浓缩;与此同时,精子核中的鱼精蛋白逐渐被卵子中的组蛋白替代。此后,雌雄原核形成,完成受精作用。
受精过程高度复杂,分子生物学、细胞生物学和遗传学研究已经发现了很多该过程中的重要调控因子,而且通过小鼠遗传学技术证明这些关键因子的缺失可导致雌性小鼠不孕不育。例如:早在20多年前研究人员就已经证明透明带基因的缺失导致卵子不能形成透明带,进而导致雌性小鼠不育(Bianchi et al.,2016)。
表观修饰主要包括DNA甲基化和组蛋白修饰等,它们通过改变染色质的高级结构参与基因表达调控。精子和卵子中的表观修饰与早期胚胎明显不同,提示表观修饰重塑是早期胚胎发育的关键事件。研究发现,受精完成以后,雌雄原核中的表观修饰发生剧烈变化,主要包括基因组水平上大规模的DNA去甲基化和组蛋白修饰的改变,也包括染色质高级结构的改变。但是,母源或父源印记基因的DNA甲基化状态在上述过程中却需要保持不变,否则会影响早期胚胎发育和后代健康。虽然表观修饰动态变化的生物学意义还未完全清楚,但是表观修饰可能有助于合子基因组启动和受精卵全能性的建立(Eckersley-Maslin et al.,2018)。
合子基因组启动是早期胚胎发育的关键环节,为基因调控方式由母源向合子的转变提供物质基础,它与母源RNA降解共同偶联于母源向合子转变(maternal to zygotic transition,MZT)过程中。不同的物种中,合子基因组启动的时间并不相同。小鼠的合子基因组启动主要发生在2细胞到4细胞阶段,而人类合子基因组启动主要发生在4细胞到8细胞阶段(图1-1-1)。阻止合子基因组启动往往导致胚胎发育停止。实际上,在体外培养过程中,小鼠胚胎经常发生2细胞阶段阻滞,而人类胚胎则经常发生4细胞到8细胞阶段阻滞,可能与合子基因组启动失败有关(Li et al.,2013)。
卵母细胞成熟到合子基因组启动之前,基因转录处于沉默状态。研究表明,除了提供遗传物质,精子在早期的胚胎发育中作用有限。因此,哺乳动物早期胚胎发育调控主要依赖母源效应基因。最近,在哺乳动物中发现了一个由多种母源效应蛋白组成的复合体——皮质下母源复合体(subcortical maternal complex,SCMC)(Li et al.,2008)。在小鼠中,该复合体功能异常导致早期胚胎致死或发育延迟,并最终导致雌性不育或生育力下降;在人类中,SCMC组分基因突变则可能与不明原因的早期胚胎丢失和双亲源性葡萄胎(familial biparental hydatidiform moles)等女性生殖疾病有关,也可能与贝-维综合征(Beckwith-Wiedemann综合征)和拉塞尔-西尔弗征(Russell-Silver综合征)等疾病的发生相关(Lu et al.,2017)。
胚胎发育早期,细胞分裂称为卵裂,每一个胚胎细胞称为卵裂球。经过多次卵裂,胚胎开始进行第一次细胞分化。胚胎卵裂过程中,体积不变,细胞数目逐渐增加,细胞体积越来越小。目前认为受精卵和开始几次卵裂形成的每一个卵裂球都具有全能性,它们能够分化形成包括滋养外胚层在内的所有细胞。在桑葚胚时期,胚胎发生致密化(compaction),细胞命运逐渐被决定,出现第一次细胞谱系分化,此后形成具有空腔的囊胚。
小鼠第一次卵裂发生在受精后24小时左右,之后每隔12小时分裂一次;此后,卵裂球在分裂时间上开始出现细微差异,但目前还不清楚这些差异是否具有生理学意义;8细胞阶段胚胎发生致密化形成桑葚胚;2细胞中的一个卵裂球被破坏后仍可产生健康后代,表明它们都具有全能性,此外致密化前的卵裂球可能都具有全能性。人类胚胎在受精后大约30小时开始第一次卵裂。第2日产生4细胞胚胎,第3日发育到6细胞~8细胞阶段。从8细胞阶段开始,胚胎出现极性;同时一些细胞开始进入胚胎内部,而其他细胞位于胚胎表层;而且胚胎发生致密化。32细胞阶段,桑葚胚开始吸收液体形成囊胚腔,胚胎发育到囊胚。囊胚形成后,胚胎明显包括滋养外胚层和内细胞团两种细胞(Johnson,2009)。
理论上讲,细胞位置和极性、内部分子的分布及细胞间相互作用等多种因素都可导致细胞不对称性的出现,它们可能是胚胎第一细胞谱系分化的基础。目前关于哺乳动物第一细胞谱系形成的机制研究主要来自小鼠。根据相关结果,研究者提出了多种形成机制的模型,但仍然很难全面地解释第一次细胞谱系分化过程中观察到的所有现象。哺乳动物早期胚胎中对称性的打破和第一次细胞命运决定的机制研究依然是发育生物学乃至整个生命科学领域的巨大挑战。但对小鼠植入前胚胎发育中的重要转录因子和信号通路的研究表明,受Hippo/Yap/Tead4通路调控的转录因子Cdx2对滋养外胚层维持至关重要,在第一次细胞命运分化中具有重要作用(聂晓庆 等,2017)。
人类植入前胚胎在输卵管中经过1周的发育,进入子宫并形成晚期囊胚,然后从透明带中孵化出来,与母体子宫进行接触发生胚胎植入。此后1周的时间内,胚胎形成双胚层胚盘(bilaminar germ disc)和各种腔室结构。植入期胚胎发育高度动态,而且不同物种差异很大。例如:人类胚胎形成双胚层胚盘结构,而小鼠胚胎则形成“杯状”卵圆筒(egg cylinder)结构(图1-1-1)。因此,模式动物的研究结果不一定适合解释人类胚胎发育的相关过程(Tang et al.,2016)。
人类胚胎植入发生在妊娠后的第7日左右,滋养层细胞分泌透明质酸酶,侵入子宫内皮开始胚胎植入过程。第8日,囊胚的一部分已经被包埋在子宫内膜基质。滋养层细胞分化为内外两层细胞,内层是能够进行细胞分裂的单核细胞,称为细胞滋养层;外层无明显细胞边界的多核细胞,称为合胞体滋养层。同时,胚胎的内细胞团进行第二次细胞谱系分化,形成两种细胞,其中与囊胚腔相邻的立方形细胞为下胚层(hypoblast),也称为原始内胚层;下胚层进一步形成卵黄囊内胚层(yolk sac endoderm)。另一层与羊膜腔相邻的柱状细胞为上胚层(epiblast),上胚层最终发育形成胚胎所有类型细胞。上胚层和下胚层形成扁平的盘状结构,称为双胚层胚盘(图1-1-1)。同时,上胚层和羊膜外胚层(由上胚层发育而来)之间形成羊膜腔,腔内充满羊水(amniotic fluid)。羊水不仅可以防止胚胎失水,还可保护胚胎免受外界影响。
随着胚胎逐渐被包埋在子宫内膜中,滋养层也进一步发育,合胞体滋养层中开始出现空泡,且空泡发生融合形成大的腔隙。经过11~12日的发育,胚胎被完全包埋在子宫内膜基质中。同时,合胞体滋养层细胞进一步向子宫基质渗透侵入母体的微血管循环系统形成血窦(sinusoids),血窦再与合胞体腔融合,建立子宫胎盘循环(uteroplacental circulation)。此外,在细胞滋养层的内表面和胚外体腔的外表面形成胚外中胚层(extraembryonic mesoderm)。然后,胚外中胚层内部开始形成大的腔,这些腔隙逐渐融合形成包裹着卵黄囊腔和羊膜腔的胚外体腔(extraembryonic cavity),又称绒毛膜腔(chorionic cavity)。
与滋养层细胞的快速增殖相比,双胚层胚盘的增长要滞后很多,双胚层胚盘在妊娠第2周只有0.1~0.2mm。在胚胎发育的同时,母体子宫内膜细胞发生蜕膜反应(decidua reaction),即细胞内合成大量糖原和脂质,细胞间隙充满渗出液,发生组织水肿等。蜕膜反应最初只发生在植入位点,但很快蔓延到整个子宫内膜。母体的蜕膜反应对妊娠的建立和维持至关重要。
人类妊娠的第3周,通过原肠作用建立胚胎的三胚层和胚胎轴系,即三胚层胚盘的形成。原肠作用的起始以上胚层表面原条(primitive streak)的形成为标志。上胚层细胞逐渐向原条迁移,到达原条部位后细胞形态发生改变并与原条脱离,整个过程称为内陷(invagination)。在细胞内陷过程中,一些细胞掺入到下胚层中,替代原来下胚层的细胞分化成定形内胚层(definitive endoderm),它们将发育成消化管、肝、胰、胸腺和甲状腺等器官的主要功能细胞;在上胚层和新形成的内胚层之间细胞分化成中胚层(mesoderm),是将来躯体的真皮、肌肉、骨骼、循环和泌尿生殖系统等组织的主要来源;而上胚层中没有发生迁移的细胞则分化成外胚层(ectoderm),它们最终分化成神经系统和表皮等。
原肠作用的同时,胚胎的体轴开始建立,包括前后轴(anteroposterior axis)、背腹轴 (dorsoventral axis)和左右 轴(left-right axis)。至此,上胚层细胞通过原肠作用分化成三胚层,同时建立胚胎的各种轴系,胚胎发育成三胚层胚盘(trilaminar germ disc),为胚胎继续发育和胎儿各种组织器官形成奠定基础。
小鼠作为模式动物最常用于哺乳动物植入前早期胚胎发育研究,促进了人类体外受精(in vitro fertilization,IVF)和植入前遗传学诊断等生殖医学技术的发展。近年来,随着基因敲除小鼠在哺乳动物早期胚胎发育研究中的展开,以及单细胞或微量高通量基因检测技术的发展,对于哺乳动物围植入期早期胚胎发育有了更加全面和深入的认识,但是基础研究和临床应用依然面临诸多挑战。
首先,由于研究材料的限制,目前对于哺乳动物早期胚胎发育分子机制的认识还非常有限。例如:尽管在基因表达和表观修饰方面进展迅速,但是全基因组水平的表观修饰与早期胚胎基因表达之间的关系,以及这些表观修饰变化在早期胚胎发育中的作用仍不清楚。此外,虽然小鼠的早期胚胎分子调控方面取得重要进展,但是由于小鼠与人类胚胎发育存在明显差异,小鼠中得到的成果有待进一步在人类胚胎中验证(Tang et al.,2016)。胚胎干细胞自主在体外形成各种类器官或胚胎可能为人类早期胚胎发育提供重要线索(Shahbaziet al.,2019)。总之,如何在材料受限的哺乳动物早期胚胎体系中进行分子机制研究面临巨大挑战。
人类早期胚胎研究还涉及如何定义人类生命起始等哲学和宗教问题。世界首例试管婴儿路易丝-布朗(Louise Brown)的诞生,激起了社会关于人类胚胎体外操作的广泛讨论,并逐渐形成了目前各界都能接受的人类胚胎体外培养“14日”的伦理限制。最近研究人员成功在体外将人类胚胎培养至早期原肠胚期,使得该限制需要重新考虑(Hurlbut et al.,2017)。此外, CRISPR/Cas9 基因编辑技术为特定遗传性疾病的治疗带来了希望,但是该技术存在的脱靶效应和编辑效率等问题,以及人们对“定制婴儿”的担忧,使该技术的临床应用依然存在争议。因此,如何正确引导和有效监管人类早期胚胎的基础和临床研究将是全世界面临的重大挑战。
(李 磊)