




人类分娩启动无疑与内分泌系统的变化密切相关,但是免疫系统介导的炎症反应在分娩启动中起到了更为重要的作用。妊娠过程中母体子宫内的免疫变化表现为对天然炎症性免疫反应的调节,防止对胎儿这一同种异体移植物的排斥。一旦炎症或其他因素使母胎界面细胞因子的精细平衡被打破,促炎性细胞因子增加,即可诱发分娩(林其德,2006)。
人类分娩启动的确切机制尚未得到全面而确切的阐明。越来越多的研究发现,人类分娩与母胎组织中白细胞侵入、核因子κB(NF-κB)激活,以及促炎性细胞因子表达增加有关,即人类分娩是一个炎症反应过程。人类分娩启动时或是分娩启动后的极短时间内,母胎局部组织内表达增加的趋化因子和细胞黏附分子可以诱导外周血中的白细胞(主要是中性粒细胞、巨噬细胞,以及T细胞)侵入并浸润子宫肌层、宫颈,以及胎膜等组织,并使这些组织中的促炎性细胞因子,如部分白细胞介素(IL)(IL-1β、IL-6、IL-8)和肿瘤坏死因子-α(TNF-α)等产生增加。后者通过自分泌、旁分泌及少数内分泌的作用,通过多种机制刺激子宫肌的收缩和重构、宫颈软化和成熟。同时,促炎性细胞因子还能通过正反馈调节机制招募更多的白细胞向子宫肌迁移,以扩大子宫肌的收缩效应并促进分娩。转录因子NF-κB参与众多细胞功能的调节活动,也是参与炎症反应的因子之一。分娩时,NF-κB有关的信号转导系统可通过正反馈调节促炎性细胞因子的产生。但是,有研究发现,早产的发生也与炎症反应有关,并可伴随胎儿发育异常。因此,在人类分娩过程中,炎症反应发生的确切机制还需要深入研究。
正常妊娠过程中,细胞因子是胎盘-母体间功能调节网络的一个整体部分。母胎界面细胞因子水平的精细调节是维持胎儿在子宫内免疫豁免(immunological privilege)的可能机制之一。妊娠期间的母胎免疫豁免在分娩时宣告无效。母胎界面的一些促炎性因子与胎盘和蜕膜的生长有关,如IL-1β、TNF-α 和干扰素-γ(IFN-γ)等,但是过度或异常分泌的促炎性因子则对妊娠有害。具有抑炎效应的细胞因子IL-10也在母胎界面产生,能抑制其他细胞产生促炎性细胞因子,但是妊娠并不依赖于IL-10。
孕酮是一种具有抗炎症反应的激素,也是参与母胎界面免疫调节的因子之一。研究表明,孕酮能阻止有丝分裂原刺激的淋巴细胞增殖,延长同种异体移植物的存活时间,调节抗体的产生,降低单核细胞的氧化代谢,使巨噬细胞对细菌产物发生反应而减少促炎性细胞因子的产生,改变T细胞克隆的细胞因子分泌,有利于IL-10的产生。孕酮本身能抑制胎儿-胎盘IL-6的生成;孕激素类药物(醋酸甲羟孕酮,又称安宫黄体酮)能抑制人子宫肌组织中促炎性细胞因子和趋化因子的生成。分娩时,胎膜内NF-κB表达水平升高。研究发现,当孕激素受体被激活时,NF-κB的表达则被抑制;相反,激活人子宫肌组织中的NF-κB可以使孕激素受体C亚单位表达增加,这是一种抑制性亚单位,可以阻断孕激素发挥作用。因此也有学者认为分娩前的“功能性孕激素撤退”与炎性反应和NF-κB的激活有关(图5-6-1)。
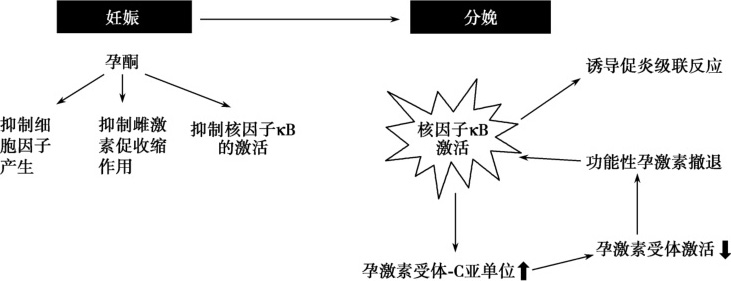
图5-6-1 孕激素作用示意图
孕酮可能通过其他类型的受体,如糖皮质激素受体,直接和/或间接调节免疫细胞的功能。反刍动物子宫内膜和人类白细胞在孕酮作用下可产生具有免疫抑制活性的蛋白质,后者可能改变母胎界面免疫细胞的增殖、活化和效应,这可能是孕酮介导的免疫抑制的另一间接机制。
人类妊娠过程中,孕妇体内的孕激素一直处于较高水平并维持子宫肌处于静息态。分娩启动时,NF-κB表达增加且孕激素受体被抑制,进而孕激素的抗炎效应减弱,NF-κB介导的炎症反应则呈现级联放大效应(Golightly et al.,2011)。
分娩过程包括三个互相依存的生理过程:①宫颈重塑,伸展扩张达到生殖道的宽度;②宫颈上方区域的胎膜弱化直至破裂;③节律性宫缩逐渐增强,最终导致胎儿及胎盘娩出。促炎性细胞因子介导了上述的某些过程。
宫颈成熟是一个生理性炎性过程。随着孕激素撤退的影响,人类分娩过程中,白细胞侵入宫颈组织,主要为中性粒细胞和巨噬细胞数量增加,但是T细胞或B细胞数量不变。由白细胞、腺上皮细胞、表皮细胞和基质细胞等产生的IL-1β,IL-6、IL-8和TNF-α表达水平升高。促炎性细胞因子可以通过多种方式导致宫颈成熟:IL-1β和TNF-α可以增加MMP-1、MMP-3、MMP-9和组织蛋白酶S的产生,可以消化宫颈细胞外基质内的胶原纤维和弹性蛋白纤维,增加宫颈容受性。
IL-1β可以使诱导宫颈扩张最有效的化学物质环氧合酶-2(cyclooxygenase-2,COX-2)和 PGE 2 产生增加。PGE 2 进一步通过增加蛋白酶刺激分娩,或者是通过增加流通白细胞的血管通透性起到间接作用。妊娠足月时,增加的一氧化氮也作为炎症介质参与血管舒张,增加白细胞流通。
IL-8刺激中性粒细胞从外周血迁移至宫颈,并能刺激宫颈组织释放MMP-8和中性粒细胞弹性蛋白酶,参与消化宫颈细胞外基质。
IL-6作用于花生四烯酸代谢途径的多个环节,能促进子宫及合成PGs,可被视为有效的预测分娩的标志物,高水平的宫颈IL-6和IL-8水平可预测羊膜腔内感染和早产。
综上所述,IL-8是引起宫颈成熟的关键因素之一,在启动分娩的准备或激活阶段起主导作用,而IL-6则可能参与分娩的维持和加速。
胎盘和胎膜产生的细胞因子与胚胎着床和胎盘发育有关,并且是妊娠中、晚期旁分泌/自分泌调节网络的一部分。细胞因子与妊娠后期胎盘生长有关,并保护胎儿免受病原体侵害。
分娩过程中,胎膜内也会发生与宫颈相似的炎症反应,即 IL-1β,IL-6、IL-8和 TNF-α 等产生增加,MMP-9含量增加,TIMPs水平下降等。 MMP-9 基因启动子的多态性与该酶的产生增加有关,在非洲和美洲人种中被认为是胎膜早破的高危因素。促炎性细胞因子也能增加胎膜内PGs的产生。IL-1β和TNF-α对羊膜和绒毛膜细胞的作用可通过COX-2增加PGE 2 的产生,后者促进MMP-9的生成,从而促进宫颈成熟和/或诱发子宫收缩。TNF-α和TGF-β在足月妊娠时由胎膜产生,参与妊娠维持和分娩启动。但是在宫内感染的环境中,上述因子由胎盘、蜕膜和胎膜合成并增加,可导致早产的发生。
妊娠过程中胎盘的生理变化对局部免疫影响较大,起免疫调节作用。研究发现,胎盘内IL-10的表达与孕周相关。正常妊娠早/中期,胎盘组织中IL-10表达水平较高,足月分娩启动前IL-10表达明显下降,可能与分娩有关。而胎盘组织中IL-1β和TNF-α的水平在临产时则显著增加。人类胎盘组织特异性表达的人类白细胞抗原G(human leukocyte antigen G,HLA-G),可通过抑制自然杀伤细胞(natural killer cell,NK cell,又称NK细胞)活性,减少由NK细胞引起的免疫损害而诱发的母体对胎儿的特异免疫耐受。在妊娠早/中期,HLA-G的表达随着孕周而逐渐增加,以维持母胎之间的免疫平衡。妊娠晚期和分娩前,HLA-G的表达下降,可能与分娩启动有关。针对胎盘组织热激蛋白(heat shock protein,HSP)及其抗体滴度的研究发现,胎盘组织内出现HSP 60 和HSP 70 抗体可诱导早产,对这些抗体敏感的孕妇,不良妊娠结局的风险较高。另外,子宫及其动脉异常的滋养细胞侵入与早产有关。人类滋养细胞的入侵由细胞黏附分子介导,如整合素和免疫球蛋白超家族成员。早产胎盘的绒毛外滋养细胞的黏附分子的表达类型与足月妊娠胎盘组织相比存在明显差异。
胎儿也通过一些免疫机制为分娩启动提供信号。早产的发生与胎儿免疫系统的激活有关,可表现为胎儿单核细胞-中性粒细胞的活化。研究发现,胎儿单核细胞来源的IL-6水平升高与正常足月妊娠分娩机制有关,但与早产无关,提示足月妊娠分娩发动和早产的机制可能不完全相同。另有研究发现,胎儿通过分泌肺泡表面活性蛋白(pulmonary surfactant protein)中的 SP-A(surfactant protein A)到羊水中,引起“无菌”炎症反应,进而使子宫组织中的NF-κB被激活,促炎性细胞因子表达增加,孕激素作用减退,刺激子宫肌收缩从而启动分娩。
子宫肌层组织中促性因子、IL-1β、IL-6和TNF-α被局限在白细胞内,其表达水平在分娩时显著增加。同时,分娩过程中,单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和IL-8水平升高并招募巨噬细胞和中性粒细胞侵入子宫肌层。因此,子宫肌层内白细胞的数量随着促性细胞因子浓度的增加而增加。IL-1β和TNF-α可增加子宫肌层PGs的产生。IL-1β可激活NF-κB信号转导通路,增加COX-2和PGE 2 在子宫肌层的表达。PGE 2 能增加子宫平滑肌细胞内Ca 2+ 浓度,与缩宫素作用相似。IL-1β和TNF-α可以增加子宫肌层MMP-9的表达水平,后者对胎盘的娩出十分关键。IL-6虽然不能刺激子宫肌层PGs的产生,也不能引起子宫肌收缩,但是IL-6可以上调子宫肌细胞上缩宫素受体的表达,进而增加子宫肌对缩宫素的反应性。IL-1β和IL-6还可增加子宫肌细胞分泌缩宫素。
Th1细胞主要分泌IL-2、IFN等细胞因子;Th2细胞主要分泌IL-4、IL-5、IL-6、IL-10等细胞因子。妊娠期 Th1/Th2比例下降是维持母胎免疫耐受的重要因素之一;尽管分娩后Th1/Th2比例升高,但是在分娩前两者的量以及比值并无明显变化,因此Th1/Th2比例与分娩发动无关。早产患者可出现外周血单核细胞向Th1型细胞因子偏移。分娩发动时,孕妇外周血T细胞亚群和NK细胞也发生改变,如外周血白细胞总数显著增加,中性粒细胞绝对数和百分数均增加,淋巴细胞绝对数和百分数均显著减少,单核细胞百分数减少;NK细胞绝对数和百分数均显著增加等。但其变化机制复杂,有待进一步研究。
研究发现,早产患者羊水中 IL-1α、IL-1β、IL-6、IL-8、IL-12和TNF-α等细胞因子水平均有改变,这些细胞因子水平升高可能与宫内感染有关。MCP-1是参与招募单核细胞/巨噬细胞至炎症部位(如子宫肌和蜕膜)的一种趋化因子,与分娩过程有关。羊膜腔内感染和早产患者羊水中可检出MCP-1水平显著升高。
(孙倩倩 倪鑫)