




自妊娠至分娩结束的生理过程中,子宫功能状态发生显著改变,可分为妊娠期、临产前、分娩及分娩后,共4个阶段(图5-3-1)。每个阶段分别对应妊娠及分娩中的子宫肌层与宫颈的不同生理变化(Challis et al.,2000;Petraglia et al.,2010)。
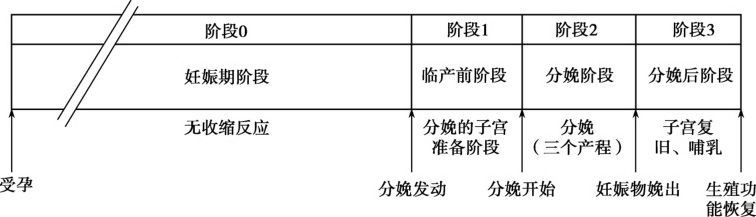
图5-3-1 子宫功能四个阶段变化
1.妊娠期阶段
子宫平滑肌处于静息状态,收缩相关蛋白,如缩宫素、前列腺素(prostaglandin,PG)受体、离子通道、CX 43 ,以及PG合成酶[如环氧合酶Ⅱ(COX-2)]等表达尚未明显增加,子宫可耐受胎儿及附属物的负荷,宫颈解剖结构稳定且坚硬。妊娠期间子宫可保持稳定静息功能状态直至妊娠足月。在此期间如果子宫静息状态被激活就会发生早产。
2.临产前阶段
子宫肌层和宫颈的形态、结构和功能发生明显变化,表现为子宫平滑肌收缩相关蛋白如缩宫素和PG受体、COX-2及离子通道等的表达大幅增加或者降低;子宫平滑肌细胞间缝隙连接增加;胞内钙离子浓度升高;子宫肌层内有白细胞聚集;宫颈软化成熟及子宫下段形成良好。这些都意味着子宫平滑肌静息状态就此结束。
3.分娩阶段
分娩发动,子宫肌层的缩宫素和前列腺素受体进一步增加;子宫局部前列腺素,如前列腺素F 2α (prostaglandin F 2α ,PGF 2α )等含量升高;子宫出现规律性宫缩,宫颈消退扩张,直至胎儿娩出。
4.分娩后阶段
为产褥期子宫肌层、宫颈和子宫下段的恢复过程。
子宫功能性改变是分娩发动的必要条件之一,子宫从维持静息态到分娩发动是一个极其复杂的生理过程,可能与以下因素有关(Challis et al.,2000;Smith,2007)。
1.前列腺素
PGs能增加子宫敏感性,诱发宫缩,促进宫颈成熟,对分娩发动起主导作用。妊娠期子宫蜕膜、子宫肌层、宫颈黏膜、羊膜、绒毛膜、脐带、血管、胎盘均能合成和释放PGs;胎儿下丘脑-垂体-肾上腺系统也能产生 PGs。但是,PGs进入血液循环后会迅速灭活,即其只能在合成组织中及其附近发挥作用。PGF 2α 主要由蜕膜合成,刺激子宫肌收缩;羊膜主要合成前列腺素 E 2 (prostaglandin E 2 ,PGE 2 ),促进宫颈成熟。此外,子宫肌细胞内含有丰富的PGs受体,维持了子宫肌对PGs的敏感性,PGs还能促进肌细胞间缝隙连接蛋白合成,使胞内Ca 2+ 浓度升高,引起子宫肌收缩。
2.雌激素
人类妊娠期间,孕妇体内雌激素一直维持在高水平,并随着妊娠进展持续升高。雌激素有如下作用:①增加人子宫肌收缩相关蛋白合成,如CX 43 和缩宫素受体等,促进肌细胞能源储备,使之含有大量的ATP和肌酐磷酸盐,促进子宫肌功能转变;②激活蜕膜产生大量细胞因子,刺激蜕膜和羊膜生成并释放PGs,进而促进宫缩及宫颈成熟;③促进Ca 2+ 向细胞内转移,刺激子宫肌收缩,但不能导致分娩的启动。正常人类妊娠足月时,胎盘雌激素的前体90%来源于胎儿,10%来源于其他组织。
3.孕激素
孕激素是维持妊娠及子宫静息态的重要激素。孕酮可以阻断子宫平滑肌的动作电位的形成或者引起平滑肌细胞质内Ca 2+ 浓度降低,抑制子宫平滑肌,使其处于松弛状态。包括绵羊、山羊、大鼠和小鼠在内的大多数物种的分娩均是由母体“孕激素撤退”而触发,即孕激素水平急剧下降从而触发子宫平滑肌收缩,进而启动分娩过程。与之截然不同的是,人类在整个妊娠及分娩过程中,孕妇的孕激素水平始终维持在较高水平,仅在胎盘娩出后,孕激素水平才出现下降。孕激素受体拮抗剂可以增强孕妇子宫肌收缩,诱导子宫由静息态转向激活态,从而启动分娩过程。有学者提出,人类分娩启动是由“功能性孕激素撤退”触发。
4.缩宫素
足月孕妇应用缩宫素成功引产已有很长历史,但是内源性缩宫素并不是人类分娩启动的决定因素。妊娠期,母血缩宫素水平不上升,而临产前阶段及分娩阶段缩宫素水平急剧增加。分娩过程中,胎儿刺激宫颈产生的机械刺激可反射性引起神经垂体释放缩宫素,以正反馈的方式促使子宫肌收缩力度增加,即表现为“催产”作用。缩宫素可促使蜕膜合成PGs并释放,增加子宫肌缝隙连接蛋白的合成,促进子宫下段形成和宫颈成熟;还可与PGs、5-羟色胺、组胺、血小板活性因子及血管紧张素Ⅱ共同作用增加子宫平滑肌细胞内Ca 2+ 水平。另外,缩宫素对子宫肌收缩的作用也与雌孕激素有关。孕激素可降低子宫肌对缩宫素的敏感性,而雌激素则对缩宫素表现为允许作用,促进缩宫素与其受体结合。
5.内皮素
内皮素(endothelin,ET)是子宫平滑肌的强诱导剂。妊娠晚期,羊膜、胎膜、蜕膜,以及子宫平滑肌含有大量内皮素,可通过自分泌或旁分泌途径作用于子宫肌的内皮素受体,促进 PGs合成,提高肌细胞内Ca 2+ 浓度,诱发宫缩。另有研究证实,内皮素可刺激妊娠子宫、胎儿胎盘单位,以及其他组织的血管内皮合成并释放PGs,从而间接诱导子宫肌收缩,促进分娩。
6.松弛素
妊娠期时,孕妇循环血中的松弛素(relaxin)由黄体产生。而胎盘和蜕膜分泌的松弛素通过旁分泌的途径在局部组织发挥作用。分娩前期,松弛素具有松弛骨盆韧带、重塑结构,以及软化宫颈的作用。松弛素还可以通过刺激前胶原素、前基质溶素(prostromelysin)、基质金属蛋白酶(matrix metalloproteinase,MMP)前体(proMMP-1和 proMMP-2)表达,同时抑制组织金属蛋白酶抑制物-1(tissue inhibitor of metalloproteinase-1,TIMP-1)的表达进而促进宫颈成熟。值得注意的是,松弛素虽然会抑制人的非孕子宫肌收缩,但是不会抑制人妊娠子宫肌收缩,这可能跟其余孕激素的竞争性作用有关。
7.促肾上腺皮质激素释放激素
灵长类动物妊娠期间,促肾上腺皮质激素释放激素(corticotrophin releasing hormone,CRH)可以由胎盘分泌,这也是人类妊娠区别于其他物种妊娠的标志性特征之一。随着妊娠进展,母体血浆中CRH水平呈指数升高,分娩时达到其峰值,在胎儿娩出后24小时内,CRH水平又恢复到妊娠前水平。与同时期妊娠的非早产孕妇相比,早产孕妇体内的CRH水平显著升高。因此,有学者提出假说,即CRH在人类妊娠过程中起着“胎盘钟”的作用,可决定妊娠期的长短及分娩启动的发生。胎盘分泌的CRH水平受胎儿分泌的糖皮质激素水平的正反馈调节影响。
如前所述,缝隙连接是子宫平滑肌细胞间的连接方式,一定数量的缝隙连接是肌细胞同步兴奋和收缩的基础。缝隙连接的主要膜蛋白是CX 43 。妊娠期间,肌细胞缝隙连接数量少,且体积小;分娩发动前,缝隙连接数量及体积大量增加,并持续增加至整个分娩过程,产后则急剧下降。PGs和雌激素可促进缝隙连接蛋白的合成,使肌细胞之间的兴奋性迅速传导,是子宫平滑肌发生协调收缩的必备条件。而孕激素则减少CX 43 的合成,并降低缝隙连接的通透性。
宫颈在妊娠期并非静止。正常宫颈中含有大量弹性纤维组织,由胶原蛋白、氨基葡萄糖聚多糖,以及弹性硬蛋白组成,随着妊娠进展,宫颈含水量逐渐增加,宫颈开始变软。在雌激素、前列腺素、缩宫素、松弛素、内皮素及细胞因子的调节作用和胎儿成熟的机械作用下,可促进子宫下段形成、宫颈成熟和宫颈功能转变。宫颈间质中胶原蛋白分解、胶原蛋白纤维重新排列,透明质酸含量增加、含水量增加,同时硫酸表皮素水平下降,使宫颈软化成熟。宫颈成熟度与临产时间、产程长短密切相关,足月前过度成熟可引起流产或早产;足月时仍不成熟者,可导致过期妊娠及产程延长。
(徐晨 倪鑫)