




人类胚胎植入后14日左右,细胞滋养层迅速生长,突破合体滋养层(STB),形成滋养层细胞柱,进入绒毛外分化途径。滋养层细胞柱中的细胞滋养层细胞逐渐分化为具有强浸润能力的绒毛外细胞滋养层细胞,并进一步分化为血管内滋养层细胞(endovascular extravillous cytotrophoblasts,enEVT)与间质滋养层细胞(interstitial extravillous cytotrophoblasts,iEVT)。iEVT浸润进入母体蜕膜,至子宫肌层的上1/3,与子宫的不同细胞相互作用,将胎盘锚定于子宫壁。enEVT进入母体蜕膜螺旋动脉,取代血管内皮细胞,改建母体子宫螺旋动脉,从而增加胎盘血流供应,为胎儿发育提供充足的营养(图 2-6-1)(Ji et al.,2013)。本节主要介绍绒毛外滋养层的浸润功能。
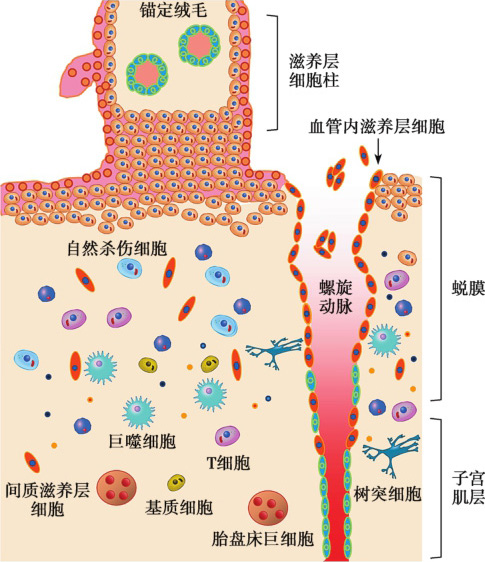
图2-6-1 妊娠期母胎界面上滋养层细胞的浸润及对血管的改建
绒毛外滋养层细胞构成胎盘滋养层细胞柱,从其近端到远端,细胞的表型逐渐发生改变。绒毛基底膜近端的数层细胞为活跃增殖的极性化上皮细胞,与绒毛滋养层细胞的形态相似;至滋养层细胞柱远端,细胞不再发生分裂,且形态发生改变,成为较大的多角形浸润性间质样细胞。这些细胞或浸润进入蜕膜化的子宫内膜与子宫肌层的上1/3,称为iEVT;或浸润进入子宫螺旋动脉,模拟血管内皮细胞的表型,称为enEVT(图2-6-1)。与细胞滋养层细胞相比,分化后的绒毛外滋养层细胞表达不同的分子标记,如细胞黏附分子、整合素、生长因子、人类白细胞抗原(human leucocyte antigen,HLA)分子。例如,细胞滋养层特征性地表达整合素α6β4,而iEVT表达整合素 α1β1与 α5β1。 此外,iEVT表达多种蛋白酶,如二肽基肽酶Ⅳ、羧肽酶M、基质金属蛋白酶(matrixmetalloproteinase,MMP)和尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,u-PA)等。滋养层细胞柱中的细胞分化过程尚未完全阐明,但体外研究表明该过程可能是以内源性因素为主,涉及相关黏附分子的变化和多种蛋白酶的表达调控。
iEVT的浸润涉及细胞增殖、基质降解、迁移与分化等过程,这些过程受多种因素的严格调控。现已发现,iEVT应答多种自分泌与旁分泌因子,包括细胞因子、生长因子、蛋白酶等;促进性因子与抑制性因子的平衡调节iEVT的浸润。子宫肌层中MMP-2、MMP-9和u-PA的表达水平低于蜕膜,可能控制iEVT向子宫肌层浸润的深度。许多激素对EVT浸润具有调节作用,包括hCG、甲状腺激素、胎盘生长因子(placental growth factor,PlGF)、促肾上腺皮质激素释放激素、促性腺激素释放激素等。免疫细胞产生的多种细胞因子也对iEVT浸润起调节作用,其中IL-1b、IL-8、IL-15等细胞因子促进浸润,而IL-10、IL-12、IL-24等细胞因子抑制浸润。上述内分泌、自分泌和旁分泌因子的时空精细调节,保证了滋养层细胞的浸润限制在整个子宫内膜与子宫肌层的上1/3处。
iEVT最终分化为胎盘床巨细胞。与合体滋养层(STB)细胞相似,胎盘床巨细胞可以分泌人胎盘催乳素和hCG,这说明,胎盘床巨细胞能在正常妊娠维持中发挥作用。此外,这些巨细胞还产生蛋白酶抑制剂,可以防止绒毛外滋养层细胞过度浸润至子宫肌层深部。
妊娠前3个月,iEVT浸润进入母体蜕膜组织,但并不引发母体的免疫反应。这种免疫豁免的具体执行机制是一个研究的热点问题。目前最受关注的焦点在于iEVT与特异性蜕膜自然杀伤(decidual natural killer,dNK)细胞间的相互作用。在胚胎植入位点附近,dNK细胞占据淋巴细胞总量的大部分。此类细胞的表面受体可与iEVT所表达的3种人类白细胞抗原(HLA)结合,后者有助于母胎界面的免疫耐受。有研究表明,HLA-E可以与dNK细胞表面的抑制性受体以高亲和力相结合,从而抑制dNK细胞的细胞毒性(Moffett-King,2002)。关于dNK细胞与iEVT相互作用的讨论详见本篇第三章。
氧分压被认为是滋养层细胞增殖与分化平衡中的一个关键因素,某些特定的转录因子作为氧感受器发挥作用,如缺氧诱导因子(hypoxia-induced factor,HIF)。缺氧或高氧可在大多数动物组织中诱导异常反应,因此适宜氧浓度对机体的健康十分重要。妊娠期间,绒毛内氧分压随母胎循环的逐步建立而发生改变。据估计,妊娠8周和10周时,绒毛内的平均氧分压分别为17.9±6.9mmHg和39.6±12.3mmHg。随着血管改建,母胎间的气体交换能力增强,氧分压水平随之增至80~100mmHg。氧分压在妊娠阶段的变化不仅依赖于母胎界面血管发育,也对调节滋养层细胞行为、维持正常的胎盘发育起关键作用。
有研究利用从妊娠5~8周绒毛中分离得到的细胞滋养层细胞与锚定绒毛外植体,发现较低的氧浓度(2%氧气或14mmHg)可以刺激细胞滋养层细胞进入细胞周期、开始活跃增殖,从而阻止其向浸润途径分化,证明氧分压可调节滋养层细胞的增殖行为(Genbacev et al.,1997)。这一观点随后被来自多个滋养层细胞系和胎盘外植体的研究证据所支持。低氧也可抑制EVT向母体螺旋动脉的浸润。与17%氧气条件相比,在3%氧气条件下与子宫肌层螺旋动脉共培养,iEVT的浸润受到抑制。
然而,另一些结果表明,低氧可能抑制滋养层细胞的增殖。这些结果指出,处于不同妊娠周龄的滋养层细胞分化能力可能存在差异。以HTR8/SVneo细胞为模型探讨氧分压对细胞浸润的影响时,不同研究得到的结果并不一致。Graham等的报道支持低氧(1%)对浸润的促进作用,该促进作用通过诱导HTR8/SVneo细胞中细胞表面uPAR的上调而实现。他们同时认为,应答低氧而浸润能力增强是滋养层细胞、癌细胞等浸润性细胞的普遍特性。另有报道则证明低氧下的HTR8/SVneo细胞浸润性有所降低。
上述明显相反的结果提出了两个问题,即哪些变量影响了体外实验;体外的低氧环境能否真实反映体内的生理与病理氧气浓度。Burton等提出,体外氧分压相关研究必须克服3个主要障碍:①体外缺乏血红蛋白作为氧载体;②特定妊娠周龄下,体内真实氧分压的精确测量;③样品采集与培养期间因疏忽所致的氧化应激。例如,外植体样本应当被修剪至5mm厚,以降低出现组织缺氧的可能性(Burton et al.,2006)。
至今为止,已有多条信号通路被发现参与调控滋养层细胞浸润,其中包括 MAPK信号通路、JAK-STAT、Wnt、FAK和Rho/ROCK、TGF-β超家族信号通路等。
MAPK信号通路参与滋养层细胞的浸润与分化过程,是许多促浸润性因子的下游通路。IGF-Ⅱ、IGFBP-1、内皮素和前列腺素E 2 均可在人类滋养层来源的永生化细胞系HTR8/SVneo中激活ERK1/2,促进细胞的浸润与迁移。表皮生长因子(EGF)通过激活MAPK与PI3K,在HTR8/SVneo细胞中诱导MMP-9的生成,从而促进细胞迁移。HGF在绒毛外滋养层细胞系SGHPL-4中通过p42/p44激活MAPK通路。LIF则通过激活ERK1/2和STAT3以诱导JEG-3细胞浸润。ERK和AKT信号通路也能够提高MMP-2水平,从而参与hCG介导的SGHPL-4细胞浸润和迁移。在子痫前期胎盘的浸润性滋养层细胞中,ERK1/2的磷酸化形式较正常胎盘显著升高。
JAK-STAT信号通路的多个成员都被发现与滋养层细胞浸润有关,包括 STAT1、STAT3与 STAT5。STAT1和 STAT3的激活参与LIF对HTR/SVneo和JEG-3细胞浸润的诱导;ERK1/2和JAK-STAT介导的STAT3磷酸化(丝氨酸727)参与LIF介导的JEG-3浸润,也与mucin1、Fos和Jun等浸润相关分子有关。人类胎盘生长因子(human PlGH,hPlGH)通过JAK2激活STAT5,并促进原代EVT浸润;EGF也通过STAT5诱导HTR/SVneo和JAR的增殖和浸润。值得注意的是,STAT3存在于早孕绒毛分离的原代滋养层细胞中,但难以在足月胎盘分离的滋养层细胞中检测到,说明JAK-STAT信号通路可能在人类胎盘发育早期的滋养层细胞浸润过程中发挥作用。
经典的Wnt信号通路在EVT分化过程中上调促迁移基因的表达而促进滋养层细胞迁移和浸润。在妊娠早期滋养层细胞中,Wnt3a通过诱导β-catenin/TCF转录因子复合体与靶基因 cyclinD1 表达而促进滋养层细胞增殖。早孕绒毛外植体与SGHPL-5细胞中,经典的Wnt信号和PI3K/Akt信号分别独立参与介导Wnt3a刺激的滋养层细胞迁移和MMP-2产生。子痫前期胎盘中Dkk1和sFRP4(Wnt信号抑制剂)表达上升,β-catenin和Wnt-2表达下降。
FAK信号接受整合素、生长因子和G蛋白偶联受体的刺激,激活下游的激酶级联反应;并能磷酸化Rho、Rac、Cdc-42等Rho家族GTP酶的正向调节因子GEF与负向调节因子GAP。Rho、Rac和Cdc-42随后激活下游效应分子,如ROCK和PAK,调节细胞骨架蛋白等多种基因的转录。FAK-Src信号参与环胞多肽A诱导的滋养层迁移与浸润,在人类原代滋养层细胞与JEG-3中上调MMP-2和MMP-9活性,并抑制E-cadherin表达。IGF-Ⅰ和IGF-Ⅱ可通过RhoA、RhoC与ROCK促进人类滋养层细胞的迁移。此外,FAK活性的降低可抑制MMP-2的活性和细胞迁移能力,而选择性抑制Rho-ROCK信号可抑制原代滋养层细胞的迁移。
TGF-β超家族包括40余个成员,通过Ⅰ型和Ⅱ型丝/苏氨酸受体酪氨酸激酶[激活素受体样激酶(activin receptorlike kinases,ALK)传导信号。该家族的每一个成员都结合特定的Ⅰ型和Ⅱ型受体,自身磷酸化并随后激活Smad,入核进行基因转录。TGF-β超家族对滋养层细胞的浸润具有负向调节作用。利用HTR8/SVneo作为细胞模型,TGF-β1、Nodal、Nodal受体与组成性激活的ALK7均可抑制细胞迁移和浸润。TGF-β信号通过 Smad2降调细胞-细胞黏附分子VE-cadherin表达。胎盘外植体中,Nodal处理可提高TIMP-1表达水平,并降调MMP-2和MMP-9,抑制外植体的扩张和EVT的迁移;反之,抑制 TGF-βⅠ型受体的表达,可增强HTR8/SVneo细胞的迁移与浸润能力。
(王雁玲)