




胚胎植入要求两个基本条件:有植入能力的胚胎和处于容受态的子宫。因此,对于子宫本身来说,其必须处于能够接受胚胎植入的状态。顾名思义,子宫在月经周期中不是一直处于接受胚胎植入的状态,只有在激素诱导后的特定时间段内才能接纳胚胎发生植入反应,所以,将能够接受胚胎并有利于其植入的子宫定义为容受性子宫,这段有限的时间被称为“植入窗口期(the window of imp lantation)”。
子宫是哺乳动物特有的器官,其主要功能之一是在植入窗口期接受有植入能力的胚胎。20世纪60年代,Dickmann等在进行胚胎移植技术的研究中首次提出了“植入窗口期”这一概念,发现子宫只在特定的时间内接纳移植胚胎的植入,这一现象首先在大鼠中被发现,并在小鼠中得到了进一步验证。子宫容受性可划分为容受态前期、容受态期和不应期3个阶段。在容受态前期,子宫有利于胚胎发育但不能起始胚胎植入;在容受态期,如果有具有植入能力的胚胎存在,子宫就可以起始胚胎植入;在不应期,子宫不利于胚胎的存活和发育。
小鼠妊娠第1~3日(见阴道栓为妊娠第1日)的子宫处于容受态前期;妊娠第4日,在卵巢孕激素和植入前雌激素峰的刺激下,子宫进入容受态;但从第5日末开始,子宫就失去了起始胚胎植入的能力。同样,人月经周期中分泌期的前7日是容受态前期;分泌期第7~10日子宫进入容受态期;分泌期的其他时间被认为是不应期。子宫容受态是决定妊娠成败的关键因素,因为具有植入能力的胚胎只能在处于容受态的子宫中才能发生植入反应。影响容受态的任何因素都会影响妊娠结局,如胚胎发育阻滞和妊娠丢失(Plant et al.,2015)。
子宫组织主要包括3层:外层为肌肉层,中间为基质层及其中的腺体,内层为子宫腔上皮层。月经期和妊娠期子宫的变化受来自卵巢的类固醇激素的调控,是一个激素主导的过程。从本质上来说,来自卵巢的两种主要类固醇激素——雌激素和孕激素,协同作用使子宫进入容受态,在此过程中上皮细胞和基质细胞会呈现出形态和功能上的改变。
1.微绒毛和胞饮突
子宫腔内衬极化的上皮。子宫从容受前状态进入容受态的一个标志是腔上皮细胞表面微绒毛的回缩。这些微绒毛在卵巢激素的影响下会发生动态改变。当雌激素和孕激素同时作用使子宫进入容受态时,子宫腔上皮的规则微绒毛由突出变扁平,是许多物种子宫容受态的形态学标志。上皮细胞微绒毛扁平化异常的子宫不能接受胚胎植入。另外,有研究表明子宫容受态过后的短时间内,子宫腔上皮很快恢复规则的突出微绒毛,进一步表明子宫容受态和子宫腔上皮微绒毛变化之间的紧密关系。
子宫进入容受态时,子宫腔上皮的另一个形态学标志是大的胞饮突出现,标志着子宫从容受前状态进入了容受态。通过传统的扫描电子显微镜技术,这种结构最早在大鼠和小鼠中被发现,由于其胞饮作用而被命名为胞饮突。研究发现,大鼠胞饮突的变化和子宫容受态的建立是同步的,因为妊娠第4日胞饮突数目增加,在妊娠第5日子宫进入容受态时胞饮突数目进一步增加,但在植入后其数目快速下降。
胞饮突是子宫腔上皮顶部表面的球状胞质突起,只在子宫处于容受态时出现。进一步的研究发现,子宫中胞饮突的动态变化也受到卵巢类固醇激素的调控。然而,人类胞饮突能否作为子宫容受态的标志仍存在争议,因为胞饮突在月经周期的整个黄体期都存在。但有证据表明,胞饮突在子宫植入窗口期最明显,表明胞饮突至少有助于判断人类子宫容受态。
2.子宫腔闭合
子宫腔闭合是子宫腔上皮和胚胎紧密接触及胚胎正确附着必需的,是子宫容受态的另一个形态学标志。已有研究证明,孕酮是子宫腔闭合必需的,因为缺失孕酮受体的伴侣分子FKBP52的小鼠对孕激素信号不敏感,不能发生子宫腔闭合。但胚胎对子宫腔闭合不是必需的,因为假孕小鼠子宫也可以子宫腔闭合。另外,有证据表明子宫腔液体的分泌和重吸收对子宫腔闭合非常重要,而这些过程至少受两种重要因子的调控:囊性纤维化跨膜转导调节因子和上皮Na + 通道(其具体作用机制见本章第三节)。
在子宫容受态建立的过程中,子宫除形态的改变外,功能也发生了改变,而这些改变是由黏附分子、细胞因子和同源框蛋白等因子共同介导,其中一些因子已经作为子宫容受态的鉴定标志分子。例如,子宫腔上皮表达的部分糖蛋白被认为是抑制子宫腔上皮和胚胎相互作用的屏障;植入位点这类糖蛋白的消失和胚胎黏附到子宫的过程一致。糖蛋白中的黏液蛋白-1(muc-1)在植入前定位在子宫腔上皮顶部质膜,其表达随着子宫容受态的获得而降低,这与糖蛋白是抑制胚胎植入的子宫屏障的观点一致。然而,muc-1在人植入窗口期的子宫中表达很高,研究人员认为人的胚胎能够特异地在植入位点下调muc-1,而非植入位点依然高表达muc-1,这种现象在兔子中也有发生。因此,人和小鼠的胚胎植入都需要在植入位点移除muc-1。
妊娠是一个激素主导的过程,包括子宫容受态的建立。调控子宫容受态建立的激素主要是卵巢的雌激素和孕激素。小鼠妊娠第1日,在排卵前卵巢雌激素的作用下,子宫上皮细胞大量增殖直到妊娠第2日。从妊娠第3日开始,来自新形成黄体的孕激素分泌增多,启动子宫基质细胞增殖。妊娠第4日早上,少量雌激素协同孕激素进一步诱导基质细胞大量增殖和上皮细胞的分化,此时子宫上皮细胞逐渐失去极性。第4日早上的少量雌激素对子宫容受性的真正建立和囊胚激活都有重要作用,这也是小鼠延迟植入模型的重要理论基础。同样,基于植入前的激素调控网络,可通过给予外源性雌激素和孕激素使卵巢摘除小鼠的子宫进入容受态。
子宫中,雌激素和孕激素主要通过其各自的核受体[雌激素受体(ER)和孕激素受体(progesterone receptor,PR)]发挥作用。ER和PR各有两种主要的亚型:ERα和ERβ及PRA和PRB。药理学和遗传学的证据发现ER和PR对子宫容受态的建立是必须的。例如,在植入前注射ER或PR的拮抗剂能有效抑制子宫容受态的建立。另外,敲除ERα或PRA的小鼠模型研究也证明ERα或PRA在子宫的胚胎植入过程中起重要作用。缺失 Esr1 (编码ERα)的小鼠子宫发育不全,不能支持胚胎植入,但缺失 Esr2 (编码ERβ)的子宫能发生正常的胚胎植入反应;缺失 Pgr (从不同的启动子编码PRA和PRB)的小鼠是不育的,但缺失PRB的小鼠具有正常的卵巢和子宫反应性,是可育的。
如前所述,雌激素和孕激素的协同作用指导子宫进入容受态,伴随着子宫上皮细胞明显的形态学和功能改变。子宫上皮细胞增殖和分化过程中卵巢雌激素和孕激素的相互作用见图2-2-1。利用缺失ER或PR的小鼠模型进行上皮和基质重构实验证实,雌激素通过子宫基质中的受体ERα促进子宫上皮细胞增殖,主要依赖于基质产生的IGF1等旁分泌因子;而子宫上皮细胞的分化需要上皮和基质细胞中ERα共同作用。孕激素通过子宫上皮和基质细胞中的PR拮抗雌激素诱导的上皮细胞增殖,同时促进基质细胞增殖。通过雌激素和孕激素主导的上皮基质相互作用及复杂调控网络,子宫逐步获得了接受胚胎植入的能力。
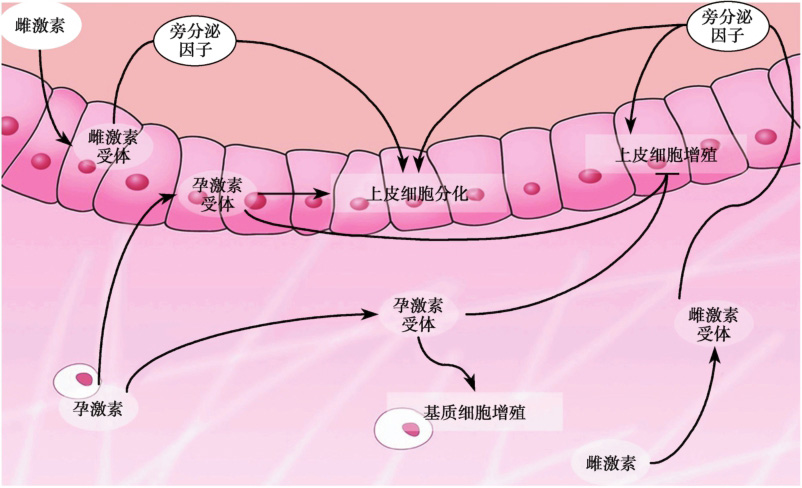
图2-2-1 卵巢雌激素和孕激素对子宫容受态的调控模式图
1.雌激素在子宫容受态窗口期的长短中起关键作用
在正常妊娠和延迟植入模型中,植入前雌激素对子宫容受态的建立和植入窗口的开放发挥重要作用。通过小鼠延迟植入模型,可以研究不同剂量雌激素对子宫植入窗口期长短的影响。研究发现,在生理范围内,低剂量雌激素可以延长植入窗口期,但高水平的雌激素会快速关闭植入窗口,使子宫进入不应期。在辅助生殖的促排卵操作中发现,取卵周期中子宫胞饮突会比自然周期提前1~2日出现,胞饮突提前出现表明植入窗口期可能前移。在这一发现的基础上可以推测,促排卵周期尤其是卵巢过度刺激综合征中,胚胎植入率的下降可能是由于过量雌激素暴露而导致子宫容受态和囊胚之间的不同步。
2.孕激素补充可以延长子宫植入窗口期
小鼠囊胚可以在正常的植入窗口期之外起始胚胎植入反应。例如,移植到妊娠第5日假孕小鼠子宫的正常囊胚可以起始胚胎植入过程,但当正常囊胚被移植到妊娠第6日的假孕子宫后则不能发生植入。然而,补充外源性的孕激素可以把植入窗口期延长到妊娠第6日。尽管如此,在这种异常窗口期植入的小鼠胚胎会在出生前有较高的死亡率,与人类中发现的异常植入窗口植入的胚胎在后期发育中有较高的流产率一致。
尽管对模式动物的子宫内膜容受性建立的分子调控有了一定认识,部分研究结果也在人类的子宫内膜中得到了验证。但在临床实践中,目前还没有可有效评价内膜容受性的标记分子。国外有研究组总结以往发表的转录组芯片等数据,综合获得子宫内膜容受性建立过程中的标记分子群,利用这些分子建立了内膜容受性芯片(endometrium receptivity array,ERA),但该芯片是否能很好地用于国内辅助生殖实践还需要实践检验。同时,利用新的微量组学等手段开展人子宫内膜容受性的深入研究,可能是开发新的内膜容受性检测和评价等应用工具的重要途径之一。
(王海滨 陈琼华)