




慢性肾脏病(chronic kidney disease,CKD)是指多种病因导致的肾脏结构或功能改变,伴或不伴有肾小球滤过率下降,可表现为肾脏损伤指标异常或病理检查异常。
CKD会影响患者血小板聚集能力和凝血功能,同时肾脏排泄能力减低又会影响经肾脏代谢的药物。CKD既是出血危险因素又是血栓栓塞的危险因素。
对于心房颤动合并CKD需抗凝治疗的患者,根据肌酐清除率决定抗凝策略。
对于心房颤动合并轻、中度CKD的患者,华法林减少脑卒中和死亡率的获益是肯定的。与华法林相比,NOACs关键试验的各亚组分析显示,所有四种NOACs在轻、中度CKD和非CKD患者中的有效性和安全性是一致的。
华法林治疗可显著降低CKD患者的脑卒中或血栓栓塞风险,但也会显著增加出血风险。华法林也未在此类患者中进行过前瞻性随机对照研究。需仔细评估华法林治疗带来的净临床效应。
由于所有NOACs确证试验基本上都排除了CrCl < 30ml/min的患者(除外少数CrCl为25~30ml/min者应用阿哌沙班),所以尚缺乏关于心房颤动合并严重CKD或者肾脏替代治疗患者应用NOACs预防脑卒中的随机对照研究数据。然而,在欧洲,利伐沙班、阿哌沙班、艾多沙班(不包括达比加群)被批准可减量用于CrCl为15~29ml/min的患者。基于药代动力学模拟计算,美国已批准低剂量达比加群每次75mg,每天2次,用于CrCl为15~29ml/min的患者。针对这些难治性患者的治疗,迫切需要进一步随机试验的数据。
华法林在此类患者中的应用也缺乏强有力的证据,华法林可降低脑卒中和栓塞的发生率,但出血风险明显增加。唯一一项评估净获益的注册研究发现,依赖透析的患者应用华法林治疗后其总体死亡率无变化。所以此类患者抗凝决策仍是多学科、高度个体化治疗方案,并需遵从患者的个人意愿。
NOACs在终末期肾功能不全和透析患者中应用的有效性和安全性尚不清楚,目前正在进行研究。在缺乏硬终点的情况下,严重肾功能不全(CrCl<15ml/min)及透析患者应尽量避免常规使用NOACs。
围手术期何时停用以及何时重启抗凝药物,应同时考虑患者的临床特征(包括年龄、出血史、伴随治疗和肾功能等)和手术的出血风险(表6-6)。侵入性外科操作需要临时停用口服抗凝药,但一些损伤性较小的操作出血风险相对低,停用抗凝药不是必需的,需结合患者的临床特征综合判断。
正在接受华法林治疗的心房颤动患者在手术前需暂时停药。若非急诊手术,一般需要在术前5天左右(约5个半衰期)停用华法林,并使INR降低至1.5以下。若INR>1.5,但患者需要及早手术,可予患者口服小剂量(1~2mg)维生素K 1 ,使INR尽快恢复正常。
表6-6 外科手术出血风险分级

续表

注:对于每位患者,应评估其本身的出血和血栓栓塞的风险,并与手术医师讨论后决定治疗方案。
a
术前末次服药时间≥1~24小时不等。
服用华法林治疗的心房颤动患者,如存在较高血栓栓塞风险,建议桥接治疗。中度血栓栓塞风险的患者,术前应用低剂量(5000U)普通肝素(unfractionated heparin,UFH)皮下注射或预防剂量(0.5mg/kg,每日2次)的低分子肝素(low molecular weight heparin,LMWH)皮下注射。高度血栓栓塞风险的患者,当INR下降时,开始全剂量(负荷量80~100 U/kg、最高剂量5000 U静脉注射后,18U·kg -1 ·h -1 静脉输注或15000~20000 U每12小时一次皮下注射)UFH或治疗剂量(1mg/kg,每日2次皮下注射)的LMWH治疗。术前持续静脉应用UFH者,术前6小时停药;术前皮下注射UFH或LMWH者,术前24小时停药。
根据手术出血的情况,在术后12~24小时重新开始抗凝治疗,出血风险高的手术,可延迟到术后48~72小时再重启抗凝治疗,术后起始可用UFH或LMWH与华法林重叠。在华法林抗凝达标后,停用UFH或LMWH。
服用NOACs的患者,由于其可预测的抗凝效果,起效快,半衰期较短,停药后作用消除快,在手术前短期停药和手术后重新服用时无需桥接治疗。
根据出血风险及肾功能状态决定NOACs停用的时间(表6-7)。当出血风险极低,且即使出血也可进行适当的局部压迫治疗,如一些口腔科的手术或白内障、青光眼手术,可以在NOACs抗凝治疗的谷值浓度时进行手术(如最近一次服药12小时或24小时之后,根据每天2次或每天1次服药而定)。
如果手术后即刻能够完全止血,可在6~8小时后开始服用NOACs。大多数外科手术后48~72小时再重启抗凝治疗。
心房颤动持续时间不详或≥48小时的患者,需应用华法林达标或新型口服抗凝药物至少3周或行经食管超声排除心房内血栓。华法林抗凝达标者术前不需要停药,维持INR在2.0~2.5。NOACs可以术前12~24小时停用或不停用。
表6-7 择期手术前末次NOACs服药时间
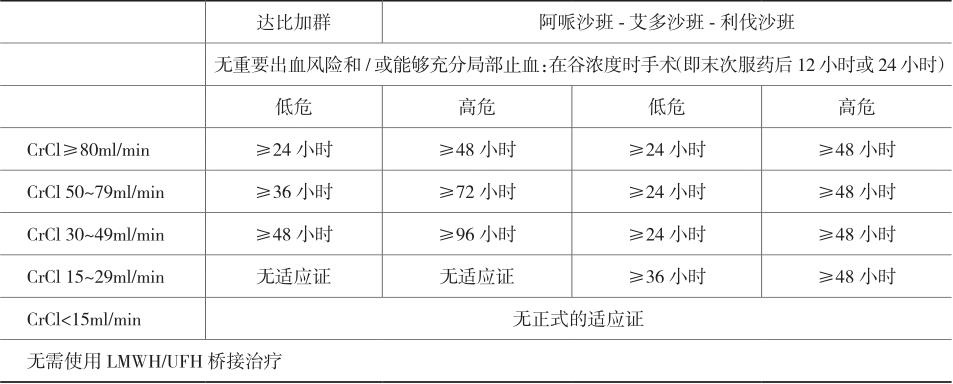
注:在低出血风险手术≥24小时后或高出血风险手术≥48~72小时后重新开始足量NOACs治疗。低危=出血风险低和/或出血影响小的手术;高危=出血风险高和/或出血影响大的手术(表6-6)。
术中房间隔穿刺前或穿刺后即刻给予普通肝素,并维持活化凝血时间(activated clotting time,ACT)在300~400秒。
术后如果止血充分,且已证实无心包积液,鞘管拔出3~4小时后恢复使用NOACs或华法林。消融术后应用华法林或NOACs抗凝治疗至少2个月。此后是否需要长期抗凝取决于栓塞危险因素。
对于置入器械(如起搏器)者,近年来的研究得出的结论是,围手术期不停用华法林,可减少出血及血栓事件。对于服用NOACs的患者,推荐采用在手术当日早晨服用、术后第1天重新启用NOACs。
使用华法林的患者在接受择期或紧急PCI时应继续使用。但不清楚对NOACs是否可以这样做,因为所有的临床试验中,接受NOACs治疗的患者在行PCI时均建议停用。故目前仍建议择期PCI时,最好应停用NOACs 24小时以上。
心房颤动伴ACS和/或PCI不但是一种常见的临床情况,也使抗凝和抗血小板治疗更加复杂,并且具有更高的发病率及病死率。双联抗血小板治疗(dual antiplatelet therapy,DAPT)可以预防支架内血栓,但其不足以预防脑卒中。口服抗凝药是预防脑卒中的基石,但其本身不足以预防新发冠状动脉事件,尤其是ACS或PCI术后近期的冠状动脉事件。当心房颤动合并ACS和/或PCI后需要联合抗栓治疗。临床上将口服抗凝药联用阿司匹林或一种P 2 Y 12 抑制剂称为“双联抗栓治疗”,将抗凝药联用阿司匹林及一种P 2 Y 12 抑制剂及称为“三联抗栓治疗”,而将阿司匹林联用一种P 2 Y 12 抑制剂称为“双联抗血小板治疗”。口服抗凝药与一种或两种抗血小板药物联用,减少缺血事件同时将不可避免地显著增加出血风险,因而临床实践中应尽量避免长期三联抗栓治疗。
到目前为止,在心房颤动合并ACS和/或PCI的患者完成了三项前瞻随机对照研究评价NOACs联合一种P 2 Y 12 抑制剂的双联抗栓治疗与华法林联合两种抗血小板的三联抗栓治疗的安全性和有效性。这些研究主要终点为出血事件,统计效能不足以比较相对发生率少的脑卒中、再梗死及支架内血栓事件。研究显示:以NOACs为基础的双联抗栓治疗较以华法林为基础的三联抗栓治疗可明显降低出血,并且血栓栓塞事件相似。
心房颤动合并ACS和/或PCI目前建议:①推荐应用新一代药物涂层支架。②尽量缩短三联抗栓治疗的时间,出血风险极高患者可考虑起始双联抗栓治疗(抗凝联合一种P 2 Y 12 抑制剂)。联合抗栓治疗的方案、时程需要根据冠状动脉血栓事件的风险、心房颤动脑卒中及栓塞风险及出血风险进行个体化调整。③尽量采用桡动脉入路,以减少出血风险。④必要时联用质子泵抑制剂或H 2 受体拮抗剂,以减少消化道出血风险。
心房颤动合并ACS患者联合抗栓治疗建议:①出血风险高:三联抗栓治疗(华法林或NOACs、阿司匹林联合氯吡格雷)1周至1个月,其后应用华法林或NOACs与一种抗血小板药物(阿司匹林或氯吡格雷)的双联抗栓治疗至ACS和/或PCI术后1年。出血风险极高的患者也可考虑起始双联抗栓治疗。②出血风险低、血栓栓塞风险高,则用三联抗栓治疗1~6个月,其后应用华法林或NOACs与一种抗血小板药物(阿司匹林或氯吡格雷)的双联抗栓治疗至ACS和/或PCI术后1年。
心房颤动合并择期PCI患者联合抗栓治疗建议:①出血风险高:三联抗栓治疗1周左右,其后应用华法林或NOACs与一种抗血小板药物(阿司匹林或氯吡格雷)的双联抗栓治疗至PCI术后6个月。其后,单用口服抗凝药。如果出血风险极高,CHA 2 DS 2 -VAS C 评分男性=1分(女性=2分),可以起始DAPT治疗。②出血风险低、血栓栓塞风险高,则用三联抗栓治疗1~3个月,其后应用华法林或NOACs与一种抗血小板药物(阿司匹林或氯吡格雷)的双联抗栓治疗至PCI术后1年。
心房颤动患者合并稳定性冠状动脉粥样硬化性心脏病(ACS或PCI后1年)、颈动脉粥样硬化性疾病或外周动脉疾病时,单独应用华法林进行二级预防至少与阿司匹林等效。NOACs比华法林的优势在心房颤动伴稳定冠状动脉粥样硬化性心脏病患者中应该是一致的。对于所有稳定冠状动脉粥样硬化性心脏病合并心房颤动的患者,均推荐口服抗凝药单药治疗,除非患者冠状动脉事件风险非常高,且出血风险较低,否则不主张口服抗凝药联合抗血小板治疗。
肥厚型心肌病合并心房颤动血栓栓塞事件发生率高,不需要进行CHA 2 DS 2 -VAS C 评分,均应抗凝治疗。
在心房颤动持续时间>48小时或持续时间不明的患者中,拟行择期心脏复律前应使用剂量调整的华法林(INR 2.0~3.0)或NOACs进行至少3周的抗凝治疗。或经食管超声检查无左心房或心耳血栓,在抗凝治疗下,提前进行转律治疗(不必等待3周的抗凝治疗)。复律后继续进行4周的抗凝治疗。其后,具有栓塞危险因素的患者,继续长期抗凝治疗。
心房颤动发作<48小时的患者在应用普通肝素或低分子肝素或NOACs治疗下可直接进行心脏复律。转律后无栓塞危险因素可不抗凝。但若具有脑卒中危险因素的患者,长期抗凝治疗。
心房颤动发生>48小时且伴血流动力学不稳定(心绞痛、心肌梗死、休克或肺水肿)应立即进行心脏复律,尽快启动抗凝治疗。复律后继续抗凝治疗。口服抗凝治疗的持续时间(4周或长期)取决于患者是否存在脑卒中的危险因素。
抗凝治疗可有效预防心房颤动患者发生脑卒中。心房颤动相关脑卒中早期复发率高,脑卒中后7~14天内应用非口服抗凝药未降低脑卒中复发,但显著增加出血,并且死亡率及致残率两者相似。目前对心房颤动患者脑卒中后的急性期抗凝治疗的安全性和有效性研究较少。
荟萃分析显示,心房颤动患者脑卒中急性期使用抗凝治疗效果并不优于阿司匹林,出血风险却显著增加。
研究显示,大面积缺血性脑卒中后即刻应用非口服抗凝药增加出血风险,且未能降低脑卒中复发率;小面积脑卒中、短暂性脑缺血后即刻应用或持续应用抗凝治疗获益大于风险。
缺血性脑卒中后,必须在(复发性)脑卒中风险超过继发性出血转化的风险时才能做出(重新)开始口服抗凝药物治疗的推荐。启用抗凝药的时机取决于脑卒中的严重性,在未启用抗凝药物前,可应用抗血小板药物。
现在缺乏应用NOACs时出现TIA或脑卒中后重启抗凝药物的大量研究数据,应由多学科团队(包括神经内科、影像科、心内科,必要时血液科等)根据患者的情况进行个体化处理,目前的推荐只是基于专家共识。重启NOACs与华法林的临床实践相类似。具体建议如下。
1.TIA患者,可继续服用NOACs,也可推迟1天服用。
2.轻度脑卒中美国国立卫生院神经功能缺损评分(national institutte of health stroke severity scale,NIHSS)<8分的患者,如果没有临床恶化或有临床改善,预计抗凝不会显著增加患者继发性出血转化的风险,可以在缺血性脑卒中后≥3天开始口服抗凝药。
3.中度脑卒中(NIHSS 8~15分)患者,通过再次脑成像(使用CT或MRI检查)排除继发性出血转化的风险后,可以在缺血性脑卒中后≥6天开始抗凝治疗。
4.重度脑卒中(NIHSS>16分)患者,(重新)启用抗凝治疗之前24小时内通过头颅CT或MRI除外出血转化的风险,可以在缺血性脑卒中后≥12天开始抗凝治疗。
5.不建议给正在使用抗凝治疗的脑卒中患者进行溶栓治疗。
6.心房颤动相关脑卒中长期口服抗凝药(华法林、NOACs)明确获益。NOACs在减少颅内出血、出血性脑卒中方面更具优势。