




原发性支气管癌(primary bronchogenic carcinoma)简称肺癌(lung cancer),为起源于支气管黏膜或腺体的恶性肿瘤。肺癌发病率位于男性肿瘤的首位,并由于早期诊断不足致使预后差。目前随着诊断方法进步、新药及靶向治疗药物出现,规范有序的诊断、分期及根据临床行为进行多学科治疗的进步,患者生存期有所延长。然而,要想大幅度地延长生存期,仍有赖于早期诊断和早期规范治疗(图6-5-1)。
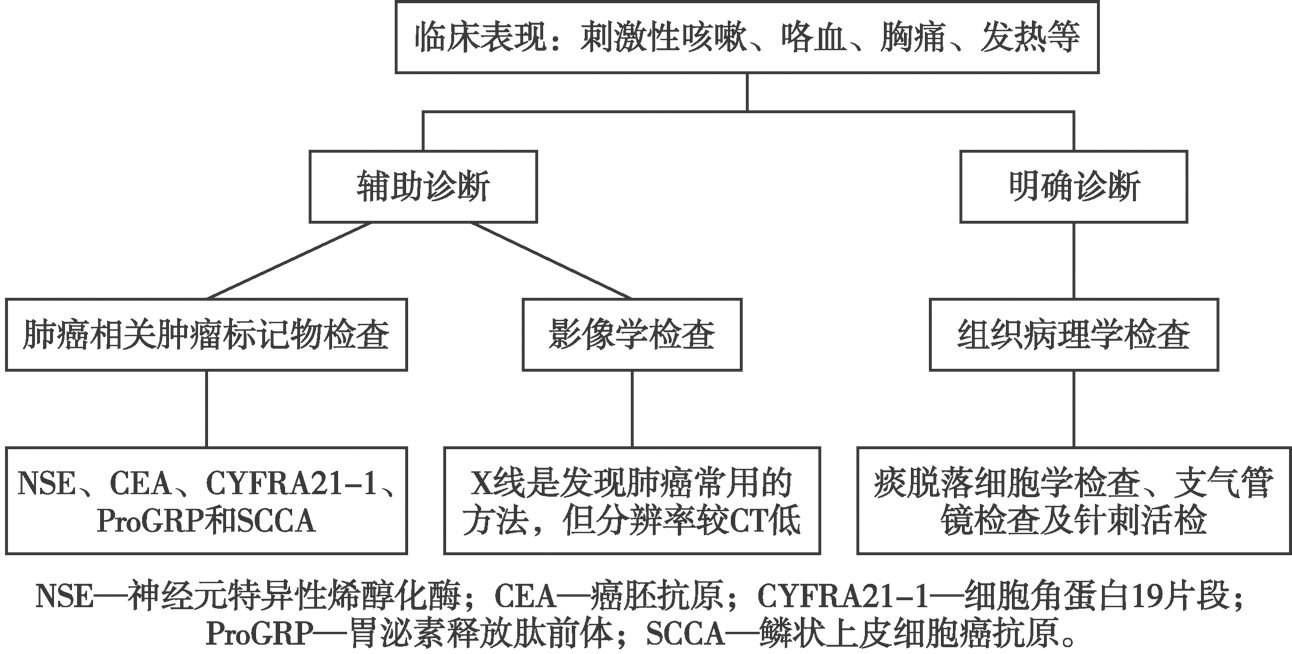
图6-5-1 肺癌的实验诊断流程
病历摘要
患者,男,62岁。因“咳嗽、咳痰2个月,痰中带血1周”入院。患者于2个月前无明显诱因出现刺激性咳嗽,咳少量灰白色黏痰,伴右胸背部胀痛,无发热、盗汗、心悸等症状。曾按呼吸道感染服用抗生素和止咳药,疗效欠佳。1周以来间断痰中带血,即来我院就诊。既往无结核等传染病病史,无药物过敏史;吸烟20余年,每日约10支。发病以来无明显消瘦,食欲尚可,大小便正常,近日偶感疲乏。体格检查:T 37℃,P 82次/min,R 20次/min,BP 124/84mmHg。患者神志清楚,检查合作,皮肤、巩膜无黄染。双侧锁骨上未触及肿大淋巴结,气管中位,无声嘶。双胸廓对称,叩诊呈清音,右上肺可闻及干啰音,无湿啰音,左肺呼吸音正常,HR 82次/min,律齐,无杂音。腹平软、未触及肝、脾或肿物。未见杵状指,膝反射正常。未引出病理征。辅助检查:Hb 120g/L,WBC 8.1×10 9 /L,胸部CT示右上肺前段有一约3cm×4cm大小椭圆形块状阴影,边缘模糊毛糙,可见细短的毛刺影。
患者为老年男性,有刺激性咳嗽、咳痰,痰中带血1周,给予止咳、抗炎药无效,有吸烟史。胸部CT示右上肺前段一约3cm×4cm大小椭圆形块状阴影,可见毛刺。
根据患者主诉、症状、个人史,高度怀疑原发性支气管肺癌。
鉴别诊断:①肺结核;②肺炎;③肺脓肿;④纵隔淋巴瘤;⑤肺部良性肿瘤;⑥转移性肿瘤。
根据国家卫生健康委员会《原发性肺癌诊疗规范(2018年版)》和原卫生部《原发性肺癌诊断标准》(2010年版)原发性肺癌的诊断依据如下。
1.高危人群 年龄55~74岁,吸烟≥30包/年,仍在吸烟或戒烟<15年;年龄≥50岁,吸烟≥20包/年,并有一项危险因素(ⅡA类证据),危险因素包括氡气暴露史、职业暴露史、恶性肿瘤病史、一级亲属肺癌家族史、慢性阻塞性肺气肿或肺纤维化病史。推荐对高危人群进行低剂量螺旋CT筛查。
2.临床症状 刺激性咳嗽、血痰或咯血、胸痛、呼吸困难、发热、喘鸣等。
3.辅助检查 胸部影像学检查,血肿瘤标记物,痰细胞学检查,纤维支气管镜等。
4.细胞、组织学等病理学诊断阳性为确诊标准。
为确诊原发性肺癌并进行病理学分类应行痰脱落细胞学检查、纤维支气管镜活检及肿瘤标记物检查。
美国胸科医师学会(American College of Chest Physicians,ACCP)公布的2013 ACCP肺癌诊疗指南(第3版)指出肺癌的确诊依赖于对原发病变和转移性病灶的细胞学和组织学检查。肺癌的病理诊断、临床及影像学改变为疾病提供正确分期、治疗和预后判断的信息。恰当的诊断技术亦可提高诊断准确性。
痰脱落细胞学检查是肺癌早期诊断的重要方法之一,简便易行,患者无痛苦,适用于肺癌高危人群的普查。
采集痰液的质量和方法直接影响痰检查阳性率。
采集痰液的基本要求:①痰液必须新鲜;②痰液必须是肺部咳出。
1.非小细胞肺癌(non-small cell lung cancer,NSCLC)包括鳞状上皮细胞癌、腺癌和大细胞癌等。
2.小细胞肺癌(small cell lung cancer,SCLC)包括燕麦细胞型、中间细胞型、复合燕麦细胞型。
肺癌相关的肿瘤标记物包括神经元特异性烯醇化酶(neuron specific enolase,NSE)、癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(cytokeratin-19 fragments,CYFRA21-1)、胃泌素释放肽前体(progastrin-releasing peptide,ProGRP)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCCA)。
1.敏感性高,使肿瘤能早期发现,早期诊断。
2.特异性好,能对良恶性肿瘤进行鉴别。
3.能对肿瘤进行定位,即具有器官特异性。
4.与病情严重程度、肿瘤大小或分期相关,即肿瘤越大或越晚期,肿瘤标记物浓度越高。
5.检测肿瘤治疗效果及复发情况。
6.预测肿瘤的预后,即肿瘤标记物浓度越高,预后越差。
美国临床生化学会(National Academy of Clinical Biochemistry,NACB)推荐神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)、胃泌素释放前体肽(ProGRP)、鳞状上皮细胞癌抗原(SCCA)为肺癌肿瘤标记物。并对这些肿瘤标记物在肺癌中的应用给予建议。
当前常用的肿瘤标记物及其意义。
美国临床生化学会(NACB)推荐如下。
(1)神经元特异性烯醇化酶(NSE):
诊断的敏感性和特异性都较低,在其他肿瘤,如肝癌、淋巴细胞瘤患者中均升高,有时在良性肿瘤中也增高。主要用于小细胞肺癌的诊断、治疗后监测和复发监测。
(2)癌胚抗原(CEA):
在腺癌和大细胞肺癌患者血清中含量高,在良性肿瘤和其他肿瘤中也会增高,主要用于监测肺腺癌和大细胞癌的治疗效果、监测复发。
(3)细胞角蛋白19片段(CYFRA21-1):
是非小细胞肺癌的最敏感的诊断标记,其特异性也较高。
(4)胃泌素释放前体肽(ProGRP):
是小细胞肺癌的可靠标记物,有很好的敏感性和特异性。ProGRP对小细胞肺癌的特异性是100%。良性肿瘤未见增高;可用于区分小细胞肺癌和其他类型肺癌;可作为早期诊断指标,但不能预测扩散。
(5)鳞状上皮细胞癌抗原(SCCA):
敏感性低,不适用于筛查;特异性低,所有腺癌均增高;需要与其他标记联合。
肺癌相关肿瘤标记物在肺癌诊断中的应用。
(1)筛查:
目前肺癌尚无好的早期诊断标记。针对高危人群(吸烟人群)及出现疑似肺癌症状(咯血、胸痛、肺部肿物)的患者进行多标记物联合筛查。如怀疑非小细胞肺癌(NSCLC),则CEA、SCC、CYFRA21-1三者联合筛查;如怀疑小细胞肺癌(SCLC),则ProGRP、NSE、CEA三者联合筛查。
(2)诊断:
肿瘤标记物被考虑用于肺部肿瘤的病理分型,CEA用于腺癌,CYFRA21-1和SCC用于鳞状细胞癌;CYFRA21-1和NSE用于大细胞癌;NSE和ProGRP用于小细胞癌。见表6-5-1。
表6-5-1 根据肺癌组织学及应用形式标记物使用的推荐
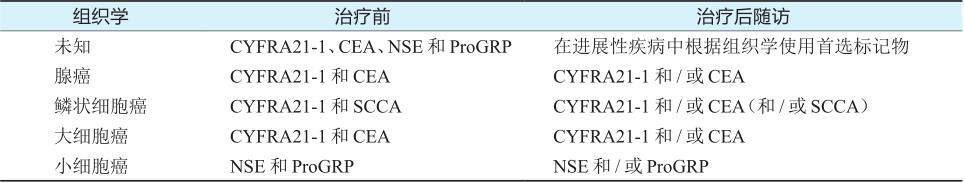
对于不同组织学类型的肺癌在治疗各个阶段对肿瘤标记物的选择,NACB指南建议,对于缺少组织学检测结果的非手术患者,当NSE和proGRP水平升高,提示SCLC;在治疗后和随访阶段使用NSE和/或proGRP,从而实现对SCLC更好的管理。
肿瘤标记物在肺癌治疗监测中的应用。
术后随访:
术后肿瘤标记物迅速下降可以预测患者的预后。在治疗性干预后肿瘤标记物会有短暂的升高,这是由损伤的正常和肿瘤组织释放出来的;下降取决于生物标记物的半衰期和残存的肿瘤细胞,治疗切除术后,CYFRA21-1、TRA和SCC应在1~2天内快速下降至健康人水平,然而CEA下降稍有延迟,取决于最初的标记物水平(半衰期1~4天),如果肾脏或肝脏功能障碍,可能会延长肿瘤标记物的半衰期。标记物的缓慢清除和/或升高预示着残存肿瘤细胞的存在和预测疾病的早期复发。
全身治疗的监测:
当通过肿瘤标记物来监测放化疗效果时,如果下降明显,则证明对治疗有反应。当升高或下降不明显时通常提示进展性疾病。在NSCLC患者,CYFRA21-1与肿瘤应答具有良好的一致性。在进展性疾病的检测中,特异性为100%,敏感性为52%,然而与疾病缓解的一致性较低。
在SCLC中,NSE和ProGRP反映临床病程和对治疗有效果。化疗期间,由于肿瘤细胞溶解,它们的水平可在治疗后24~72小时短暂性升高,而后快速降至个体基线水平。相反,治疗失败与肿瘤标记物浓度持续升高或下降不明显相关。如果NSE和ProGRP同时升高,联合检测会提示更多的信息。
复发监测:
肿瘤标记物是疾病复发很敏感的指标,通常比影像学方法领先数月,对于NSCLC患者,CYFRA21-1诊断的敏感性为79%;对于术前患者,当CYFRA21-1水平>3.3mg/L,其诊断敏感性可上升至100%。有报道CYFRA21-1、TPS和SCCA对鳞癌细胞亚型复发的监测有潜在的作用,而TPS和CEA是监测腺癌复发最好的生物标记物。
在SCLC,NSE、ProGRP和CEA是检测疾病复发的相关标记物,其中,ProGRP显示了最高的检测效能,敏感性为67%(细胞游离神经元特异性烯醇化酶为20%,CEA为38%),但当ProGRP和NSE联合检测时,会显示明显的叠加作用,敏感性达到79%。ProGRP的中位领先时间为35天。在NSE中未发现。
这些肿瘤标记物应用时的注意事项。
(1)目前,单个肿瘤标记物,如CYFRA21-1、CEA、NSE及ProGRP不能作为无症状人群和高危肺癌人群的筛查指标。
(2)CYFRA21-1、NSE和/或ProGRP的检测有助于首次治疗前的肺癌的组织学分类,在术前无组织学证据时,4种标记物的检测都是有必要的首选标记物。
(3)无组织学证据且怀疑为不宜手术的肺癌,血清NSE升高,尤其是ProGRP升高则高度提示小细胞肺癌,血清SCCA升高则提示鳞状细胞癌。
(4)对首次治疗后无症状肺癌患者的随机观察一直存有争议,然而,合适的肿瘤标记物的组合测定可能帮助评估肿瘤切除的完整性及提示复发的早期指征。
(5)在非小细胞肺癌全身治疗过程中可检测CEA和CYFRA21-1。在小细胞肺癌全身治疗过程中,NSE和ProGRP对治疗有反应,并能为进展性疾病提供证据,将来“生物学进展”的可靠标准仍需引用以肿瘤标记物为基础的干预试验。
(6)关注分析前因素是非常必要的。用于NSE检测的标本应在标本采集60分钟内从凝块中分离出来,溶血标本不能检测。溶解后血清样本的充分混合不适于细胞角蛋白的检测。受表皮和唾液污染的标本不适于SCCA检测。样本应在+4℃(短期)和− 70℃(长期)保存。
(7)同一类肿瘤标记物检测应执行组合检测,这应体现在实验室报告中并记录于患者的病历。
血液标本的正确采集和保存是肿瘤标记物测定结果准确的重要保证。血液标本采集后应及时离心,保存于4℃冰箱中;如在2~3个月内测定,应−20℃保存。酶类和激素类肿瘤标志物不稳定,易降解,应及时测定或低温保存。由于红细胞和血小板中也存在NSE,因此,样本溶血可使血液中NSE浓度增高。
2018年美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐使用酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)治疗,具体流程见图6-5-2。
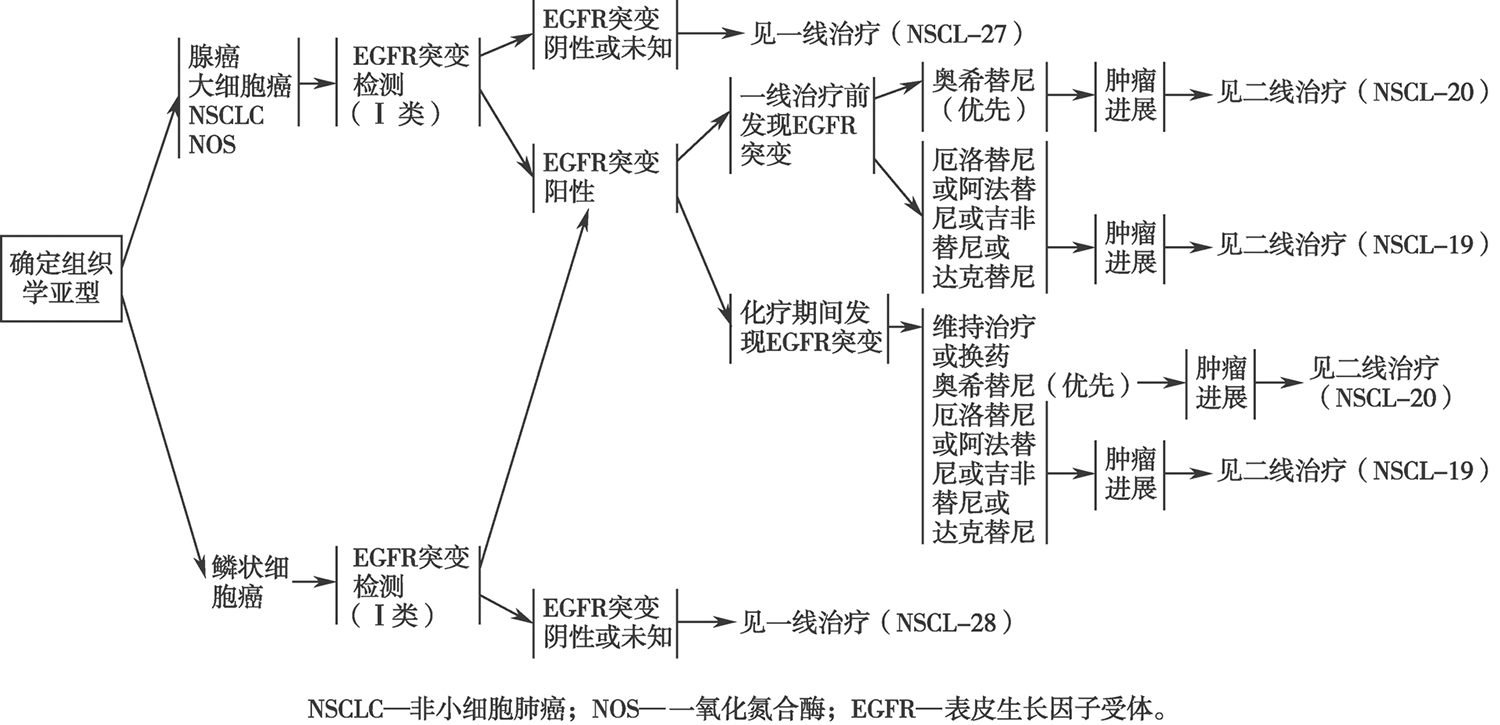
图6-5-2 肺癌复发和转移的一线治疗流程
应检测表皮生长因子受体(epidermal growth factor receptor, EGFR )基因和 K-RAS 基因突变情况。
在《非小细胞肺癌临床实践指南》(中国版)中明确指出, EGFR 和 K-RAS 突变的检测,有助于进一步病理评估,为患者接受酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)治疗提供有力依据。
(1) EGFR 正常情况下表达于上皮细胞表面,而在一些人类恶性肿瘤中通常过度表达,选择患者时,活化的 EGFR 突变是重要生物学指标。
(2) EGFR 突变,尤其是外显子19缺失、外显子21突变( L861Q )及外显子18突变( GT19X ),与肿瘤对TKIs的敏感性有重要关系,是患者选择TKIs治疗的最好指标。
(3)腺癌 EGFR 突变的发生率在西方国家为10%,亚洲人群达到50%,在不吸烟者、女性及非黏液性肿瘤中发生率更高。
(4) EGFR 和 K-RAS 突变在肺癌中互相排斥。
(5) K-RAS 突变与TKIs内源性耐药有关,对 K-RAS 无突变患者,可选择接受TKIs治疗。
(6) K-RAS 突变在非亚洲人群、吸烟者及黏液性腺癌中最常见。
EGFR 突变检测在肺癌治疗与预后预测中的意义
最常见的 EGFR 突变为外显子19缺失(45%患者)和外显子21的 L858R 突变(见于40%的患者),两者都可以导致酪氨酸激酶结构域活化,且都与肿瘤对小分子TKIs(厄洛替尼、吉非替尼)的敏感性有关。其他的药物敏感性突变类型还包括外显子21( L861Q )和外显子18( G719X ),这些药物敏感性突变在白种NSCL患者为10%,而在亚洲患者高达50%。外显子20的 T790M 突变可导致TKIs类药物耐药,有关报道显示该突变类型见于约50%的肿瘤进展患者。
(姜晓峰)