




本章内容是肿瘤化疗相关基本理论知识的简要回顾,属于妇科医生在恶性肿瘤化疗方面应掌握的基础理论知识。
很少有细胞分裂,如神经元、骨骼肌。
经常有细胞分裂,但细胞增殖与消亡是平衡的,如骨髓、上皮。
在特殊情况下增殖,如肝脏。
细胞消亡与增殖之间的平衡失调,癌细胞不受机体约束,无限增殖。
肿瘤细胞从一次分裂结束到下一次分裂结束的时间。
DNA合成前期(G 1 期)、DNA合成期(S期)、DNA合成后期(G 2 期)和有丝分裂期(M期)。

图1-1 细胞增殖周期
(1)增殖期细胞(细胞不断进行分裂增殖)。
(2)静止期(G 0 期)。
(3)无活力细胞(细胞不能进行分裂,逐渐老化死亡)。
Tips: ①任何时候,肿瘤组织都包含有增殖周期各时相的细胞、静止期细胞和无活力细胞;②各类肿瘤细胞的增殖周期的时间长短不一,增殖期细胞所占的比例亦不同;③处于增殖周期中的细胞对化疗药物最敏感。
根据药物对细胞增殖动力学影响的不同分为细胞毒类和非细胞毒类抗肿瘤药物。
依据药物对增殖周期各时相肿瘤细胞的敏感性不同,将细胞毒类抗肿瘤药物分为两大类:细胞周期非特异性药物和细胞周期特异性药物。
(1)在大分子水平上直接破坏DNA的双链,与之结合成复合物,从而影响蛋白质的合成,因此能迅速杀灭处于细胞周期各时相的细胞(甚至包括G 0 期细胞)。
(2)此类药物作用较强,并且起效快,对细胞的杀伤作用呈剂量依赖性(也称浓度依赖性,即在机体能耐受的药物毒性限度内,杀伤作用与药物剂量成正比)。
(3)常用药物:①抗肿瘤抗生素:阿霉素类、放线菌素D、丝裂霉素;②烷化剂:环磷酰胺、异环磷酰胺;③杂类:铂类、氮烯咪胺、亚硝脲类。
(1)此类药物在小分子水平上阻断DNA合成,从而影响RNA转录和蛋白质合成。
(2)药物只对增殖周期中的某时相敏感,对静止期细胞是不敏感的,因此其对肿瘤细胞的作用往往较弱并且慢,杀伤作用呈时间依赖性(即需要一定时间后才能发挥作用,当药物达到一定剂量后即使再增加剂量,其作用也不再增强)。
(3)常用药物包括:①G 1 期特异性药物:门冬酰胺酶;②S期特异性药物:5-氟尿嘧啶、甲氨蝶呤、健择;③G 2 期特异性药物:博来霉素、平阳霉素,足叶乙苷;④M期特异性药物:紫杉醇类、长春新碱。
Tips: ①静止期(G 0 期)细胞对抗肿瘤药的敏感性极低。当抗肿瘤药物杀伤增殖期细胞后,G 0 期细胞即进入增殖期。所以在肿瘤的化疗方面,主要是如何消灭增殖期细胞和G 0 期细胞的问题。②在化疗药物的使用上,常常是细胞周期非特异性药物和特异性药物配合,序贯应用比较合理。一方面,有效的细胞周期非特异性药物可使G 0 期细胞进入增殖周期,为细胞周期特异性药物发挥作用创造了条件。另一方面,细胞周期特异性药物在杀灭敏感时相的肿瘤细胞的同时,能延缓肿瘤细胞在增殖周期的进程,阻止细胞进入下一时相,导致细胞暂时性蓄积。当该阻滞解除后,肿瘤细胞将同步进入下一个时相,此时如给予作用于这一时相的化疗药,则将明显增加化疗效果。③细胞增殖周期和药物作用示意图,见图1-2。
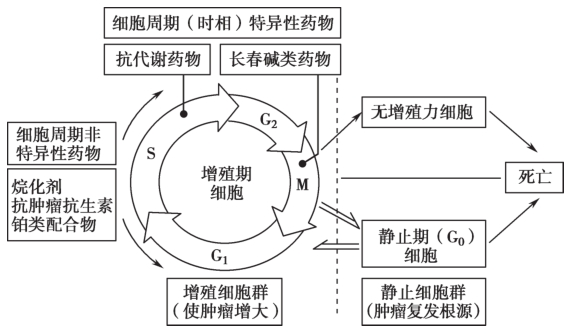
图1-2 细胞增殖周期和药物作用示意图
(1)改变激素平衡失调状态,抑制激素依赖性肿瘤的生长。
(2)常用药物:①孕酮类:甲羟孕酮等;②抗雌激素类:他莫昔芬;③芳香化酶抑制剂:来曲唑、依西美坦。
(1)酪氨酸激酶信号转导途径是癌症发生的重要转导途径,与此途径密切相关的表皮生长因子受体(epidermal growth factor receptor,EGFR)和血管内皮生长因子(vascular endothelial growth factor,VEGF)成为药物作用靶点。
(2)常用药物:①单克隆抗体:曲妥珠单抗、贝伐珠单抗;②小分子化合物:PARP抑制剂、格列卫、吉非替尼。
(1)通过增强抗肿瘤免疫应答和/或打破肿瘤的免疫抑制来产生抗肿瘤作用。
(2)分类:①主动免疫治疗(肿瘤疫苗):乙肝疫苗、HPV疫苗;②被动免疫治疗;③非特异性免疫调节剂治疗。
如重组人血管内皮抑素可通过多种通路抑制肿瘤血管生成。
涉及药物学、肿瘤生物学和患者免疫功能三个方面。
(1)口服、肌内注射和静脉注射属于全身性化疗。
(2)动脉注射属于区域性化疗。腔内和肿瘤局部注射属于局部化疗。此类途径时肿瘤组织接受的药物浓度高。
分布至肿瘤的药物浓度受多种因素的影响。如药物本身的物理性质,小分子的药物易进入肿瘤组织。
(1)大多数药物直接具有抗肿瘤作用。有的药物需经代谢后才有抗肿瘤活性,如环磷酰胺和异环磷酰胺需要在肝内转换成具有烷化活性的磷酰胺氮芥。
(2)大多数药物通过肾脏排泄,少数经肝脏(如阿霉素、长春新碱)。
Tips: ①理解环磷酰胺不能用于腔内注射和肿瘤局部注射的原因;②肝肾功能不全时,排泄减慢,可能会增加毒性反应。
抗瘤效果和毒性都增加。
增加抗瘤效果,毒性相对减轻。
抗瘤效果减低,如5-氟尿嘧啶能阻止甲氨蝶呤的抗叶酸作用。
1.不同肿瘤对不同抗肿瘤药的敏感性不同:卵巢癌对烷化剂、铂类、阿霉素敏感;子宫颈癌对氟尿嘧啶、顺铂敏感;滋养细胞肿瘤对氟尿嘧啶、放线菌素D、甲氨蝶呤等敏感。
2.不同增殖比率的肿瘤对抗肿瘤药的敏感性不同:高增殖比率的肿瘤(滋养细胞肿瘤、卵巢恶性生殖细胞肿瘤)对周期特异性药物敏感;低增殖比率的肿瘤(卵巢上皮性癌)对周期非特异性药物较易产生疗效。
3.肿瘤的大小直接影响疗效,肿瘤越大,化疗效果越差。
4.肿瘤细胞耐药是化疗失败的重要原因。
(1)天然耐药:非增殖G 0 期肿瘤细胞一般对多数抗肿瘤药不敏感。
(2)获得性耐药:常见的是多重耐药性,为肿瘤细胞在接触一种抗肿瘤药后,产生了对多种结构不同、作用机制各异的其他抗肿瘤药的耐药性。
Tips: 初始化疗剂量不足,或肿瘤较大,需长时间、多疗程化疗的患者,易产生耐药。
患者一般状况差或肝肾功能不全时,既影响化疗效果,又易发生不良反应。
这是临床合理用药的基础,主要从以下方面考虑。
细胞周期非特异性药物和特异性药物序贯应用,使更多G 0 期细胞进入增殖周期,从而得以杀灭。
(1)对增长缓慢的实体瘤,先用细胞周期非特异性药物杀灭增殖期和部分G 0 期细胞,使瘤体缩小而招募G 0 期细胞进入增殖周期,继而用细胞周期特异性药物发挥作用。
(2)对增长快的肿瘤,宜先用细胞周期特异性药物(作用于S期或M期),杀灭处于增殖周期中的大量肿瘤细胞,再用细胞周期非特异性药物杀伤其他各时相的细胞,待G 0 期细胞进入增殖周期后,再重复上述用药方法。
先用细胞周期特异性药物将肿瘤细胞阻滞于某时相,待药物作用消失后,肿瘤细胞即同步进入下一时相,再用作用于后一时相的药物。
联合应用作用于不同靶点的药物,提高疗效,同时考虑减少不同药物毒性的重叠,使毒性分散。
一定剂量的药物只能杀灭恒定比例(注意,不是恒定数量)的肿瘤细胞(一级动力学),所以不能剂量过小;同时由于机体耐受原因,也不可能无限制加大剂量。合适剂量、足疗程、及早给药很重要。
Tips: 对药物一级动力学的理解应用:①人体所能耐受的最大药物剂量是最合适的量,即使当肿瘤体积较小(肿瘤负荷较少)时,也不应为片面避开药物毒副反应而随意减小剂量;②在肿瘤细胞数量较少的时候开始化疗是最合适的时机。
如侵袭性葡萄胎和绒毛膜癌对化疗敏感,多数患者单靠化疗即可治愈。
针对全身播散、无治愈可能的实体瘤所进行的化疗,以延长生存期和改善生活质量为目标,如晚期外阴黑色素瘤的姑息化疗。
消除残留肿瘤灶、减少复发,如卵巢癌术后补充化疗。
降低肿瘤负荷、提高手术切除率。
放疗的同时进行化疗,可以增加放疗敏感性、提高对肿瘤的局部控制效果、减少远处转移,如子宫颈癌的同步放化疗。
通过动脉、胸腹腔内、鞘内途径给予抗肿瘤药。不是所有药物都可局部化疗。
同时应用提高了肿瘤细胞对化疗的敏感性,如卵巢癌时新生血管抑制剂贝伐珠单抗和传统化疗药并用。
1.考虑用药原则,了解拟用药物特性。
2.正确掌握化疗适应证,充分化疗前评估。
3.选用有效方案及合适的用药途径,及时尽早化疗。
4.原则基础上给药个体化。药物的剂量很大程度上是参考患者的骨髓和肝肾功能后,由医生凭经验确定的。
5.重视监测化疗效果及不良反应。
6.初始治疗化疗者,以治愈为治疗目标,较重的毒副反应是允许的。
7.对于复发后再次化疗者,了解既往所用药物、疗效、毒性反应及耐药情况。有必要与患者共同探讨后续化疗方案和治疗目标(减轻肿瘤负荷,缓解症状)。
单一化疗药物的疗效有限、易耐药、常复发,联合化疗能发挥药物协同作用,降低耐药发生,达到最佳疗效。
环磷酰胺、铂类、阿霉素、六甲蜜胺等较敏感。
博来霉素、长春新碱、顺铂、足叶乙苷等敏感。
与卵巢上皮性癌相似。
氟尿嘧啶、丝裂霉素、博来霉素、顺铂等。
1.任何时候肿瘤内部同时存在增殖期和非增殖期细胞,也同时存在增殖周期中各时相细胞。
2.选用作用于不同时相的药物,各药之间抗瘤作用相互补充。
1.尽可能降低药物不良反应的重叠,使各药毒性反应分散。
2.药物剂量比单药化疗的剂量适当减少。
Tips: 不可因为过于担心药物的毒副作用而随意降低药物剂量,这样做既降低疗效又容易发生耐药。
1.对化疗敏感,通过化疗可完全控制甚至根治的肿瘤,如滋养细胞肿瘤、卵巢恶性生殖细胞肿瘤。
2.实体瘤术后或者局部放疗后辅助化疗,可减少复发,提高生存率。
3.术前新辅助化疗提高手术切除率。
4.与放疗联合对子宫颈癌的根治性治疗。
5.姑息性化疗,用于肿瘤远处广泛转移且不适用手术或放疗者,或者术后或放疗后肿瘤复发播散者。
6.经特殊给药途径的局部化疗,如常用的胸腹腔化疗控制胸、腹水,以及鞘内注射和动脉介入化疗。
Tips: 除个别有一定指征的葡萄胎可预防性化疗外,化疗只用于已经确诊的恶性肿瘤患者。化疗有风险,不可超适应证使用。
1.疾病终末期(预计生存期很短)。
2.孕期前3个月和哺乳期。
3.严重感染期。
4.患者处于无意识状态或者极度不合作。
5.患者一般情况极差,重要脏器功能严重异常难以耐受化疗者。
Tips: 临床患者情况复杂,肿瘤也可导致器官的功能异常,需根据具体情况来谨慎判断能否化疗。
1.病史 复习患者病史,确认化疗指征,排除化疗禁忌证。
2.既往史 尤其是有化疗史者,需详细了解既往所用药物、剂量、时间、疗效及毒副反应等情况。
3.系统回顾 尤其是骨髓、心肺及肝肾功能方面。
4.体格检查
5.辅助检查
(1)实验室检查:血尿常规、肝肾功能、凝血功能、肿瘤标记物等。
(2)影像学检查:超声、CT、MRI、X线等。
(3)心功能检查:心电图(紫杉醇类)、心功能(蒽环类)。
(4)肺功能检查(使用博来霉素或平阳霉素时)。
1.向患者及家属谈明化疗必要性及可能毒副反应等问题。
2.叮嘱患者按要求做好化疗后监测项目。
3.签署化疗知情同意书。
1.血、尿常规 血常规每周复查2次,尿常规每周检查1次。
2.肝、肾功能和肿瘤标记物 每次化疗前检查。
3.心电图 于每次化疗前检查。
4.影像学检查 超声于每次化疗前检查;CT或MRI于首次化疗前和化疗计划完成后各检查一次。
5.填写化疗观察表。
6.停药指征 多天化疗的患者在化疗期间发生2度以上骨髓抑制时或腹泻超过5次(或血性腹泻)时,需要暂停当天化疗,若3天内症状缓解,可继续后面化疗;若超过3天症状仍不能缓解,则结束本疗程化疗。其他停药指征:①呕吐频繁而剧烈,带来难以纠正的电解质紊乱;②感染性发热>38℃;③出现较严重并发症如胃肠道出血或穿孔等。
在化疗过程中,需要根据患者的毒副反应和疗效反应调整药物剂量、增减疗程次数或变换化疗方案。
根据监测的主客观指标,参照世界卫生组织(World Health Organization,WHO)或美国国立癌症研究所常见毒性反应标准(national cancer institute common toxicity criteria,NCI-CTC)毒性分级标准,对化疗毒副反应分级。
根据上一疗程的毒副反应决定下一疗程的抗肿瘤药物剂量。
(1)出现1、2度毒性反应,一般维持上一疗程用药剂量。
(2)出现3度及以上非血液学毒性反应(恶心、呕吐、脱发除外),需减量。
(3)出现4度骨髓抑制或粒细胞减少性发热或3度及以上血小板减少,需减量。
(4)剂量减量幅度:一般为20%,不超过30%。
(5)未出现明显毒性反应或仅是1度反应,可考虑在剂量调整允许范围内适当增加剂量。
Tips: ①强调:剂量的调整必须有理有据,片面为追求抗瘤作用而随意加大药物剂量和片面追求小的毒副反应而随意减少药物剂量,对疾病的治疗都是不利的;②部分药物如蒽环类、博来霉素等达到累计剂量后不能再用。
1.评估原则 化疗方案选择遵循“循证医学”原则和“个体化”原则。
2.评估时机 化疗效果评估一般在2~3个疗程时进行(短期内迅速进展者除外)。
3.评估指标 一般通过肿瘤标记物变化和影像学检查结果(肿瘤大小)来评估。
4.化疗有效者继续化疗并完成规定的疗程次数;病情进展者更换化疗方案。
Tips: ①姑息性化疗只要未进展即可维持原方案,达到规定疗程次数后,一般不再增加化疗次数;②对于化疗敏感、可治愈的疾病如滋养细胞肿瘤,一定周期后未完全缓解者,应更换化疗方案并积极寻找原因。
1.初始辅助化疗有效者完成规定疗程。
2.姑息性化疗有效且达到规定疗程。
3.多次更换方案效果仍不佳者或难以耐受毒副反应者,应停止化疗,建议采用生物治疗、中医药治疗等综合治疗或采用最佳的支持治疗。
涉及患者、肿瘤和医疗三个方面。
1.不能耐受足够剂量的化疗,主要是患者重要脏器功能不全,一般情况太差。
2.患者不能配合。
1.原发或继发耐药。
2.药物难以到达肿瘤所在区域,如肿瘤发生颅内转移。
1.化疗方案、药物剂量或者给药途径选择不当。
2.不良反应处置不及时。
3.综合治疗能力欠缺。
是化疗的主要障碍。
恶心、呕吐最常见。
停止化疗后可再生。
以阿霉素类(多柔比星)最常见,可引起心肌退行性变和心肌间质水肿。
主要是间质性肺炎和肺间质纤维化,主要药物有博来霉素、丝裂霉素、甲氨蝶呤。
药物有放线菌素D、环磷酰胺。
大剂量环磷酰胺可引起出血性膀胱炎。顺铂对肾脏的损害。
长春新碱最易引起外周神经病变;紫杉醇易有末梢神经的损害。
博来霉素、紫杉醇均易发生。
多柔比星、丝裂霉素刺激性强,血管外渗后可致局部组织坏死。
特别是烷化剂具有致癌性和致突变性,以及免疫抑制作用。第二原发肿瘤中以白血病和恶性淋巴瘤多见。白血病一般发生在化疗后2年。
烷化剂最明显,可致永久性卵巢功能障碍和闭经。
Tips: 分子靶向药物、免疫治疗药物具有与传统抗肿瘤药显著不同的不良反应。
1.需要监测的辅助检查内容,特别是血常规检查和肿瘤标记物检查。
2.化疗后可能出现的常见不良反应及对策,特别是所用药物突出的不良反应。
3.需要及时就诊的情况 ①发热超过38℃;②4度骨髓抑制;③严重胃肠反应,呕吐>6次/d;④腹泻>5次/d。
4.经外周静脉穿刺中心静脉置管的日常维护。
5.下一次化疗时间。
6.结束计划化疗疗程后,告知患者长期随访的重要性及时间要求。
给药顺序是很有讲究的,正确的给药顺序不仅可以增加抗肿瘤效果,还可以减少毒副反应。给药顺序基本原则:
许多化疗药物之间会发生相互作用,从而改变药物的体内过程,可能影响到疗效和毒性。如紫杉醇和顺铂联合使用时,铂类会延缓紫杉醇的排泄,加重其不良反应,所以铂类需要在紫杉醇后使用。
生长较慢的肿瘤处于G 0 期的细胞较多,增殖期的细胞较少,需要先用周期非特异性药物杀灭一部分肿瘤细胞,诱导肿瘤细胞进入增殖期后再用周期特异性药物。对于生长快的肿瘤先用周期特异性药物大量杀灭处于增殖周期的细胞,减少肿瘤负荷,随后用周期非特异性药物杀灭残存的肿瘤细胞。
使用非顺序依赖性化疗药物时,应先用对组织刺激性较强的药物。这是由于开始治疗时静脉结构稳定性好,药液渗出机会小,由此可能产生的对局部组织的损害风险小。当前外周静脉穿刺中心静脉置管(peripherally inserted central venous catheters,PICC)在静脉化疗中的推广,避免了化疗药物对局部皮肤组织的损害。
常用联合化疗方案的用药顺序:TP(先紫杉醇,后顺铂)、EP(先足叶乙苷,后顺铂)、GP(先吉西他滨,后顺铂或先卡铂,后吉西他滨)、AP(先表阿霉素,后顺铂)、TAC(依次给紫杉醇、阿霉素、环磷酰胺)、AT(先阿霉素,后紫杉醇)、PF(先顺铂,后氟尿嘧啶)、IP(先异环磷酰胺,后顺铂)、CMF(MTX之后4~6小时再用5-FU)。
Tips: 具体方案的具体给药顺序是全面考虑各种因素来确定的,不可片面依据某一原则来刻板使用。
1.一般原则 止吐药—保肝护胃药—普通液体—化疗药—普通液体—止吐药(必要时)。
2.化疗药物不宜第一瓶或最后一瓶输注,也不宜晚间输注。
3.刺激性强的药物上午输注,如阿霉素、长春新碱。
阿霉素类(多可静脉推注)、吉西他滨(30分钟)、环磷酰胺(静脉推注)、多西他赛(前15分钟慢滴,1小时内滴完)等。与药物对光、热敏感,溶液不稳定有关。
5FU(4~6小时)、顺铂(2~3小时)、IFO(2~4小时)、紫杉醇(3小时)等。与快速滴注时毒性明显增加有关。
药时曲线下面积(area under the curve,AUC),代表药物的生物利用度,具体到卡铂AUC,指卡铂在体内被吸收利用的程度。AUC越大,药物在体内的吸收利用程度越大。AUC值的选择是人为的,但它的合理选择范围是经过了严格科学论证的。卡铂几乎完全通过肾脏排泄,按照AUC来选择剂量,是充分考虑了人体代谢和排泄的个体差异,以及性别、年龄、身高、体重等诸多个体因素,因而较按照体表面积计算剂量更加科学、精准。
相同组织类型的肿瘤对同一化疗药物的反应也是不尽相同的。目前绝大多数化疗所采用的是针对某种脏器既定的方案,这样必然会有一定的盲目性。基于肿瘤化疗个体化的观念,产生了各种化疗药物敏感性试验方法,包括体内和体外方法两大类,当前尚无证据表明这些方法的检测结果比标准化疗方案更有效,这是由于人体内外环境差异较大所致。因此,通常情况下尚不建议单纯根据药物敏感试验结果来选择化疗方案,当然这并不否认药敏试验结果的参考价值。
(闫 震 黄 磊)