




现行艾滋病实验室检测和诊断的适用标准、规范和指南包括:行业标准《艾滋病和艾滋病病毒感染诊断》(WS 293——2019)、《全国艾滋病检测技术规范(2020年修订版)》、《中国艾滋病诊疗指南(2018年版)》、《艾滋病病毒感染者及艾滋病患者CD4 + T淋巴细胞检测及质量保证指南》(2013年8月发布)、《HIV-1病毒载量测定及质量保证指南(2013版)》、《HIV-1基因型耐药检测及质量保证指南(2013年版)》,以及《HIV耐药监测策略和检测技术》《艾滋病病毒抗体快速检测技术手册(2011年版)》《国家免费艾滋病抗病毒药物治疗手册》(第4版)等。这些标准和规范主要涵盖了艾滋病抗原/抗体检测、艾滋病确证试验、CD4细胞计数、HIV-1病毒载量、基因型耐药,以及快速检测等检测技术和诊疗标准。
有关艾滋病检测实验室的设置、建立、验收和管理要求和规定,可以参考《全国艾滋病检测工作管理办法》。
用于HIV感染实验室诊断的检测靶标包括三个:HIV抗体、P24抗原、病毒核酸。参考HIV-1急性和近期感染的Fiebig实验室分期(图1-1),HIV建立感染后,在体液中最先出现的检测靶标为HIV-1核酸(RNA),感染后1~2周出现;其次为HIV-1 P24抗原,感染后2~3周出现,这是HIV抗原抗体联合检测试剂(第四代检测试剂)最重要的检测靶标之一;再次为HIV抗体,感染后3~4周出现,这是HIV抗体检测试剂(第三代检测试剂)最重要的检测靶标。
临床上常用的艾滋病检测方法是血清学试验,以HIV抗原和/或抗体为检测靶标。按照《全国艾滋病检测技术规范(2015年修订版)》,HIV抗体检测可分为筛查试验和补充实验。艾滋病筛查试验通常采用酶联免疫吸附试验(ELISA)、化学发光或免疫荧光试验、胶体金(硒)快速检测试剂等方法。不同类型试剂和方法的检测效力(灵敏度和特异度)略有不同;应根据本地区艾滋病流行特征和所检测人群特征选择适宜的检测方法和试剂类型。

图1-1 HIV-1急性和近期感染Fiebig实验室分期
艾滋病筛查有反应的样本需进行补充实验,最常用的是艾滋病确证试验,包括蛋白质印迹法(western blotting,WB)和条带免疫(recombinant strip immunoblot assay,RIBA)。
HIV-1核酸检测(定性或定量)作为补充试验的一种,可以用于艾滋病筛查试验有反应而确证试验阴性或不确定样本的检测,以及HIV-1感染急性期和晚期病例的实验室诊断。
对于急性期感染和晚期病例的诊断需结合流行病学史、临床表现,以及相关实验室检测指标(如HIV抗原抗体联合检测、CD4 + T淋巴细胞计数和HIV-1核酸检测等),按照《艾滋病和艾滋病病毒感染诊断》(WS 293——2019)进行综合判断。
近几年,市场上出现了艾滋病口腔黏膜渗出液(HIV-1/2型,免疫层析法)和尿液检测(HIV-1型,ELISA法或胶体金法)试剂,为疑似病例提供了无创、便捷、快速的检测渠道。建议该类试剂在经过培训的专业技术人员指导下使用,按照试剂盒说明书进行操作。但是,这里要强调的是口腔黏膜渗出液不是唾液,而是牙龈刮擦后的渗出液。
口腔黏膜渗出液试剂使用:打开样本提取管,插入操作台圆孔中;用拭子在上、下牙龈取样,各左右刮擦5~6秒;取样拭子放入样本提取管中充分搅拌刮擦试管壁6~8次;将试纸箭头朝下放入样本提取管样本浴液中;等待15~30分钟后,拿出试纸,读取结果。按“检验结果的解释”及“检验方法的局限性”部分说明,判读并记录检测结果(有反应、无反应或无效结果)。测试结束后,将用后的测试条、样本提取管和口腔渗出液取样拭子按生物医疗废弃物进行处理。
口腔黏膜渗出液试剂试验注意事项和局限性:读取结果应从试验开始时起,不能迟于30分钟。有反应结果仅表示样本中HIV 1/2型抗体的存在,而不能作为机体感染HIV的唯一标准。检测结果解释须结合临床表现和流行病学进行诊断。受方法灵敏度限制,口腔黏膜渗出液检测无反应结果可能由于样本中HIV抗体浓度过低或处于检测窗口期,故不得作为排除感染的证据。在未咨询专业医生前,不应根据口腔黏膜渗出液检测结果采取医疗措施。
目前,市场上有尿液检测ELISA法和胶体金法试剂。其中,人类免疫缺陷病毒1型尿液抗体检测试剂盒(胶体金法)获得医疗器械注册证,成为全球首个获批上市的艾滋病病毒尿液自检试剂。
自我检测是高危行为后独自或在其信任的伴侣陪同下自我采集尿液样本、检测和读取结果的过程,能及时了解自身艾滋病病毒感染状态。按照试剂盒说明书操作,取一次性尿杯收集尿液,取一次性吸管吸取尿液,加3滴尿液至加样孔中,等待15分钟充分反应,判读结果(有反应、无反应或检测无效)。
如果检测结果有反应,经过医疗卫生机构确诊后可以尽早获得治疗、关怀等服务。同时也有助于高危行为者隐私保护,提高艾滋病检测的主动性,增强艾滋病检测的可及性和便利性。
遵循“初筛-复检-补充试验”的检测流程和策略对临床艾滋病疑似病例进行实验室检测。根据不同的试剂类型和检测效力,以及疑似病例的流行病学特征和临床表现,确定适宜的检测策略和流程,并作出合理的检测结果解释。
以市场上常见的抗原抗体联合检测试剂(不能区分抗原和抗体检测结果)为例,对艾滋病实验室检测的策略和流程予以阐述。参照《全国艾滋病检测技术规范(2015年修订版)》,某个样本经过不区分抗原抗体联合检测试剂初筛,如果检测有反应,则建议选用“原试剂+抗体检测试剂”进行复检;如果均无反应,报告HIV抗体阴性;如果两者均有反应,表示HIV抗体有反应,则建议直接进行艾滋病确证试验或HIV-1核酸检测;如果抗原抗体联合检测试剂有反应,而抗体检测试剂无反应,则建议直接进行HIV-1核酸检测(定量或定性),或2~4周后随访检测。
按照《艾滋病和艾滋病病毒感染诊断》(WS 293——2019),广义的HIV窗口期:从HIV感染人体到在感染者血清中的HIV抗体、抗原或核酸等感染标志物达到能被检测出之前的时期。在窗口期内的血液已有感染性。现有诊断技术检测HIV抗体、抗原和核酸的窗口期约分别为感染后的3周、2周和1周左右。
结合艾滋病临床诊疗需要、感染者特征分析和实验室检测实践,建议将窗口期解读为HIV检测窗口期(抗原抗体检测盲区)和隐蔽期(eclipse phase,核酸检测盲区)。
HIV检测窗口期是指自暴露于HIV后至运用某种检测方法或试剂在血液中可以检测到HIV相关标志物(P24抗原或抗体)之前的时期。这一时期也被称为血清学检测盲区,简称“窗口期”。根据检测试剂类型不同和感染者个体差异,窗口期可以达2周到3个月。
窗口期内包含一个HIV核酸检测相关的隐蔽期,是指自病毒感染至病毒RNA被首次检出的时间间隔,通常大约持续10天时间(范围7~21天)。该阶段HIV在黏膜或淋巴系统中复制,而血液系统检测不到病毒核酸,此期也被视为核酸检测盲区。
处于HIV检测窗口期的感染者体液呈现较高的病毒载量,但是,血清学检测为阴性或不确定,患者不自察已被感染而极容易作为传染源导致二次传播。
HIV感染后到出现HIV特异性的、可检测的靶标(抗原、抗体或核酸)需要一定的时间。该阶段病毒经历反转录、整合、复制、基因表达组装成病毒颗粒,诱导产生特异性抗体和抗体成熟等一系列过程。抗体经历了从无到有、从少到多、从弱到强的亲和力成熟变化过程。其免疫反应强弱与宿主基础免疫状况(免疫应答机制)和感染途径有关系,也与试剂检测灵敏度有关系。
暴露后或急性感染期服用抗反转录病毒药物可以影响病毒复制、HIV-1抗体产生时间,从而延长HIV检测窗口期,但最长一般不超过3个月。
目前,常用艾滋病检测试剂的检测窗口期长短(置信区间为检测到95%感染者)大致如下:
核酸检测(HIV-1病毒载量或定性检测试剂)1~2周。
第四代试剂(Ag/Ab联合检测-化学发光法)2~4周,第四代试剂(Ag/Ab联合检测-ELISA法)3~6周,第三代试剂(抗体检测-ELISA/化学发光法)4~8周,第三代试剂(抗体检测-快速检测方法)4~12周。
确证试剂相当于第三代试剂检测灵敏度(6~8周)。
按照《全国艾滋病检测技术规范(2020年修订版)》检测策略,不同类型试剂组合检测结果解释总结在表1-1中。
表1-1 HIV检测策略结果解释和意义

续表

无论哪种检测方法和试剂类型,受检测技术方法局限和机体免疫应答动态变化影响,任何实验室检测方法或试剂均存在一定检测盲区。因此,在试剂类型选择时应结合本地区艾滋病疫情特征尽可能选择高灵敏度的方法和试剂进行艾滋病筛查试验。
实验室检测结果的解释需根据所使用的试剂类型、检测策略和结果,并结合患者临床表现、流行病学和既往病史等信息综合进行。对艾滋病筛查有反应而确证试验无反应或不确定病例,可加做HIV-1核酸检测、CD4细胞计数等予以辅助诊断,或进行2~4周后随访。现有的艾滋病检测试剂、方法和检测策略能够发现已知的HIV感染者,并做出明确诊断。
血清学检测的适用范围是检测机体对HIV产生的抗体的检测方法,适用于从HIV感染窗口期后至艾滋病患者死亡的整个病程中的抗体检测,是最常用的艾滋病实验室诊断方法。使用国家药品监督管理局(NMPA)批准的试剂,在试剂盒有效期内进行艾滋病筛查,如果发生检测窗口期内的漏检,则不存在技术错误。
但是,如果因为检测窗口期漏检导致医疗事故发生,相关医疗机构尽管没有主观过错,仍然应从道义角度对医疗行为负责,履行相应的赔付义务。因此建议尽量选择灵敏度高的试剂,缩短检测窗口期,并且在临床诊疗中仔细询问流行病学信息,避免检测窗口期漏检发生。
人对HIV普遍易感,因此,建议那些具有高危行为[男男性行为者(men who have sex with men,MSM)或不安全性行为者]或职业暴露HIV风险人员定期做艾滋病检测。部分人群的高危性行为具有隐蔽性,例如有同性性行为或婚外异性性接触的男性,可以通过日常性生活将HIV毒株传播给妻子或女朋友。发现传染源并进行有效干预是防控HIV传播的关键环节。
如果存在如下情形,建议女性与配偶或性伴侣一起进行艾滋病检测:①婚前或同居前检测;②孕前或孕早期;③产前检测;④配偶或性伴侣存在免疫力低下、性传播疾病,或具有冶游史、男男性行为等高危行为;⑤发生性侵犯或强暴行为的女性;⑥存在无安全套的婚外性行为的女性。
男男性行为者的配偶,又被称为“同性恋妻子、同妻”,需要关注这部分人的艾滋病检测和心理干预。配偶或性伴侣来自男男性行为人群或婚外性行为人群,由于性行为具有隐蔽性,性伴侣很难察觉疾病状态而自我设防;建议主动进行婚前传染病筛查,避免潜在被感染风险。
我国全人群检出率为0.08%~0.09%,育龄期妇女约为普通人群检出率的1倍。在临床监测、检测过程中,由于受女性独特生理特征影响,检测方法和试剂灵敏度提高,导致临床实验室检测疑似阳性病例增多,因此,经常遇到初筛有反应、确证阴性或不确定的孕产妇病例,对这部分病例需要进行慎重处理。
(1)如果配偶或性伴侣为HIV抗体阳性,且该孕产妇没有采取有效的预防或阻断,则考虑孕产妇被感染的可能性较大,按流程送检艾滋病确证试验,或进行HIV-1核酸检测。
(2)如果配偶或性伴侣为HIV抗体阴性,排除输血、手术等医源性感染可能性,则考虑为假阳性可能性较大,建议对该病例继续随访,或进行HIV-1核酸检测予以排除;必要时,可以加做CD4 + T淋巴细胞计数,计算CD4/CD8比值来辅助诊断。
结合文献分析和临床检测经验,影响女性艾滋病实验室诊断的因素包括:妊娠激素水平改变、自身免疫性疾病带来的免疫系统紊乱、肿瘤发生伴有新生物质增多、输血或骨折等带来新生抗原暴露、试管婴幼儿激素诱导、尿毒症等疾病。临床诊疗过程中,经常遇到部分孕产妇随着妊娠发展,其体内可能产生与HIV抗原接近的抗原物质(具有类似的抗原决定簇),产生交叉反应带来假阳性,且确证结果达到阳性判断标准,最终随访确认为妊娠带来的假阳性。
如果孕产妇艾滋病筛查有反应,需要慎重下结论。要遵循《艾滋病和艾滋病病毒感染诊断》(WS 293——2019)中艾滋病病毒感染诊断原则做出HIV/AIDS诊断,应结合流行病学和临床表现,对检测结果作出合理解释,必要时参考CD4细胞计数和HIV-1病毒载量综合判断。
临床上,婴幼儿HIV-1感染核酸检测的适用范围为:①未满18个月的婴幼儿,母亲为HIV抗体阳性;②未满18个月的婴幼儿,其母亲HIV感染状态不详,婴幼儿出现HIV相关临床表现(如:血液系统疾病、免疫力低下等),临床怀疑HIV感染者。
HIV感染母亲的IgG可以直接经过胎盘进入胎儿体内,使一部分新生儿出生后即带有HIV抗体。这些抗体一般需要9~12个月逐渐消失,在出生后18~24个月基本上全部消失。如果生后18个月HIV抗体仍然阳性,提示抗体可能为自身感染产生的抗体。许多研究发现10%未感染婴幼儿15个月龄以后HIV抗体阴转,2.5%在18个月龄以后阴转。
按照《全国艾滋病检测技术规范(2015年修订版)》,婴幼儿于生后9~12个月进行第一次HIV抗体筛查检测,如果检测结果无反应,应用另一种试剂再次检测,结果仍然无反应,则报告“HIV抗体阴性”,排除是HIV感染。
如果第一次检测结果有反应(一种为阴性反应、一种为阳性反应或两种均呈阳性反应),不能排除感染,应继续追踪随访,至儿童满18个月按照HIV抗体检测流程进行HIV抗体检测。
出生后18个月时做第二次HIV抗体检测,如果检测结果为无反应,用另一种检测试剂再次检测,结果再次无反应,则报告“HIV抗体阴性”,排除是HIV感染。如果第二次HIV抗体检测结果为有反应,进行艾滋病确认试验。确认试验阴性者,除外HIV感染;确认试验阳性者,纳入当地艾滋病综合防治系统。
母乳喂养的婴幼儿需要监测更长时间,尤其是长期母乳喂养的婴幼儿,在18个月后仍有感染HIV的可能。
婴幼儿HIV-1早期诊断通常采用HIV-1 DNA-PCR(定性)方法检测。
1)无论是否经历母婴阻断,于出生后第6周(或尽可能早的时间)采集第一份血样本制备成干血斑(DBS)进行早期诊断检测。如检测有反应,则尽快采集第二本血样本送检,如仍有反应,则报告“婴幼儿HIV感染早期诊断结果阳性”,诊断儿童HIV感染。及时对HIV感染儿童进行追踪和病情监测,将其转介到抗病毒治疗医疗服务机构,并为其提供机会性感染预防等服务措施。若第二份血样本检测呈阴性反应,待婴幼儿满3个月再次采集血样本进行检测。
2)若第一份血样本(第6周)检测呈阴性反应,继续提供儿童保健和随访服务,待婴幼儿满3个月再次采集血样本进行检测。
3)若婴幼儿满3个月再次检测呈阴性反应,报告“婴幼儿HIV感染早期诊断检测结果阴性”,按照未感染儿童处理,继续提供儿童保健随访服务。于儿童满12个月时,开始HIV抗体检测,最终确定儿童感染状态。若婴幼儿满3个月再次检测呈阳性反应,尽快再次采集血样本进行检测。第三份血样本检测呈阳性反应,报告“婴幼儿HIV感染早期诊断检测结果阳性”;若第三份血样本检测呈阴性反应,报告“婴幼儿HIV感染早期诊断检测结果阴性”。
HIV-1感染母亲所生的、小于18个月龄的婴幼儿,不同时间的两次采样HIV-1核酸检测均为阳性即可作出诊断(首选定性检测,定量亦可以)。
18个月龄以上儿童诊断与成人相同。
在艾滋病实验室检测过程中,检测技术人员依据实验室检测结果、参考所用检测试剂检测效力特性分析,出具对样本的检测报告,宜同时结合样本所附带的病例相关流行病学信息综合判断。诊治医生不能仅仅依据实验检测结果做出诊断,必须结合受检者相应流行病学史进行综合分析。
按照《全国艾滋病检测技术规范(2015年修订版)》要求,当某个样本经抗原抗体联合检测有反应,而抗体检测试剂复检无反应,提示可能为感染早期或处于急性期感染阶段(第三代试剂检测窗口期)。建议对这部分病例进行HIV-1核酸试验、HIV-1 P24抗原试验或2~4周后随访。
但是,对该部分病例样本检测结果的解释和意义需要结合病例的流行病学特征来综合判断,不能只认样本检测结果,而忽略病例特征。如果患者具有高危行为,宜尽早进行HIV-1核酸检测、HIV-1 P24抗原试验或2~4周后随访。如果患者为中老年人或孕产妇,否认高危行为或性伴侣为阴性,则应该理性解释这类检测结果。
CD4 + T淋巴细胞水平是评价HIV感染者免疫状况、判断疾病进程、评价抗病毒药物治疗效果和判断预后的重要指标。
(1)判断艾滋病疾病分期:根据CD4 + T淋巴细胞计数及其与CD8 + T淋巴细胞比值的变化,可以确定HIV感染者的疾病分期。
(2)帮助确定抗病毒治疗的时机、方案及评估抗病毒治疗效果:CD4 + T淋巴细胞计数是开始抗病毒治疗的重要指征之一,也是抗病毒药物选择的参考依据。开始抗病毒治疗后,CD4 + T淋巴细胞在病程的不同阶段可有不同程度的增加,定期监测CD4 + T淋巴细胞计数可为评估抗病毒治疗效果提供依据。
(3)指导机会性感染的预防治疗:CD4 + T淋巴细胞计数水平不同,容易发生的机会性感染不同。例如,当CD4 + T淋巴细胞计数<200个/µl时,容易发生肺孢子虫病[又称卡氏肺孢子虫肺炎(pneumocystis carinii pneumonia,PCP)],应给予相应的预防性治疗;当CD4 + T淋巴细胞计数<50个/µl时,易发生巨细胞病毒(CMV)和鸟分枝杆菌(MAC)感染。
(4)CD4 + T淋巴细胞计数与病毒载量相配合是预测疾病进程的可靠指标,并可以独立预测艾滋病临床过程和生存期。
核酸检测作为补充试验可用于HIV-1感染诊断,包括抗体复检试验有反应和抗体补充试验不确定样本的判定;急性期和晚期感染者的诊断。对于急性期感染和晚期的诊断需结合流行病学史、临床症状,以及其他相关实验室检测指标(如CD4 + T淋巴细胞计数等)。此外,对HIV抗体阴性的高危人群样本及采供血机构的原料血浆进行集合核酸检测,可及时发现窗口期感染,降低“残余危险度”,减少二代传播。核酸检测结果低于最低检测限不能排除HIV-1感染。
艾滋病患者经抗病毒药物治疗后,定期进行HIV-1核酸定量检测,可判断抗病毒药物治疗的效果。病毒载量结果动态分析,对决定是否继续使用原定的治疗方案,以及是否需要更改治疗方案起到重要作用。通常在治疗1个月后病毒载量降低0.5log以上才被认为临床治疗有效,6个月后应降到小于检测限(详见《国家免费艾滋病抗病毒药物治疗手册》(第4版)。
HIV感染者体内病毒载量的变化具有一定规律,这种变化与疾病的进程密切相关。对未进行抗病毒药物治疗的感染者定期进行病毒载量检测,可监测病程变化,定期进行HIV病毒载量检测有助于确定疾病发展的阶段。
HIV-1基因型耐药检测是目前常用的耐药监测检测方法,一般采用患者血清/血浆或全血样本进行检测。按照耐药发生时机,可以分为传播性耐药(TDR)和获得性耐药(ADR);2017年,WHO提出了治疗前耐药(PDR)概念。
顾名思义,传播性耐药(TDR)是指未接受抗反转录病毒治疗(ART)的HIV感染者存在基因突变,并导致对某种一线药物或二线药物耐药。
获得性耐药(ADR)是指接受ART治疗的HIV感染者,在治疗过程中产生的基因突变,并导致对此前所采用的抗反转录病毒治疗药物耐药。
治疗前HIV耐药(PDR)是指系统开始ART治疗前检出的耐药,包括以前未接受治疗的或以前使用过抗病毒药物(母婴阻断、暴露前预防)或重新开始一线治疗的患者,耐药株可为传播性(TDR)或获得性耐药毒株(ADR)。
耐药检测一般首选血清或血浆样本进行检测,代表患者体液内具有感染性的病毒遗传和耐药特征;也可以采用全血样本(含干血斑DBS)进行前病毒DNA(proviral DNA)基因型耐药检测。
研究表明,血清或血浆样本RNA基因型耐药与全血前病毒DNA基因型耐药检测结果吻合度比较高(80%以上)。前病毒DNA作为整合到宿主基因组的病毒基因片段,具有更高的检测灵敏度,储存了疾病进展过程中几乎所有病毒变异体的遗传特征,部分遗传特征在血清或血浆样本RNA中找不到副本,但不会丢失RNA基因型耐药特征。
前病毒DNA基因型耐药检测一般适用于接受ART治疗后的病例,且病毒抑制不全,尤其适用于那些血清或血浆RNA检测未检出到或未发现基因型耐药的病例,借以分析治疗效果不理想的原因。
前病毒DNA基因型耐药检测过程与血清或血浆样本RNA基因型耐药检测类似,只是去掉了反转录步骤。
HIV-1毒株的典型特征就是遗传多样性,表现在每天产生大约1 010个病毒颗粒;基因表达过程中,其反转录酶不具有校准功能,导致cDNA存在大量基因突变;HIV独特的基因复制模式导致存在大量的亚型内或亚型间基因重组,导致大量新发重组毒株(CRFs或URFs)产生。
在ART治疗过程中,受药物选择压力和宿主免疫选择压力的作用,HIV-1发生基因变异,选择出导致药物不敏感的基因突变,即发生了获得性耐药(ADR)。HIV-1基因型耐药发生不可避免,可以通过提高服药依从性、调整合理膳食结构促进药物吸收,推迟耐药发生的时间。通过周期性病毒载量、CD4细胞计数或基因型耐药监测检测,识别可能发生的治疗失败或耐药突变,及时更换药物治疗方案。
在开始系统ART治疗前进行基因型耐药检测,如果存在TDR或PDR,在选择一线治疗药物时应慎重选择,避免选择使用不敏感的、已经存在耐药的药物。研究显示,具有TDR的病例如果没有及时更换药物,将有20%~30%的概率导致治疗失败。发生了ADR的病例,及时反馈给临床诊疗医生,根据基因型耐药检测结果,更换敏感的治疗药物,并在换药后6个月左右,进行HIV-1病毒载量或基因型耐药检测。
依据《国家免费艾滋病抗病毒药物治疗手册》(第4版),为了提高抗反转录病毒治疗成功率,了解所感染毒株的遗传特征和病毒水平,实现临床上个性化诊疗目的,建议在开始ART治疗基线进行相关的艾滋病实验室检测:
治疗前开展传播性耐药(TDR)或治疗前耐药(PDR)检测,了解所感染毒株基因型(genotype),并根据基因型突变药物耐受情况选择适宜的抗反转录病毒药物组合。对治疗半年以上的病例进行基因型耐药检测,判断ART治疗效果;对治疗后病毒抑制失败病例进行基因型耐药检测,分析药物和免疫选择压力下的基因突变发生情况及其生物学意义,并据此进行依从性教育,必要时更换ARV药物组合。
对治疗前病例进行病毒载量检测,判断感染者体内病毒数量和毒力,优化抗反转录病毒药物组合;对低病毒载量病例或疾病进展较慢的病例进行随访观察,使用安全套保护性伴侣;一般地,ART治疗3~6个月后,感染者体内HIV-1病毒载量应该低于检测限。国家免费抗病毒治疗要求至少每年开展一次病毒载量检测,有条件的地区建议每半年做一次。
判断HIV感染者或艾滋病患者的免疫状态和判断HIV感染临床分期及抗HIV疗效的重要指标。CD4 + T淋巴细胞计数<200个/µl者,不管有没有HIV相关症状,都属于艾滋病期。对所有HIV-1感染者,无论CD4水平多少,均需接受抗反转录病毒治疗。抗病毒治疗以后,CD4 + T淋巴细胞计数一般都可以得到不同程度的恢复,但恢复速度因人而异。国家免费抗病毒治疗要求至少每年一次CD4 + T淋巴细胞计数(可根据患者具体病情需要增加检测频次)。
在开始联合抗反转录病毒治疗(ART)后,应开展系列病毒学、免疫学检测指标和临床诊疗描述,判断是否存在抗反转录病毒治疗失败。根据《国家艾滋病免费抗病毒药物治疗手册》(第4版),治疗失败的定义如下:
(1)病毒学失败:接受ART治疗24周后,连续两次血浆HIV RNA>400拷贝/ml。
(2)免疫学失败:无论病毒载量是否被完全抑制,HIV感染者在接受ART治疗后,CD4 + T淋巴细胞计数降到治疗前的基线水平(或之下),或持续低于100个/µl。
(3)有效进行ART治疗6个月后,之前的机会性感染重新出现,或者出现预示临床疾病进展的新的机会性感染或恶性肿瘤,或者出现新发或复发的WHO临床Ⅳ期疾病。
HIV病毒储存库是指HIV感染者体内整合了HIV前病毒DNA的CD4 + T淋巴细胞,处于HIV潜伏感染状态(latent state)。构成HIV病毒储存库的细胞主要是静息CD4 + T细胞,包括中央记忆细胞和过渡性记忆细胞。
HIV病毒储存库是传统抗反转录病毒治疗清除HIV感染并达到功能性治愈的最大障碍。联合抗反转录病毒治疗(ART)能够显著降低血浆HIV-1病毒载量(低于检测限),提高机体免疫力,最终降低HIV-1感染者的病死率和发病率。但是,在因故中断ART治疗后,病毒储存库中潜伏的HIV-1前病毒DNA经基因转录和翻译,再次包装成病毒颗粒释放出来,导致病毒反弹。
(辛若雷 喻剑华)
垂直传播又称母婴传播,艾滋病母婴传播是指感染艾滋病病毒的妇女在妊娠、分娩和产后哺乳等过程中,将艾滋病病毒传染给胎儿或婴儿,导致胎儿或婴儿感染艾滋病病毒的过程。如果没有任何防护措施,HIV的母婴传播概率是15%(没有母乳喂养的情况下)到40%(母乳喂养到2岁的情况下)。母婴传播是儿童感染艾滋病病毒的最主要途径,大约90%以上的HIV感染儿童是通过母婴传播途径感染的。
HIV母婴传播主要发生在妊娠、分娩和哺乳三个阶段,即宫内传播、产时传播和产后传播。
也称“宫内传播”,是指妊娠期间,艾滋病病毒通过胎盘感染胎儿。宫内传播占母婴传播的25%~38%。有研究显示,不经任何干预的情况下,妊娠期间感染给胎儿的机会是5%~10%。
也称“产时传播”,是指在分娩过程中,胎儿与带有艾滋病病毒的母血,以及宫颈和阴道分泌物接触而感染艾滋病病毒。大约1/3的母婴传播发生在产程中。目前认为,不经任何干预的情况下,分娩过程中艾滋病母婴传播率为10%~20%。
母乳喂养是造成产后传播的主要因素,即HIV感染母亲通过产后哺乳将HIV传播给婴儿。艾滋病母婴传播率同喂养方式及持续时间有关:混合喂养的婴儿发生母婴传播的危险高于纯母乳喂养婴儿;母乳喂养时间越长,婴幼儿感染HIV的危险越大。母乳喂养一年,艾滋病母婴传播的危险为10%~15%。当然,除了母乳喂养,口对口喂食也可能造成婴幼儿感染,不过所占比例很小。
通过母婴传播途径感染艾滋病病毒的儿童,通常在出生后1岁内出现症状,1/3在1岁内死亡,50%在2岁内死亡,平均存活期约是7年。美国的研究显示,通过母婴传播的HIV感染儿童存活到10岁的概率不足30%。
世界范围内,儿童HIV感染中90%以上通过母婴传播而感染。在每年新发感染HIV的儿童中,90%来自撒哈拉以南非洲地区,不同国家和地区的艾滋病母婴传播水平不同。在未采取任何干预措施的情况下,艾滋病母婴传播率为15%~50%。发达国家为15%~25%,发展中国家为25%~35%。采取综合的干预措施能有效减少艾滋病母婴传播的危险。2015年WHO宣布古巴第一个消除了HIV母婴传播,之后的泰国、白俄罗斯及亚美尼亚、斯里兰卡等国家也消除了艾滋病的母婴传播。我国整体艾滋病母婴传播率由未采取任何干预措施时的34.8%下降到2020年的4%,部分地区艾滋病母婴传播率甚至降低至2%以下,有望成为下一个达到WHO消除HIV母婴传播标准的国家。
HIV阳性母亲不一定要剖宫产。对于未接受抗病毒治疗,病毒载量未知的孕妇,在妊娠满38周,临产前或胎膜早破之前采用选择性剖宫产术会使HIV母婴传播率降低55%~80%。但是对于已经接受抗病毒治疗而且HIV病毒载量<1 000拷贝/ml的孕妇,或已经临产或胎膜早破的孕妇行剖宫产术可能对预防母婴传播没有益处,反而会增加手术感染性并发症的风险。这些情况下可以选择阴道分娩。
孕妇尽早进行抗病毒治疗,尽可能快地将病毒载量抑制到检测限以下,可以大大减低母婴传播的风险。
减少新生儿暴露的可能。比如选择合适的生产方式可以减少产时新生儿暴露;生产过程中避免损伤性操作;尽量选择人工喂养,避免或者尽可能缩短纯母乳喂养时间,杜绝混合喂养。
HIV阳性母亲所生的所有新生儿都应预防性应用抗病毒药物。
除此以外,还要注意做好宣教工作,预防育龄妇女感染HIV,预防HIV感染的育龄妇女非意愿妊娠。
是的,预防HIV母婴传播是一个全程多环节管理的问题,这些环节包括:①接受至少5次产前保健;②有效的检测和咨询,所有孕产妇及其配偶都应在第一次产检时接受HIV检测;③有效的抗病毒治疗,HIV孕产妇应尽早开始启动抗病毒治疗,以保证有效的母婴阻断;④安全住院分娩,选择适宜的分娩方式,分娩过程中继续使用抗病毒治疗,产后选择安全的婴儿喂养方式;⑤产后保健与随访,母亲继续使用抗病毒治疗,新生儿及时有效预防用药,并进行检测和随访。全程管理的每一个环节都对预防母婴传播非常重要。
这是影响垂直传播的高危因素,艾滋病患者较单纯的HIV感染者发生垂直传播的概率高3倍。
HIV阳性孕妇血液及生殖道分泌物中的病毒载量是发生垂直传播最直接的风险因素,母体中病毒载量越高,母婴传播概率越大。
CD4细胞计数的下降与母婴传播概率的上升呈线性关系,随着CD4淋巴细胞数量的下降,母婴传播率几乎直线上升。
母体营养状况不良会增加新生儿感染风险。
孕妇的一些不良行为如吸烟、静脉吸毒、多性伴侣及孕期无保护性行为等可增加母婴传播风险。
如性传播疾病、丙型肝炎病毒感染、绒毛膜羊膜炎、胎盘早剥、感染性因素等,以及各种导致胎盘炎症或破损的诱因均可增加母婴传播概率。
产前检查,如有损伤性操作如羊水穿刺、胎儿镜检查等,可能增加胎儿HIV感染的概率。
在妊娠过程中,胎儿通过不同的途径与母体细胞和体液接触,炎症等因素引起的胎盘损伤,均可以促进HIV的传播。
分娩过程中的侵袭性操作,如胎儿头皮电极、会阴侧切术、产钳或吸引器助产等,都可能增加胎儿感染HIV的概率。
胎膜早破时间是影响母婴传播率的独立因素。破膜时间越长,母婴传播发生率越高。
产程越长,使得胎儿与产道接触的时间越长,感染HIV的概率越高。
阴道分娩过程中,胎儿以较大体表面积暴露于宫颈分泌物和母血,增加了传播HIV的危险性。
早产、低体重儿、胎膜感染、滞产、产时出血及血性羊水等,也具有传播HIV的高危险性。
产后哺乳可造成HIV垂直传播。
当产妇患有乳腺炎、乳头皲裂、乳房脓肿时,母乳喂养时传播的概率明显增加。
是的,所有HIV阳性母亲所生新生儿均需在出生后尽早(最好6~12小时内)开始预防性应用抗病毒药物,具体方案见本书“二、HIV母婴传播阻断”中“24.HIV暴露后新生儿如何预防性应用抗HIV药物?”。
这种情况下,除非有其他产科指征,否则可以选择自然生产。在生产过程中避免人工破膜、会阴外切等创伤性操作,尽量缩短产程,减少新生儿暴露风险。孩子出生后6小时内尽早预防性应用抗病毒药物,具体预防用药方案见本书“二、HIV母婴传播阻断”中“24.HIV暴露后新生儿如何预防性应用抗HIV药物?”。
育龄期HIV阳性的女性是一类相对特殊人群,比如她们需要面对的问题包括:避孕措施、孕前咨询、妇科问题、生育问题等。相关研究表明:绝大多数育龄期女性的意外怀孕与避孕措施不当有关,对于她们的孕前常规保健咨询和辅导非常重要;对于有怀孕意愿的育龄女性,在抗病毒治疗方案的选择时,应该选择对孕产妇和新生儿安全性最好的方案。具体用药方案见本书中“三、女性和抗反转录病毒治疗”的相关内容。
(1)孕产妇应即刻给予抗病毒治疗,尽量选择抗病毒效果强的方案,例如包含整合酶抑制剂的方案。
(2)尽可能地选择剖宫产。
(3)新生儿出生后尽早服用HIV感染预防药物,具体用药方案见“二、HIV母婴传播阻断”中“24.HIV暴露后新生儿如何预防性应用抗HIV药物?”。
(4)选择人工喂养,不要母乳喂养。
(1)母亲尽快做HIV筛查(可以先使用快速检测的方法,1小时出结果)。
(2)新生儿在最终确定结果前应按照母亲HIV阳性对待,即尽快开始使用暴露后预防药物,并暂时避免母乳喂养,如果最终母亲排除感染则可以终止暴露后预防措施。
目前尚缺乏足够的数据以提供推荐方案。有研究认为,即便母亲体内存在齐多夫定耐药病毒株,但是因为耐药株的适应性较差,传播仍会以野毒株为主,也就是说传给孩子的还是敏感病毒株可能性大,所以也可以仍然给予新生儿齐多夫定进行预防性服药。目前没有证据表明需要按照母亲的耐药结果来选择预防性治疗方案。具体病例需要和医生讨论后制订方案。
妊娠早期发现HIV阳性,只要采取正确的干预措施,就可避免把HIV传染给孩子。
(1)孕妇尽早接受抗病毒治疗。治疗方案选择参见“三、女性和抗反转录病毒治疗”中“8.目前推荐的初治育龄或妊娠女性抗病毒治疗方案是什么?”。
(2)对于所有血浆病毒载量>500~1 000拷贝/ml的初治HIV感染孕妇,在启动ART前都应进行HIV耐药检测。但是,可以不等待耐药检测结果,先开始抗病毒治疗。待HIV耐药检测结果报回后,如有必要可调整抗病毒治疗方案。
(3)理想状况下,抗病毒治疗以后每个月进行1次病毒载量检测,直至血浆病毒载量降至检测下限以下,然后至少每3个月检测1次。在妊娠34~36周时再次检测病毒载量,以进一步评估分娩方式(病毒载量小于1 000拷贝/ml时可以自然分娩)。
(4)抗病毒治疗以后每3~6个月检测1次CD4 + T淋巴细胞计数(对于持续病毒抑制良好,且CD4计数高于200个/µl的患者,每6个月检测1次)。
(5)病毒载量>1 000拷贝/ml的孕妇,建议在妊娠38周时采用剖宫产分娩。
(6)新生儿:出生后6小时内尽早给予暴露后预防药物,其预防用药方案见“二、HIV母婴传播阻断”中第24题。
(1)即刻给予孕妇抗病毒治疗。建议采用较强病毒学效果的治疗方案,例如包含整合酶抑制剂的方案,尽快控制病毒载量。
(2)晚期才开始抗病毒治疗,在妊娠34~36周时,病毒载量很可能不能控制在检测限以下,如果病毒载量>1 000拷贝/ml,建议在38周时采用剖宫产分娩。
(3)新生儿出生6小时内开始暴露后预防,具体预防用药方案参见“二、HIV母婴传播阻断”中第24题。
1)尽量避免宫颈检查。
2)避免产程延长。如果需要,可考虑使用缩宫素来缩短产程。
3)避免常规人工破膜。
4)分娩过程中避免不必要的损伤性操作(侧切、产钳)。
5)尽量减少产后出血发生的风险。
6)仅在必要时输血。
1)遵循标准防护原则。
2)缩短新生儿接触母亲血液、羊水及分泌物的时间。
3)有条件的情况下,交台下巡回护士处理;无条件的情况下,接生者更换手套再处理。
4)出生后立即钳夹脐带,断脐前用纱布覆盖,避免血液喷溅。
5)及时用流动的温水清洗婴儿。
6)用吸耳球清理鼻腔及口腔黏膜。
7)将新生儿放置于复苏台上护理,注意保暖。
8)避免损伤新生儿皮肤和黏膜。
9)操作手法应轻柔;使用低压吸痰器而不要使用常规吸痰器。
10)避免母乳喂养,杜绝混合喂养。
随着喂养时间的延长,母乳喂养传播HIV的风险成倍增长,纯母乳喂养最好不要超过3个月。母乳喂养过程中母亲要持续进行抗病毒治疗。如果在母乳喂养过程中母亲出现乳头皲裂、乳腺炎和脓肿或婴儿患有口腔溃疡要中断母乳喂养。可挤出母乳后加热,加热后母乳中的大多数营养素都能够保留。通过加热,可杀死母乳中的HIV。
慎重进行。原则上,HIV感染母亲所生儿童尚未确定是否感染前,应避免接种活疫苗,如卡介苗、脊髓灰质炎疫苗、麻疹疫苗、水痘带状疱疹疫苗等。建议在监测儿童有无艾滋病临床症状、CD4细胞绝对计数及CD4细胞百分比的基础上,科学指导计划免疫。如果CD4细胞百分比>15%,或5岁以上CD4细胞绝对数≥200个/µl的儿童原则上可以接种所有疫苗。
未完成预防接种的婴儿和儿童,避免在人群密集或通风不良的场所过久停留。在确定排除HIV感染后应尽快补种未接种的疫苗。建议HIV感染的儿童种流感嗜血杆菌疫苗,2岁时应接种肺炎链球菌疫苗。
世界卫生组织(WHO)和联合国儿童基金会(UNICEF)建议任何HIV感染母亲所生的婴幼儿都应接受PCP的预防性治疗,直到排除HIV感染。葡萄糖-6-磷酸脱氢酶(glucose-6-phoshate dehydrogenase,G-6PD)缺乏的新生儿禁用复方磺胺甲
 唑(复方SMZ)。过敏或不能耐受者,可用喷他脒雾化吸入,但我国没有这种药物。
唑(复方SMZ)。过敏或不能耐受者,可用喷他脒雾化吸入,但我国没有这种药物。
《国家免费艾滋病抗病毒药物治疗手册》(第4版)建议以下三种情况的儿童(<14岁)应给予复方SMZ预防PCP:
(1)所有HIV感染母亲所生的婴儿在出生4~6周(ART预防之后)都开始服用复方SMZ,一直到排除HIV感染为止。
(2)确诊HIV感染的1~5岁儿童,CD4细胞计数<500个/µl,或CD4细胞百分比<15%。
(3)确诊HIV感染的>5岁儿童,CD4细胞计数<200个/µl,或CD4细胞百分比<15%。
体重小于15kg的儿童,尽可能选择复方SMZ混悬液(每ml含SMZ 20mg,TMP 5mg)剂量如下:体重<5kg者2.5ml,每日1次;体重5~15kg者5ml,每日1次。体重15~30kg者,复方SMZ(片剂)1片,每日1次;体重>30kg者2片,每日1次。
HIV暴露新生儿预防性应用抗病毒药物基本不会影响生长发育和寿命。HIV感染儿童生长发育的影响因素是生理、心理及社会多方面的,预防性抗病毒药物不是主要因素。
由于相似的传播途径,HIV阳性的母亲常常还伴有HBV、HCV和梅毒的感染,在母婴阻断时应予以注意:
(1)HIV/HBV共感染孕妇抗病毒治疗应包括TDF联合3TC或FTC,新生儿出生12小时内应接种乙肝免疫球蛋白和乙肝疫苗。
(2)对HIV/HCV共同感染的孕妇,HCV的治疗比较受限(口服抗HCV药物没有在孕妇中评估使用,并且在妊娠期间禁止用利巴韦林),新生儿应在出生18个月后行抗HCV检测,筛查阳性的婴儿应进行HCV RNA检测。也可以在出生2个月后进行HCV RNA病毒学检测以进行HCV的早期诊断。HIV/HBV或HIV/HCV共感染孕妇应在开始ART 1个月后监测评估转氨酶,并且在妊娠期间至少每3个月评估1次。HBV或HCV共感染的孕妇分娩方式依据标准的产科和艾滋病相关适应证,如果没有其他情况,并不需要剖宫产。
(3)梅毒的合并感染见本书“十、孕产期保健与预防HIV、梅毒和乙肝母婴传播综合干预服务”。
所有HIV感染母亲所生婴儿均需预防性应用抗病毒药物,不管母亲HIV是否控制。
美国DHHS指南根据新生儿不同的围产期HIV暴露风险,推荐HIV暴露新生儿预防性用药见表2-1。
表2-1 HIV暴露新生儿预防性用药推荐

续表

HIV暴露新生儿预防性用药剂量见表2-2。
表2-2 HIV暴露新生儿预防性用药剂量

续表

* 如果母体在分娩前2~24小时服用了RAL,新生儿的首次RAL给药应延迟至出生后24~48小时;应尽快开始额外的ARV药物治疗
根据国家卫生健康委《预防艾滋病、梅毒和乙肝母婴传播工作规范(2020年版)》的规定,暴露于HIV的新生儿出生后6小时内尽早开始服用HIV预防药物,根据围产期HIV暴露风险不同,推荐用药方案不同。
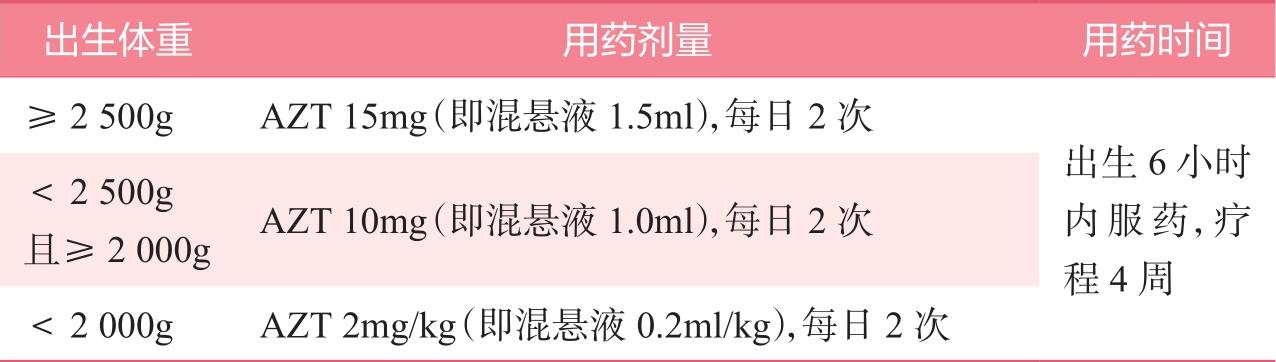
1)对于普通暴露风险儿童,可以选择以下AZT方案或NVP方案中的一个;选择母乳喂养的新生儿,首选NVP方案,具体推荐见表2-3、表2-4。
表2-3 NVP方案
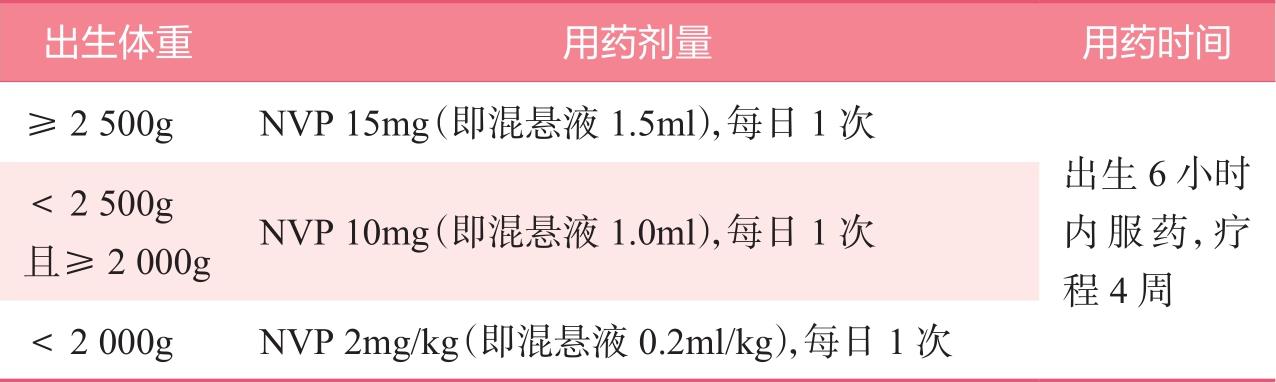
表2-4 AZT方案
2)如孕产妇符合以下条件之一时,则新生儿属于HVI围产期高暴露,需要采用三联药物阻断:①孕晚期HIV病毒载量>50拷贝/ml;②孕晚期HIV病毒载量未知,且孕妇ART短于12周;③临产或分娩后,孕产妇HIV初筛实验阳性;
三联药物方案如下:①出生后2周内:AZT+3TC+NVP。②出生2~6周:AZT+3TC+LPV/r。
(代丽丽 孙丽君 吴爱萍)