




2015年,一项基于国家外科手术质量改进项目数据库(national surgical quality improvement program analysis,NSQIP)的研究发现,大型腹部手术患者中有6%会存在术后肺部并发症(postoperative pulmonary complications,PPCs)。PPCs的定义为术后患者出现呼吸道状况,对术后恢复产生了不良影响,包括几大类有临床意义的并发症:肺不张、感染(包括支气管炎和肺炎)、肺栓塞、潜在慢性肺疾病的恶化、支气管痉挛、长期机械通气和呼吸衰竭。术后早期并发症中约25%是肺部来源,而PPCs的发生率与围手术期死亡率、重症监护病房(intensive care unit,ICU)入住率和住院日长呈正相关,风险因素包括患者和手术相关因素(包括麻醉因素)。因此,术前对妇科肿瘤患者,尤其是有肺部病史的患者,进行仔细的肺功能评估和干预很有必要,结合呼吸科和麻醉科会诊意见,综合评估患者对手术/麻醉的耐受程度和判断手术风险及选择手术方式,以期减少PPCs的发生和改善患者术后生活质量。
肺部并发症的危险因素可分为患者相关的危险因素和手术相关的危险因素,目前研究提示的患者相关因素包括以下几个方面:
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是PPCs的首要预测风险因素。
年龄是第二大风险因素,即使是健康的老年患者,PPCs的风险也显著增加。
即使没有基础肺部疾病病史,吸烟者的PPCs风险也增加,术前戒烟可减少并发症的风险,戒烟超过8周的患者与非吸烟者的风险相似。
目前证据表明充血性心力衰竭是PPC明显的高危因素,甚至有Meta分析指出心力衰竭患者与慢性阻塞性肺疾病(COPD)患者相比,肺部并发症风险可能更高。
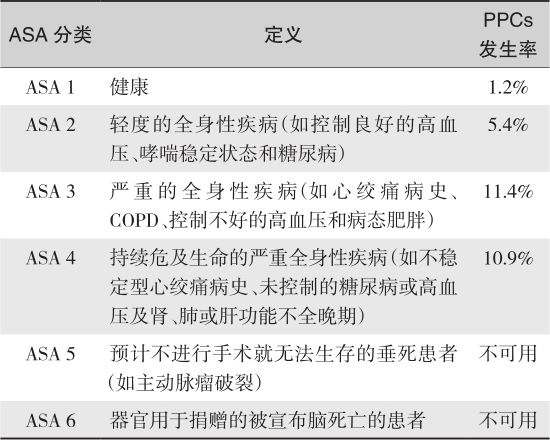
总体健康状态是肺部风险的重要决定因素,功能依赖和意识受损均增加PPCs的风险,美国麻醉医师学会(American Society of Anesthesiologists,ASA)体格状态分级原目标是用来预测围手术期的死亡率,但是后来证明ASA分级预测术后心肺并发症也同样可靠(表1-1)。
病态肥胖[体重指数(body mass index,BMI)>40kg/m 2 ]能增加PPCs的风险,但肥胖不是PPCs的重要危险因素,不影响高风险手术的患者选择。
表1-1 ASA分级和PPCs发生率
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)在手术中主要增加气道管理难度,增加PPCs的风险。
无论肺动脉高压的潜在病因是什么,目前研究中显示肺动脉高压(包括轻-中度肺高压)能增加PPCs的发生率。
尽管早期报道表明,哮喘患者的PPCs发生率高于预期,但近期研究发现控制良好的患者与术后肺部并发症没有关联。
对于进行高危手术且目前或近期存在上呼吸道感染(upper respiratory infection,URI)的成人推迟择期手术是比较明智的。
血清白蛋白<35g/L是重要的PPCs相关预测因子,因此术前低白蛋白血症的患者需要纠正;血尿素氮>7.5mmol/L也是PPCs的风险因素,但是干预措施有限。
手术对肺功能的影响超过生理范围就会产生并发症,术后肺容量减小是影响肺功能最主要的因素。不同的手术操作方式、手术部位、手术持续时间及麻醉类型等,均可能引起患者呼吸生理紊乱、有效肺通气及换气功能下降等肺功能障碍,造成程度不一的术后并发症。急诊手术会增加PPCs的风险。
手术部位是预测PPCs最重要的因素,并发症发生率与手术切口至膈肌的距离呈反比。因此,胸部和上腹部手术与下腹部手术相比,肺部并发症发生率显著升高,与手术对呼吸肌和膈肌功能的影响有关。
手术持续时间超过3小时具有较高的PPCs风险,认为与手术时间延长导致感染发生的可能性更高有关。
腹部手术麻醉方式主要有硬膜外麻醉和全身麻醉两种,现在认为与硬膜外麻醉相比,全身麻醉造成的PPCs风险更高,应用硬膜外麻醉和止痛可以改善膈肌功能、降低术后低氧血症发生率,从而减少PPCs发生率。同时神经肌肉阻滞剂类型也与PPCs相关,长效的神经肌肉阻滞剂比短效的更容易引起并发症,因为残留的神经肌肉阻滞可引起膈肌功能障碍、黏液纤毛清除功能受损并最终促进PPCs的发生。
与开腹手术相比,腹腔镜手术具有创伤小、恢复快、全身炎症反应轻和术后疼痛轻等特点,这也是目前认为腹腔镜手术会降低术后PPCs发生的原因。但是一项Meta分析比较腹腔镜和开放结肠癌手术的研究,发现腹腔镜手术有减少肺部并发症发生的趋势,但是没有显著性差异。因此,手术方式不能作为评估PPCs的独立危险因素。
详细的病史和体格检查是术前风险评估最重要的部分,不可忽略既往已经诊断的慢性肺疾病史和隐匿性潜在肺疾病或心力衰竭的病史,比如:运动不耐受、不明原因性呼吸困难或咳嗽等。体格检查可以直接提示COPD,比如:桶状胸、肺部叩诊过清音、呼吸音减弱、干啰音、呼气相延长等。
实验室检查作为临床评估的辅助手段,在特定的患者中进行。
肺功能测定主要是肺容积、肺通气、肺换气功能的测定,还包括支气管舒张试验、支气管激发试验及运动心肺功能测定等。肺通气功能在临床应用最广泛、最常用的指标有:用力肺活量(forced vital capacity,FVC)、第1秒用力呼气量(forced expiratory volume in one second,FEV 1 )、最大通气量(maximal voluntary ventilation,MVV)。术前FVC>80%预计值,MVV>65%预计值,可以行全肺切除手术;术前FVC>50%预计值,MVV>40%预计值,可以行肺叶切除手术。手术耐受力的最低标准为:FEV 1 >40%预计值且FEV 1 /FVC>50%,或MVV>50%预计值,或肺一氧化碳弥散量(D L CO)>50%预计值,或残气量/肺总量(RV/TLC)<40%。理论上能耐受胸部手术也就能耐受腹部手术,但是不同部位的手术对肺功能要求不一样,通常认为下腹部手术只要患者能耐受麻醉就可以了。并不是所有患者和所有手术类型均需要常规进行肺功能测定,临床上需根据患者和手术相关因素进行有选择性的筛查,比如:年龄>60岁、ASA分级≥2、COPD、充血性心力衰竭、手术预计时间>3小时等。需要注意的是,肺功能测定不能作为手术禁忌的首要指标,需要结合病史和体格检查进行综合判断;有多个研究发现,与病史体格检查相比,术前肺功能预测PPCs并无优越性。
胸片是术前常规,可以提示肺炎、肺不张等病变,但是病史和体格检查更重要。
对于腹部手术,术前动脉血气分析不作为常规。如果为了了解阻塞性肺疾病的严重程度,可以通过血气分析了解通气情况、酸碱平衡、氧合状态和血红蛋白浓度。但是,不能单用术前动脉血气分析的测量值评估术后PPCs的风险,需要结合临床病史、体格检查和其他实验室结果。
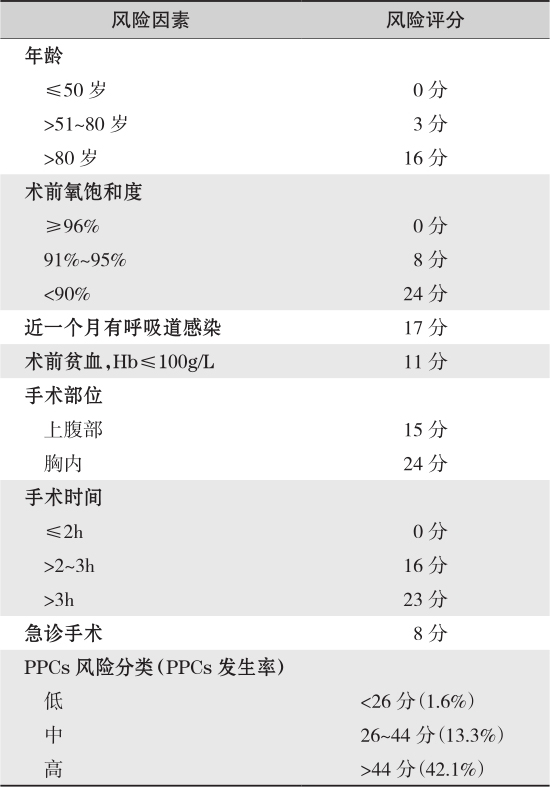
术前PPC评估可采用西班牙加泰罗尼亚外科患者呼吸风险评估量表(Assess Respiratory Risk in Surgical Patients in Catalonia,ARISCAT)(表1-2)。此量表包含7个独立危险预测因素:年龄、术前血氧饱和度、近1个月是否有急性呼吸道感染、术前贫血、是否为上腹部或胸部手术、手术预计时间和是否急诊手术。根据患者所得总分,可以分为3类:①低危患者:总分<26分,术后肺部并发症发生率为1.6%,一般无需特殊处理。②中危患者:总分介于26~44分,术后肺部并发症发生率为13.3%,建议术前请呼吸专科或者麻醉科会诊。③高危患者:总分>44分,术后肺部并发症发生率为42.1%,建议考虑其他治疗方式或者对相关危险因素处理后手术。
表1-2 ARISCAT量表
对有慢性阻塞性肺疾病、吸烟、年老、肥胖和急性呼吸系统感染的患者进行术前肺功能评估,有助于手术医师选择手术时机、手术科室和麻醉科室对患者进行更好的围手术期管理。
慢性肺部疾病[如COPD、哮喘、阻塞型睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAS)、肺动脉高压等]如果症状已经控制稳定,可以进行手术;如果症状未控制,建议推迟择期手术,优化治疗达到最佳控制再进行手术。具体每个疾病均有相应的围手术期管理指南,在这里不一一详述。由于COPD的管理几乎涵盖了肺功能异常患者的所有措施,因此以典型的COPD作为肺功能异常的围手术期管理的例子进行阐述。
吸烟本身导致围手术期并发症和死亡风险增加,还是诱发慢性阻塞性肺疾病的重要原因。我国女性患者吸烟率一直处于低水平状态,但如果患者平时吸烟,术前戒烟4周以上可降低PPCs发生率,戒烟3~4周可降低伤口并发症的发生,由于短时间戒烟的影响不明显,所以推荐吸烟患者术前尽早开始戒烟。
COPD患者约1/3合并某种程度的营养不良,加强营养支持能明显提高患者的生活质量。首选口服营养支持,目标是维持BMI为20~25kg/m 2 ;同时纠正可能存在的低白蛋白血症。
适用于中度以上的COPD患者,根据个人情况在专业医师指导下进行。内容包括:①教育患者使用正确的咳嗽、排痰和缩唇呼吸等。②心肺功能训练,包括伸屈训练、力量训练和有氧运动等。术前进行心肺功能训练可以有效提高COPD患者的活动耐量、降低术后PPCs的发生率。
首选吸入治疗,短效制剂(短效β 2 -受体激动剂,短效抗胆碱能药物)适合所有慢性阻塞性肺疾病患者,短效β 2 -受体激动剂包括沙丁胺醇、特布他林,短效抗胆碱能药物包括异丙托溴铵;长效制剂(包括长效β 2 -受体激动剂,长效抗胆碱能药物)适用于中度以上患者,长效β 2 -受体激动剂包括福莫特罗、沙美特罗等,长效抗胆碱能药物包括格隆溴铵、噻托溴铵等。具体药物治疗方案需呼吸科制订。术前给予支气管扩张剂可以减轻症状、改善肺功能,但是需要监测药物相关不良反应。术前持续使用吸入支气管扩张剂的COPD患者推荐维持吸入到手术当日。
包括乙酰半胱氨酸、盐酸氨溴索、厄多斯坦等。慢性支气管炎、COPD患者,有明确咳嗽、咳痰症状,祛痰治疗可以减轻症状、减少COPD急性加重、部分改善肺功能。研究表明,术前使用氨溴索进行祛痰治疗配合心肺功能训练可以降低PPCs的发生率。
COPD急性加重期患者如无禁忌,建议应用系统性糖皮质激素,首选口服治疗,建议给予泼尼松30~40mg/d,疗程5~7天。也可以选择吸入糖皮质激素,术前1周使用布地奈德联合支气管扩张剂吸入可以改善肺功能并减轻症状,降低PPCs发生率。
术前合并低氧血症的患者可给予氧疗,氧疗是住院COPD患者的基础治疗,病情平稳的术前患者一般给予低流量的鼻导管吸氧即可,氧流量为1~2L/min,目的是维持静息状态下动脉血氧分压≥60mmHg或血氧饱和度>90%。
预防性使用抗生素预防术后肺炎没有效果。COPD急性加重多数由感染引起,对于有肺部感染症状患者根据痰培养加药敏结果调整抗生素应用,在痰培养结果出来之前经验性用药,抗生素治疗的推荐时间是5~7天。具体用药需同呼吸科医师共同拟定。
麻醉方式尽可能选用风险低的(麻醉风险:全身麻醉>硬膜外麻醉)及尽可能不用长效神经肌肉阻滞剂,术中严密监测的同时进行肺保护性通气(低潮气量通气)。
术中根据患者和手术情况监测血流动力学指标和尿量,指导循环和液体管理,目标是避免容量过负荷。限制性液体治疗可以降低围手术期并发症发生率。
尽可能将手术时间控制在3小时之内。
为避免患者因剧烈疼痛而不敢咳嗽、活动,术后应给予持续有效的镇痛,尤其在开腹手术后。有效的咳嗽排痰及早期活动有助于减少术后肺部并发症。常用的镇痛方法包括:局部浸润、区域阻滞和静脉镇痛。区域阻滞镇痛效果确切,对呼吸功能影响小,是COPD患者术后镇痛的理想选择,其中硬膜外镇痛是胸、腹部和下肢手术术后镇痛的金标准。
无创正压通气适用于辅助早期撤机和呼吸衰竭的早期干预,适应证包括:中、重度呼吸困难;伴辅助呼吸肌参与或胸腹矛盾运动;中、重度酸中毒。禁忌证包括:循环不稳定(低血压、严重心律失常);昏迷、缺乏咳嗽吞咽反射、腹胀;近期面部和颈部手术史;脸部畸形。
术后氧疗以控制性低浓度氧疗为主。一般采用鼻导管吸氧,氧流量为1~2L/min,氧疗的目标是静息状态下SaO 2 >90%。
COPD治疗所用的吸入用支气管舒张剂、吸入用糖皮质激素和祛痰剂都建议围手术期持续使用。
合并细菌感染的患者可使用抗生素,围手术期使用抗生素可减少痰量,根据病情严重程度结合常见的致病菌类型、耐药趋势和痰培养药敏情况尽早选择敏感的抗菌药物。
常见的胸部物理治疗包括振动、体位引流、用力呼气、咳嗽训练、正压通气、呼气正压、胸部扩张运动和步行锻炼等。间歇正压通气和呼气正压有助于改善咳嗽,下地行走有助于改善动脉血气、肺功能、呼吸困难症状和生活质量,所有COPD患者术后应预防性实施胸部物理治疗。
术后早期活动有助于康复,研究表明对于腹部大手术患者,术后第一天开始进行有氧运动减少了呼吸道感染,缩短了住院时间,并改善了活动耐量。所以,建议患者术后尽早离床活动,并循序渐进逐渐增加活动量。
营养不良导致免疫功能低下、伤口愈合不良、术后并发症增加和住院时间延长。情况允许时首选肠内营养,肠内摄入不足时联合肠外营养。
肺栓塞少见但致命,超过95%的肺栓塞来自下肢深静脉血栓,手术导致深静脉血栓的因素与制动、炎症状态、基础疾病和肿瘤有关。可采用术后早期活动、弹力袜、低分子肝素等方法预防深静脉血栓。
妇科肿瘤合并肺功能异常的患者术前需要根据患者和手术相关的风险因素进行分层,综合评估手术和麻醉风险,确定手术方式。呼吸科和麻醉科多学科协作进行围手术期管理,以降低围手术期并发症和改善患者生活质量。
(李 惠 颛孙永勋 王丽娟)