




众所周知,除了分析仪器外,分析试剂也是分子光谱分析赖于发展的两大类物质基础之一,因此,也一直受到人们的关注。自身具有光学性质的化合物可以直接进行分子光谱分析。然而,更多的有机物质、无机物质,以及生物活性分子等因其不具有或仅表现较弱的光学响应而无法分析。对此,可以让被测物质与某种分析试剂发生相互作用,再利用两者的相互作用所引起的吸光、荧光等光信号的呈现或改变来进行分析与测定。这种具有光信号响应的分析试剂或检测试剂,可称为光学探针。显然,光学探针主要包括吸光(显色或比色)、荧光及发光分析试剂,其是现代分子光谱分析的核心内容之一。在以往,显色试剂、荧光试剂、发光试剂通常可分别论述。目前,依据该领域的不断演变和快速发展,我们可以具体地定义:光学探针是指与目标物质(或环境因素)发生相互作用或反应(包括配位、包合和基团反应等)并引起光学(吸光、荧光或发光)性质的变化,利用这些光信号的变化从而可对目标物质进行分析与测定的一类分析试剂 [2,9,10,13-15] 。需要指出的是,在具体的研究中,可采用荧光探针、显色或比色探针;然而,因为大多数探针不仅产生荧光变化,而且会有颜色的改变,所以在通常情况下推荐使用更广泛含义的术语——光学探针,显得更为简明和全面。光学探针的英文为spectroscopic probe(也有用optical probe的)。对于“光学”,本书采用spectroscopic而非optical,是因为前者更符合分析化学的分光色彩 [1-6] ,而后者更适合物理学范畴;对于“探针”,目前应用较多的是probe,其他不同的习惯用法有dye,indicator,reagent,label,chemosensor,sensor[该术语不具有“器件(device)”特征,因而有些人不建议使用]等,它们的含义本质上是相似的。
传感分析(sensing analysis)这一概念目前比较模糊,这可能是多学科不断交叉与发展的结果。从最宽泛的定义来看,传感分析是一种分析检测技术,是利用一种传感装置或体系检测其周围环境中的事件或变化,进而提供相应的输出信号与信息 [2] 。
目前,基于光学探针的传感分析主要涉及紫外、可见和近红外光谱区域的200~1400 nm的光。根据上述定义,光学传感分析的原理是:利用光学探针与周围的分析物或环境因素产生相互作用并伴有光信号(如波长、强度、寿命等)的变化而进行分析,如图2-8所示。这种光信号变化传到信号变换与放大器上,再经计算机数据处理与显示,进而获取需要的信息。如何使光学探针与分析物产生专一性的、信号强的、快速的,且最好是可逆的光信号响应(这实际上是选择性、灵敏度以及速度等问题)便成为该领域的一个关键课题。
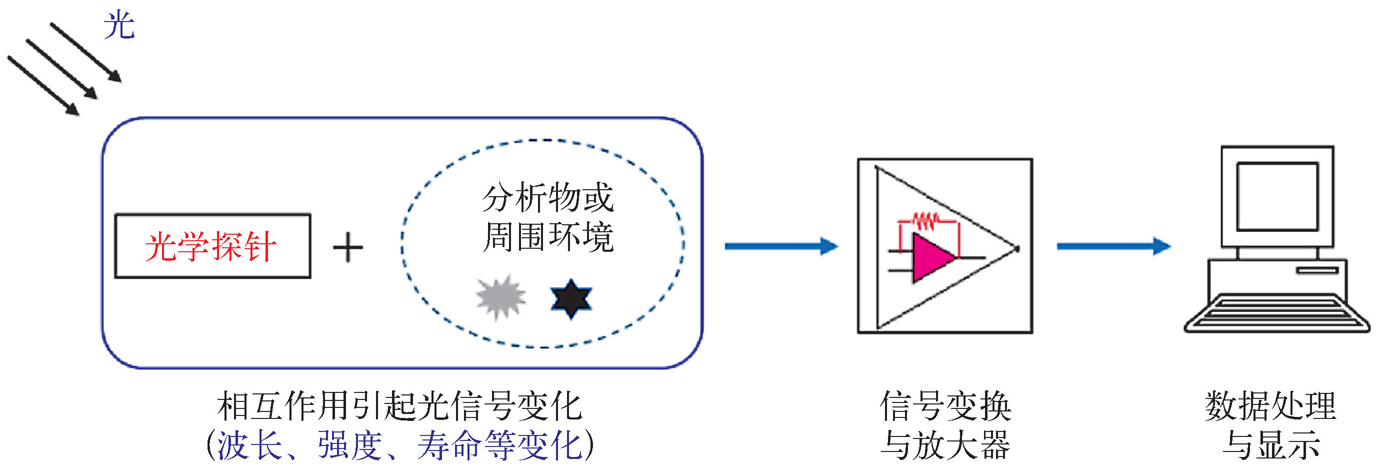
图2-8 基于光学探针的传感分析原理
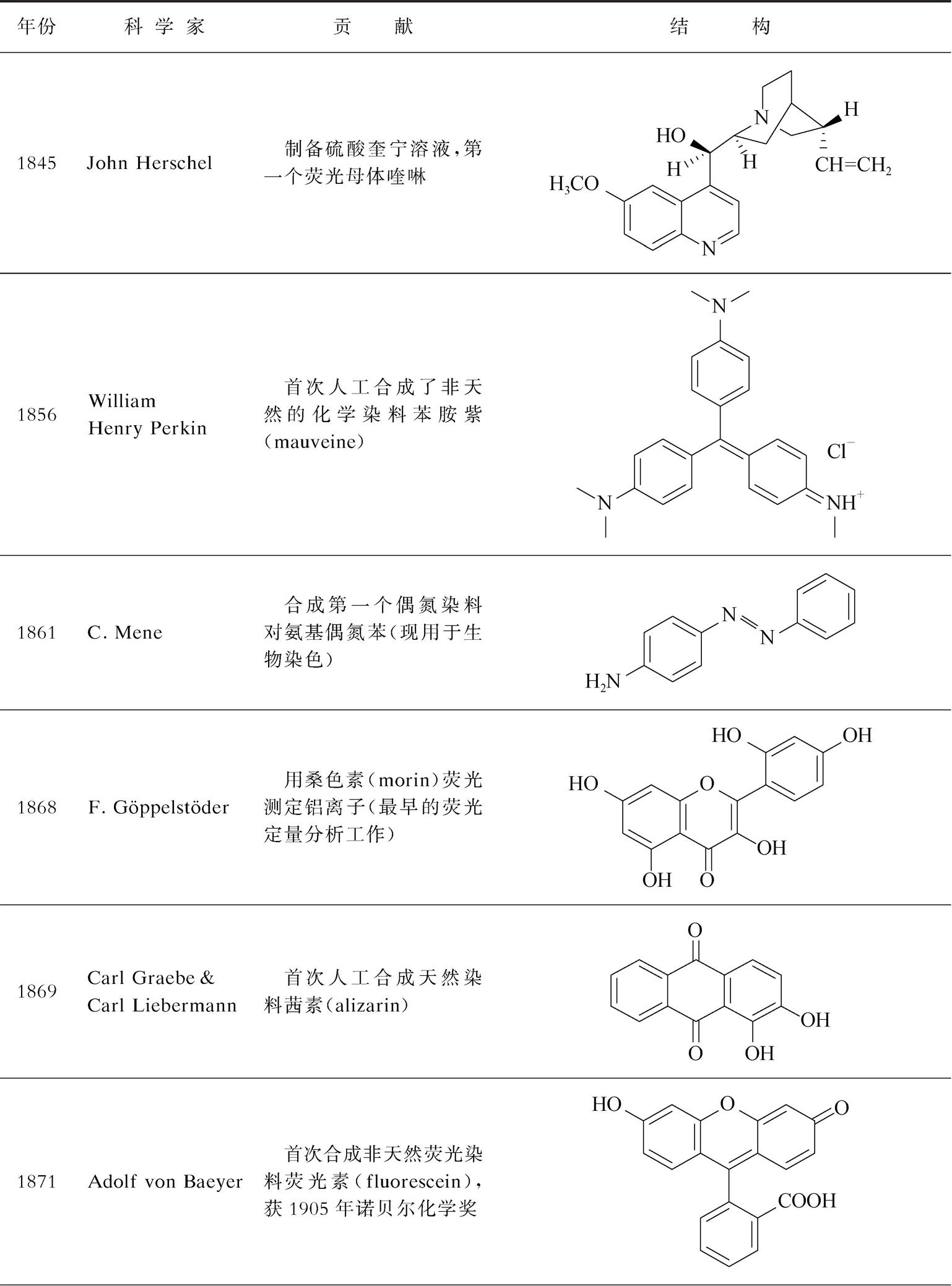
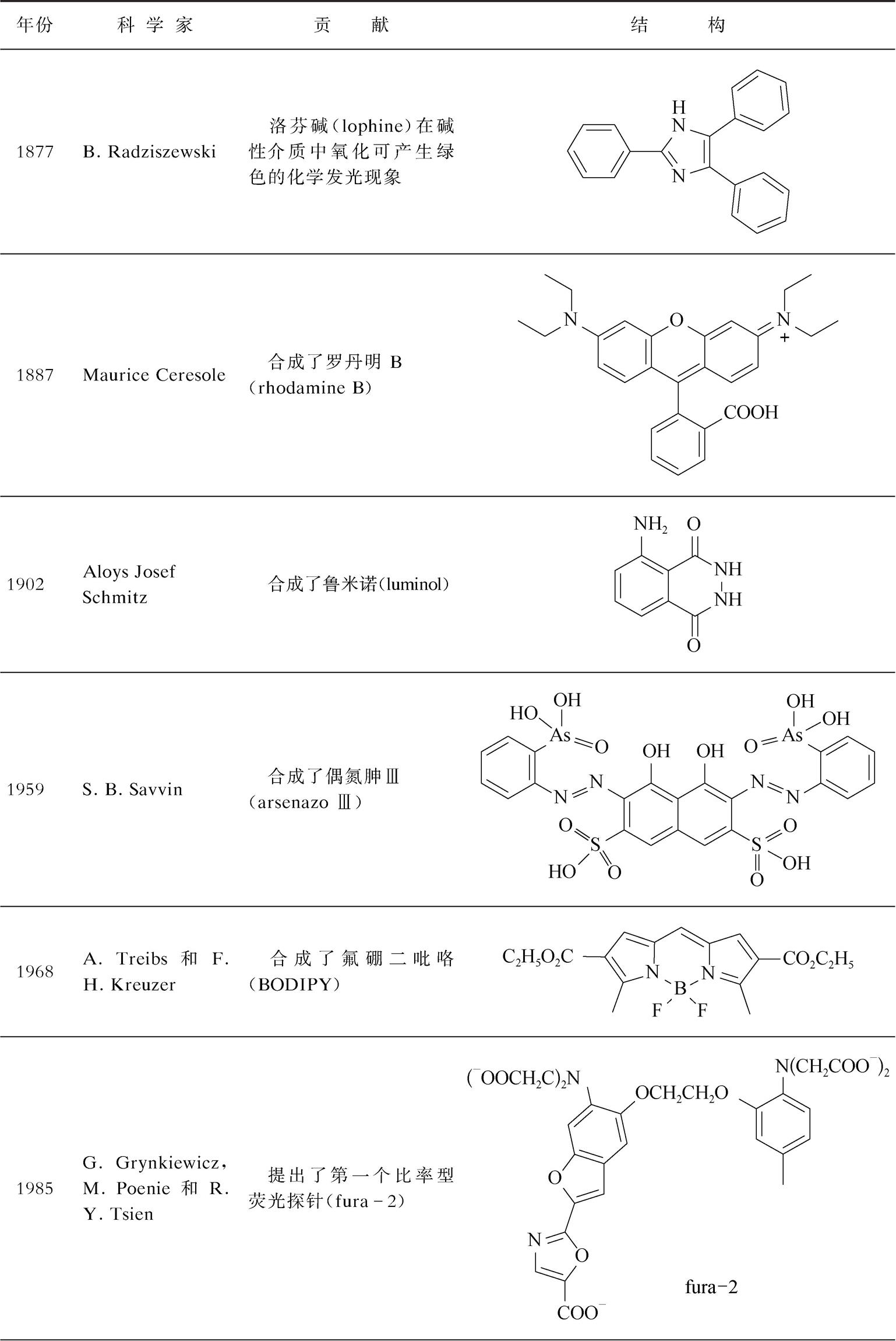
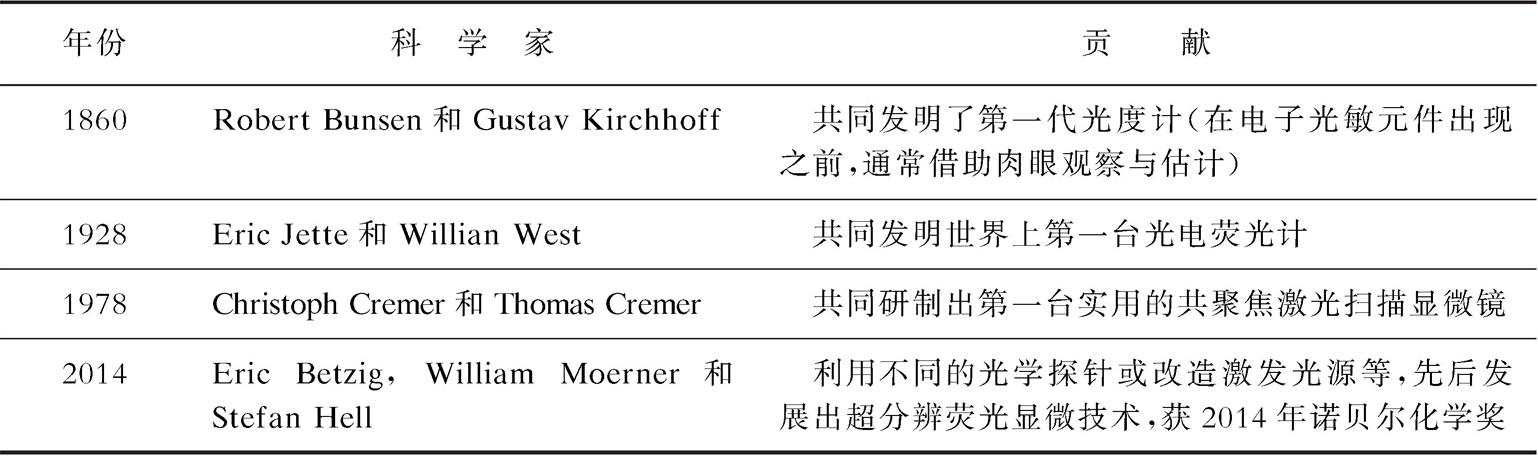
性能优良的光学探针是构建光学传感与活体成像分析方法的物质基础,同时也是促进相关仪器发展的重要因素。表2-4和表2-5列出了该领域中的喹啉、荧光素、罗丹明等一些重要荧光体(fluorophore)或荧色体(fluorochrome),以及第一台分光光度计、荧光仪、共聚焦荧光显微镜等相关里程碑研究或事件 [1-15] 。可以看出,与其他许多研究领域不同(诺贝尔奖仅光顾一次),光学探针与传感分析领域可以数次获得诺贝尔奖。因此,这是一个有前途的方向。若有更优异的光学探针或超高分辨率仪器出现,相信诺贝尔奖将会再次造访这个领域 [2] 。
表2-4 光学探针的部分重要荧光体的出现
续表
续表

表2-5 光学仪器的出现
光学探针通常由光学基团(信号响应单元)、识别基团(反应或标记单元)和桥联键三部分组成,前两者通过适当的桥联键而连接在一起(在某些情况下,光学基团和识别基团两者直接集成为一体而无须桥联键)。其中,反应或标记单元决定对不同分析物的选择性,而信号响应单元则起着将反应信息转变为光信号的作用。因此,在进行光学探针设计时,不仅要考虑反应或标记单元对分析物的反应选择性,使之尽可能地高,而且还必须考虑信号响应单元的特性,使目标物质尽可能大地改变其光学响应,以获得高的灵敏度。图2-9为光学探针的结构特征、响应原理及具体示例 [2,13-15] 。
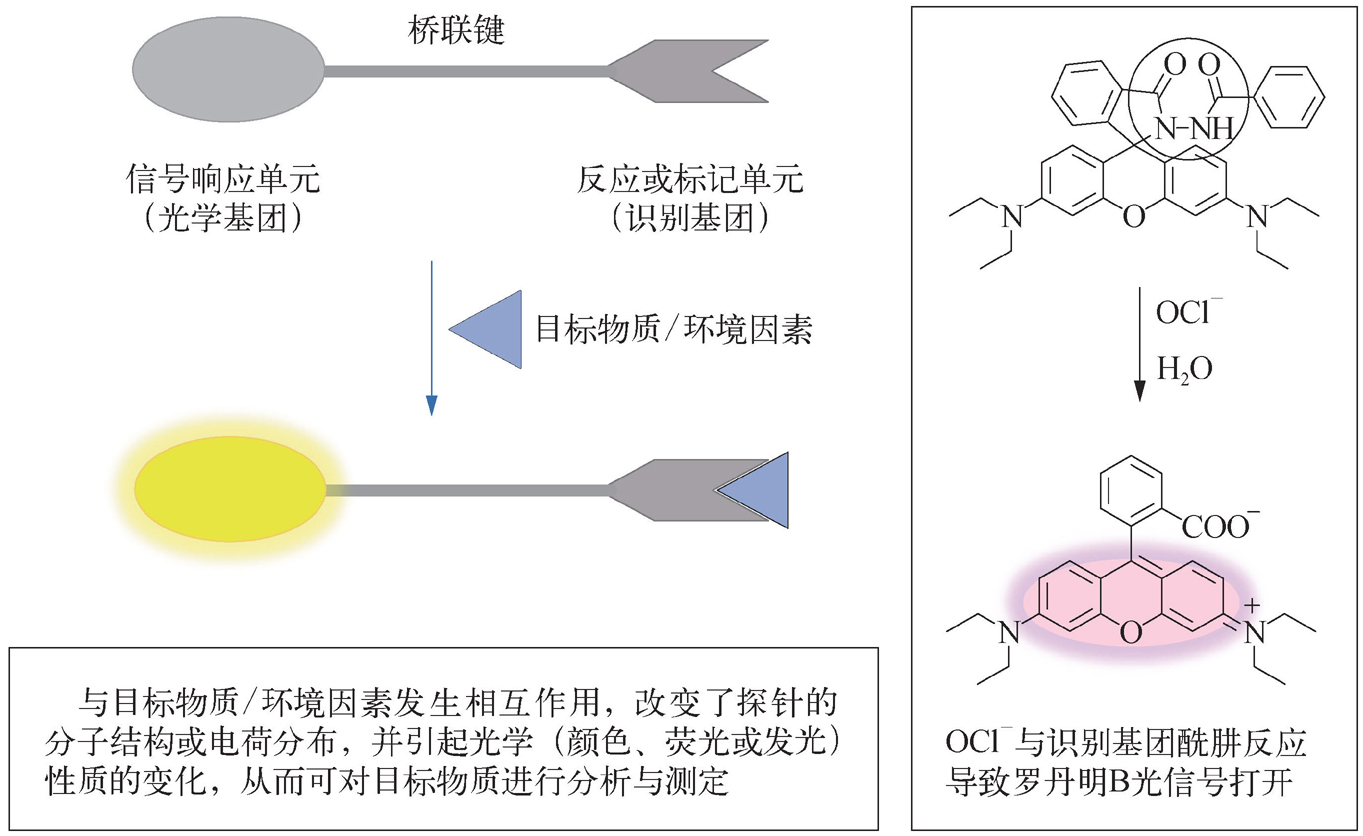
图2-9 光学探针的结构特征、响应原理及具体示例
光学探针的光信号响应有多种模式。常见的有:(1)光信号强度改变,包括猝灭型和打开型两种,打开型也称增强型;(2)波长与强度改变,如荧光共振能量转移、比率型探针;(3)寿命、各向异性改变等。不同响应模式可用不同的光物理过程(光诱导电子转移、电荷转移、能量转移等)进行解释 [2,13-15] 。
这些响应模式都有各自的特点。例如,猝灭型探针是基于光信号由强变弱而进行分析;由于其具有高的背景信号,故在分析检测领域(特别是在低浓度分析物检测时)优势不明显。打开型探针是基于光信号从无到有或由弱变强而进行分析,由于其具有低的背景光信号,因而通常具有高的检测灵敏度;然而,这种基于荧光强度变化的检测易受探针浓度、测试环境、光程长度等因素的影响,因此当用于生物体系如细胞时,其比较适用于痕量物质的灵敏与定性分析,而不适用于定量测定。比率型荧光探针是基于两个波长处的荧光强度比值进行检测,可以较好地消除上述多种因素的干扰,故比较适用于分析物的准确定量测定;不过,比率型探针由于产生波长的漂移,所以整个检测体系同样具有高的背景荧光,其检测灵敏度通常低于打开型探针,且分析操作较麻烦。鉴于此,在实际应用中根据具体的需要选择合适的探针则是关键 [2,13-15] 。
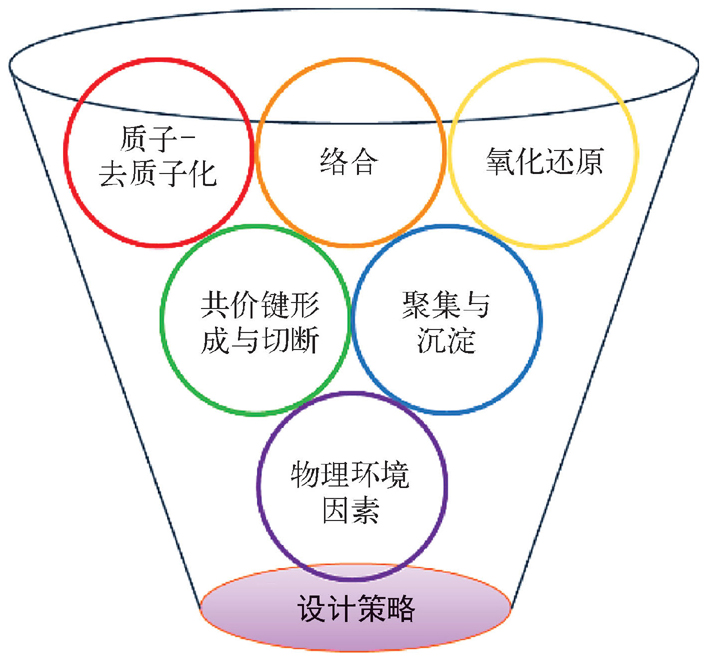
图2-10 光学探针常用的设计策略
根据研究目的与分析对象的不同,马会民等 [2,14,15] 系统地归纳并阐明了光学探针常用的设计策略(图2-10),主要包括两大类:一类是基于不同的化学反应,另一类是基于合适的物理环境因素(如极性、黏度、温度、压力等)。前者主要利用如下5种化学反应:质子-去质子化反应、络合反应、氧化还原反应、共价键的形成与切断,以及聚集与沉淀反应。
(1)质子-去质子化反应
此类反应主要是借助—OH、—COOH、—NH 2 等基团对酸度的敏感性而用于pH光学探针等的设计。pH探针通常可提供的精确测量范围仅为两个pH单位,即p K a±1。若需要pH响应范围宽的探针,一个有效措施是将多个质子敏感的电负性原子(如N或/和O)设置在荧光体的不同而差别又不大的电子环境中,以产生近似线性的pH响应。另外,质子敏感的电负性原子也是金属离子的配位原子,通常会引起络合作用而产生干扰。因此,电负性原子的设置应尽量避免提供适当的立体空穴或5-元环络合物、6-元环络合物形成的环境。
(2)络合反应
络合反应常用于金属离子等光学探针的设计。这类探针通常具有反应速度快、反应可逆的优点,甚适于分析物浓度的动态变化监测。须指出的是,溶液pH可改变电负性配位原子的质子化状态和配位能力,从而影响探针的性能,因此,缓冲溶液的使用一般必不可少。络合型探针的设计关键是如何借助分子识别、主-客体超分子作用、空间体积匹配等因素,构筑高选择性的配位识别单元。常用的手段有:设计与金属离子体积相匹配的空穴或环,如冠醚等;构筑便于5-元环络合物、6-元环络合物的形成环境;软硬酸碱原理的运用,如向荧光体中引入软碱原子S用于软酸Hg 2+ 的检测等。
(3)氧化还原反应
氧化还原反应主要用于氧化还原性物质(如活性氧物种)光学探针的设计,也可用于金属离子、蛋白酶、小分子等物质的探针构建。其中,活性氧物种的特点是浓度低、寿命短、氧化性相近;因此,对探针的要求是灵敏度高、捕获快、选择性好。这通常需要借助特殊的化学反应才能实现。
(4)共价键的形成与切断
此类反应可用于各种无机物、有机物或生物活性物质的光学探针的设计。其中,共价键的形成很早就广泛用于色谱衍生和生物分子的标记,近年注重利用亲电/亲核加成等偶联反应、分析物诱导分子内环化、亲电/亲核取代等特殊的反应来发展无须色谱分离的高选择性光学探针;共价键的切断主要是借助多米诺分解、诱导水解与消除、氧化切割等作用来设计蛋白酶、金属离子、活性氧等物种的光学探针。与络合型探针相比,这类探针通常具有更高的灵敏度和选择性,但反应速度较慢,且可逆性较差,所以通常不适于分析物浓度的动态变化监测。
(5)聚集与沉淀反应
此类反应主要是利用物质在反应前后溶解度的改变来设计探针,其光信号响应机理与黏度敏度的光学探针类似,即可用局部黏度的变化影响分子内旋转与非辐射去活过程来解释。这种聚集与沉淀反应曾广泛用于蛋白酶的聚集型或固态型光学探针的设计 [16,17] ,例如,1992年R.P. Haugland等报道了碱性磷酸酶的沉淀型或聚集型荧光探针。这类探针也可称为聚集增强型或聚集诱导发光探针。当其用于细胞等生物体系时,这类聚集型或固态探针可能出现分布不均甚至沉淀现象,从而导致分析测量的重复性欠佳,此为其缺点之一。此外,这类探针对黏度十分敏感,若用于测定其他物质,则其固有的黏度干扰与影响通常难以消除,此为其另一个突出的缺点。
除上述常用的光学探针设计策略之外,还可借助超分子、体积匹配、共轭结构可变等作用来设计光学探针。特别是利用共轭结构可变的措施,可发展出分析性能较易预测的优良光学探针。另外,相关研究人员还广泛结合各种光物理过程扰动原理(光诱导电子转移、电荷转移、能量转移等)来设计光学探针。
上述这些设计策略虽然很宽泛,但它们有助于在整体或宏观上了解光学探针的本质。显然,这些策略适用于小分子、大分子、纳米等各类光学探针的设计,对基于其他(如电化学)信号响应原理的探针制备也具有重要借鉴或指导作用 [2] 。
不同的研究目的对光学探针有着不同的要求。在通常情况下,由于光学探针的最终目的是用于分析和检测,因此,其最重要的评价标准是新探针是否具有优良的分析性能。这需要从三方面着手,即灵敏度、选择性和实用性 [2] 。
(1)灵敏度取决于分析物与光学探针作用后对光学信号响应的改变程度。理想的探针是其本身无光学响应,与分析物作用后则产生强的光学信号。然而,许多探针含有光学基团,本身具有背景信号峰,这就需要设计识别基团或合适的桥联键,使探针与分析物作用后其波长与强度同时或分别产生变化。对此,使用光学响应强的基团,如吸光响应的偶氮基、荧光响应的罗丹明母体和化学发光响应的邻苯二甲酰肼等,将有助于提高波长发生变化探针的分析灵敏度。
(2)选择性的需求分两种,一是分类或分组型的光学探针,其选择性主要取决于标记或识别基团,这对色谱衍生极为重要(如丹磺酰氯中的活性氯标记各种氨基酸);二是检测单一物质的专属性光学探针,它往往需要利用特殊的化学反应,或通过合理地引入辅助基团,或利用体积匹配因素、静电/氢键作用以及实验条件的优化等才能实现。
(3)实用性则包括探针易于合成、制备,与分析物的反应快速、可逆且易于操作(用于生物体系时最好能在水介质中进行)等。
光学探针有多种分类法。例如,可以根据响应原理、分析对象、结构特征等进行分类,各有特点。采用不同的角度分类,是为了为便于记忆和选用。
按响应原理分类。光学探针主要有显色探针(也叫比色探针)和发光探针两大类。根据上述光学传感分析原理,发光探针还包括荧光探针、磷光探针、化学发光探针等。
按分析对象分类。光学探针主要有检测离子的探针、检测小分子的探针、检测大分子(蛋白质、核酸等)的探针、环境敏感光学探针、亚细胞器光学探针等。
按结构特征分类。光学探针主要有小分子光学探针、大分子光学探针和纳米光学探针三类。下文将简要介绍这三类光学探针,特别是小分子光学探针的研究进展,以展望基于光学探针的分子光谱分析的发展前景。
这类探针可根据结构特点进一步细分为偶氮类、多环芳烃类、三苯甲烷类、氧杂蒽类、香豆素类、卟啉类、BODIPY类、1,8-萘酰亚胺类、联吡啶及邻菲罗啉类、花菁类、螺吡喃类、方酸菁类等。
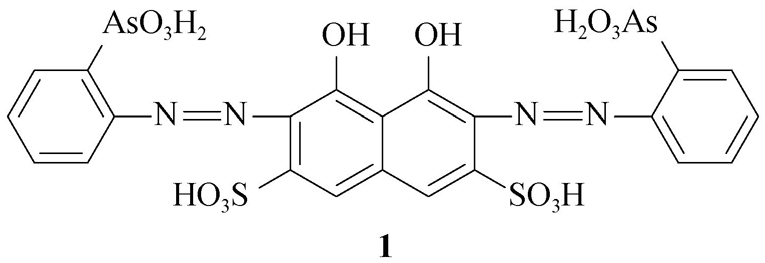
(1)偶氮(diazo)类。此类光学探针含有—N=N—基团,具有很深的颜色,每个N原子上都有一对孤对电子,可形成顺、反异构体。偶氮化合物的—N=N—双键超快的构象变化等会导致荧光猝灭,因此,该类化合物通常用作显色剂(比色探针)而不是荧光探针。例如,代表性显色剂偶氮胂Ⅲ( 1 )。
(2)多环芳烃(polycyclic aromatic)类。此类探针涉及萘、蒽、菲、芘等衍生物。因它们毒性大,故其应用受到一定限制。值得一提的是,蒽的9-位和/或10-位引入强供电子基团,可捕获单线氧形成内过氧化物,从而可发展成单线氧的光学探针。李晓花等 [18] 在蒽的9-位引入强供电子基团——四硫富瓦烯,发展了高灵敏检测单线态氧的化学发光探针 2 (图2-11)。四硫富瓦烯单元激活的蒽可快速捕获 1 O 2 并产生不稳定的内过氧化物,后者自动分解产生的化学能将蒽核激发继而通过辐射失活产生强的化学发光。四硫富瓦烯单元在这一过程中会被氧化为阳离子,不仅可以促进反应的进行,而且可以进一步增强化学发光的强度。
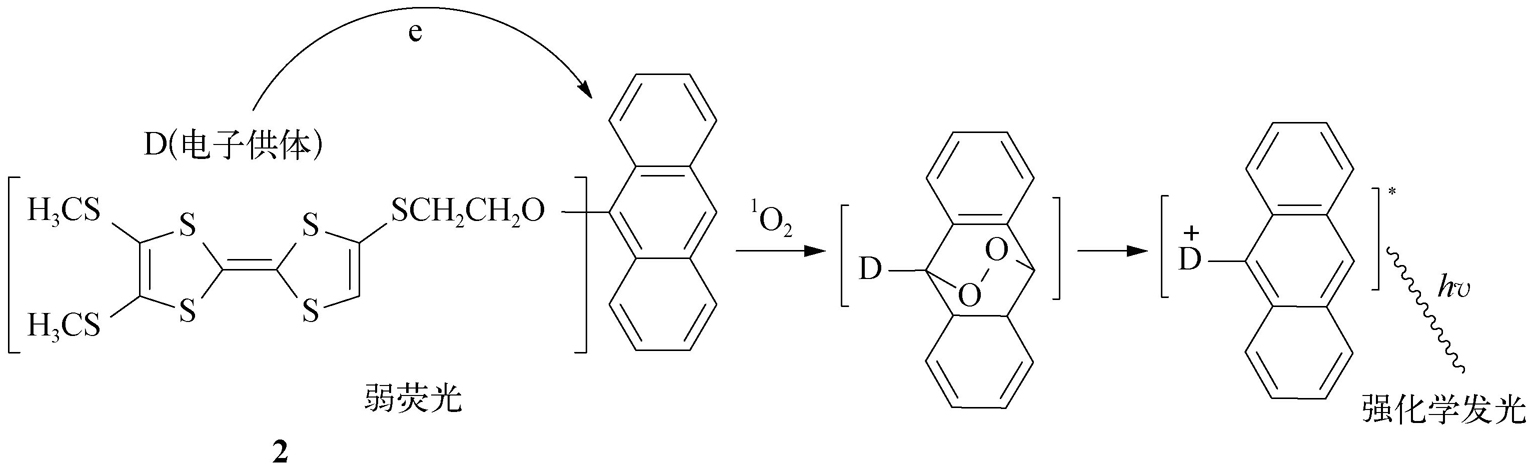
图2-11 化学发光探针 2 检测单线态氧的原理
(3)三苯甲烷(也叫三芳甲烷,triarylmethane)类。此类光学探针包括荧光酮( 3 )、二甲酚橙( 4 )、结晶紫( 5 )、荧光素( 6 )、罗丹明( 7 )等母体的多种衍生物,其光学性能优良,并广泛用于各种物质的分析。例如,荧光酮( 3 )类试剂与有机溶剂或表面活性剂配合使用,是测定一系列高价金属离子(锗、钼、钨、钛、锆、钽等)的重要显色剂;结晶紫( 5 )常用于生物组织学或革兰氏染色;荧光素( 6 )、罗丹明( 7 )的结构还是优良的荧光母体,人们以其为平台,特别是借助其母体中五元环的开、关作用,通过设置不同的识别基团,发展了一系列性能更为优越的新型光学探针。
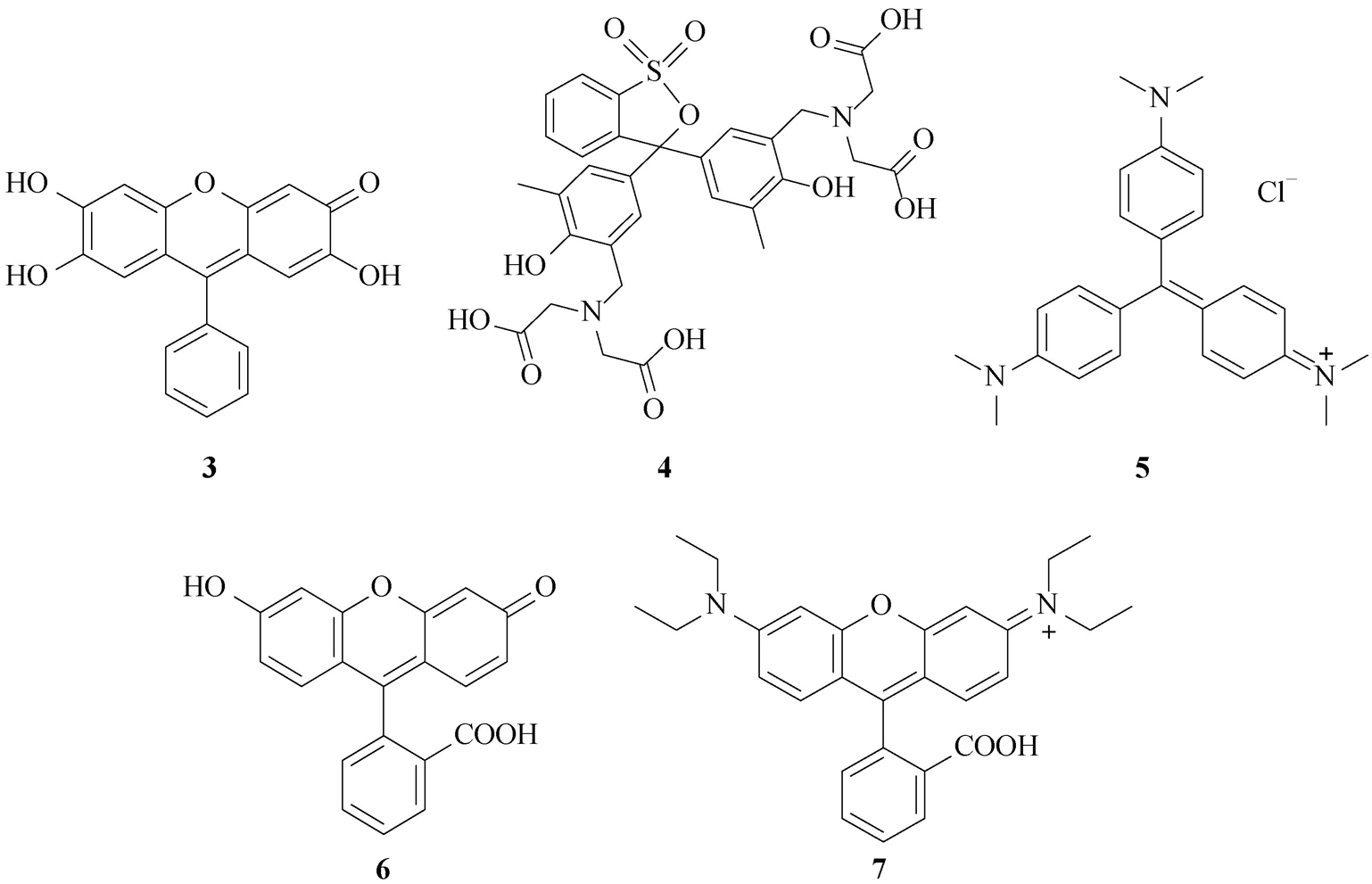
史文和马会民利用Hg 2+ 的高亲硫性,合成了光学探针罗丹明B硫内酯( 8 )(图2-12)。该探针本身没有荧光,与HgCl 2 反应后,水解成罗丹明B,实现了在水溶液中对Hg 2+ 的快速、高灵敏度检测 [19] 。另外,通过将荧光素、罗丹明结构中的氧桥置换为硅、硒桥,可获得具有近红外分析波长的光学探针。
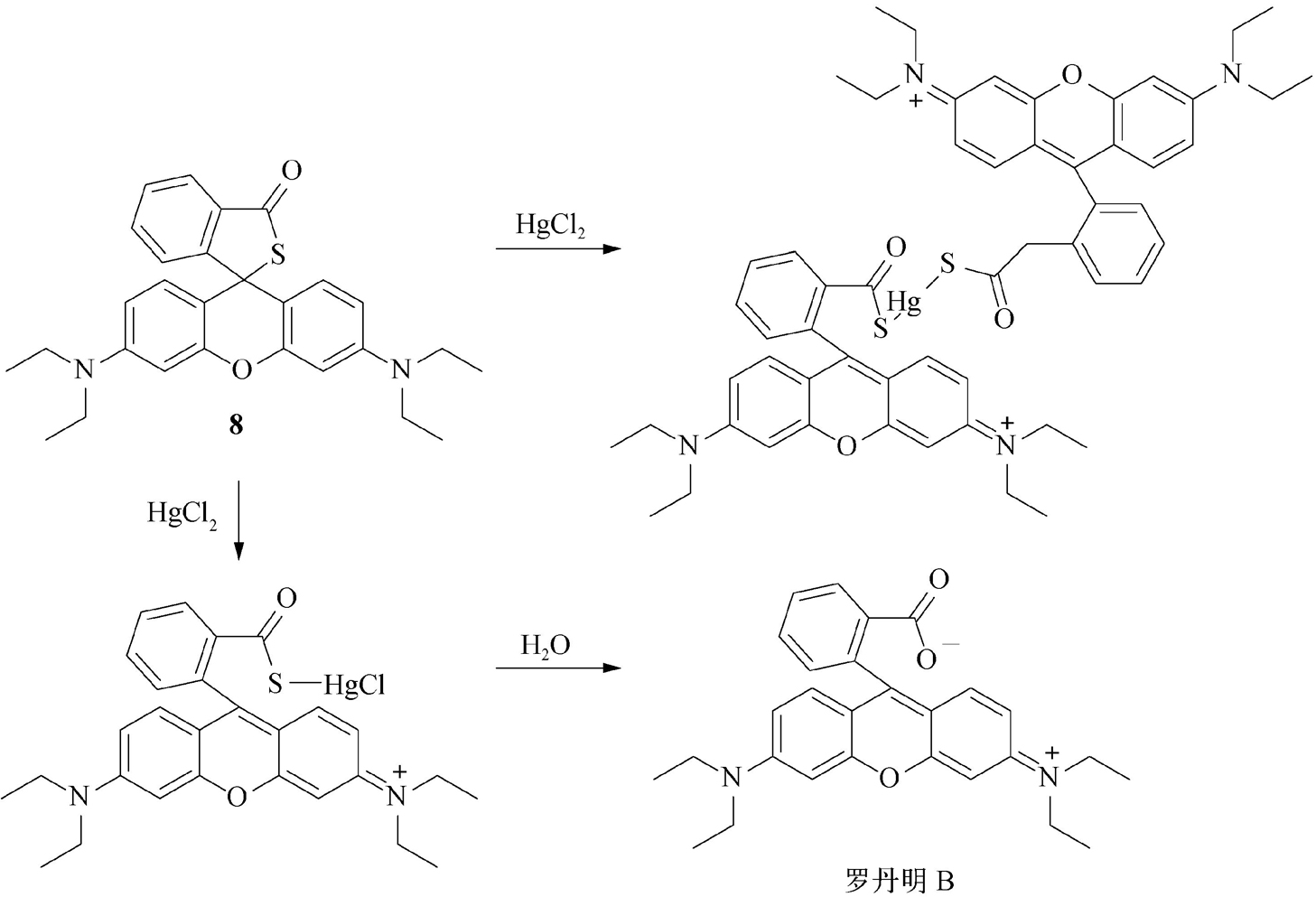
图2-12 罗丹明B硫内酯8检测汞离子的原理
(4)氧杂蒽(xanthene)类。氧杂蒽( 9 )也称呫吨,其衍生物主要包括试卤灵( 10 )、甲酚紫( 11 )等;部分三苯甲烷类探针同时也具有氧杂蒽结构的特点,如荧光素、罗丹明母体等。它们一般具有量子产率高、分析波长长、生物兼容性好等优点,是发展打开型或比率型光学探针的重要荧光母体。
以生物体内的气体信号分子一氧化氮(NO)与硫化氢(H 2 S)探针的设计与检测为例来说明。已知NO是细胞内一种活性氧物种,它主要是由一氧化氮合成酶以L-精氨酸为原料合成的。目前,检测NO的荧光探针主要有三类:第一类是以邻苯二胺为识别基团;第二类涉及过渡金属配合物;第三类则是依赖NO与硒形成Se—N键。其中,邻苯二胺类探针易受其他物种干扰,过渡金属配合物类探针则对生物体毒害性较大。马会民等 [2] 利用Se和NO的反应,提出了一种新的NO检测探针( 12 )。该探针具有罗丹明内硒酯的螺环结构,本身没有荧光。然而,探针与NO反应后,生成了一个具有Se—N键结构的中间体,再进一步水解释放出罗丹明荧光母体,导致荧光增强(图2-13)。该探针很大程度上克服了上述邻苯二胺类及过渡金属配合物类NO探针的缺点,并可应用于活细胞内NO的检测。
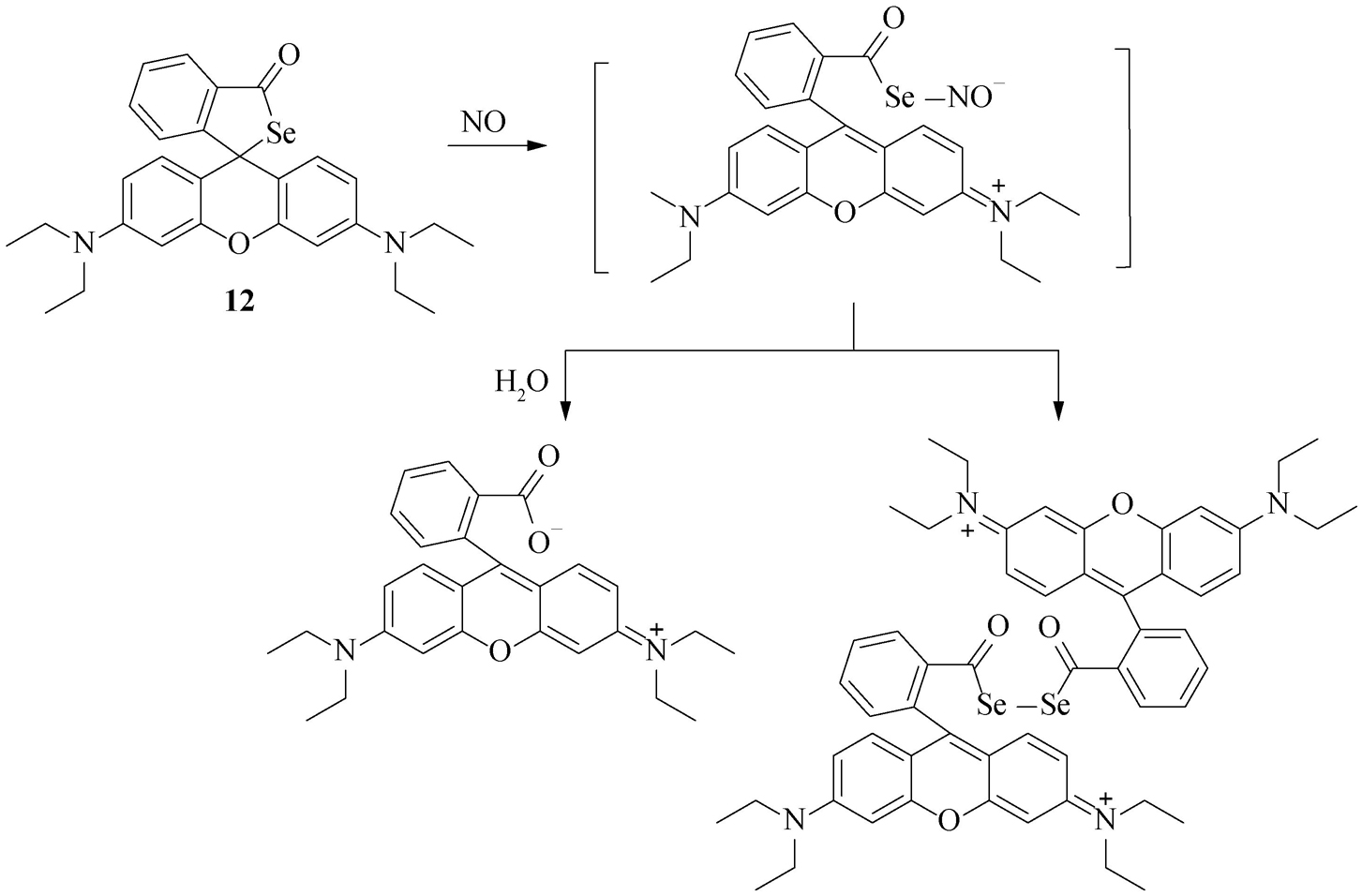
图2-13 探针 12 检测NO的原理
H 2 S是继CO、NO之后的第三类气体信号分子,在细胞内部的氧化还原反应以及与疾病相关的信号传导过程中起着重要的作用。万琼琼等 [8] 利用H 2 S对叠氮基团的还原反应,在甲酚紫荧光母体上引入叠氮基,并借助探针反应时从吸电子叠氮基到供电子胺基的转变(图2-14),提出了一种新的长波长比率型H 2 S光学探针( 13 )。该探针本身在566 nm处有强烈荧光,当与NaHS(H 2 S供体)作用时,发射波长红移至620 nm处,从而实现了H 2 S的比率荧光检测。该探针可用于细胞与斑马鱼活体的H 2 S检测。
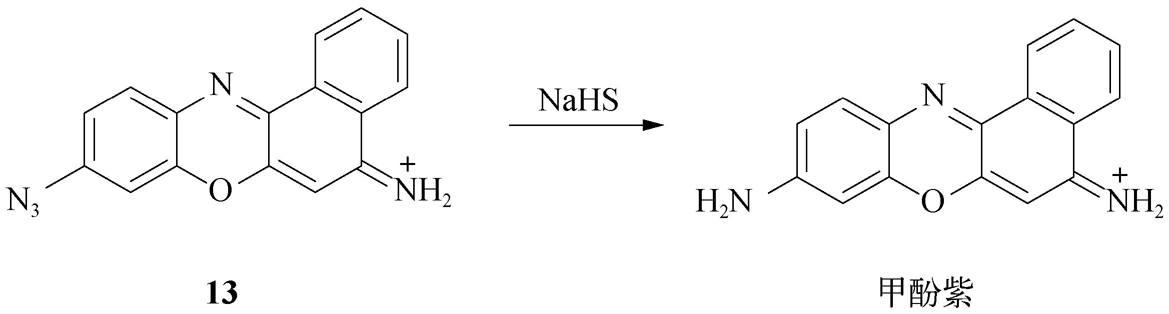
图2-14 探针 13 检测H 2 S的原理
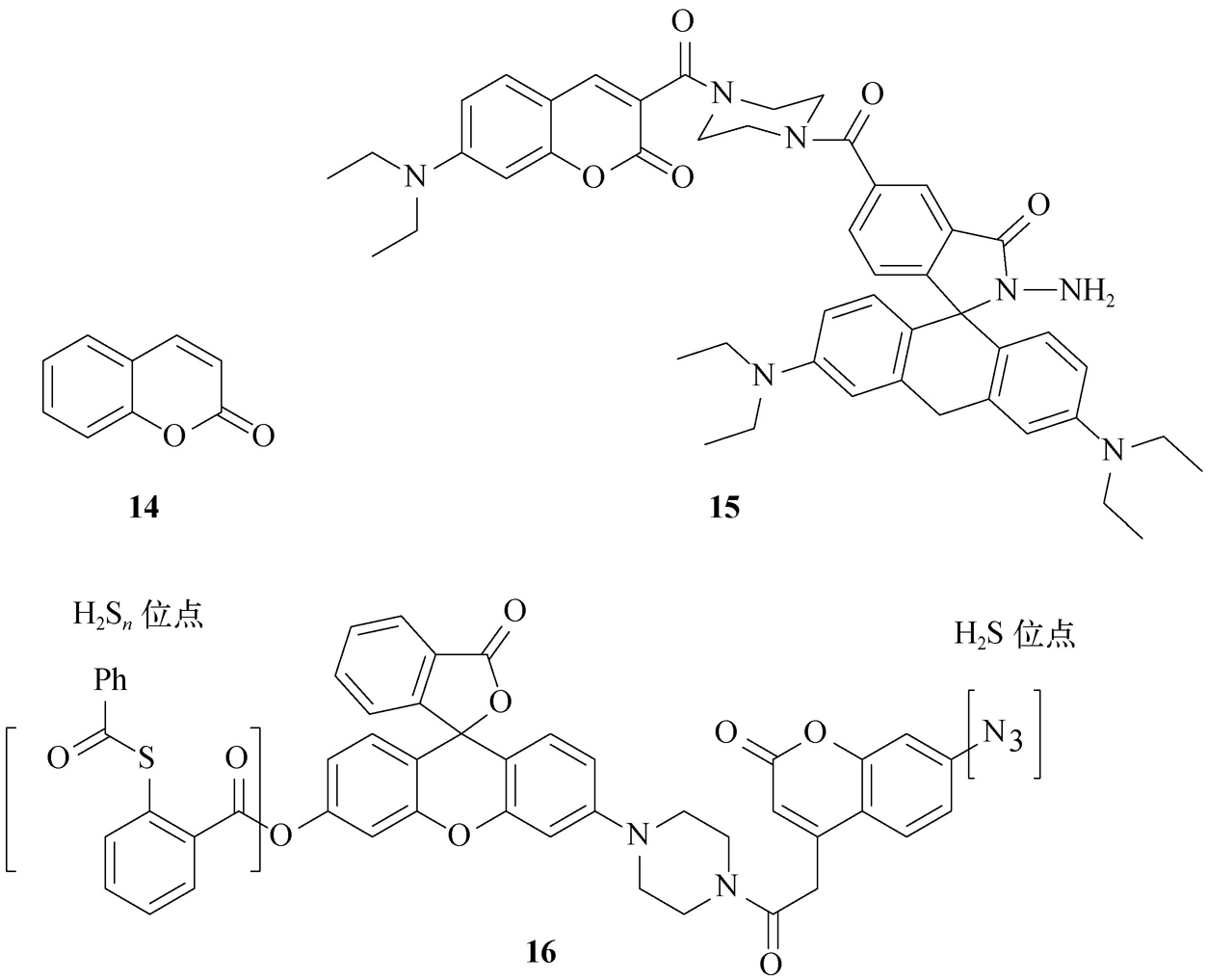
(5)香豆素类。这类光学探针具有较强的荧光和较大的斯托克斯位移,且对pH敏感,可用于pH检测。然而,在实际工作中,香豆素荧光体( 14 )由于分析波长较短( λ ex/em =360/450 nm),容易受到生物体系自发荧光的干扰,其直接应用逐渐变少,反而较常用作荧光供体发展荧光共振能量转移(fluorescence resonance energy transfer,FRET)等比率型光学探针。如用香豆素与罗丹明母体构建的探针 15 可实现Cu 2+ 的比率型荧光检测。另外,陈巍等 [20] 将香豆素与rhodol染料母体相连,并分别引入对H 2 S和H 2 S n 特异性识别基团叠氮基与苯基-2-(苯甲酰硫代)苯酸盐,构建了多功能探针 16 ,实现了用一个探针对H 2 S和H 2 S n 的检测与区分。
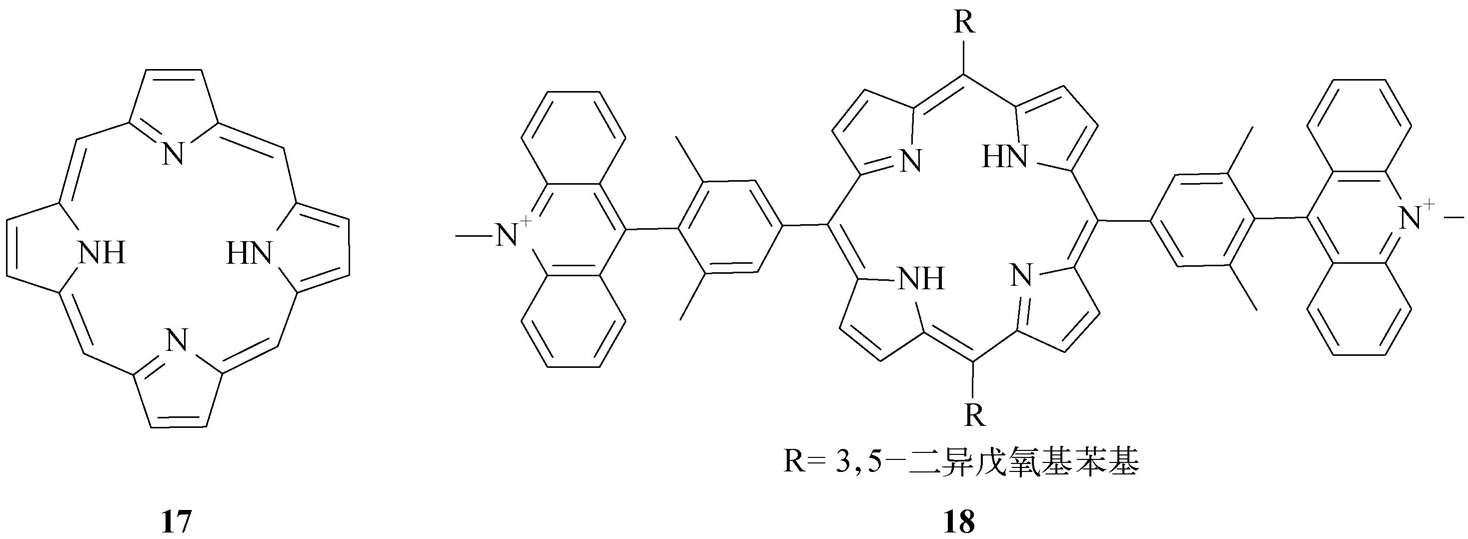
(6)卟啉类。这是一类大环化合物,其母体结构为卟吩( 17 ),周围可以连接不同取代基,并可与许多金属离子按1∶1结合形成金属卟啉,如血红蛋白的铁卟啉、叶绿素的镁卟啉、维生素B 12 的钴卟啉等。卟啉类化合物一般微溶于水,呈蓝紫色,其Soret吸收带位于400~450 nm,半峰宽窄,摩尔吸光系数很高[可达10 6 L/(mol·cm)水平],是灵敏度最高的一类显色剂,并具有强荧光,在分子识别、光传感分析中获得了广泛应用。此类化合物在不同条件下可形成一维的J型(端对端排列)和H型(面对面排列)二聚体,并引起Soret带漂移。卟啉类光学探针的缺点是其与分析物的反应速度较慢,通常需要加热或添加催化剂等。Kotani等 [21] 将两分子吖啶盐与卟啉相连合成了光学探针 18 。该探针本身荧光背景很低,几乎没有荧光,但当其与超氧阴离子(超氧化钾的18-冠醚-6)反应时,卟啉母体的荧光显著增强,因此该探针可用于超氧阴离子的传感分析。
(7)BODIPY类。BODIPY(核心骨架 19 )类光学探针具有摩尔吸光系数和荧光量子产率高、荧光半峰宽窄、光稳定性好、对溶剂极性和pH不敏感等优点,适于作荧光标记探针。在BODIPY中心骨架上引入强的吸电子基,或在3,5-位置上通过Knoevenagel缩合反应引入推电子基的芳香结构、扩大共轭体系,均可导致分析波长向长波长移动(红移,red shift)。BODIPY类光学探针的缺点是斯托克斯位移小,这一性质可用于homo-FRET(也称donor-donor FRET;常规的FRET叫hetero-FRET,即donor-acceptor FRET)研究。陈素明等 [22] 将强的猝灭基团二茂铁引入BODIPY荧光母体中,发展了一种用于高灵敏度检测痕量水的荧光探针 20 。在该探针分子中,电子从富电子基团二茂铁转移到BODIPY结构上,从而导致BODIPY的荧光猝灭;当在自然光和水存在条件下,二茂铁的结构被破坏,探针荧光打开(图2-15)。这一反应过程还伴随着显著的溶液颜色变化。其对水的检测限低至0.001%,在痕量水的快速可视化检测以及定量分析中具有重要的应用前景。
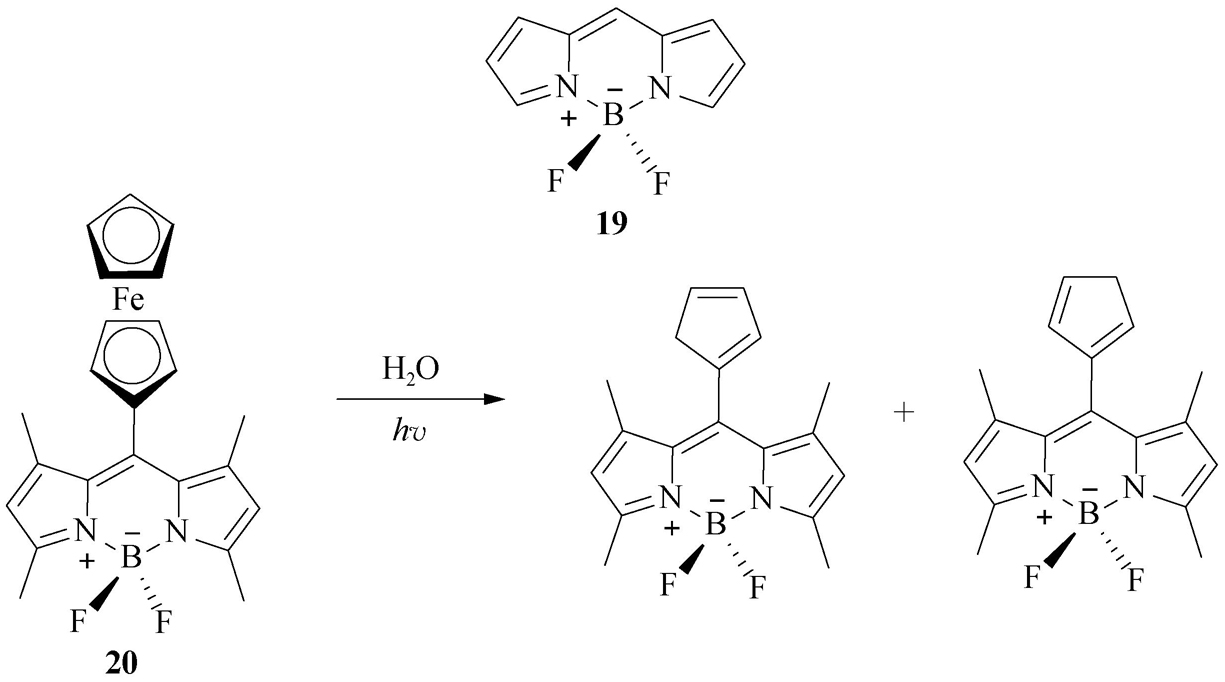
图2-15 光学探针 20 检测H 2 O的原理
(8)1,8-萘酰亚胺(1,8-naphthalimide)类。此类光学探针(核心骨架 21 )通常为吸-供电子共轭体系,其荧光性质易受取代基影响。例如,萘环上若有给电子基团,则可产生强荧光;若引入吸电子基团,则不显示荧光。萘酰亚胺4-位上含有氨基或羟基的母体,常用于发展打开型或比率型光学探针,并具有良好的稳定性、细胞与组织穿透性。该类探针的缺点是分析波长一般小于600 nm。吴晓峰等 [23] 将单胺氧化酶(monoamine oxidase,MAO)的识别基团丙胺引入1,8-萘酰亚胺的荧光母体结构中,发展了特异性检测单胺氧化酶A(MAO-A)的比率型探针 22 和 23 (图2-16)。这些探针的发射波长为454 nm;当与MAO-A相互作用时,发射波长红移至550 nm;值得注意的是,MAO-B对探针不产生响应。这些探针可用于海拉细胞与NIH-3T3细胞中MAO-A的选择性比率型荧光成像分析。
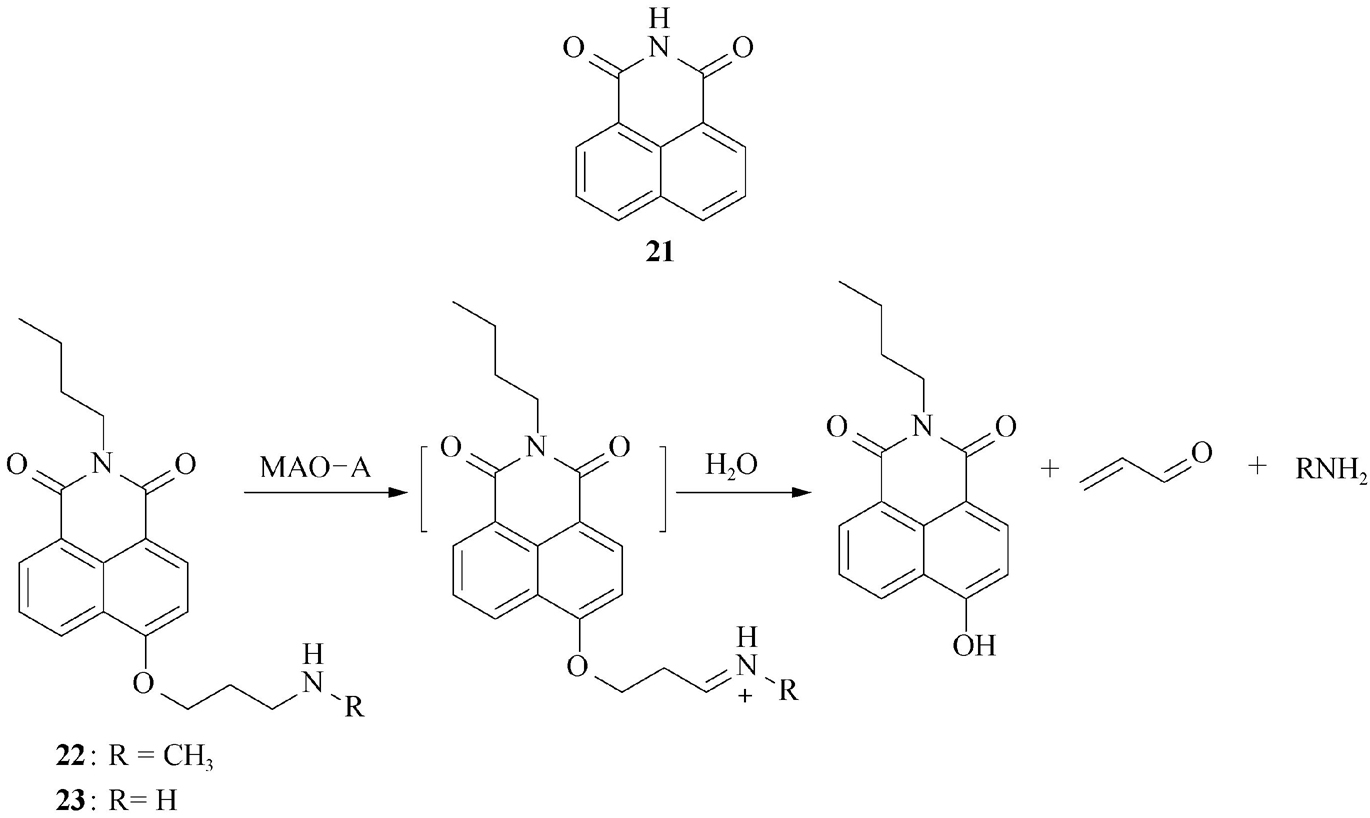
图2-16 光学探针 22 和 23 检测MAO-A的原理
(9)联吡啶(dipyridyl, 24 )及邻菲罗啉(phenanthroline, 25 )类。此类光学探针均为氮杂环化合物,是高选择性检测Fe(Ⅱ)、Cu(Ⅱ)等离子的经典显色剂,迄今仍广泛使用;其缺点是水溶性较差,通常需使用有机溶剂。近十年,这类氮杂环衍生物与一些金属离子如钌(Ⅱ)、铕(Ⅲ)等络合可构建化学发光、长寿命(毫秒级)发光探针,有力推动了时间分辨技术的发展。
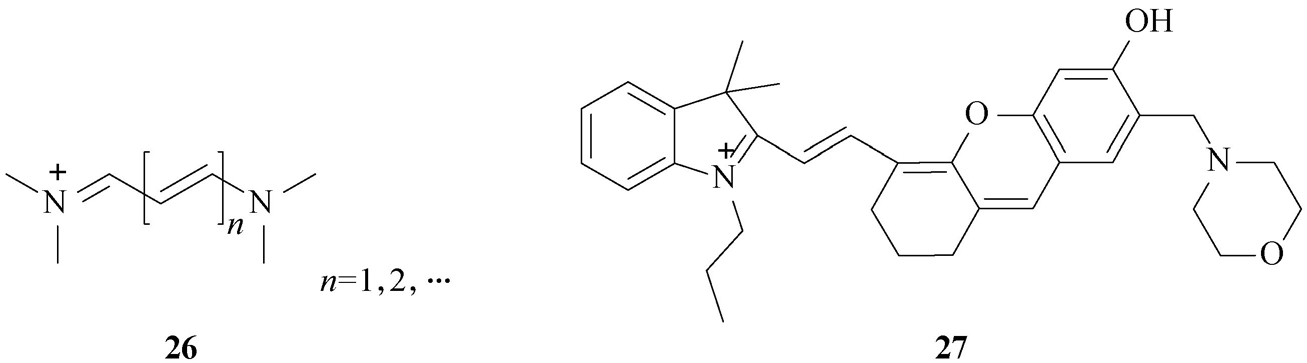
(10)花菁(cyanine;核心骨架 26 )类。此类探针是以次甲基链(—CH=CH—)连接两个氮原子所构成的共轭分子,通常带有正电荷,具有很深的颜色和高的摩尔吸光系数,是目前发展近红外光学探针最常用的荧光母体,其分析波长大多在600~800 nm。此类探针最大的缺点是稳定性差、量子产率低(约0.1水平)和易发生聚集,故其应用有时受到限制。近年,人们发现花菁的分解或降解产物半花菁表现出较高的稳定性,且仍具有近红外分析波长,因此其受到新的重视。例如,万琼琼等 [24] 将溶酶体的靶向基团吗啉引入到稳定的半花菁骨架中,发展了靶向溶酶体的近红外比率型pH探针 27 。该探针表现出良好的稳定性和溶酶体靶向能力,且对pH变化响应灵敏、迅速,已成功应用于活细胞溶酶体pH随温度变化的实时检测中,并揭示了热休克可导致溶酶体的pH升高,且该升高在短期内是不可逆的。
(11)螺吡喃(spiropyran)类。此类探针分子中的吲哚环和苯并吡喃环通过中心处的螺碳原子(sp 3 杂化)相连接( 28 ),因而两个环相互正交、构不成共轭,形成无色的闭环体;在紫外光(<400 nm)照射或金属离子等作用下,螺环处的C—O键发生异裂,继而电子排布和分子结构发生显著变化,使两个芳环单元变为平面共轭结构,形成有色的半花菁类开环体,在500~600 nm出现强的吸收峰。再在可见光、加热,或去金属离子等条件下,发生可逆闭环,又恢复为原来的结构而消色。如图2-17所示,这种可逆的结构异构化行为,使螺吡喃成为一种重要的有机光致变色化合物,并广泛用于光开关探针的设计与制备。类似的化合物还有螺硫吡喃等。

图2-17 螺吡喃衍生物可逆开-闭环反应
(12)方酸菁(squaraine)类。此类光学探针大多由方酸( 29 )衍生而来,分为对称型方酸菁和不对称型方酸菁,有很深的颜色,适于作光敏剂。它们具有独特的芳香四元环体系,是一类强荧光有机染料,光稳定性和量子产率高,分析波长主要分布在红色和近红外区域(600~700 nm),并表现出双光子吸收。其缺点是水溶性欠佳,在水环境中易聚集;引入磺酸基是最常用的改进试剂水溶性的方法。方酸菁的聚集猝灭效应,可进一步发展成功能性的荧光探针。例如,Grande等 [25] 发展了聚集双亲类的方酸菁类荧光探针( 30 ),探针聚集后没有荧光,在与G-四面体作用时,形成三明治结构,荧光打开,该探针可用于高灵敏度鉴定G-四面体复合物。Sreejith等 [26] 也报道了一种π键衍生的方酸菁类探针 31 (图2-18),该探针在800 nm处有发射峰,但脂肪链的硫醇引入可导致800 nm的发射峰逐渐减弱,并伴随在595 nm处出现新峰,据此建立了检测血样中的小分子氨基硫醇类物质(如半胱氨酸与高半胱氨酸)的方法。
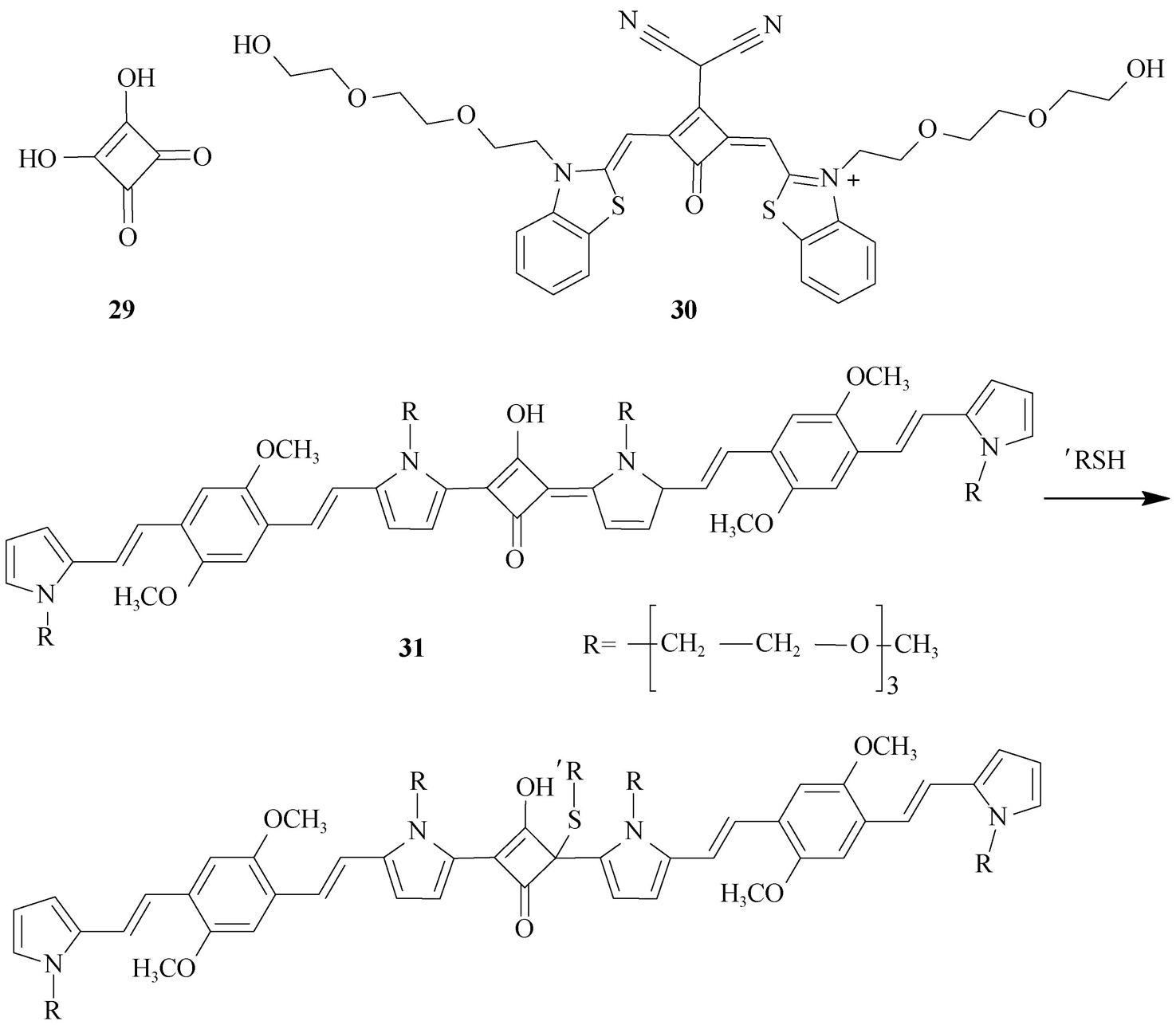
图2-18 光学探针 31 检测硫醇的原理
常见的大分子光学探针有水溶性高分子显色剂/荧光试剂、荧光共轭聚合物、核酸荧光探针、荧光蛋白等 [27] 。
(1)水溶性高分子显色剂/荧光试剂(water-soluble polymeric chromogenic reagent/fluorescence reagent)。此类光学探针最早于1989年由中国科学院化学研究所梁树权实验室提出。其设计思想是 [2] ,将光学基团赋予水溶性高分子,并利用高分子链的增效作用,使所制得的试剂兼具显色和增效等多种功能。据此,将不同的光学基团分别与主链非共轭的聚乙烯醇、聚2-丙烯胺、壳聚糖等进行连接,制得了相应的高分子光学探针,并用于铝、镁、铟、铜、铁、氢离子的测定,获得了比相应小分子更好的效果。
(2)荧光共轭聚合物(fluorescent conjugated polymers)。此类探针主要是指主链为共轭结构并具有荧光性质的高分子化合物,目前已用于各种蛋白酶和DNA的检测。
上述两类高分子光学探针的缺点是提纯、表征较为困难,且久置易变质。
(3)核酸荧光探针。该类探针包括分子信标、核酸适配体等。分子信标是由20~30个碱基组成并具有发夹结构的单链DNA分子,由于分子内氢键的作用,标记在两端的荧光基团和猝灭基团相互靠近,并通过FRET等作用导致荧光猝灭。当存在目标链时,分子内氢键被破坏,形成更稳定的双链结构,荧光基团与猝灭基团分开,导致荧光信号变化。这种探针广泛应用于目标核酸链的检测、细胞原位成像以及实时荧光聚合酶链式反应(polymerase chain reaction,PCR)。近年来发展的链置换检测方法也是通过核酸的杂交来诱导荧光信号变化。末端分别标记荧光基团和猝灭基团的两条单链DNA杂交在一起,其中一条DNA略长出几个碱基。待测目标核酸链首先与该突出序列部分相结合,在反应动力学和热力学的共同作用下,逐渐将标有猝灭基团的单链取代,从而导致荧光基团的分离,产生荧光信号的变化。
核酸适配体(aptamer)是利用体外筛选技术(systematic evolution of ligands by exponential enrichment,SELEX)从随机寡核苷酸文库中筛选获得的对目标物质具有高特异性与亲和力的一段寡核苷酸片段。核酸适配体在识别其目标物的过程中,常有构象变化发生,可以用FRET来表征,从而可开发针对这些目标物的荧光探针。
DNA作为多种核酸酶的底物,在核酸酶的作用下磷酸二酯键会发生断裂。核酸链断裂能导致标记在核酸上的荧光基团与猝灭基团发生分离,从而产生光信号变化。这类探针已经用于多种核酸酶活性的检测和抑制剂的筛选,包括聚合酶、单链结合蛋白、连接酶、多聚核苷酸激酶、限制性内切酶等 [28] 。将探针与切割酶等联用,还可建立信号放大体系,提高DNA检测的灵敏度。为了避免非目标核酸酶水解探针造成假阳性信号,可对核酸链中酶作用位点以外的辅助区域进行化学修饰保护,例如将磷酸骨架进行硫磷酰化等。赵美萍等 [29] 开发了对脱碱基核酸内切酶APE1特异性响应的核酸荧光探针(图2-19)。该探针为含脱碱基位点的发夹结构,在空位3′侧的第四个碱基上标记荧光基团,5′侧的第五个碱基上标记猝灭基团,荧光基团和猝灭基团之间发生共振能量转移,荧光保持猝灭状态。当探针遇到目标酶APE1时,APE1切割空位5′侧的磷酸二酯键,荧光基团与猝灭基团分离,荧光得到恢复。由于空位5′侧的四个碱基对和3′侧的三个碱基对是APE1识别的主要底物区域,在该区域设计了一个由连续两错配及一个空位形成的特殊内环结构,对APE1响应灵敏,且能有效抑制DNase Ⅰ的非特异性作用。此外,还对探针其他部分的磷酸骨架进行了硫磷酰化保护,防止核酸外切酶和非特异性内切酶水解产生假阳性信号。探针末端设计为散口式,有利于酶切后带有荧光基团的小片段与底物迅速分离产生荧光信号。该探针对APE1有很好的选择性,线性范围为6 pg/mL~1.2 ng/mL,最低检测限为3 pg/mL,可以直接对血清和其他生物样品中的APE1进行定量检测。相比其他检测核酸酶的方法,这类功能特异性荧光探针有诸多优势,如快速简单、灵敏度高、特异性强、污染小、可以连续实时监测等。
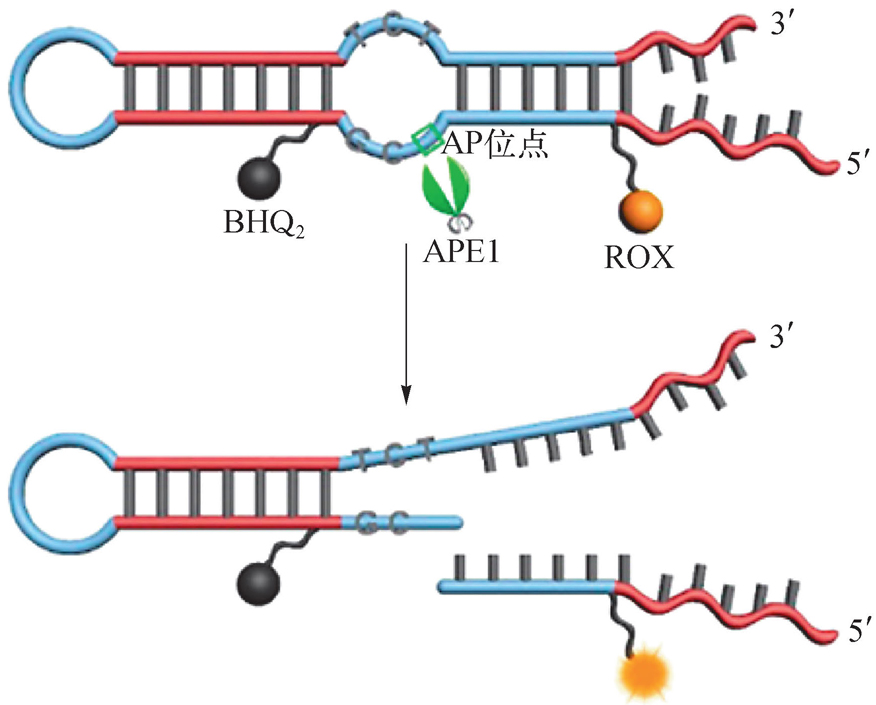
图2-19 对APE1特异性响应的核酸荧光探针 [29]
核酸荧光探针在检测基因突变方面也发挥了重要的作用。赵美萍等 [30] 在研究 λ -核酸外切酶与不同双链DNA的相互作用时,发现了一种新的疏水作用介导的结合模型。利用这一结合模式下 λ -核酸外切酶对底物5′末端结构变化的敏感响应性质,他们设计了一种将FAM荧光基团标记在5′末端、猝灭基团标记在3′末端、同时将5′末端紧邻的两个碱基设计成与目标基因片段错配而其他碱基与待测突变链完全匹配的单链荧光探针。该探针可以与突变链结合,并被 λ -核酸外切酶水解释放出荧光信号,同时启动信号放大反应,从而达到很高的灵敏度。而探针与野生链的杂交产物中由于存在错配,几乎不被 λ -核酸外切酶水解,背景信号很低。该探针对突变链的最低检测限可达0.02%,成功实现了肿瘤患者血清中EGFR L858R、EGFR 19del、EGFR T790M、EGFR G719S、KRAS G13D等突变的定量检测。该方法简单、易行,测试成本低于二代测序和液滴数字PCR等,在高通量临床检测方面有重要的应用价值。
(4)荧光蛋白(fluorescent protein)。最早出现的是绿色荧光蛋白(green fluorescent protein,GFP),它是由日本的下村修(Osamu Shimomura)等在1962年从水母中发现的,后来,马丁·查尔菲(Martin Charfie)、钱永健(Roger Y. Tsien)等也先后对绿色荧光蛋白进行研究与改造,三人一同获得了2008年诺贝尔化学奖。GFP是由238个氨基酸组成的单体蛋白质,分子量约为27kD。在氧气存在下,GFP分子内的三肽Ser65-Tyr66-Gly67经过自身催化环化、氧化,形成了对羟基苯亚甲基咪唑环酮生色团而发光,且荧光稳定、抗光漂白能力强。然而,GFP的分析波长小于500 nm,对生物体的穿透性能力有限。对此,俄罗斯科学家Chudakov等研制出了穿透性强的深红色荧光蛋白,显著提高了活体、组织成像的质量 [31] 。在普通的实验室中,如何通过活细胞等方便地表达出性能优良的荧光蛋白,仍是该类探针获得更广泛应用的瓶颈问题。
纳米光学探针种类多样,包括金属纳米簇、半导体量子点、碳纳米管和碳量子点(包括石墨烯量子点)、荧光纳米颗粒、稀土(上转换)以及导电高分子等。
金属纳米簇一般由几个到几百个金属原子组成,是一种新型的纳米发光材料。其粒径通常小于5 nm,尺寸接近电子费米波长,具有离散的电子状态并表现出出色的分子特性,包括强的自由电子量子限域效应和尺寸依赖性荧光。金属纳米簇具有光致发光的特性,主要来源于配体-金属的电荷转移和配体-金属-金属电荷转移。金属纳米簇的双光子激发特性在光学探针领域具有发展潜力,金属纳米颗粒优良的局域表面等离子体共振(localized surface plasmon resonace,LSPR),作为比色与光散射探针得到了广泛应用。金属纳米材料具有高散射效率,例如粒径为60 nm的金纳米颗粒与2.7×10 5 个荧光素分子发光的能力相当 [32] 。当金纳米颗粒的粒径大于40 nm时,使用配有卤钨灯光源的普通暗场显微镜就可以实现单颗粒水平的成像,并且能获得多维度的信息。自van Duyne创立了单颗粒暗场散射光谱的理论与方法以来 [33] ,基于LSPR特性的单颗粒金属纳米暗场散射成像研究得到了快速发展,其分析应用也得到了长足的进步,并出现了基于单颗粒金属纳米暗场散射成像计数的分析方法。例如,李娜等 [34-36] 对不同形貌的金纳米颗粒暗场计数的可行性进行了初步研究,建立了一系列基于暗场散射成像单颗粒金纳米计数的核酸与蛋白质检测方法,无须目标物或信号放大即可实现对目标物高灵敏度、高选择性的检测。
荧光纳米颗粒、碳纳米管和碳量子点的特点是信号稳定、发光效率高、生物相容性好、制备成本低,在生物传感以及成像分析中均得到了广泛应用。荧光纳/微米颗粒表面或内部可标记或封装数千个有机荧光小分子,与单个荧光分子相比,荧光纳/微米颗粒具有非常高的成像亮度,甚适于荧光显微成像计数。另外荧光纳/微米颗粒具有丰富的编码元素,为多目标物的高灵敏度同时测定提供了基础。基于荧光纳/微米颗粒发展的悬浮阵列技术,是20世纪90年代中期以来影响最深远的生物分子高通量多目标物检测技术 [37] ,广泛应用于基因检测、细胞因子检测、蛋白质分析以及药物开发、临床诊断、疾病筛查等研究。单颗粒计数方法克服了编码探针发光强度不同产生的信号偏差,在多目标物的同时检测中具有方法学和灵敏度优势。李娜等 [38,39] 开展了基于荧光纳米颗粒的荧光显微成像计数方法的探索,构建了基于发光颜色编码的多目标物定量方法,并实现了高灵敏的多目标单链DNA、多目标微RNA(miRNA)以及低丰度单碱基突变检测。这些研究表明纳米单颗粒显微成像计数方法在高灵敏度、多目标物检测方面具有发展潜力。
量子点的特点是尺寸较小,且其尺寸和荧光发射波长在300~2400 nm内可调,可实现一元激发、多元发射,光化学稳定性好。然而,高毒性是量子点探针在生物体内应用的致命缺点。含有稀土元素的上转换发光纳米材料是一种在近红外光激发下能发出可见光的特殊材料,可通过多光子机制把长波辐射转换成短波辐射。这种近红外激发具有较强的组织穿透能力、对生物组织损伤小、背景荧光的干扰低,在生物与医学成像上有重要的应用前景。
与有机光学探针相比,纳米光学探针的优点主要是化学与光稳定性高、波长范围可调性强,尤其是较容易制备出具有近红外Ⅱ区特性的纳米光学探针,因此,纳米光学探针受到人们的广泛关注;其缺点是信号重复性较差(主要由尺寸、表面修饰/性质、或在样品如细胞中分布的非均一性等问题所致),且不适于尺寸较小的亚细胞器研究。