




真实世界证据(RWE)目前还没有公认的定义。2016年12月,美国国会通过了《21世纪治疗法案》( 21st Century Cures Act )。在该法案中,“真实世界证据”被明确定义为:“从随机对照试验以外的其他来源获取的关于用药方式、药物潜在获益或者安全性方面的数据。”之后,美国食品药品监督管理局(Food and Drug Administration,FDA)专家在《新英格兰医学杂志》上发表题为“真实世界证据——它是什么以及它能告诉我们什么”的文章,指出真实世界证据与经典临床试验等其他科学证据的区别不在于是否有提前计划的干预措施以及是否采用随机,而在于数据的来源,包括产生数据的总体以及获取数据的方法,并对“真实世界证据”的数据来源给出了具体的说明,指出真实世界数据是“指来自经典临床试验以外的其他类型的医疗保健信息,包括电子健康档案、医疗保险理赔与账单、药品与疾病的登记单,以及从个人医疗器械与保健活动中收集来的数据”。根据FDA的定义,这些“真实世界数据”的来源与“真实世界证据”的来源是完全一致的。但是,不能把真实世界数据直接等同于“真实世界证据”。对于两者间的关系,FDA的界定为:“真实世界证据是通过汇集和分析真实世界数据内容而得到的。”也就是说,首先是通过“真实世界研究”以获得“真实世界数据”,然后再通过对“真实世界数据”的分析来提炼出真实世界证据。真实世界研究是从真实世界数据(RWD)获得真实世界证据(RWE)的桥梁。三者的关系如图2-2所示。
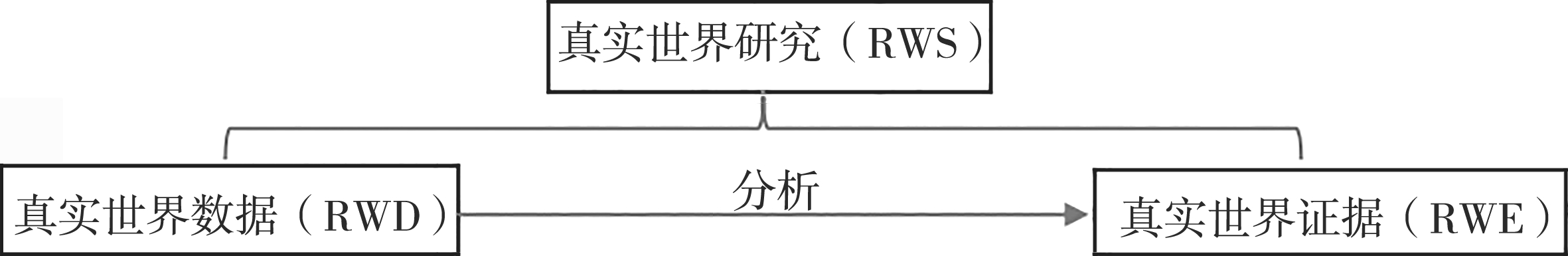
图2-2 真实世界研究、真实世界数据和真实世界证据三者之间的关系
目前,对于真实世界证据的认识存在以下几个误区:
1.真实世界证据是与经典临床试验证据相对立的
FDA专家发表在《新英格兰医学杂志》上的文章指出,“真实世界证据”与临床试验证据的根本区别在于获取数据的来源不一样:前者源于实际医疗场地或家庭、社区等真实场景,而后者则来自严格受控的科研环境。为了避免对这个概念的误读,美国FDA专家特别强调,“两者间的区别不应该建立在是否存在有计划地干预试验以及是否采用了随机化试验设计这两种情况之上”。也就是说,“真实世界证据”仍然可以涉及干预试验和随机化试验设计。随机化设计可以用来平衡不同试验组之间潜在的风险,以降低试验偏倚,这在真实世界研究中有同样重要的作用。
比如2016年开展的阿司匹林心血管获益研究(ADAPTABLE),该研究为以患者为中心的试验,评价了两种阿司匹林剂量的临床获益和长期有效性。这项实用性RCT比较了两种常用的阿司匹林剂量,81mg和325mg,随机将有心肌梗死或已知动脉粥样硬化心血管疾病史的20,000名患者分为两种剂量之一。试验使用电子算法从国家以基于患者的临床研究网络(National Patient-Centered Clinical Research Network,PCornet)健康系统合作伙伴中识别潜在参与者,使用EHRs和索赔数据获得主要终点,如死亡、非致命心肌梗死或非致命中风的住院治疗,以及次要终点,如冠状动脉血管重建手术、严重出血的住院治疗和其他患者报告结局。该研究属于采用随机化设计进行干预性试验的“真实世界研究”。
有时,在“真实世界研究”中,干预性研究和观察性研究还可以共存于同一个试验。例如,1954年的脊髓灰质炎疫苗Salk现场试验,该试验将75万名患者随机分配接受疫苗或安慰剂,另外,研究还包含了100万接受了疫苗的患者作为非随机的“观察组”。
由此可见,RWS不能简单地视为仅仅只有非干预性研究一种类型,而是涉及干预性研究和观察性研究两种类型。多数情况下RWS是观察性研究,但在某些情况下是干预性研究,有时甚至是干预性和观察性研究同时存在于一个试验中。相反,经典临床试验只有单一的基于随机对照设计的干预性研究。真实世界证据与经典临床试验证据并不是相对立的关系,也不会取代经典的临床试验证据在药物评审中的地位,而是提供一种新的补充证据。在《21世纪治疗法案》中,明确规定了“真实世界证据”在药物评审中的两个用途:①用来支持已获批的药物进行扩大其适应证的批准。②用来支持或满足已获批的临床试验的相关需求。因此,FDA并没有要把“真实世界证据”定为评估药物和医疗器械的单一标准的意思,而是视之为临床试验证据之外的补充证据。两者的关系见图2-3。
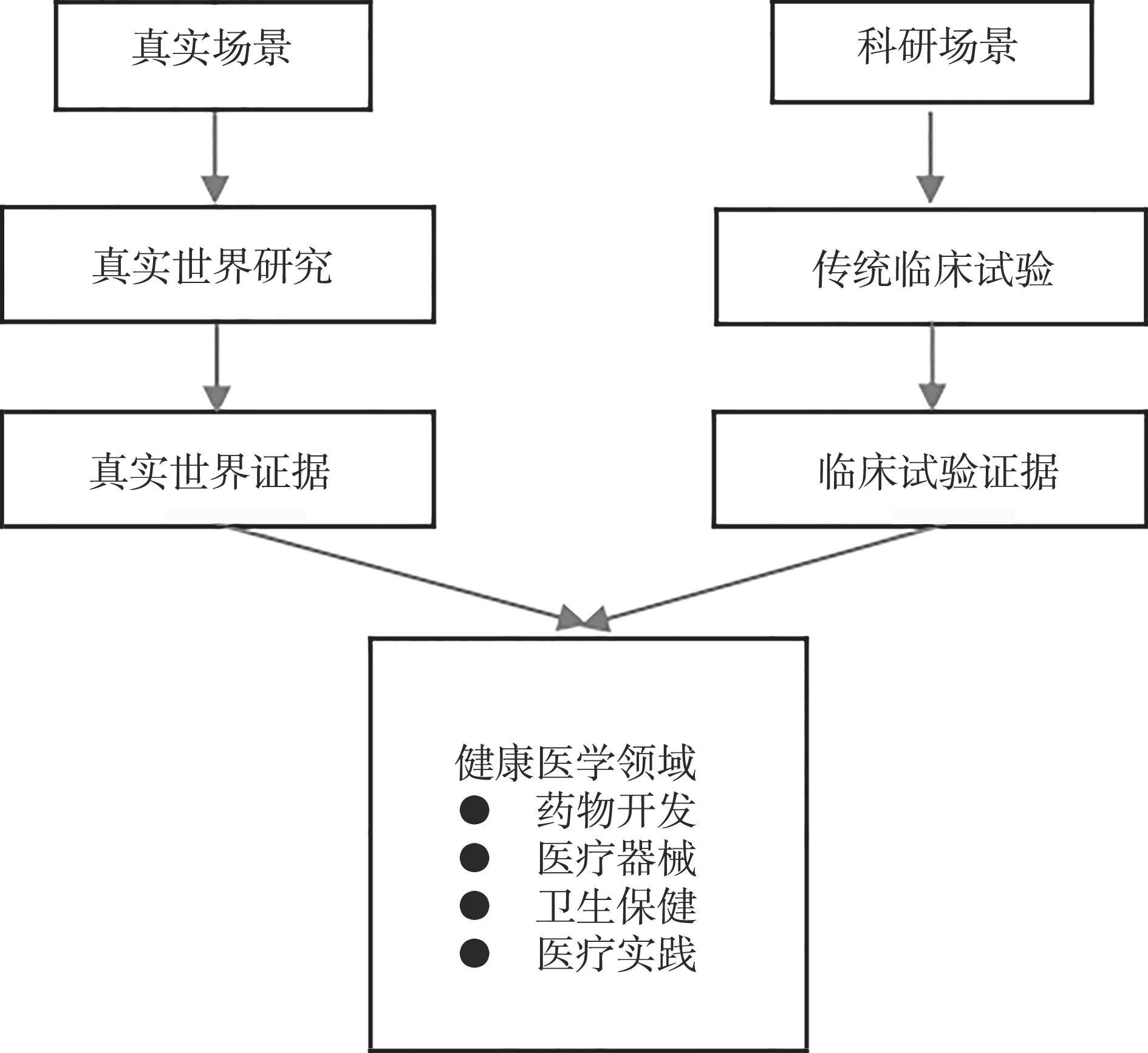
图2-3 真实世界证据与临床试验证据的关系
2.真实世界证据属于低级别研究证据
很多人认为,真实世界缺少严格的方法学控制,研究中存在不可预测或无法控制的混杂因素,研究结果存在较大偏倚,由此认为真实世界证据的可信度弱于RCT研究产生的证据。实际上,这种理解是片面的,RWE与RCT证据是相互补充的关系,两者在“证据等级”中处于平等地位。
研究问题决定研究设计。没有任何一种研究设计可以解决所有研究问题,因此也就不存在任何一种研究设计绝对优于其他设计。针对同一个研究问题,可选用不同的研究设计来回答。决策者和研究者需要判断的是,这些不同设计的优缺点,及其可能获得的证据是否能充分回答研究问题本身。也就是说,最佳证据的判断首先要区分临床研究问题,针对不同研究问题,最佳证据来源可有不同。
例如,对于药物疗效的评价,既可以选择真实世界研究,也可以选择经典临床试验,但是两者的目的存在显著差异。RWS评价的是药物在真实条件下的实际结果,RCT评价的是药物本身是否存在生物学作用(治疗效能)。若研究问题是评价该高血压药物本身是否能起到降压作用(治疗效能),RCT显然是最佳证据。但若研究问题关注该药物在临床上对复杂患者(如合并糖尿病、CKD、COPD)的实际效果,RWS则是最好的研究设计。在RWS中,基于数据库的队列设计和实效性试验都是可以选择的方式,但是,由于实效性随机对照试验能更好解决选择性偏倚的问题,因此证据说服力更强。