




1.了解浓度、温度及催化剂对化学反应速率的影响。
2.测定过二硫酸铵与碘化钾反应时的速率。
3.学会计算反应级数、反应速率常数及反应的活化能。
在水溶液中过二硫酸铵和碘化钾发生如下反应:

其反应速率方程可表示为:

式中,v为反应速率;k为速率常数;C(
 )、C(I
-
)为即时浓度;m与n之和称为反应级数。
)、C(I
-
)为即时浓度;m与n之和称为反应级数。
通过实验能测定在单位时间内反应的平均速率
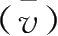 ,如果在一定时间Δt内
,如果在一定时间Δt内
 的浓度变化为ΔC(
的浓度变化为ΔC(
 ),则平均速率可表示为:
),则平均速率可表示为:

当Δt→0时,可用平均速率代替瞬时速率。即:

为了测定在一定时间Δt内
 的浓度变化值,在将(NH
4
)
2
S
2
O
8
和KI混合的同时,加入定量的Na
2
S
2
O
3
溶液和淀粉指示剂,这样在反应(4-1)进行的同时,体系中还进行着如下反应:
的浓度变化值,在将(NH
4
)
2
S
2
O
8
和KI混合的同时,加入定量的Na
2
S
2
O
3
溶液和淀粉指示剂,这样在反应(4-1)进行的同时,体系中还进行着如下反应:

反应(4-2)进行得非常快,瞬间即可完成,而反应(4-1)比反应(4-2)慢得多,由反应(4-1)生成的
 立即与
立即与
 反应,生成无色的
反应,生成无色的
 和I
-
。因此,在反应刚开始的一段时间内看不到
和I
-
。因此,在反应刚开始的一段时间内看不到
 与淀粉相遇所呈现的特有蓝色。一旦Na
2
S
2
O
3
耗尽,反应(4-1)继续生成的
与淀粉相遇所呈现的特有蓝色。一旦Na
2
S
2
O
3
耗尽,反应(4-1)继续生成的
 很快与淀粉作用而显现蓝色。
很快与淀粉作用而显现蓝色。
从反应(4-1)和(4-2)可以看出,ΔC(
 )等于ΔC(
)等于ΔC(
 )的1/2。
)的1/2。
在本实验中,每份混合液中Na
2
S
2
O
3
的起始浓度都相同。由于溶液呈现蓝色标志着
 全部耗尽,故从Na
2
S
2
O
3
的起始浓度可求出ΔC(
全部耗尽,故从Na
2
S
2
O
3
的起始浓度可求出ΔC(
 ),进而可计算ΔC(
),进而可计算ΔC(
 )和反应的平均速率。
)和反应的平均速率。
对反应速率方程两边取对数得:

当控制C(I
-
)不变时,以lgv对lgC(
 )作图,可得一直线,斜率为m。同理,当C(
)作图,可得一直线,斜率为m。同理,当C(
 不变时,以lgv对lgC(I
-
)作图,可求出n。
不变时,以lgv对lgC(I
-
)作图,可求出n。
求出m和n后,可用一组
 、C(I
-
)和v数据代入速率方程求得反应速率常数k。
、C(I
-
)和v数据代入速率方程求得反应速率常数k。
根据阿伦尼乌斯公式,反应速率常数k与反应温度T之间有以下关系:

式中,E a 为反应的活化能,kJ·mol -1 ;R为摩尔气体常数,R=8.314J·K -1 mol -1 ;T为热力学温度;A为常数项。
测出不同温度时的k值,以lgk对1/T作图,可得一直线,由直线斜率
 可求得反应的活化能Ea。
可求得反应的活化能Ea。
1.器材:100mL烧杯,大试管,量筒,电热恒温水浴槽,秒表,温度计。
2.试剂:(NH 4 ) 2 S 2 O 8 (0.2 mol·L -1 ,新配制),KI(0.2 mol·L -1 ),KNO 3 (0.2 mol·L -1 ),Na 2 S 2 O 3 (0.05 mol·L -1 ),(NH 4 ) 2 SO 4 (0.2 mol·L -1 ),Cu(NO 3 ) 2 (0.02 mol·L -1 ),淀粉溶液(0.2%)。
在室温下,用量筒准确量取表4-1所列用量的各试剂,除(NH 4 ) 2 S 2 O 8 溶液外,其余各试剂均可按用量混合在对应编号的烧杯中,当加入(NH 4 ) 2 S 2 O 8 溶液时,立即计时,将溶液混合均匀,待溶液变为蓝色时,停止计时,记录时间Δt及室内温度。
表4-1 浓度对化学速率的影响 室温:___℃

续表

按表4-1中实验1的试剂用量分别在高于室温5℃、10℃和15℃的温度下继续进行实验。将测得的各温度下的反应时间、计算得出的各温度下的反应速率及速率常数记录于表4-2。
表4-2 温度对化学反应速率的影响

根据表4-2中的数据,以lgk对1/T作图,求出直线的斜率,进而求出反应(4-1)的活化能。
在室温下,按表4-1中实验1的试剂用量,再分别加入1滴、5滴、10滴Cu(NO 3 ) 2 溶液,不足10滴的实验迅速用(NH 4 ) 2 S 2 O 8 溶液补充至10滴,搅拌,计时,把此时实验的反应速率与表4-1中实验1的反应速率比较。
表4-3 催化剂对反应速率的影响

1.实验中为什么可以由反应溶液出现蓝色的时间长短来计算反应速率?反应溶液岀现蓝色后,反应是否就终止了?
2.试分析本实验中Na 2 S 2 O 3 的用量过多或过少,对实验结果有什么影响?

●配套课件

续表
