





|
2.2 磷酸和磷肥 |

|
磷酸盐是磷在土壤中存在的主要形式。磷酸是生产磷酸铵、重过磷酸钙及其他复合肥料的中间产品,也是多种磷酸盐的中间产品。因此,本节首先讨论磷酸,然后再讨论磷肥。
 2.2.1 磷酸
2.2.1 磷酸
生产磷酸的方法分为湿法磷酸和热法磷酸。从广义上说用酸分解磷矿制磷酸的方法称为湿法磷酸。生产中所用的酸是酸性较强的无机酸,如硫酸、硝酸、盐酸、氟硅酸等。磷元素通过氧化、水化而制成磷酸的方法称为热法磷酸。这里主要介绍湿法磷酸的原理与工艺。
2.2.1.1 湿法磷酸生产的基本原理
磷酸通常指正磷酸(Phosphoric Acid),分子式H 3 PO 4 ,分子量为 97.995。
1)湿法磷酸生产的主要化学反应
磷矿的结构与成分非常复杂,并随产地不同而异。通常,用硫酸分解磷矿的化学反应可以下述一步或两步完成的反应来描述。一步完成的反应为:
Ca 5 F(PO 4 ) 3 + n H 3 PO 4 +5H 2 SO 4 ═( n +3)H 3 PO 4 +5CaSO 4 ·H 2 O+HF
两步完成的反应为:
Ca 5 F(PO 4 ) 3 + n H 3 PO 4 ═( n -7)H 3 PO 4 +5Ca(H 2 PO 4 ) 2 +HF
5Ca(H 2 PO 4 ) 2 +5H 2 SO 4 ═10H 3 PO 4 +5CaSO 4 ·H 2 O
由于磷酸一钙对磷酸离解有缓冲作用,第一步反应进行到一定程度后就会变慢。当有硫酸存在时,第二步反应生成的硫酸钙沉淀可使第一步反应继续进行。
反应中生成的HF与磷矿中的SiO 2 或硅酸盐作用形成H 2 SiF 6 :
6HF+SiO 2 ═H 2 SiF 6 +2H 2 O
通常少量的H 2 SiF 6 将分解为SiF 4 和HF逸出:
H 2 SiF 6 ═SiF 4 (g)+2HF(g)
当有SiO 2 存在时,分解反应如下:
2H 2 SiF 6 +SiO 2 ═3SiF 4 (g)+2H 2 O
气相中的氟主要以SiF 4 的形式存在,在吸收装置中用水吸收时生成氟硅酸水溶液和硅胶:
3SiF 4 + n H 2 O═2H 2 SiF 6 +SiO 2 · m H 2 O
若溶液中有碱金属离子,则氟硅酸将与之结合成难溶的氟硅酸钾等,很易堵塞滤网。
磷矿中的碳酸盐在生产磷酸的过程中,首先被硫酸分解:
CaCO 3 +H 2 SO 4 ═CaSO 4 +H 2 O+CO 2
CaCO 3 ·MgCO 3 +2H 2 SO 4 ═CaSO 4 +MgSO 4 +2H 2 O+2CO 2
生成的镁盐对磷酸生产不利。
磷矿中的三价金属氧化物要与磷酸反应:
Fe 2 O 3 +2H 3 PO 4 ═2FePO 4 +3H 2 O
Al 2 O 3 +2H 3 PO 4 ═2AlPO 4 +3H 2 O
反应中生成的磷酸盐将造成磷的损失,对磷酸生产过程有很大的危害。
在湿法磷酸反应过程中,磷矿的分解与硫酸钙的结晶是同时进行的。因此,固体结晶很可能沉积在磷矿颗粒表面,形成一层固体膜,包裹磷矿颗粒并减慢生成磷酸的反应过程,这种现象称为磷矿的“钝化现象”。所以对硫酸钙的结晶过程进行详细研究对磷酸生产有着重要的意义。
2)硫酸钙的结晶过程
在磷酸溶液中,硫酸钙结晶可以下列 3 种水合物的形式存在:二水物CaSO 4 ·2H 2 O、半水物CaSO 4 ·0.5H 2 O及无水物CaSO 4 。半水物有 α 半水物和 β 半水物两种晶型。无水物又有 3种变体形式:无水物Ⅰ、无水物Ⅱ和无水物Ⅲ。CaSO 4 -P 2 O 5 -H 2 O体系的平衡图如图2.14所示。
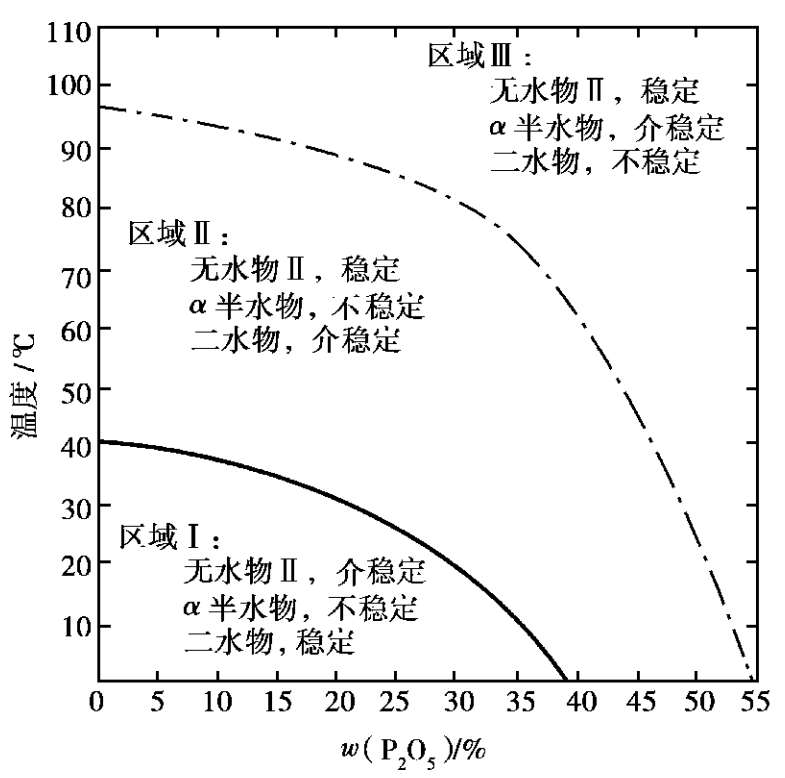
图 2.14 CaSO
4
-P
2
O
5
-H
2
O体系平衡图
实线━━CaSO
4
·2H
2
O⇆CaSO
4
Ⅱ+2H
2
O热力学平衡曲线
点画线CaSO
4
·2H
2
O⇆α-CaSO
4
·0.5H
2
O+1.5H
2
O介稳平衡曲线
从图 2.14 中可以看出,硫酸钙仅有两种稳定的变体:二水物和无水物Ⅱ。二水物在区域Ⅰ是稳定的,在区域Ⅱ是介稳的,在区域Ⅲ是不稳定的。无水物Ⅱ在区域Ⅱ和区域Ⅲ是稳定的,在区域Ⅰ是介稳的。状态处于平衡曲线上的溶液,可与平衡的两个固相共存,但最终必将转化为稳定固相。根据这一相图,当采用二水物流程时,工艺条件必须选在区域Ⅱ内,降低反应温度可提高产品磷酸的质量分数。当采用半水物流程时,工艺条件则应选在区域Ⅲ内,此时或磷酸浓度较高或温度较高才能保证反应正常进行。
在含有硫酸的磷酸溶液中,二水物和 α 半水物的介稳平衡如图 2.15 所示。从图中可以看出,当H 2 SO 4 质量分数增加时,二水物与 α 半水物的介稳平衡曲线向温度和P 2 O 5 质量分数降低的方向移动。此图也可作选择工艺条件的参考。
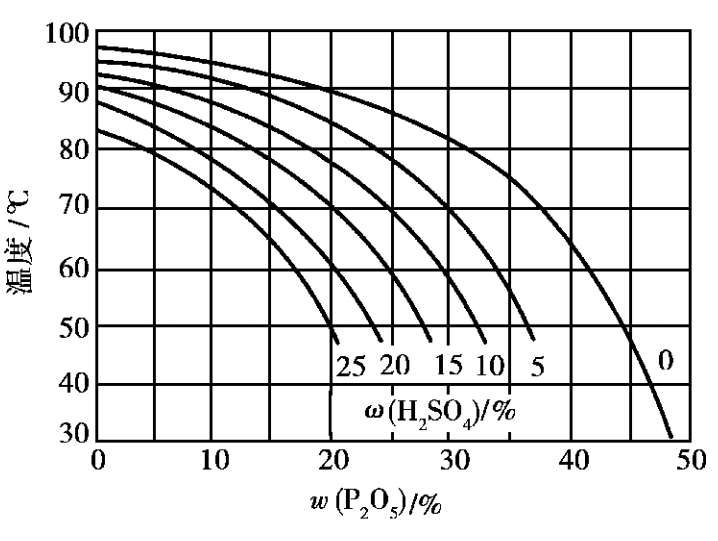
图 2.15 在磷酸与硫酸的混合溶液中二水物与 α 半水物的介稳平衡
在湿法生产磷酸的过程中,得到粗大稳定的硫酸钙晶体以利于过滤和洗涤是一个很重要的问题。硫酸钙晶体的形成是磷酸溶液中钙离子和硫酸根离子不断碰撞的结果,但同时硫酸钙分子又不断地分解成离子。在溶液浓度达到某一临界过饱和度之前,晶核实际上不能形成。溶液浓度超过这一临界值,晶核生成速度急剧增加。
研究表明,溶液中剩余硫酸的质量分数是半水物转化成二水物的重要因素。半水物吸水转化是一个溶解-再结晶的相变过程。首先是半水物溶解为饱和溶液,对二水物来说这又是过饱和溶液,从而有二水物结晶析出。定温下,硫酸质量分数对半水物吸水转化速率的影响如图 2.16 所示。从图中可以看出,每一温度都有一使转化速率最快的硫酸质量分数。温度升高,这一最快值向硫酸质量分数降低的方向移动,转化速率也相应减慢。
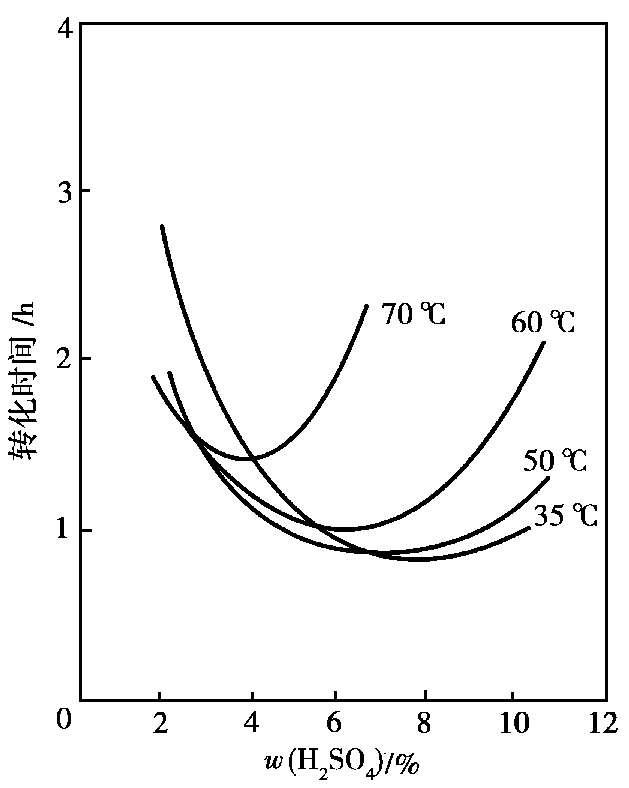
图 2.16 温度及 w (H 2 SO 4 )对半水物吸水转化过程速率的影响
3)酸分解磷矿动力学
酸分解磷矿的化学反应属于多相反应,反应是在磷矿颗粒表面进行的。反应物必须扩散通过颗粒表面的一个不流动界面(液膜),才能与颗粒接触反应。当扩散速度与化学反应速度基本相当时,可以得到反应速度的关系为:
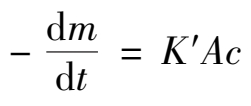
(2.2.1)
式中 m ——矿物质量;
t ——时间;
K ′——速率常数;
A ——反应表面积;
c ——反应物的浓度。
反应表面积 A 一般很难准确测量,所以实际生产中往往将动力学方程表示为磷矿分解分率的关系。设磷矿颗粒近似为球形,初始颗粒平均半径为 r 0 ,时间 t 后颗粒平均半径为 r 。则时间 t 后,磷矿的分解分率 α 为:
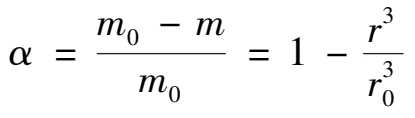
式中 m 0 ——初始磷矿质量;
m ——时间 t 后残余磷矿质量。
因为反应物面积
A
= 4π
r
2
,反应物质量
m
=
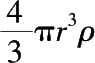 。将
A
和
m
代入速度方程可得:
。将
A
和
m
代入速度方程可得:
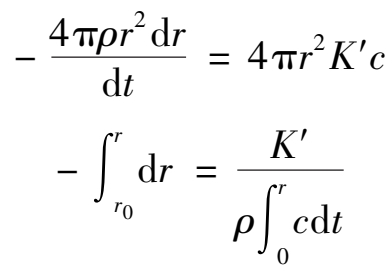
当反应过程中酸浓度基本不变时, c 可视为常数,整理后可得:
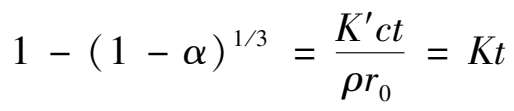
(2.2.2)
这就是有液膜存在,且化学反应速度与扩散速度基本相当时的动力学方程。
若磷矿颗粒表面形成的固体产物膜是疏松可透性膜时,也可近似用上述方程。
当形成的固体产物膜是致密膜时,这种多相反应一般属于扩散控制型,同样可以得到下述方程:
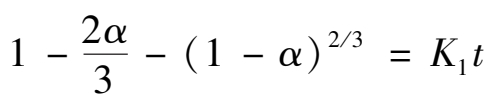
(2.2.3)
其中
k
1
=
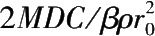 。这里
M
,
ρ
分别为反应物分子量和密度;
D
为扩散系数;
β
是一比例常数。式(2.2.4)表明反应速度与颗粒初始平均半径的平方成反比,可见颗粒半径对反应速度影响极大。对于已形成的固体膜,用一般搅拌方式不能降低固体膜的厚度,但充分搅拌可以减少固体产物在固体膜上的附着。
。这里
M
,
ρ
分别为反应物分子量和密度;
D
为扩散系数;
β
是一比例常数。式(2.2.4)表明反应速度与颗粒初始平均半径的平方成反比,可见颗粒半径对反应速度影响极大。对于已形成的固体膜,用一般搅拌方式不能降低固体膜的厚度,但充分搅拌可以减少固体产物在固体膜上的附着。
2.2.1.2 湿法磷酸的工艺流程
1)二水物流程
典型的二水物湿法磷酸流程如图 2.17 所示。
反应槽是一单槽,由两个直径不同的同心圆组成。内外圆之间的环形部分装有 6 只搅拌桨,按搅拌方向的顺序称为第 1 到第 6 反应区。在第 1 到第 6 区之间设有隔墙,隔墙上方外侧有一缺口,称为“回浆口”。搅拌桨将大量浆料从第6 区通过回浆口送入第1 区,再从第1 区顺环形部分流回第 6 区,如此循环。反应槽料浆用鼓入空气的办法进行冷却,鼓入空气量根据反应温度确定。
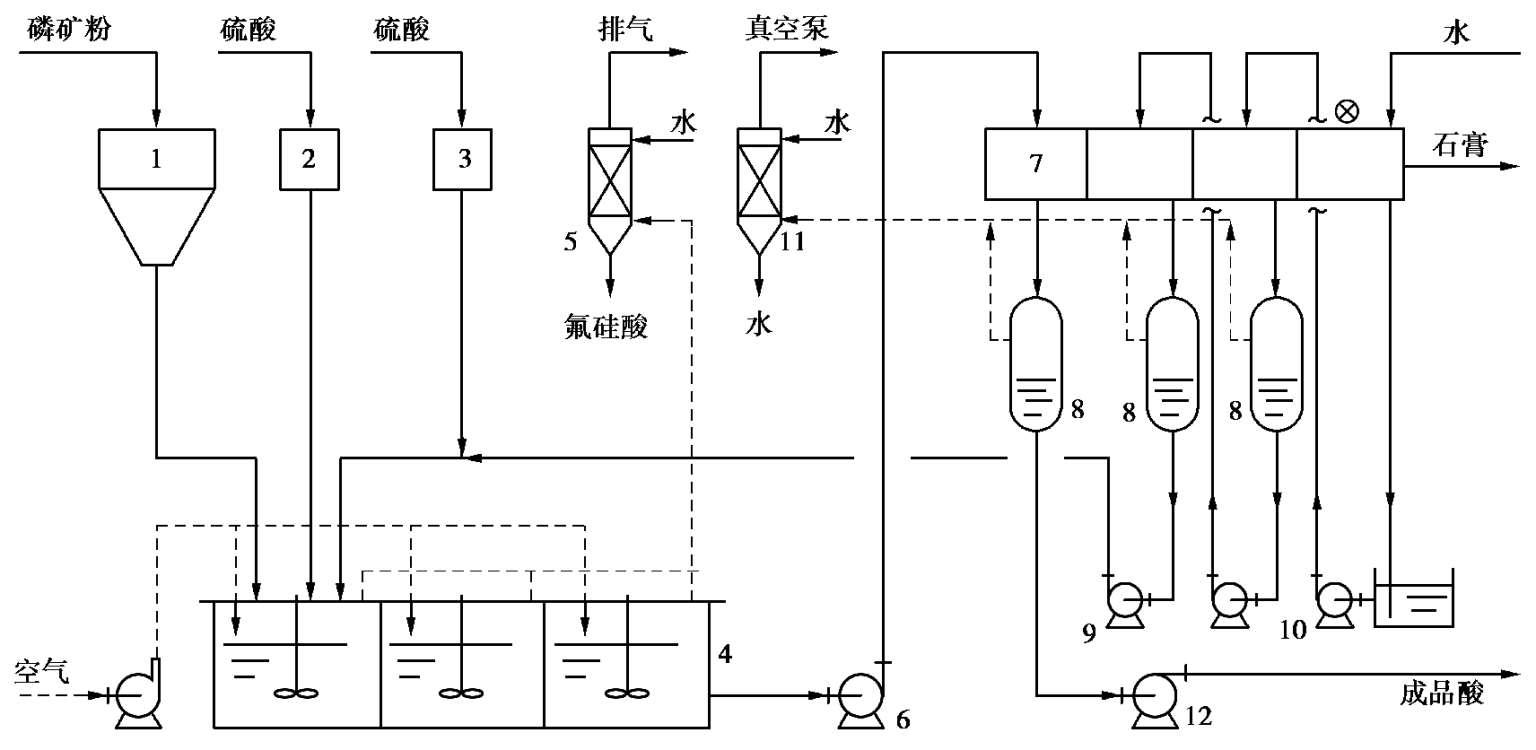
图 2.17 典型二水物流程制湿法磷酸流程图
1—矿粉仓;2—硫酸高位槽;3—磷酸高位槽;4—反应单槽;5—废气洗涤器;6—反应物料泵;7—盘式过滤机;8—气液分离罐;9—稀磷酸泵;10—洗涤液泵;11—水气冷凝器;12—成品酸泵
从反应槽逸出的含氟废气被送入气体洗涤器洗涤,洗涤后通过排风机放空。从反应槽流出的磷酸料浆用泵送至盘式过滤机过滤和洗涤。
硫酸的质量分数是影响结晶的重要因素,其质量分数过大可能形成硫酸钙针状结晶缔合体,即由许多针状结晶围绕一中心晶核缔合在一起形成“聚合晶体”。硫酸质量分数偏低时,易形成薄片状晶体,其比表面积大,孔隙率小,难以过滤。
磷酸质量分数和反应温度是二水物流程的决定条件。虽然理论上磷酸质量分数越高越好,但生产上应根据实际操作条件来选择。
反应物料在反应槽内停留的时间越长,得到的硫酸钙晶体越粗大。但过长的反应时间在经济上并不合理,因此现在的反应时间一般为 4~6 h。缩短反应时间后,必须注意反应料浆的冷却问题。
生产中大量的回浆对分解过程起着稳定的作用,同时可防止硫酸钙结晶过程生成过多的晶核和控制晶核形成和晶体生长速度。
料浆中的液相量增大将有利于分解和结晶过程,但也会使过滤机负荷增大,反应槽的生产能力下降。料浆中的液固比很大程度上取决于料浆的输送情况,一般为 2.2∶1~2.5∶1。
磷矿与硫酸反应时要放出大量的热,除了一部分用来维持指定的温度和有些散热损失外,大部分热量必须及时地从反应槽移走。工业生产中一般有稀释硫酸、鼓气和利用真空等冷却方式。
气体洗涤器内吸收SiF 4 反应生成的硅胶很容易堵塞设备和管道,要定期清理。
2)半水-二水再结晶流程
半水-二水工艺是日本开发的,有分离半水物和不分离半水物两种。不分离半水物的工艺流程如图 2.18 所示,分离半水物的工艺流程如图 2.19 所示。
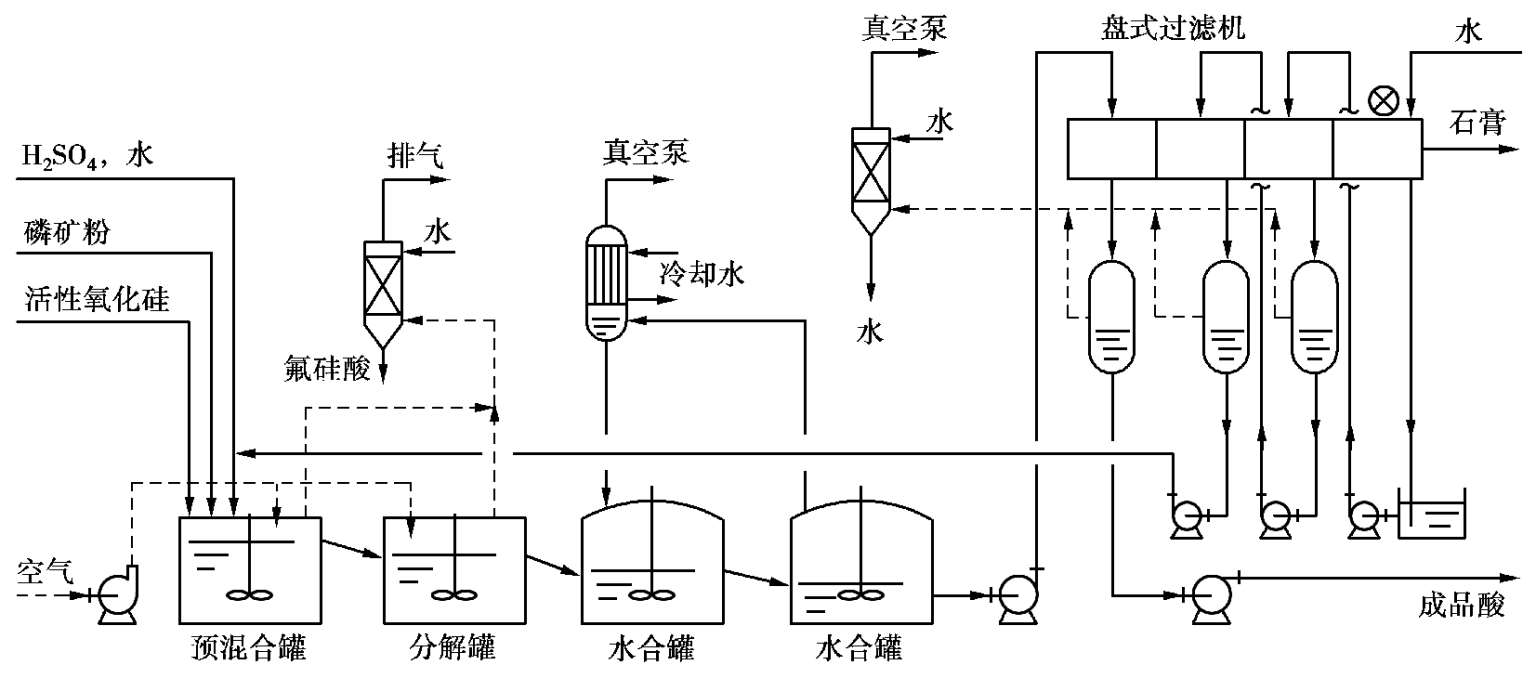
图 2.18 半水-二水法(不分离)工艺流程图
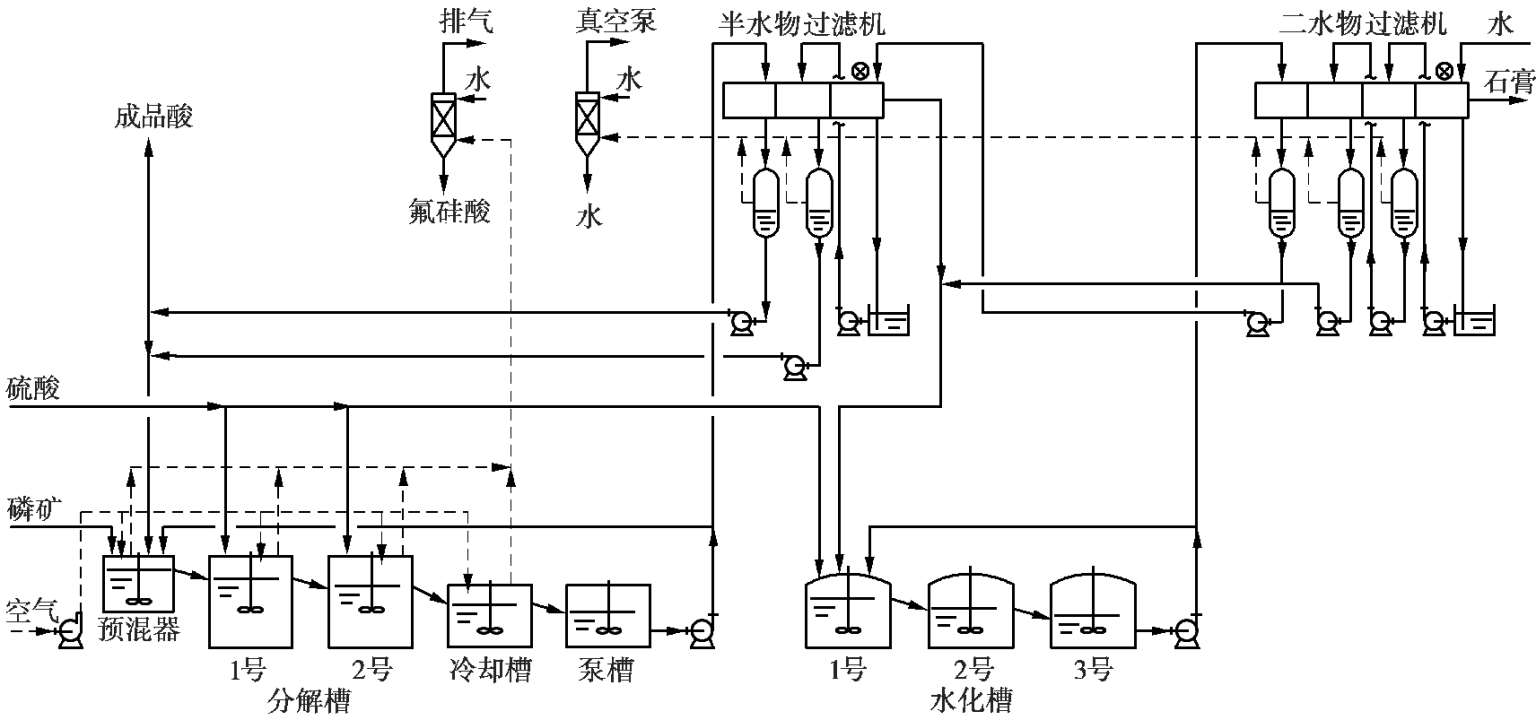
图 2.19 半水-二水法新工艺流程图
不分离半水物流程中,预混合分解反应是在半水物条件下操作的,水化槽是在有利于半水物再水化的条件下操作的。磷矿粉与活性氧化硅一起加入预混槽,硫酸与返回稀磷酸混合后加入预混槽。料浆经充分混合后溢流入分解槽,在槽内停留 2 h,反应温度维持在 90~100℃。反应后的料浆进入水化槽与经闪蒸冷却的二水物料浆混合,温度下降到 50~60℃并使半水物溶解、再结晶为粗大的二水物。此法制得的磷酸的质量分数与二水法相同,但可得到较纯的石膏。
在分离半水物流程中,半水物水化再结晶前先经过滤直接获得
w
(P
2
O
5
)为 40%~45%的产品磷酸。过滤后的半水物硫酸钙经水化、酸洗涤后再送到水化槽。硫酸大部分加到水化槽,小部分加入反应槽。水化槽温度为 60℃,所得
w
(P
2
O
5
)为 10%~15%的水化酸经洗涤半水物滤饼后循环回半水物反应槽。半水物硫酸钙在水化槽的操作条件下(60℃),
w
(
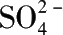 )为10%~15%,
w
(P
2
O
5
)为 10%~15%,迅速水化并形成粗大的二水物晶体。
)为10%~15%,
w
(P
2
O
5
)为 10%~15%,迅速水化并形成粗大的二水物晶体。
2.2.1.3 湿法磷酸的浓缩
目前,世界上绝大部分湿法磷酸是以二水物法制得的,二水物流程生产的湿法磷酸的质量分数一般为 28%~30%,需要浓缩到 40%以上用以制造重过磷酸钙,或 52%~54%作为商品磷酸。
湿法磷酸中通常含有 2%~4%游离硫酸和含氟约 2%的氟硅酸,腐蚀性非常强。在蒸发浓缩的高温条件下,对管道和设备的腐蚀性更强。因此湿法磷酸的浓缩设备常用非金属材料,闪蒸室和管道也用橡胶衬里。
磷酸溶液中含多种处于饱和或过饱和状态的离子和化合物,它们在磷酸的质量分数提高时会析出,析出的沉淀有钙盐、氟盐等。沉淀物可在器壁上结垢,增大阻力,特别是在传热表面结垢后会降低传热效率,要及时清除它们。
在浓缩过程中,磷酸中的氟硅酸将分解成四氟化硅和氟化氢与水蒸气一起逸出。同时,逸出气相也可发生逆反应生成硅胶。所以要及时清洗沉积在气体管道内的硅胶,以减少阻力损失。
磷酸浓缩方法有直接传热蒸发和间接传热蒸发两种。直接传热蒸发中,有Prayon器外燃烧喷淋塔式磷酸浓缩装置、Chemico器外燃烧鼓泡浓缩装置、Nordac浸没燃烧装置等;间接传热蒸发中,有列管式强制循环真空蒸发装置等。
 2.2.2 酸法磷肥
2.2.2 酸法磷肥
2.2.2.1 普通过磷酸钙的生产
普通过磷酸钙(Single Superphosphate,SSP)简称普钙,其分子式为Ca(H 2 PO 4 ) 2 ·H 2 O,分子量为 252.05。
普钙成品为疏松多孔的粉状或粒状物。主要含水溶性一水磷酸二氢钙和无水磷石膏,另外还含少量水和游离磷酸。
普钙加热时不稳定,加热到 120℃时一水磷酸二氢钙失去结晶水变为无水磷酸二氢钙,水溶性P 2 O 5 逐渐减少;加热到 150℃时,无水磷酸二氢钙又失去结合水转化为焦磷酸氢钙而不具肥效;温度再高则焦磷酸氢钙转变为偏磷酸钙。
1)普钙的生产原理
生产普钙的主要化学反应是硫酸与矿粉中的氟磷灰石的作用。首先生成磷酸和半水硫酸钙,然后磷酸再与矿粉反应生成磷酸二氢钙。
7Ca 5 F(PO 4 ) 3 +35H 2 SO 4 +17.5H 2 O═21H 3 PO 4 +35CaSO 4 ·0.5H 2 O+7HF
3Ca 5 F(PO 4 ) 3 +21H 3 PO 4 +15H 2 O═15Ca(H 2 PO 4 ) 2 ·H 2 O+3HF
第二阶段还有硫酸钙脱水的反应:
2CaSO 4 ·0.5H 2 O═2CaSO 4 +H 2 O
第一阶段还存在许多副反应,如:
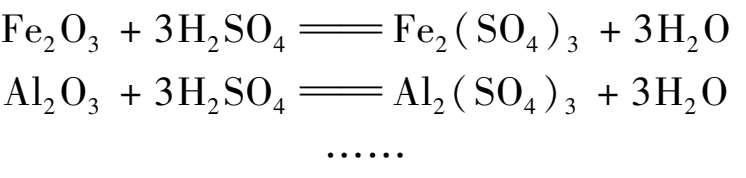
反应中生成的HF与矿粉中的SiO 2 作用生成SiF 4 。SiF 4 在化成室上部和气体管道内温度较低的地方可与HF作用生成氟硅酸。有关反应如下:
4HF+SiO 2 ═SiF 4 +2H 2 O
SiF 4 +2HF═H 2 SiF 6
2SiF 4 +2H 2 O═SiO 2 +2H 2 SiF 6
硫酸与矿粉的反应非常激烈,生成的硫酸钙使料浆很快变稠并逐渐固化。如果固化正常,最后所得产品应内含液相,疏松多孔又表面干燥。物料的固化结构主要是半水硫酸钙交叉堆积形成的骨架,其次是少量硅酸从液相中析出形成的凝胶质点,还有气体逸出形成的许多空隙。这些骨架、质点和空隙都包涵和吸附大量液相,硫酸钙也结合了半个水分子。第一阶段生成的半水硫酸钙介稳态,随着反应的进行,将转变为无水硫酸钙。温度的升高和磷酸质量分数的提高,将加快半水硫酸钙的相转变。半水物晶粒大,可以形成良好骨架。无水物晶粒细小,难以形成良好骨架结构。因此,要有足够时间来稳定半水物结构,使硫酸钙水合结晶释放水分时其骨架仍能稳定不变。
第一阶段的反应十分迅速,转化率大于 70%。第二阶段反应速度很慢,需数天数周才能达到 95%左右。第二阶段反应慢主要有下列因素:
①第一阶段反应生成的晶体分布在矿粉周围,甚至形成细小无水硫酸钙薄膜,使磷酸与矿粉的接触困难。
②由于磷酸二氢钙的生成大大降低了氢离子的浓度使液相反应推动力下降。
③细颗粒矿粉先与硫酸作用,第二阶段反应剩余的较粗矿粉与酸的接触表面减少。
磷酸二氢钙在第二阶段反应时,开始是溶解于液相的,温度越高溶解度越大,当溶液过饱和时就结晶出来,因此物料自 110℃左右的化成室卸出后,要定期翻堆以加速物料的冷却。这样可减少磷酸二氢钙的溶解度,增加磷酸的活性,加速分解反应。
2)普钙的生产方法及工艺流程
普钙的生产方法可分为稀酸矿粉法和浓酸矿浆法两类,现分述如下。
(1)稀酸矿粉法
以锥形混合器链板化成室流程为例,这种流程如图 2.20 所示。
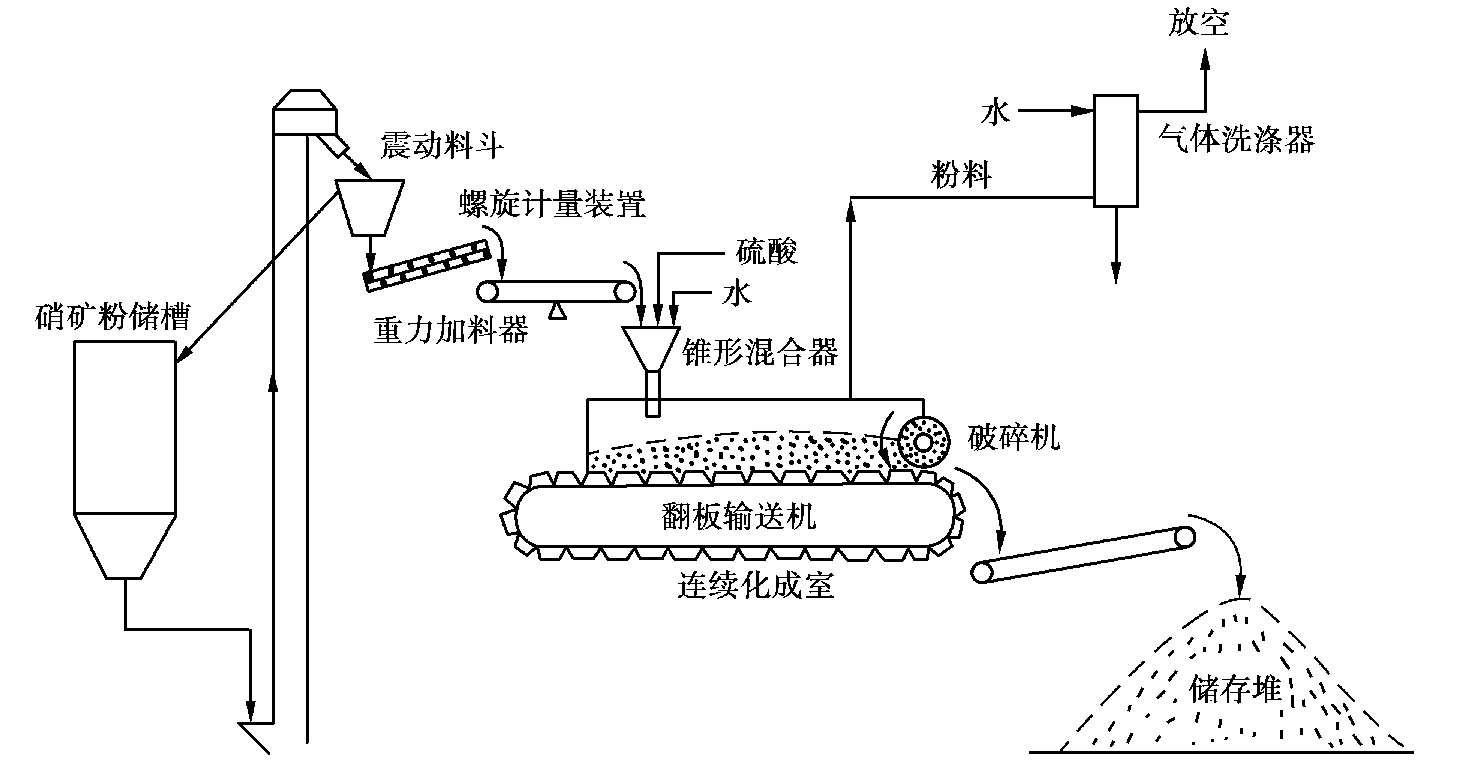
图 2.20 锥形混合器链板化成室流程
矿粉由锥形混合器中央加料管进入,冲击倒置的圆锥体,使矿粉均匀分布。酸由紧贴锥壁的几根导管喷入,导管与锥壁成一定角度,使硫酸沿切线方向流动。稀释水从喷嘴加入,使酸、矿粉呈漩涡状均匀混合,混合时间 2 s左右。化成室为链板化成室,过磷酸钙在运动的钢质翻板运输机上化成,物料在化成室中停留时间通常为 0.5~1 h。通过改变链板输送机的速度可调节停留时间。
锥形混合器没有机械搅拌装置,不消耗动力,占地少,造价和维修费用低,生产能力大。硫酸稀释用水从混合器加入,可省一套配酸设备。但硫酸、磷矿混合反应时间短,适合于容易分解的磷矿。该流程也适用于制造重钙和富钙。
(2)浓酸矿浆法
该法是先将水和磷矿石加球磨机研磨,研磨后的矿浆过筛后流入矿浆池,然后用泵加入混合器与 93%~98%的浓硫酸混合。一典型流程如图 2.21 所示。
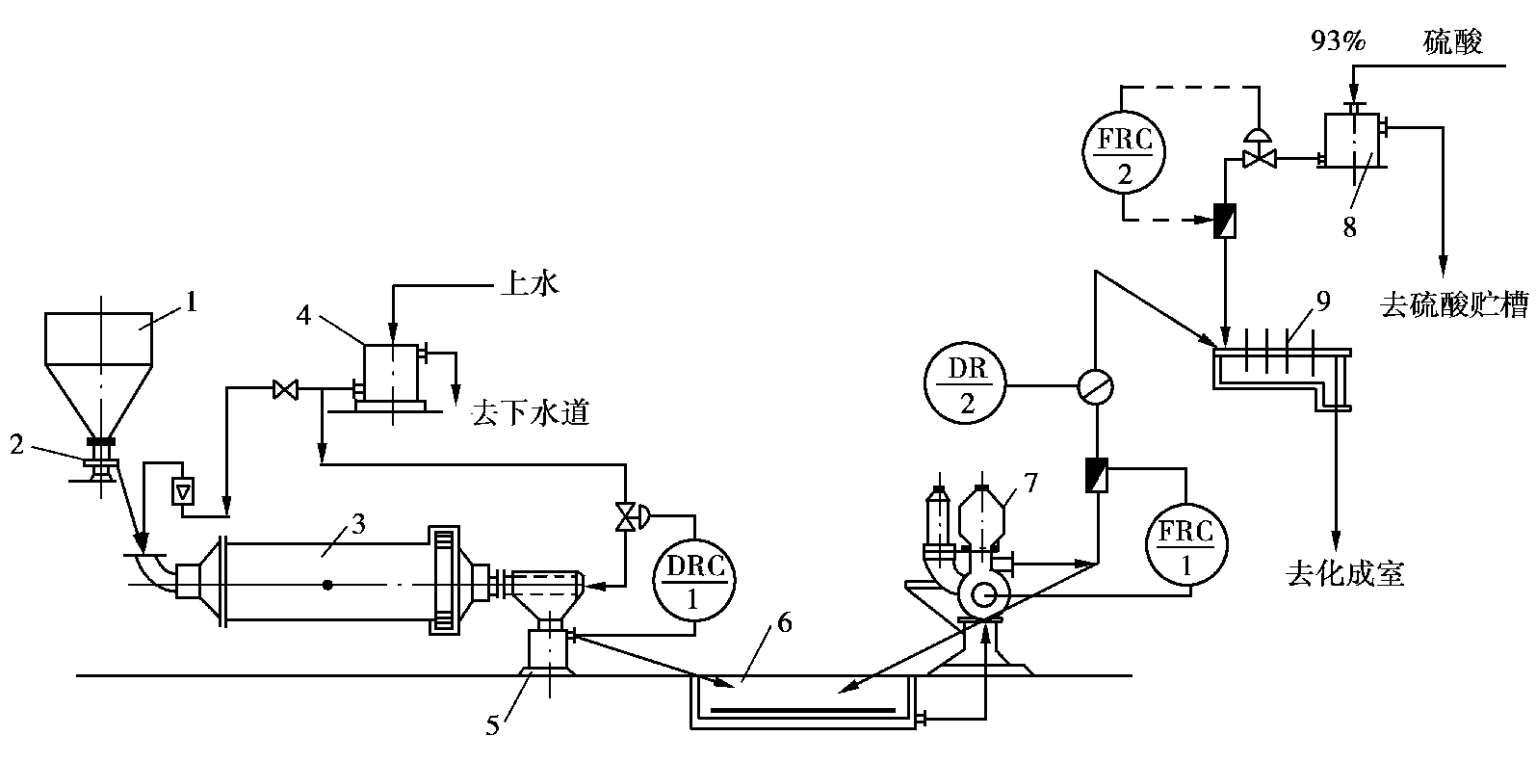
图 2.21 浓酸矿浆法流程
1—矿贮斗;2—圆盘给料器;3—球磨机;4—水高位槽;5—矿浆密度测量槽;6—矿浆贮槽;7—隔膜泵;8—硫酸高位槽;9—混合器
磷矿经两级破碎,控制粒度在 30 mm以下送至贮料斗,由喂料机按一定的速度送进球磨机加水湿磨后入矿浆密度测量槽,根据所测密度大小自动调节从磨尾加入球磨机的水量,以保证矿浆浓度的稳定。从矿浆密度测量槽溢流出来的矿浆流入矿浆池,然后由隔膜泵泵入混合器。加入混合器的浓硫酸由高位槽、电磁流量计、气动隔膜等组成的自动调节装置实现自动控制。
与稀酸矿粉法比较,浓酸矿浆法的特点是流程短,设备少,磷矿无须干燥,可以露天堆放,不用仓库和干燥设备,也省去了硫酸稀释冷却的配酸设备。稀酸矿粉法的建筑费比浓酸矿浆法要高 42%左右。生产每吨普钙浓酸法比稀酸法可节电约 42.86%,节煤约 20 kg。但湿磨的球耗较高,是通常干磨的 4~6 倍,矿浆的水分因不同的矿种而异,不易控制。同时,浓酸矿浆法对磷矿的适应性有一定限制,适用于亲水性差的、矿浆水分低而流动性好的磷矿。
2.2.2.2 重过磷酸钙的生产及工艺流程
重过磷酸钙简称重钙(Triple Superphosphate,TSP),比普钙含磷量高 2~3 倍。
1)重钙的生产原理
重钙生产的主要反应相当于普通过磷酸钙生产的第二阶段反应,即磷酸二氢钙从磷酸溶液中不断结晶的过程。磷酸用量的计算法与所用的是热法磷酸或湿法磷酸是不同的。对湿法磷酸,因部分P 2 O 5 被阳离子杂质化合而失去活性,故不能按磷酸中的全部P 2 O 5 来计算磷酸用量。计算时以磷酸中的氢离子浓度为基础,按下列方程式计算:
CaO+2H 3 PO 4 ═Ca(H 2 PO 4 ) 2 ·H 2 O
Fe 2 O 3 +2H 3 PO 4 ═2FePO 4 ·2H 2 O
Al 2 O 3 +2H 3 PO 4 ═2AlPO 4 ·2H 2 O
理论磷酸用量的份数(1 份重量磷矿所需 100%磷酸的份数)为:
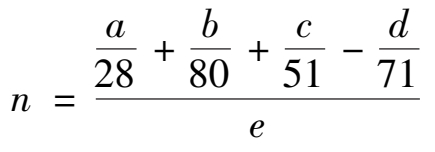
式中 a , b , c , d ——磷矿中CaO,Fe 2 O 3 ,Al 2 O 3 和P 2 O 5 的质量分数;
e ——磷酸中氢离子的质量分数,实际用量约为理论用量的 105%。
磷酸分解磷矿主要受扩散控制,磷矿分解率与酸矿混合时的酸浓度、矿粉细度、反应温度、混合强度和液相组成等条件有关。反应过程分为两个阶段:第一阶段受钙离子的扩散控制,磷矿在钙离子未饱和的磷酸中分解,磷矿的溶解速度主要取决于钙离子从磷矿表面扩散到液相中的速度;第二阶段受氢离子的扩散控制。第一阶段末期,磷矿表面和液相的钙离子浓度已十分接近,磷酸二氢钙结晶不断析出,这时磷矿的继续分解主要靠液相中氢离子向矿粒表面渗透。磷酸二氢钙以很小的晶体密集在未分解的矿粒表面,造成了很大的扩散阻力,因此生产上需更长的熟化时间或加热干燥促使磷矿加速分解。
2)重钙生产的工艺条件及生产方法
磷酸浓度是重钙生产的关键工艺条件。一般来说提高磷酸浓度有利于反应进行,可缩短熟化时间,提高产品质量。但也有影响酸矿均匀混合,黏度增加阻碍反应进行等不利因素。生产的最佳酸浓度要根据酸矿性质通过试验决定。
重钙的生产方法主要有浓酸熟化法(或化成室法)和稀酸返料法(或无化成室法)。浓酸熟化法采用 w (P 2 O 5 )为 45%~54%的湿法磷酸。浓酸堆置熟化流程与普通过磷酸钙生产相似,不同的是混合化成时间较短,但熟化时间则较长。浓酸法的典型生产流程有美国的可用热法磷酸或湿法磷酸的TVA流程、法国的Kuhlman法等。产品分为堆置熟化后不再加工的粉状重钙和加工成形的粒状重钙。浓酸熟化法工艺流程和生产设备简单,磷矿的分解率高,不需要繁杂的返料系统,适用于普通过磷酸钙厂的改建。缺点是磷酸须浓缩,同时要庞大的半成品熟化仓库,对磷矿的质量要求也较高。
稀酸法主要有返料造粒流程,用 w (P 2 O 5 )为25%~39%的磷酸分解磷矿制得料浆,然后将稀酸带入的大量水分蒸发掉,同时提高磷矿的分解率以取代浓酸法的堆置熟化过程。但造粒干燥过程必须用大量的返料,降低了设备的生产能力,增加了能量消耗。稀酸法可以直接用二水物或半水物流程制得的磷酸,无须浓缩,生产过程是连续的,整个装置适应性广,具有适应多种工艺过程的特点。生产厂可根据季节变化和市场需求,稍加调整即可改变生产品种。稀酸法不需庞大的熟化仓库,改善了操作环境。正是由于它的这些优点,现在多用稀酸法生产重钙。